2022-2023学年鲁科版高中化学必修二 3.3.1 乙醇 (共20张PPT)
文档属性
| 名称 | 2022-2023学年鲁科版高中化学必修二 3.3.1 乙醇 (共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-03 08:38:16 | ||
图片预览





文档简介
(共20张PPT)
鲁科版必修第二册
第三章 简单的有机化合物
第1课时 乙醇
第3节 饮食中的有机化合物
实验探究Ⅰ:乙醇的物理性质
1.观察颜色、状态、气味
2.溶解性实验
(1)向酒精中倒入任意体积水摇匀,观察现象
(2)荧光笔涂画在手上,用棉签蘸取乙醇反复擦拭手上的字,看是否能擦去
一、物理性质
颜色 气味 状态 挥发性 溶解性
无色
透明
特殊
香味
液 体
跟水以任意比互溶
易挥发
(沸点78℃)
能够溶解多种无机物和有机物
俗称
乙醇
酒精
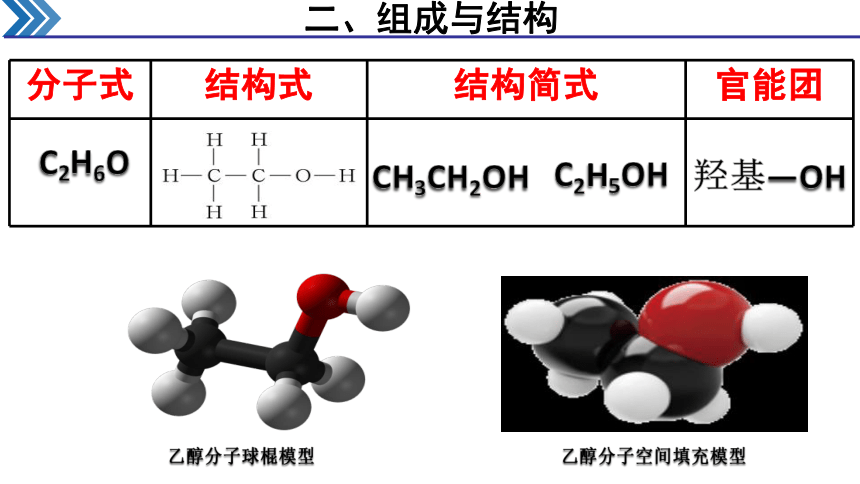
二、组成与结构
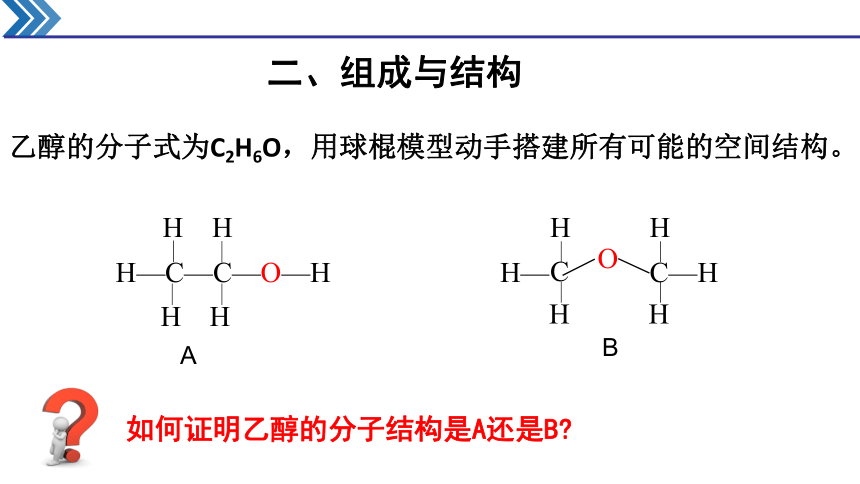
乙醇的分子式为C2H6O,用球棍模型动手搭建所有可能的空间结构。
H— C—H
H H
H H
C
O
B
H—C—C—O—H
H H
H H
A
如何证明乙醇的分子结构是A还是B
1、水的结构式 乙烷的结构式
2、金属钠保存在煤油中,煤油的主要成分是烃类。
3、钠能与水反应产生氢气。
资料卡片
【实验探究Ⅱ】乙醇与金属钠反应
反应现象
水
乙醇
浮、熔、游、响
钠粒沉在试管底部之后,反应产生气体。点燃生成的气体,产生淡蓝色火焰,烧杯内壁有水雾,澄清石灰水不变浑浊。
二、组成与结构
乙醇分子球棍模型
乙醇分子空间填充模型
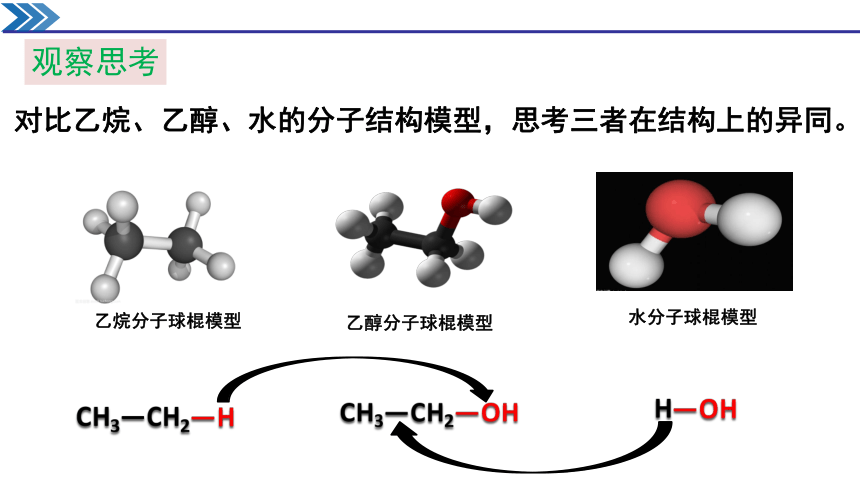
观察思考
对比乙烷、乙醇、水的分子结构模型,思考三者在结构上的异同。
乙烷分子球棍模型
乙醇分子球棍模型
水分子球棍模型
CH3—CH2—H
CH3—CH2—OH
H—OH
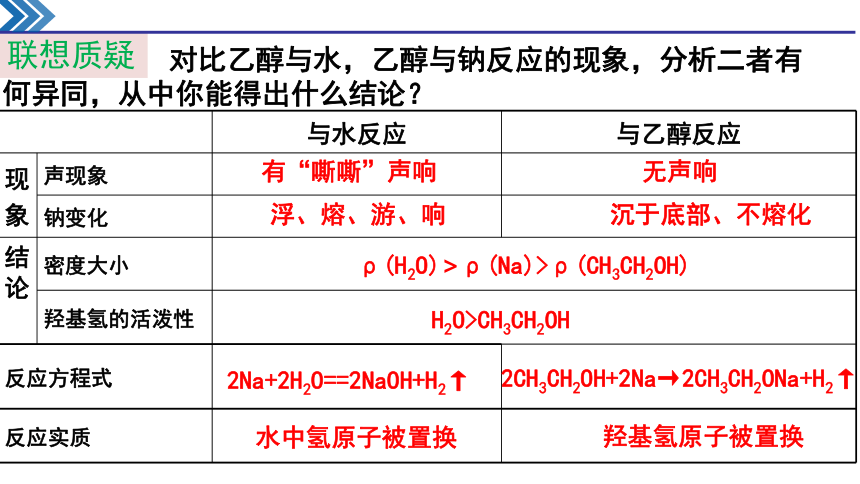
联想质疑
对比乙醇与水,乙醇与钠反应的现象,分析二者有
何异同,从中你能得出什么结论?
与水反应 与乙醇反应
现
象 声现象
钠变化
结
论
密度大小
羟基氢的活泼性
反应方程式
反应实质
有“嘶嘶”声响
无声响
浮、熔、游、响
沉于底部、不熔化
H2O>CH3CH2OH
ρ(H2O)>ρ(Na)>ρ(CH3CH2OH)
2Na+2H2O==2NaOH+H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
水中氢原子被置换
羟基氢原子被置换
①燃烧:
C2H5OH+3O2 2CO2+3H2O
三、化学性质
2、氧化反应
实验现象:
产生淡蓝色火焰,放出大量的热
乙醇着火应该怎么扑灭
【探究实验Ⅲ】乙醇的催化氧化
向试管中加入约 2 ml 无水乙醇,取一根光洁的铜丝绕成螺旋状,置于酒精灯外焰上加热,然后伸入无水乙醇中,反复几次,观察铜丝的变化并闻一闻液体的气味。
【思考】
(1)铜丝加热后有什么变化?
(2)铜丝伸入后乙醇有什么现象?
(3)铜丝在反应中的作用?氧化剂是谁?
【思考】
(1)铜丝加热后有什么变化?
(2)铜丝伸入后乙醇有什么现象?
(3)铜丝在反应中的作用?氧化剂是谁?
催化剂
氧气
条件:
氢原子
碳原子
氧原子
乙醛
2CH3CH2OH+O2 2CH3CHO+2H2O
乙醛无色、有刺激性气味的液体。
方程式:
②催化氧化
-OH所连的C上要有H
是不是所有的醇都能发生催化氧化
③强氧化剂氧化
加入乙醇
CH3CH2OH
CH3COOH
酸性KMnO4 溶液
酸性K2Cr2O7溶液
K 2 Cr2O7(橙红色)
Cr2(SO4 )3
(绿色)
四.乙醇的“是非功过”
燃料
造酒原料
有机溶剂和化工原料
请联系实际生活归纳乙醇的用途?
杀菌、消毒
酒精(乙醇)
乙醛
乙酸
乙醛脱氢酶
乙醇脱氢酶
有毒性
造成酒后第二天恶心的主要原因,给肝脏带来损害的主要物质
无毒性
被人体迅速转化为能量,最后分解成H2O和CO2
乙醇进入人体后的代谢过程
请同学们利用本节课的知识设计一个简单的酒精检测仪呢
1.下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
A
【巩固练习】
2. 根据乙醇与Na的反应特征,写出甲醇( CH3-OH )、乙二醇
( HO-CH2-CH2-OH )分别与Na的反应方程式。
*
3. 乙醇分子中不同的化学键如下图,下列关于乙醇在各种反应中断裂键的说法不正确的是( )
A.乙醇和钠反应,键①断裂
B.在Ag催化下和O2反应,键①③断裂
C.在Cu催化下和O2反应,键④⑤不可能断裂
D.乙醇是电解质,在水中键①断裂能电离出氢离子
D
鲁科版必修第二册
第三章 简单的有机化合物
第1课时 乙醇
第3节 饮食中的有机化合物
实验探究Ⅰ:乙醇的物理性质
1.观察颜色、状态、气味
2.溶解性实验
(1)向酒精中倒入任意体积水摇匀,观察现象
(2)荧光笔涂画在手上,用棉签蘸取乙醇反复擦拭手上的字,看是否能擦去
一、物理性质
颜色 气味 状态 挥发性 溶解性
无色
透明
特殊
香味
液 体
跟水以任意比互溶
易挥发
(沸点78℃)
能够溶解多种无机物和有机物
俗称
乙醇
酒精
二、组成与结构
乙醇的分子式为C2H6O,用球棍模型动手搭建所有可能的空间结构。
H— C—H
H H
H H
C
O
B
H—C—C—O—H
H H
H H
A
如何证明乙醇的分子结构是A还是B
1、水的结构式 乙烷的结构式
2、金属钠保存在煤油中,煤油的主要成分是烃类。
3、钠能与水反应产生氢气。
资料卡片
【实验探究Ⅱ】乙醇与金属钠反应
反应现象
水
乙醇
浮、熔、游、响
钠粒沉在试管底部之后,反应产生气体。点燃生成的气体,产生淡蓝色火焰,烧杯内壁有水雾,澄清石灰水不变浑浊。
二、组成与结构
乙醇分子球棍模型
乙醇分子空间填充模型
观察思考
对比乙烷、乙醇、水的分子结构模型,思考三者在结构上的异同。
乙烷分子球棍模型
乙醇分子球棍模型
水分子球棍模型
CH3—CH2—H
CH3—CH2—OH
H—OH
联想质疑
对比乙醇与水,乙醇与钠反应的现象,分析二者有
何异同,从中你能得出什么结论?
与水反应 与乙醇反应
现
象 声现象
钠变化
结
论
密度大小
羟基氢的活泼性
反应方程式
反应实质
有“嘶嘶”声响
无声响
浮、熔、游、响
沉于底部、不熔化
H2O>CH3CH2OH
ρ(H2O)>ρ(Na)>ρ(CH3CH2OH)
2Na+2H2O==2NaOH+H2↑
2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
水中氢原子被置换
羟基氢原子被置换
①燃烧:
C2H5OH+3O2 2CO2+3H2O
三、化学性质
2、氧化反应
实验现象:
产生淡蓝色火焰,放出大量的热
乙醇着火应该怎么扑灭
【探究实验Ⅲ】乙醇的催化氧化
向试管中加入约 2 ml 无水乙醇,取一根光洁的铜丝绕成螺旋状,置于酒精灯外焰上加热,然后伸入无水乙醇中,反复几次,观察铜丝的变化并闻一闻液体的气味。
【思考】
(1)铜丝加热后有什么变化?
(2)铜丝伸入后乙醇有什么现象?
(3)铜丝在反应中的作用?氧化剂是谁?
【思考】
(1)铜丝加热后有什么变化?
(2)铜丝伸入后乙醇有什么现象?
(3)铜丝在反应中的作用?氧化剂是谁?
催化剂
氧气
条件:
氢原子
碳原子
氧原子
乙醛
2CH3CH2OH+O2 2CH3CHO+2H2O
乙醛无色、有刺激性气味的液体。
方程式:
②催化氧化
-OH所连的C上要有H
是不是所有的醇都能发生催化氧化
③强氧化剂氧化
加入乙醇
CH3CH2OH
CH3COOH
酸性KMnO4 溶液
酸性K2Cr2O7溶液
K 2 Cr2O7(橙红色)
Cr2(SO4 )3
(绿色)
四.乙醇的“是非功过”
燃料
造酒原料
有机溶剂和化工原料
请联系实际生活归纳乙醇的用途?
杀菌、消毒
酒精(乙醇)
乙醛
乙酸
乙醛脱氢酶
乙醇脱氢酶
有毒性
造成酒后第二天恶心的主要原因,给肝脏带来损害的主要物质
无毒性
被人体迅速转化为能量,最后分解成H2O和CO2
乙醇进入人体后的代谢过程
请同学们利用本节课的知识设计一个简单的酒精检测仪呢
1.下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
A
【巩固练习】
2. 根据乙醇与Na的反应特征,写出甲醇( CH3-OH )、乙二醇
( HO-CH2-CH2-OH )分别与Na的反应方程式。
*
3. 乙醇分子中不同的化学键如下图,下列关于乙醇在各种反应中断裂键的说法不正确的是( )
A.乙醇和钠反应,键①断裂
B.在Ag催化下和O2反应,键①③断裂
C.在Cu催化下和O2反应,键④⑤不可能断裂
D.乙醇是电解质,在水中键①断裂能电离出氢离子
D
