化学人教版(2019)必修第二册7.3.2.乙酸(共37张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.2.乙酸(共37张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 16.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-04 00:00:00 | ||
图片预览










文档简介
(共37张PPT)
第三节 乙醇与乙酸
第2课时 乙酸
(醋酸)
学习目标
1.了解乙酸的物理性质以及组成和结构,并认识其结构与性质的关系。
2.能描述乙酸的部分化学性质,并能书写相关反应的化学方程式。.知道酯化反应等有机反应类型。
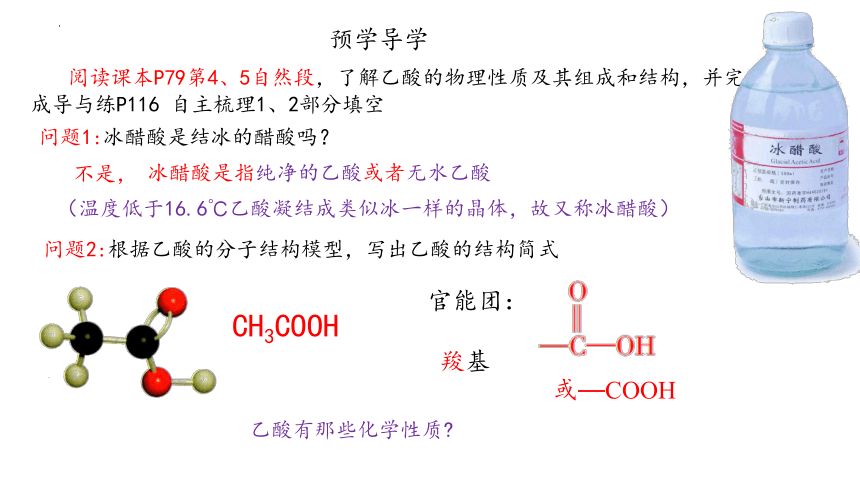
预学导学
阅读课本P79第4、5自然段,了解乙酸的物理性质及其组成和结构,并完成导与练P116 自主梳理1、2部分填空
问题1:冰醋酸是结冰的醋酸吗?
不是,
问题2:根据乙酸的分子结构模型,写出乙酸的结构简式
官能团:
羧基
或—COOH
CH3COOH
乙酸有那些化学性质
(温度低于16.6℃乙酸凝结成类似冰一样的晶体,故又称冰醋酸)
冰醋酸是指纯净的乙酸或者无水乙酸
2CH3COOH + CaCO3 → (CH3COO)2Ca +H2O+CO2↑
问题3:家里的水壶用的时间久了,里面就会留下水垢,水垢的主要成分是 ,用食醋可以清除水壶中的少量水垢,这是利用了乙酸的什么性质?乙酸为什么具有这种性质?该反应类似实验室制CO2反应,请写出该反应的化学方程式。
乙酸呈酸性,乙酸与水垢中难溶于水的碳酸钙发生复分解反应,生成易溶于水的乙酸钙
上述反应说明乙酸的酸性比碳酸的酸性 。即:CH3COOH H2CO3
合作探究
碳酸钙
乙酸分子中含有官能团-COOH,在水中部分电离
CH3COOH CH3COO- +H+
强 >
乙酸是一元弱酸
2HCl + CaCO3 = CaCl2 +H2O+CO2↑
乙酸的酸性比盐酸的酸性 。即:CH3COOH HCl
弱 <
酸性强弱顺序:
HCl>CH3COOH>H2CO3
乙酸根离子
(酸性强的酸制取酸性弱的酸)
乙酸的化学性质---导与练P116
1、弱酸性
问题4:乙酸是一元弱酸,具有酸的通性,除与碳酸钙反应外,还能与什么物质反应?
①与指示剂反应
能使紫色石蕊溶液变红
②与金属发生置换反应(Na、Mg、Al、Zn、Fe等)
2Na + 2CH3COOH → 2CH3COONa + H2↑
③与碱性氧化物反应(如Na2O、CaO、CuO等)
④与碱反应(NaOH、Cu(0H)2)
NaOH+ CH3COOH → CH3COONa + H2O
⑤与盐反应(Na2CO3 NaHCO3 )
合作探究
CH3COOH+NaHCO3 → CH3COONa+CO2↑+H2O
拓展提升
分子 乙酸 乙醇 CH3CH2OH 水
H-OH
酸碱性
遇石蕊溶液
与Na
与NaOH
与NaHCO3
变红 不变红(不变色) 不变红(不变色)
反应生成H2 反应生成H2 反应生成H2
乙酸、乙醇、水的性质比较
弱酸性 中性 中性
中和反应 不反应 不反应
反应生成CO2 不反应 不反应
CH3
由上可知:分子中含有官能团 的有机物,能与Na反应生成H2,分子中含有官能团 的有机物,能与NaHCO3反应生成CO2
-OH或-COOH
-COOH
检测评价
1、乙酸是生活中常见的一种有机化合物,下列关于乙酸的说法中正确的是 ( )
A.乙酸分子中含有4个氢原子,所以乙酸不是一元酸
B.乙酸的酸性比碳酸的弱,不能使紫色石蕊溶液变红
C.乙酸溶液又称冰醋酸
D.乙酸能够与金属钠反应产生氢气
2、下列物质中不能用来鉴别乙醇和乙酸的是( )
A、铁粉 B、溴水 C、碳酸钠溶液 D、紫色石蕊溶液知道酯化反应等有机反应类型。
D
B
3、下列叙述不正确的是 ( )
A.乙酸的最简式为CH2O
B.相同物质的量浓度的乙酸溶液和碳酸相比,pH小的是乙酸
C.用钠除去乙酸混有少量的水
D.分别向等体积等浓度的盐酸和醋酸溶液中加入足量的锌粒,盐酸产生氢气的速率大
C
4、高强度运动会导致肌肉乳酸堆积,产生酸痛感。已知乳酸的结构简式如右图所示,关于乳酸的说法错误的是( )
A.能与NaOH反应
B.乳酸不能使紫色石蕊试液变红C.能与NaHCO3反应生成CO2
D.能与钠反应的官能团有2种
B
作业
导与练P118 1、2
导与练课时作业P219 1、2
第三节 乙醇与乙酸
第3课时 乙酸
(醋酸)
学习目标
1.正确理解羟基氢及羧基氢反应的定量关系。
2.通过乙酸乙酯的制备实验探究,能描述相应性质实验的现象并加以分析说明,能从微观结构利用官能团解释酯化反应。.知道酯化反应等有机反应类型。
烧鱼时常加醋并加点酒,这样鱼的味道就变得 无腥、香醇,特别鲜美。
实验探究
酯化反应
液面上层有无色透明、
不溶于水的油状液体产生,并可以闻到香味。
在一支试管中加入3 mL 乙醇,然后边振荡试管边加慢慢加入2 mL浓硫酸和2 mL 乙酸,再加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和碳酸钠液面上 ,观察现象 。
2. 酯化反应
乙酸的化学性质
CH3—C—OH + C2H5 —OH CH3—C—O—C2H5 + H2O
浓硫酸
=
=
O
O
乙酸乙酯(果香味)
合作探究
思考: 乙酸和乙醇可能是以怎样的方式相互结合的呢?结合过程中乙酸和乙醇是如何断键的?
可能一
a、
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
可能二
b、
CH3—C—O—H+HO—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
酯化反应:酸和醇起作用,生成酯和水的反应。
CH3COOH+C2H5OH CH3COOC2H5+H2O
合作探究
思考:前面已学过那些有机反应类型,酯化反应属于那种反应类型?
取代反应
酯化反应历程:
酸中羧基上的羟基和醇羟基上的氢结合成水,剩余部分结合成酯。
碎瓷片防暴沸
导管在饱和Na2CO3液面上:防止倒吸
长导管冷凝、回流、导气作用
加物顺序:乙醇→浓硫酸→乙酸
饱和Na2CO3作用
①溶解乙醇;
②中和乙酸;
③降低乙酸乙酯的溶解度,利于酯的析出
浓硫酸:催化剂、吸水剂
沸点:
乙酸乙酯(77.1)
乙醇(78.3 ℃ )
乙酸(118℃)
小心加热:减少乙酸、乙醇的挥发。
加热:加快反应速率,蒸出乙酸乙酯,提高乙酸转化率。
分离碳酸钠和乙酸乙酯:分液
酯化反应实验细节解读
分液:将互不相溶的液体混合物分离开来的操作叫分液
检测评价
1、乙酸与乙醇在浓硫酸作用下发生酯化反应,下列叙述错误的是( )
A.浓硫酸起催化剂和吸水剂作用
B.反应中乙醇分子羟基上的氢原子被取代
C.反应中乙酸分子中的羟基被—OCH2CH3取代
D.产物用氢氧化钠溶液吸收,上层得到有水果香味的油状液体
D
2、在实验室制备并获得乙酸乙酯粗产品的实验过程中,下列操作未涉及的是( )
D
作业
课本P82 8
导与练P118 5、P119 6
导与练课时作业P219 3、4、6 P220 8
第三节 乙醇与乙酸
第4课时 乙酸
(醋酸)
某研究小组用如图所示装置制取乙酸乙酯,请回答下列问题:
(1)为防止试管a中液体实验时发生暴沸,加热前应采取的措施为___________________。
(2)装置中的球形漏斗除起冷凝作用外,
它的另一重要作用是__________。
(4)试管b中饱和碳酸钠溶液的作用除了溶解乙醇,还有____________,
_______________ 。
(5)待试管b收集到一定量产物后停止加热,撤去试管b并用力振荡试管b,静置后试管b中所观察到的实验现象:_________________________________ ,要分离试管中的液体混合物,采用的方法为_____。
加入碎瓷片
防止倒吸
降低乙酸乙酯的溶解度
中和乙酸
分层,上层为无色透明有香味的油状液体
分液
(3)试管a中加入浓硫酸的作用是 。
催化剂、吸水剂
知识回顾
合作探究
乙酸与乙醇发生酯化反应所得产物是否纯净 如不纯净,含有何种杂质,如何除去?
不纯净,含有乙酸和乙醇,向产物中加入足量饱和 Na2CO3溶液,充分振荡,再分液。
酯化反应:酸和醇起作用,生成酯和水的反应。
CH3COOH+C2H5OH CH3COOC2H5+H2O
知识回顾
酯化反应历程:
酸中羧基上的羟基和醇羟基上的氢结合成水,剩余部分结合成酯。
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
合作探究
X酸+Y醇→X酸Y酯
甲酸 + 甲醇 → 甲酸甲酯
HCOOH+CH3OH
HCOOCH3+H2O
乙酸 + 甲醇 → 乙酸甲酯
CH3COOH+CH3OH
CH3COOCH3+H2O
甲酸 + 乙醇 → 甲酸乙酯
HCOOH+CH3CH2OH
HCOOCH2CH3+H2O
苯甲酸 + 甲醇 → 苯甲酸甲酯
-COOH+CH3OH
-COOCH3+H2O
酯
(1)酯的概念:
醇与酸反应所得产物
(2)酯的官能团:
酯基 ( C O R或 COOR)
O
(3)酯的结构特点:
难溶于水,易溶于有机溶剂,密度一般比水小。低级酯具有一定的挥发性,有芳香气味。
(4)酯的物理性质:
(R C O R1或RCOOR1)如CH3COOC2H5 C6H5COOCH3
O
酯类广泛存在于自然界中
酯是有芳香气味的液体,存在于各种水果和花草中。如草莓含有乙酸乙酯和乙酸异戊酯,苹果中含有戊酸戊酯,香蕉里含有异戊酸异戊酯等。酯可用作溶剂,也可用作制备饮料和糖果的香料。
类别 Na∽H2 NaHCO3∽CO2 NaOH
1molH2O
1molC2H5OH
1molCH3COOH
1mol-OH
1mol-COOH
羟基氢及羧基氢反应的定量关系
1mol 0.5mol
1mol 0.5mol
1mol 0.5mol 1mol 1mol 1mol
1mol 0.5mol
1mol 0.5mol 1mol 1mol 1mol
2Na+2H2O=2NaOH+H2↑
2Na+2CH3CH2OH→2CH3CH2ONa+H2↑
2Na+2CH3COOH→2CH3COONa+H2↑
2、某有机物的结构简式如下,下列关于该有机物的说法不正确的是 ( )
A、1mol该有机物能与3molNaOH反应
B、1mol该有机物能与3molNaHCO3反应生成3molCO2
C、1mol该有机物能与3molNa反应生成1.5molH2
D、1mol该有机物能与4molNa反应生成2molH2
C
检测评价
3、46g某无色液体与足量钠完全反应,得到11.2L氢气( 标准状况),该物质可能的是( )
A、CH3COOH B、H2O C、C2H5OH D、C6H14知道酯化反应等有机反应类型。
C
课堂小结
检测评价
课本P82 1、2、6
作业
课本P82 6、7
导与练课时作业P219 5 P220 9、10、11
合作探究
问题5:根据学过的知识,如何设计实验比较乙酸与碳酸、盐酸的
酸性强弱?
提示:在一个实验中同时比较乙酸与碳酸、盐酸的酸性强弱比较难,可以设计两个实验来进行比较
实验1,比较乙酸与碳酸的酸性强弱
实验2,比较乙酸与盐酸的酸性强弱
实验1,比较乙酸与碳酸的酸性强弱
(1)A试剂为___________,
B试剂为___________ 。
(2)证明乙酸强于碳酸的实验现象:__________________________________。
稀醋酸
碳酸钠粉末或大理石粉末
当稀醋酸滴入圆底烧瓶时,产生无色气泡,澄清石灰水变浑浊
实验2,比较乙酸与盐酸的酸性强弱
(利用强酸制弱酸原理)
(比较反应速率或测定溶液PH大小)
①用相同浓度的盐酸和醋酸分别和碳酸钙反应,产生气泡快的是 ;
②用相同浓度的盐酸和醋酸分别和锌粒反应,产生气泡快的是 ;
③测定相同浓度醋酸和盐酸溶液的PH值大小,pH小的是 。
盐酸
盐酸
盐酸
①②③三个实验证明盐酸强于醋酸
结论:由实验1和实验2可知,酸性:HCl>CH3COOH>H2CO3
第三节 乙醇与乙酸
第2课时 乙酸
(醋酸)
学习目标
1.了解乙酸的物理性质以及组成和结构,并认识其结构与性质的关系。
2.能描述乙酸的部分化学性质,并能书写相关反应的化学方程式。.知道酯化反应等有机反应类型。
预学导学
阅读课本P79第4、5自然段,了解乙酸的物理性质及其组成和结构,并完成导与练P116 自主梳理1、2部分填空
问题1:冰醋酸是结冰的醋酸吗?
不是,
问题2:根据乙酸的分子结构模型,写出乙酸的结构简式
官能团:
羧基
或—COOH
CH3COOH
乙酸有那些化学性质
(温度低于16.6℃乙酸凝结成类似冰一样的晶体,故又称冰醋酸)
冰醋酸是指纯净的乙酸或者无水乙酸
2CH3COOH + CaCO3 → (CH3COO)2Ca +H2O+CO2↑
问题3:家里的水壶用的时间久了,里面就会留下水垢,水垢的主要成分是 ,用食醋可以清除水壶中的少量水垢,这是利用了乙酸的什么性质?乙酸为什么具有这种性质?该反应类似实验室制CO2反应,请写出该反应的化学方程式。
乙酸呈酸性,乙酸与水垢中难溶于水的碳酸钙发生复分解反应,生成易溶于水的乙酸钙
上述反应说明乙酸的酸性比碳酸的酸性 。即:CH3COOH H2CO3
合作探究
碳酸钙
乙酸分子中含有官能团-COOH,在水中部分电离
CH3COOH CH3COO- +H+
强 >
乙酸是一元弱酸
2HCl + CaCO3 = CaCl2 +H2O+CO2↑
乙酸的酸性比盐酸的酸性 。即:CH3COOH HCl
弱 <
酸性强弱顺序:
HCl>CH3COOH>H2CO3
乙酸根离子
(酸性强的酸制取酸性弱的酸)
乙酸的化学性质---导与练P116
1、弱酸性
问题4:乙酸是一元弱酸,具有酸的通性,除与碳酸钙反应外,还能与什么物质反应?
①与指示剂反应
能使紫色石蕊溶液变红
②与金属发生置换反应(Na、Mg、Al、Zn、Fe等)
2Na + 2CH3COOH → 2CH3COONa + H2↑
③与碱性氧化物反应(如Na2O、CaO、CuO等)
④与碱反应(NaOH、Cu(0H)2)
NaOH+ CH3COOH → CH3COONa + H2O
⑤与盐反应(Na2CO3 NaHCO3 )
合作探究
CH3COOH+NaHCO3 → CH3COONa+CO2↑+H2O
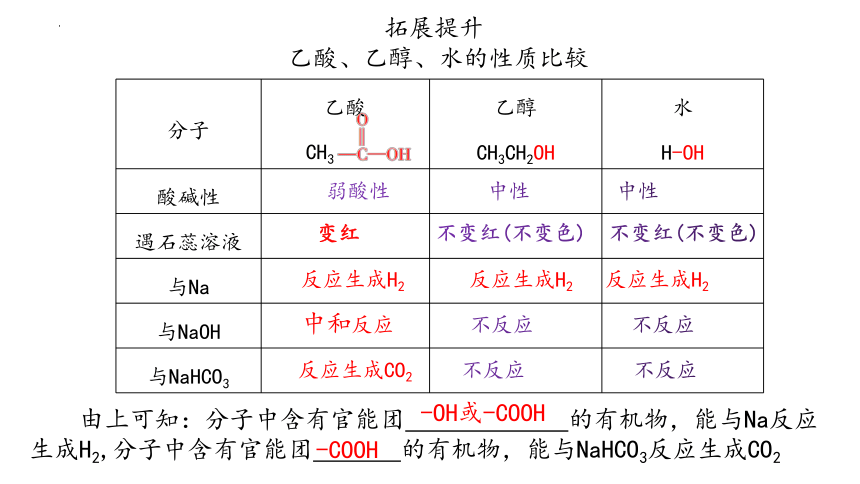
拓展提升
分子 乙酸 乙醇 CH3CH2OH 水
H-OH
酸碱性
遇石蕊溶液
与Na
与NaOH
与NaHCO3
变红 不变红(不变色) 不变红(不变色)
反应生成H2 反应生成H2 反应生成H2
乙酸、乙醇、水的性质比较
弱酸性 中性 中性
中和反应 不反应 不反应
反应生成CO2 不反应 不反应
CH3
由上可知:分子中含有官能团 的有机物,能与Na反应生成H2,分子中含有官能团 的有机物,能与NaHCO3反应生成CO2
-OH或-COOH
-COOH
检测评价
1、乙酸是生活中常见的一种有机化合物,下列关于乙酸的说法中正确的是 ( )
A.乙酸分子中含有4个氢原子,所以乙酸不是一元酸
B.乙酸的酸性比碳酸的弱,不能使紫色石蕊溶液变红
C.乙酸溶液又称冰醋酸
D.乙酸能够与金属钠反应产生氢气
2、下列物质中不能用来鉴别乙醇和乙酸的是( )
A、铁粉 B、溴水 C、碳酸钠溶液 D、紫色石蕊溶液知道酯化反应等有机反应类型。
D
B
3、下列叙述不正确的是 ( )
A.乙酸的最简式为CH2O
B.相同物质的量浓度的乙酸溶液和碳酸相比,pH小的是乙酸
C.用钠除去乙酸混有少量的水
D.分别向等体积等浓度的盐酸和醋酸溶液中加入足量的锌粒,盐酸产生氢气的速率大
C
4、高强度运动会导致肌肉乳酸堆积,产生酸痛感。已知乳酸的结构简式如右图所示,关于乳酸的说法错误的是( )
A.能与NaOH反应
B.乳酸不能使紫色石蕊试液变红C.能与NaHCO3反应生成CO2
D.能与钠反应的官能团有2种
B
作业
导与练P118 1、2
导与练课时作业P219 1、2
第三节 乙醇与乙酸
第3课时 乙酸
(醋酸)
学习目标
1.正确理解羟基氢及羧基氢反应的定量关系。
2.通过乙酸乙酯的制备实验探究,能描述相应性质实验的现象并加以分析说明,能从微观结构利用官能团解释酯化反应。.知道酯化反应等有机反应类型。
烧鱼时常加醋并加点酒,这样鱼的味道就变得 无腥、香醇,特别鲜美。
实验探究
酯化反应
液面上层有无色透明、
不溶于水的油状液体产生,并可以闻到香味。
在一支试管中加入3 mL 乙醇,然后边振荡试管边加慢慢加入2 mL浓硫酸和2 mL 乙酸,再加入几片碎瓷片。连接好装置,用酒精灯小心加热,将产生的蒸气经导管通到饱和碳酸钠液面上 ,观察现象 。
2. 酯化反应
乙酸的化学性质
CH3—C—OH + C2H5 —OH CH3—C—O—C2H5 + H2O
浓硫酸
=
=
O
O
乙酸乙酯(果香味)
合作探究
思考: 乙酸和乙醇可能是以怎样的方式相互结合的呢?结合过程中乙酸和乙醇是如何断键的?
可能一
a、
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
可能二
b、
CH3—C—O—H+HO—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
酯化反应:酸和醇起作用,生成酯和水的反应。
CH3COOH+C2H5OH CH3COOC2H5+H2O
合作探究
思考:前面已学过那些有机反应类型,酯化反应属于那种反应类型?
取代反应
酯化反应历程:
酸中羧基上的羟基和醇羟基上的氢结合成水,剩余部分结合成酯。
碎瓷片防暴沸
导管在饱和Na2CO3液面上:防止倒吸
长导管冷凝、回流、导气作用
加物顺序:乙醇→浓硫酸→乙酸
饱和Na2CO3作用
①溶解乙醇;
②中和乙酸;
③降低乙酸乙酯的溶解度,利于酯的析出
浓硫酸:催化剂、吸水剂
沸点:
乙酸乙酯(77.1)
乙醇(78.3 ℃ )
乙酸(118℃)
小心加热:减少乙酸、乙醇的挥发。
加热:加快反应速率,蒸出乙酸乙酯,提高乙酸转化率。
分离碳酸钠和乙酸乙酯:分液
酯化反应实验细节解读
分液:将互不相溶的液体混合物分离开来的操作叫分液
检测评价
1、乙酸与乙醇在浓硫酸作用下发生酯化反应,下列叙述错误的是( )
A.浓硫酸起催化剂和吸水剂作用
B.反应中乙醇分子羟基上的氢原子被取代
C.反应中乙酸分子中的羟基被—OCH2CH3取代
D.产物用氢氧化钠溶液吸收,上层得到有水果香味的油状液体
D
2、在实验室制备并获得乙酸乙酯粗产品的实验过程中,下列操作未涉及的是( )
D
作业
课本P82 8
导与练P118 5、P119 6
导与练课时作业P219 3、4、6 P220 8
第三节 乙醇与乙酸
第4课时 乙酸
(醋酸)
某研究小组用如图所示装置制取乙酸乙酯,请回答下列问题:
(1)为防止试管a中液体实验时发生暴沸,加热前应采取的措施为___________________。
(2)装置中的球形漏斗除起冷凝作用外,
它的另一重要作用是__________。
(4)试管b中饱和碳酸钠溶液的作用除了溶解乙醇,还有____________,
_______________ 。
(5)待试管b收集到一定量产物后停止加热,撤去试管b并用力振荡试管b,静置后试管b中所观察到的实验现象:_________________________________ ,要分离试管中的液体混合物,采用的方法为_____。
加入碎瓷片
防止倒吸
降低乙酸乙酯的溶解度
中和乙酸
分层,上层为无色透明有香味的油状液体
分液
(3)试管a中加入浓硫酸的作用是 。
催化剂、吸水剂
知识回顾
合作探究
乙酸与乙醇发生酯化反应所得产物是否纯净 如不纯净,含有何种杂质,如何除去?
不纯净,含有乙酸和乙醇,向产物中加入足量饱和 Na2CO3溶液,充分振荡,再分液。
酯化反应:酸和醇起作用,生成酯和水的反应。
CH3COOH+C2H5OH CH3COOC2H5+H2O
知识回顾
酯化反应历程:
酸中羧基上的羟基和醇羟基上的氢结合成水,剩余部分结合成酯。
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
=
=
O
O
合作探究
X酸+Y醇→X酸Y酯
甲酸 + 甲醇 → 甲酸甲酯
HCOOH+CH3OH
HCOOCH3+H2O
乙酸 + 甲醇 → 乙酸甲酯
CH3COOH+CH3OH
CH3COOCH3+H2O
甲酸 + 乙醇 → 甲酸乙酯
HCOOH+CH3CH2OH
HCOOCH2CH3+H2O
苯甲酸 + 甲醇 → 苯甲酸甲酯
-COOH+CH3OH
-COOCH3+H2O
酯
(1)酯的概念:
醇与酸反应所得产物
(2)酯的官能团:
酯基 ( C O R或 COOR)
O
(3)酯的结构特点:
难溶于水,易溶于有机溶剂,密度一般比水小。低级酯具有一定的挥发性,有芳香气味。
(4)酯的物理性质:
(R C O R1或RCOOR1)如CH3COOC2H5 C6H5COOCH3
O
酯类广泛存在于自然界中
酯是有芳香气味的液体,存在于各种水果和花草中。如草莓含有乙酸乙酯和乙酸异戊酯,苹果中含有戊酸戊酯,香蕉里含有异戊酸异戊酯等。酯可用作溶剂,也可用作制备饮料和糖果的香料。
类别 Na∽H2 NaHCO3∽CO2 NaOH
1molH2O
1molC2H5OH
1molCH3COOH
1mol-OH
1mol-COOH
羟基氢及羧基氢反应的定量关系
1mol 0.5mol
1mol 0.5mol
1mol 0.5mol 1mol 1mol 1mol
1mol 0.5mol
1mol 0.5mol 1mol 1mol 1mol
2Na+2H2O=2NaOH+H2↑
2Na+2CH3CH2OH→2CH3CH2ONa+H2↑
2Na+2CH3COOH→2CH3COONa+H2↑
2、某有机物的结构简式如下,下列关于该有机物的说法不正确的是 ( )
A、1mol该有机物能与3molNaOH反应
B、1mol该有机物能与3molNaHCO3反应生成3molCO2
C、1mol该有机物能与3molNa反应生成1.5molH2
D、1mol该有机物能与4molNa反应生成2molH2
C
检测评价
3、46g某无色液体与足量钠完全反应,得到11.2L氢气( 标准状况),该物质可能的是( )
A、CH3COOH B、H2O C、C2H5OH D、C6H14知道酯化反应等有机反应类型。
C
课堂小结
检测评价
课本P82 1、2、6
作业
课本P82 6、7
导与练课时作业P219 5 P220 9、10、11
合作探究
问题5:根据学过的知识,如何设计实验比较乙酸与碳酸、盐酸的
酸性强弱?
提示:在一个实验中同时比较乙酸与碳酸、盐酸的酸性强弱比较难,可以设计两个实验来进行比较
实验1,比较乙酸与碳酸的酸性强弱
实验2,比较乙酸与盐酸的酸性强弱
实验1,比较乙酸与碳酸的酸性强弱
(1)A试剂为___________,
B试剂为___________ 。
(2)证明乙酸强于碳酸的实验现象:__________________________________。
稀醋酸
碳酸钠粉末或大理石粉末
当稀醋酸滴入圆底烧瓶时,产生无色气泡,澄清石灰水变浑浊
实验2,比较乙酸与盐酸的酸性强弱
(利用强酸制弱酸原理)
(比较反应速率或测定溶液PH大小)
①用相同浓度的盐酸和醋酸分别和碳酸钙反应,产生气泡快的是 ;
②用相同浓度的盐酸和醋酸分别和锌粒反应,产生气泡快的是 ;
③测定相同浓度醋酸和盐酸溶液的PH值大小,pH小的是 。
盐酸
盐酸
盐酸
①②③三个实验证明盐酸强于醋酸
结论:由实验1和实验2可知,酸性:HCl>CH3COOH>H2CO3
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
