2023届高考化学二轮复习专题课件化工流程题中的曲线分析应用(共19张PPT)
文档属性
| 名称 | 2023届高考化学二轮复习专题课件化工流程题中的曲线分析应用(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-04 11:06:06 | ||
图片预览


文档简介
(共19张PPT)
重点题空热练(三) 化工流程题中的 曲线分析应用
2023届高考化学二轮复习专题课件★★
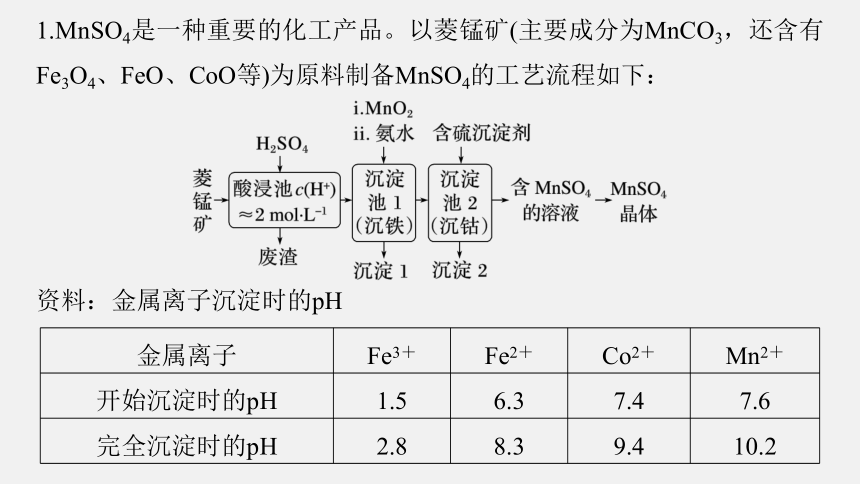
1.MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、CoO等)为原料制备MnSO4的工艺流程如下:
资料:金属离子沉淀时的pH
金属离子 Fe3+ Fe2+ Co2+ Mn2+
开始沉淀时的pH 1.5 6.3 7.4 7.6
完全沉淀时的pH 2.8 8.3 9.4 10.2
(1)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是________________
________________________________________。
离子反应生成氢氧化锰沉淀而使锰元素损失
因为NaOH能与锰
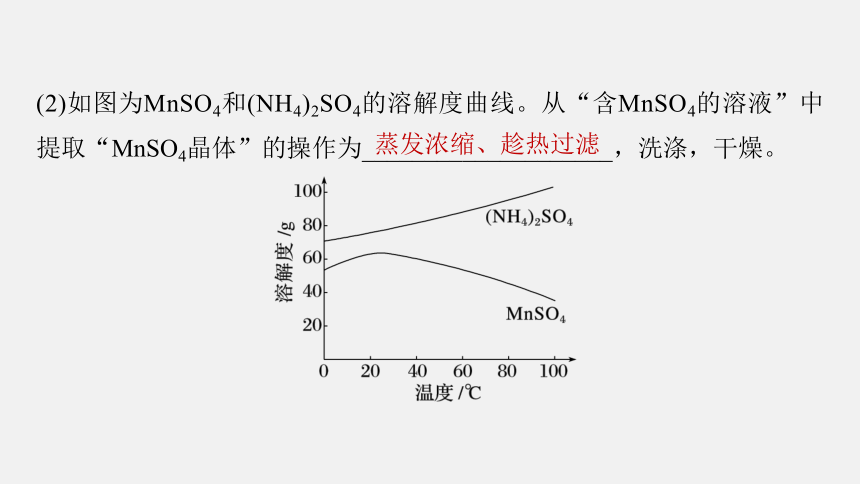
(2)如图为MnSO4和(NH4)2SO4的溶解度曲线。从“含MnSO4的溶液”中提取“MnSO4晶体”的操作为____________________,洗涤,干燥。
蒸发浓缩、趁热过滤
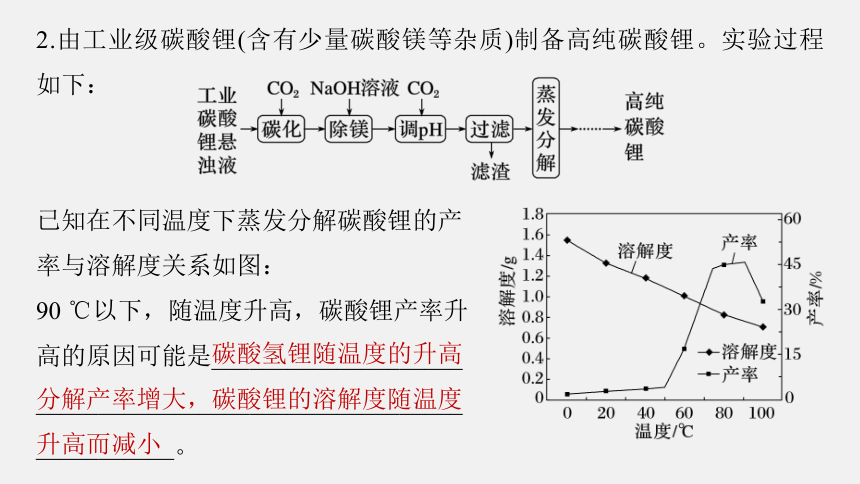
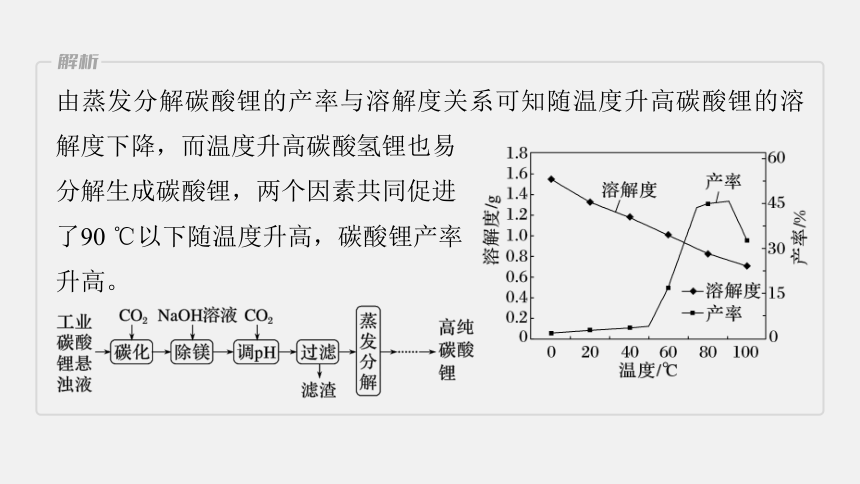
2.由工业级碳酸锂(含有少量碳酸镁等杂质)制备高纯碳酸锂。实验过程如下:
已知在不同温度下蒸发分解碳酸锂的产
率与溶解度关系如图:
90 ℃以下,随温度升高,碳酸锂产率升
高的原因可能是____________________
__________________________________
___________。
碳酸氢锂随温度的升高
分解产率增大,碳酸锂的溶解度随温度
升高而减小
由蒸发分解碳酸锂的产率与溶解度关系可知随温度升高碳酸锂的溶解度下降,而温度升高碳酸氢锂也易
分解生成碳酸锂,两个因素共同促进
了90 ℃以下随温度升高,碳酸锂产率
升高。
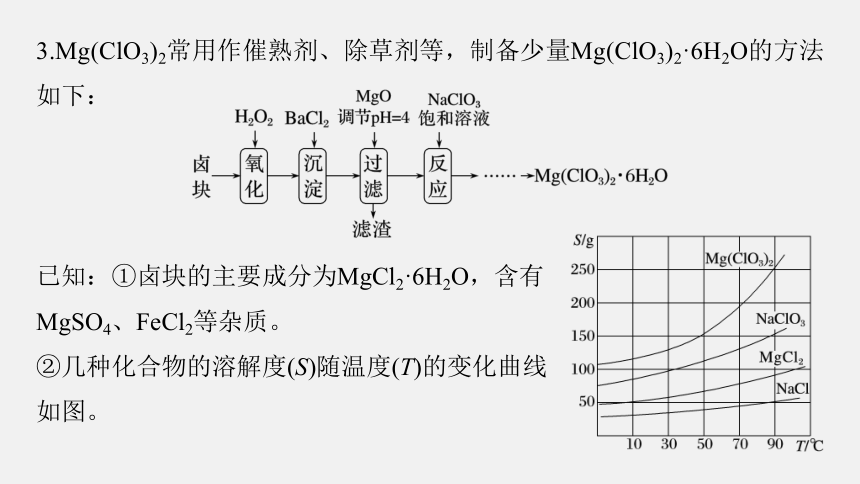
3.Mg(ClO3)2常用作催熟剂、除草剂等,制备少量Mg(ClO3)2·6H2O的方法如下:
已知:①卤块的主要成分为MgCl2·6H2O,含有
MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)的变化曲线
如图。
(1)加入BaCl2的目的是除_______(填离子符号),如何判断该离子已除尽:______________________________________________________________。
静置,取上层清液加入BaCl2溶液,若无白色沉淀生成,则 已除尽
(2)加入NaClO3饱和溶液会发生反应:MgCl2+2NaClO3===Mg(ClO3)2+2NaCl↓,请利用该反应,结合溶解度图,制取Mg(ClO3)2·6H2O的实验步骤依次为①取样,加入NaClO3饱和溶液充分反应;②蒸发浓缩;
③_________;④冷却结晶;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
趁热过滤
4.从铜氨废液{含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、 等}中回收铜的工艺流程如下:
(1)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为_____________
________________________________________。
2[Cu(NH3)4]2+
(2)pH与铜的回收率关系如图所示,为尽可能提高铜的回收率,需控制的pH约为_____________。
6(或5.5~6.5)
5.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如下:
“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为_________
__________________________________;该过程中浸出时间和液固比对锰浸出率的影响分别如图所示。
则适宜的浸出时间和液固比分别为________、__________。
3MnO2+
2Fe+12H+===3Mn2++2Fe3++6H2O
60 min
3∶1(或3)
6.金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3等]为原料制备钛的工艺流程如下:
滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为_________________________________________,硫酸质量分数对钛、铁浸出率的影响如图所示,据此判断,酸浸时所加硫酸的质量分数应为___________(填范围)。
80%~85%
7.2019年诺贝尔化学奖颁给了为锂电池发展作出突出贡献的三位科学家。某废旧锂电池正极主要由LiFePO4、铝箔、炭黑等组成,Fe、Li、P具有极高的回收价值,具体流程如下:
浸出液X的主要成分为Li+、Fe3+、 等。过程③控制碳酸钠溶液浓度20%、温度85 ℃、反应时间3 h条件下,探究pH对磷酸铁沉淀的影响,如图所示。
(1)综合考虑铁和磷沉淀率,最佳pH为_____。
2.5
(2)结合平衡移动原理,解释过程③中pH增大,铁和磷沉淀率增大的原因:______________________________________________________________________________________________________________________________________________________。
与Fe3+结合形成磷酸铁沉淀
(3)当pH>2.5后,随pH增加,磷沉淀率出现了减小的趋势,解释其原因:_________________________________________________________________________________________。
pH>2.5时,沉淀中的磷酸铁会有部分开始转变生成Fe(OH)3,使得部分
释放,导致磷沉淀率下降
已知 ,当pH>2.5后,随pH增大,溶液中c(OH-)增大,Fe3+开始转变生成Fe(OH)3,促进溶解平衡正向移动,使得部分 释放,导致磷沉淀率下降。
重点题空热练(三) 化工流程题中的 曲线分析应用
2023届高考化学二轮复习专题课件★★
1.MnSO4是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有Fe3O4、FeO、CoO等)为原料制备MnSO4的工艺流程如下:
资料:金属离子沉淀时的pH
金属离子 Fe3+ Fe2+ Co2+ Mn2+
开始沉淀时的pH 1.5 6.3 7.4 7.6
完全沉淀时的pH 2.8 8.3 9.4 10.2
(1)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是________________
________________________________________。
离子反应生成氢氧化锰沉淀而使锰元素损失
因为NaOH能与锰
(2)如图为MnSO4和(NH4)2SO4的溶解度曲线。从“含MnSO4的溶液”中提取“MnSO4晶体”的操作为____________________,洗涤,干燥。
蒸发浓缩、趁热过滤
2.由工业级碳酸锂(含有少量碳酸镁等杂质)制备高纯碳酸锂。实验过程如下:
已知在不同温度下蒸发分解碳酸锂的产
率与溶解度关系如图:
90 ℃以下,随温度升高,碳酸锂产率升
高的原因可能是____________________
__________________________________
___________。
碳酸氢锂随温度的升高
分解产率增大,碳酸锂的溶解度随温度
升高而减小
由蒸发分解碳酸锂的产率与溶解度关系可知随温度升高碳酸锂的溶解度下降,而温度升高碳酸氢锂也易
分解生成碳酸锂,两个因素共同促进
了90 ℃以下随温度升高,碳酸锂产率
升高。
3.Mg(ClO3)2常用作催熟剂、除草剂等,制备少量Mg(ClO3)2·6H2O的方法如下:
已知:①卤块的主要成分为MgCl2·6H2O,含有
MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)的变化曲线
如图。
(1)加入BaCl2的目的是除_______(填离子符号),如何判断该离子已除尽:______________________________________________________________。
静置,取上层清液加入BaCl2溶液,若无白色沉淀生成,则 已除尽
(2)加入NaClO3饱和溶液会发生反应:MgCl2+2NaClO3===Mg(ClO3)2+2NaCl↓,请利用该反应,结合溶解度图,制取Mg(ClO3)2·6H2O的实验步骤依次为①取样,加入NaClO3饱和溶液充分反应;②蒸发浓缩;
③_________;④冷却结晶;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
趁热过滤
4.从铜氨废液{含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO-、 等}中回收铜的工艺流程如下:
(1)步骤(Ⅵ)发生反应生成难溶Cu2(OH)3Cl的离子方程式为_____________
________________________________________。
2[Cu(NH3)4]2+
(2)pH与铜的回收率关系如图所示,为尽可能提高铜的回收率,需控制的pH约为_____________。
6(或5.5~6.5)
5.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如下:
“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为_________
__________________________________;该过程中浸出时间和液固比对锰浸出率的影响分别如图所示。
则适宜的浸出时间和液固比分别为________、__________。
3MnO2+
2Fe+12H+===3Mn2++2Fe3++6H2O
60 min
3∶1(或3)
6.金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3等]为原料制备钛的工艺流程如下:
滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为_________________________________________,硫酸质量分数对钛、铁浸出率的影响如图所示,据此判断,酸浸时所加硫酸的质量分数应为___________(填范围)。
80%~85%
7.2019年诺贝尔化学奖颁给了为锂电池发展作出突出贡献的三位科学家。某废旧锂电池正极主要由LiFePO4、铝箔、炭黑等组成,Fe、Li、P具有极高的回收价值,具体流程如下:
浸出液X的主要成分为Li+、Fe3+、 等。过程③控制碳酸钠溶液浓度20%、温度85 ℃、反应时间3 h条件下,探究pH对磷酸铁沉淀的影响,如图所示。
(1)综合考虑铁和磷沉淀率,最佳pH为_____。
2.5
(2)结合平衡移动原理,解释过程③中pH增大,铁和磷沉淀率增大的原因:______________________________________________________________________________________________________________________________________________________。
与Fe3+结合形成磷酸铁沉淀
(3)当pH>2.5后,随pH增加,磷沉淀率出现了减小的趋势,解释其原因:_________________________________________________________________________________________。
pH>2.5时,沉淀中的磷酸铁会有部分开始转变生成Fe(OH)3,使得部分
释放,导致磷沉淀率下降
已知 ,当pH>2.5后,随pH增大,溶液中c(OH-)增大,Fe3+开始转变生成Fe(OH)3,促进溶解平衡正向移动,使得部分 释放,导致磷沉淀率下降。
同课章节目录
