模块2 其他常见的羧酸 学案 高中化学 人教版(2019) 选择性必修3 第三章 烃的衍生物(含解析)
文档属性
| 名称 | 模块2 其他常见的羧酸 学案 高中化学 人教版(2019) 选择性必修3 第三章 烃的衍生物(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-05 08:57:57 | ||
图片预览



文档简介
模块2 其他常见羧酸
1认识并了解常见羧酸。
2会书写相应化学方程式。
三、特殊羧酸的性质
1甲酸 (俗称蚁酸)
(1) 结构:
(2) 性质:
甲酸中既有类醛基结构又有羧基,所以兼具有类似醛基的性质和羧基的性质。
>> 注 意 <<
① 能发生银镜反应的有机物一定含有醛基,但不一定是醛,如甲酸、甲酸甲酯等。
② 甲酸具有还原性,因此甲酸也能使 KMnO4 溶液褪色。
知识精炼
1.下列各组物质可用酸性KMnO4溶液鉴别的是
A.油酸和硬脂酸 B.苯和己烷 C.乙烯和乙炔 D.甲酸和甲醛
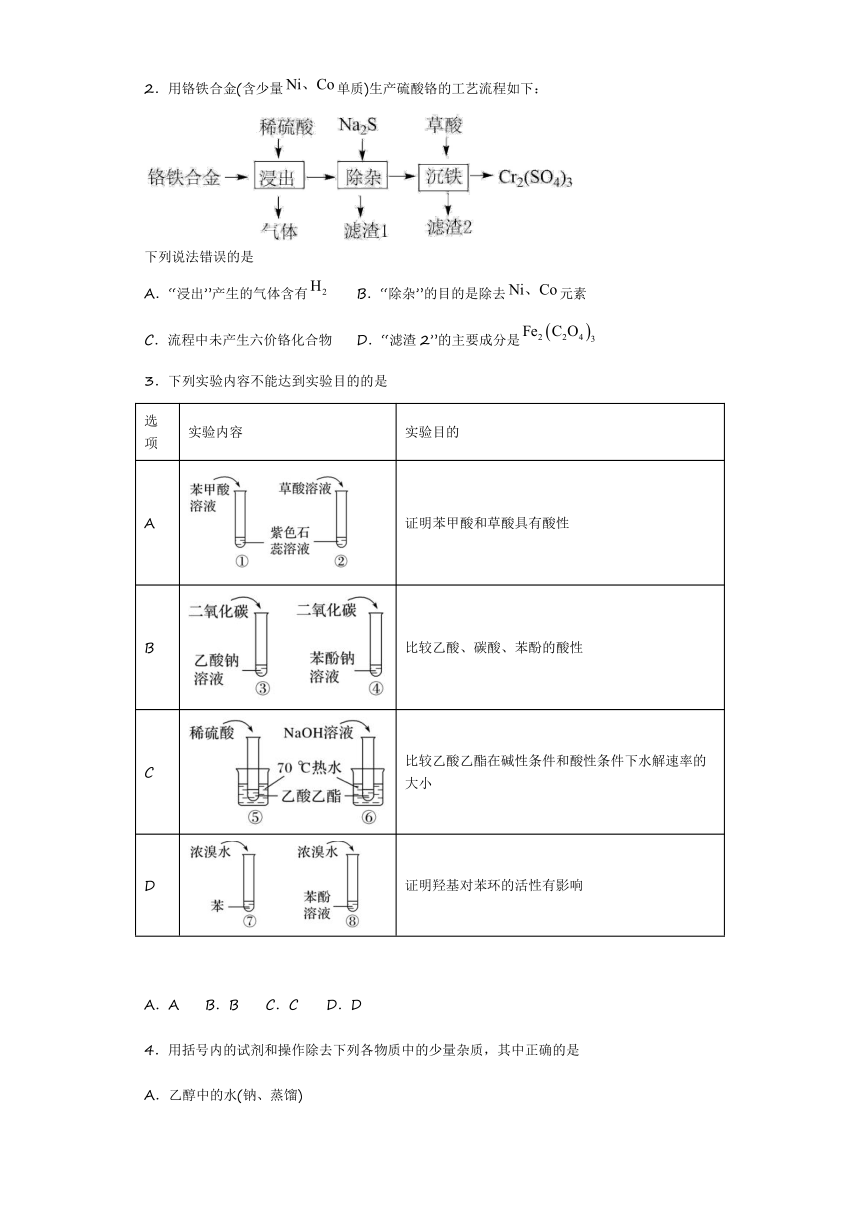
2.用铬铁合金(含少量单质)生产硫酸铬的工艺流程如下:
下列说法错误的是
A.“浸出”产生的气体含有 B.“除杂”的目的是除去元素
C.流程中未产生六价铬化合物 D.“滤渣2”的主要成分是
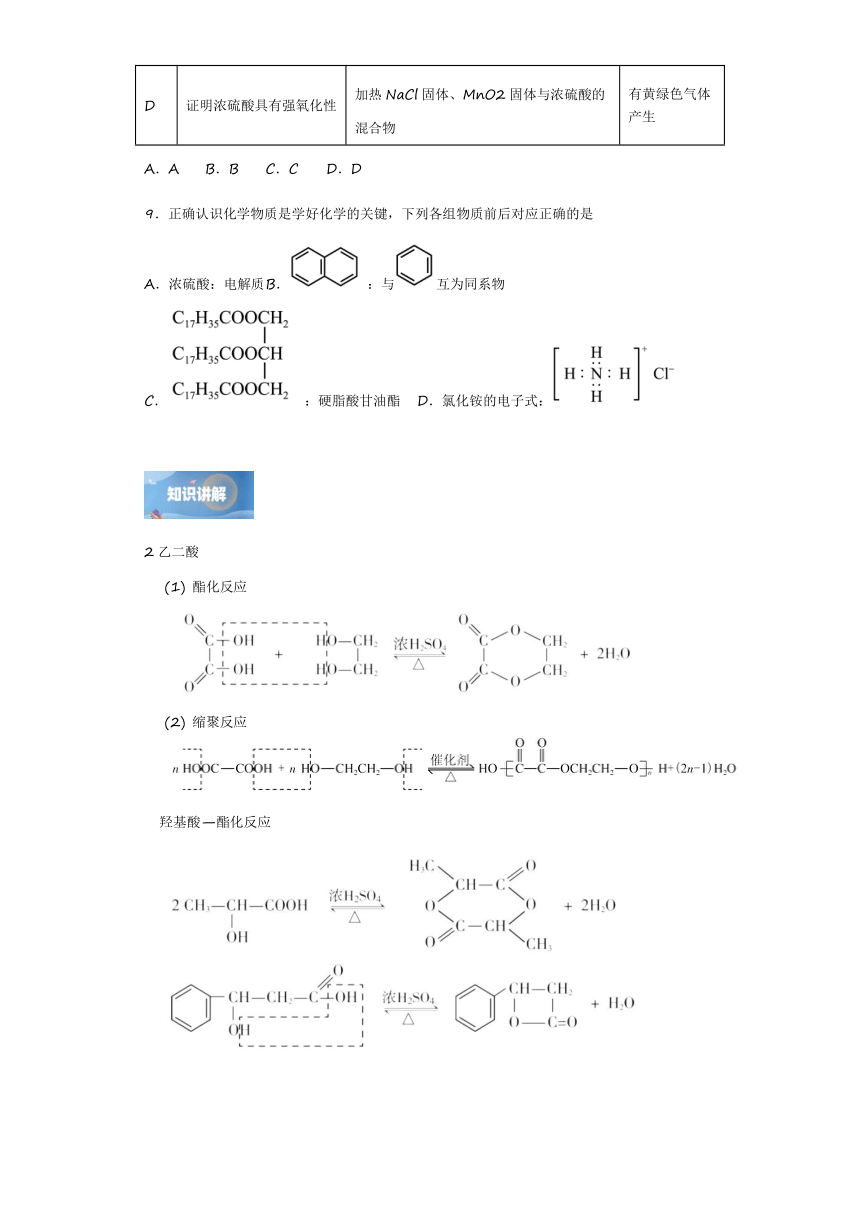
3.下列实验内容不能达到实验目的的是
选项 实验内容 实验目的
A 证明苯甲酸和草酸具有酸性
B 比较乙酸、碳酸、苯酚的酸性
C 比较乙酸乙酯在碱性条件和酸性条件下水解速率的大小
D 证明羟基对苯环的活性有影响
A.A B.B C.C D.D
4.用括号内的试剂和操作除去下列各物质中的少量杂质,其中正确的是
A.乙醇中的水(钠、蒸馏)
B.苯甲酸中的氯化钠(水、重结晶)
C.淀粉中的氯化钠(水、过滤)
D.乙烷中的乙烯(酸性高锰酸钾溶液、洗气)
5.化学与生产、生活密切相关,下列说法正确的是
A.金属在潮湿的空气中生锈,主要发生析氢腐蚀
B.工业废水中的Ag+、Hg2+等重金属离子可通过加适量Na2S除去
C.皮肤被昆虫叮咬后会产生红疹,主要是由于昆虫分泌出来的液体中含有乙酸
D.明矾和漂白粉常用于自来水的净化和杀菌消毒,均利用了其氧化性
6.下列物质对应的化学式不正确的是
A.软脂酸: B.蚁酸:
C.纯碱: D.摩尔盐:
7.下列有关常见羧酸的说法正确的是
A.甲酸是一种无色有刺激性气味的气体,易溶于水
B.乙酸的沸点低于丙醇,高于乙醇
C.苯甲酸的酸性比碳酸强,可以和碳酸氢钠反应制取CO2
D.乙二酸具有酸性,因此可以使酸性KMnO4溶液褪色
8.为实现下列实验目的,实验操作和实验现象都正确的是
选项 实验目的 实验操作 实验现象
A 证明金属性Na>Cu 少量金属Na与蓝矾隔绝空气加热 有红色固体生成
B 证明HCOOH具有还原性 HCOOH溶液中加入少量新制氢氧化铜悬浊液并加热 有砖红色沉淀产生
C 证明维生素C可用作抗氧化剂 向FeCl3和 KSCN混合溶液中加入足量维生素C 溶液红色褪去
D 证明浓硫酸具有强氧化性 加热NaCl固体、MnO2固体与浓硫酸的混合物 有黄绿色气体产生
A.A B.B C.C D.D
9.正确认识化学物质是学好化学的关键,下列各组物质前后对应正确的是
A.浓硫酸:电解质 B. :与互为同系物
C. :硬脂酸甘油酯 D.氯化铵的电子式:
2乙二酸
酯化反应
缩聚反应
3 羟基酸—酯化反应
知识精炼
10.乙二酸又称草酸,通常在空气中易被氧化而变质,但H2C2O4·2H2O能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O作还原剂定量测定KMnO4的含量。下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O42H++
B.草酸溶液滴定KMnO4属于中和滴定,可用石蕊作指示剂
C.乙二酸可由乙烯经加成反应、水解反应、氧化反应制得
D.乙二酸既不溶于水也不溶于乙醇
11.以含锰废催化剂(主要成分是)和,还含有少量的、炭黑、等)为原料制备碳酸锰的工艺流程如图所示。已知:具有强氧化性,能与常见的还原剂反应。有关说法错误的是
A.“热浸取”时,稀硫酸可以用浓盐酸代替且不会造成污染
B.“热浸取”时,主要的离子反应方程式为
C.“除杂”时,滤渣Ⅱ的主要成分为氢氧化铁
D.“炭化”时,滤液Ⅱ中含有
12.下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:
B.甲酸溶液与新制氢氧化铜碱性浊液混合加热:
C.苯酚钠溶液中通入少量二氧化碳:
D.甲醛溶液与足量的银氨溶液共热:
13.试剂可以鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液
A.新制Cu(OH)2悬浊液 B.浓溴水
C.银氨溶液 D.FeCl3溶液
14.菠菜、苋菜等蔬菜富含草酸(H2C2O4)。为了探究草酸的性质,进行如下实验。
实验 装置 试剂 现象
① 澄清石灰水 产生白色浑浊
② 澄清石灰水 产生白色沉淀
③ NaClO溶液 产生无色气泡
④ 酸性KMnO4溶液 紫红色溶液褪色
对四组实验进行分析,下列由上述实验得到的反应方程式不正确的是
A.①:
B.②:
C.③:
D.④:
15.下列实验操作、现象及结论都正确的是
选项 实验操作 现象 结论
A 向两份蛋白质溶液中分别加入甲醛和(NH4)2SO4饱和溶液 均有白色沉淀 蛋白质均发生了变性
B 向甲酸中加入银氨溶液,水浴加热 有光亮的银镜产生 银氨溶液也能被羧基还原
C 向苯酚钠溶液中滴加乙酸溶液 溶液变浑浊 相同条件下,乙酸的酸性比苯酚强
D 用酒精灯灼烧某有机物 有刺激性气味气体产生 该有机物是蛋白质
A.A B.B C.C D.D
16.捕获二氧化碳生成甲酸的过程如图所示,下列说法错误的是
A.甲酸可与碳酸氢钠发生反应,有气体生成
B.甲酸分子中所有的原子可能在同一平面上
C.甲酸、醋酸都可以与水任意比互溶,所以含有的化合物都可以与水任意比互溶
D.该方法有利于减缓温室效应
17.某物质中可能有甲酸、乙酸、甲酸乙酯、乙醇中的一种或几种,在鉴定时有下列现象:(1)有银镜反应;(2)加入新制的氢氧化铜的悬浊液,沉淀不溶解;(3)与含酚酞的氢氧化钠溶液共热,溶液颜色逐渐变浅。下列判断正确的是
A.有甲酸和甲酸乙酯 B.有甲酸乙酯和乙醇
C.有甲酸乙酯,可能有乙醇 D.有甲酸和乙酸,可能有甲酸乙酯
18.下列物质与俗名对应的是
A.草酸:CH3COOH B.蚁醛:CH3CHO
C.TNT: D.氯仿:CCl4
19.化学与生产、生活、社会密切相关。下列有关说法正确的是
A.来苏水(主要成分甲酚)和过氧乙酸混合使用,消毒效果更好
B.冰箱中放入活性炭,能起到除异味和杀菌作用
C.福尔马林具有防腐作用,可用作食品的保鲜剂
D.肥皂水可用作蚊虫叮咬处的清洗剂
20.下列化学用语使用正确的是
A.硝基苯的结构简式为
B.甲酸中存在和两种官能团
C.乙醚分子的球棍模型为
D.乙炔的电子式为
21.下列有机物中,不属于羧酸的是
A.乙二酸 B.苯甲酸 C.石炭酸 D.硬脂酸
22.下面关于物质性质和用途的陈述都正确,且存在因果关系的是
A.乙二酸具有酸性,能使酸性高锰酸钾溶液褪色
B.油脂在碱性水溶液中能水解,可用于制备肥皂
C.氨基酸具有两性,可发生缩聚反应制备高分子
D.葡萄糖、蔗糖都是还原性糖,可用于在玻璃上镀银
23(多选).下列离子方程式正确的是
A.甲酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O
B.醋酸溶液与Cu(OH)2:2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
C.苯酚钠溶液通少量CO2 :2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D.甲醛溶液与足量的银氨溶液共热:HCHO +4Ag(NH3)2++4OH- CO32-+2NH4++4Ag↓ +6NH3+2H2O
24.HCOOH和CH3COOH具有相同的官能团,性质相似。(____)
25.乙二酸、苯甲酸、硬脂酸、石炭酸都属于羧酸类有机物。( )
26.某兴趣小组设计实验探究,催化空气氧化的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备(加热及夹持装置省略),反应方程式:
(1)装置A中盛放甲酸的仪器的名称是_______。
(2)从B、C、D中选择合适的装置收集,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______。
步骤Ⅲ 探究催化空气氧化的效率
将一定量与空气混合,得到体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至,按一定流速通入气体样品。(已知:是白色固体,易吸水潮解:)
(4)通入(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了。
①能证明被空气氧化的现象是_______;
②被催化氧化的百分率为_______;
③若未通入氮气,②的结果将_______(填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______。
27.常见的羧酸
典型羧酸 物理性质 主要用途
甲酸(蚁酸)HCOOH 无色、有____气味的液体,有____性,能与____等互溶 在工业上可用作还原剂,是合成医药、农药和染料等的原料
苯甲酸(安息香酸) ____色晶体,易升华,微溶于____,易溶于____ 用于合成香料、药物等,其钠盐是常用的食品____
乙二酸(草酸)HOOC—COOH 无色____,通常含有____,可溶于____和_____ 化学分析中常用的____,也是重要的化工原料
28.牛奶放置时间长了会变酸,这是因为牛奶中含有的乳糖在微生物的作用下分解变成了乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为CH3CH(OH)COOH。完成下列问题:
(1)写出乳酸与足量金属钠反应的化学方程式:__________。
(2)乳酸发生下列变化:
所用的试剂是a________,b________(写化学式);写出乳酸与少量碳酸钠溶液反应的化学方程式:___________。
(3)写出下列反应的化学方程式,并注明反应类型。
乳酸与乙醇反应:__________,________。
(4)乳酸在浓硫酸作用下,两分子相互反应生成六元环状结构的物质,写出此生成物的结构简式_______。
29.已知两个羟基同时连在同一碳原子上的结构是不稳定的,它要发生脱水反应:
现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应
试回答下列问题:
(1)X为____________________(填元素符号);
(2)上述转化中其中属于氧化反应的共有_______步(填数字);M与NaOH溶液共热反应的所属类型是_______________ 反应。
(3)M的结构简式为 ________________________________
(4)写出下列反应的化学方程:
E和银氨溶液反应的化学方程式:_______________________________________________
试卷第1页,共3页
参考答案:
1.A
【详解】A.油酸中含有碳碳双键,能使酸性高锰酸钾溶液褪色,而硬脂酸不含不饱和键,不能是酸性高锰酸钾溶液褪色,故可用酸性高锰酸钾溶液鉴别,A符合题意;
B.苯和己烷分子中均不含不饱和键,不能使酸性高锰酸钾溶液褪色,故不可用酸性高锰酸钾溶液鉴别,B不合题意;
C.乙烯和乙炔均可使酸性高锰酸钾溶液鉴别,故不可用酸性高锰酸钾溶液鉴别,C不合题意;
D.甲酸和甲醛均均有还原性,均可使酸性高锰酸钾溶液鉴别,故不可用酸性高锰酸钾溶液鉴别,D不合题意;
故答案为:A。
2.D
【分析】由流程可知,加入稀硫酸溶解,生成气体为氢气,溶液中含加入Na2S分离出滤渣1含CoS和NiS,不会沉淀,再加入草酸除铁生成FeC2O4,过滤分离出硫酸铬,以此来解答。
【详解】A.四种金属均与稀硫酸反应生成H2,A正确;
B.共有四种金属,由流程可知,沉铁后分离出硫酸铬,则“除杂"的目的是除去Ni、Co元素,B正确;
C.由上述分析可知,流程中未产生六价铬化合物,C正确;
D.“滤渣2”的主要成分是FeC2O4,D错误;
故本题选D。
3.B
【详解】A.酸性溶液能使紫色石蕊试液变红,故变红现象可证明苯甲酸和草酸具有酸性,则A正确;
B.二氧化碳通入乙酸钠溶液没有现象,不能证明二者未反应,例如二氧化碳通入氢氧化钠溶液能反应但无明显现象,故该实验不能比较乙酸的酸性大于碳酸,则B不正确;
C.相同时间内,加入稀硫酸的剩余酯层厚度大、加入氢氧化钠的剩余酯层薄甚至完全消失,乙酸乙酯在碱性条件下水解速率比酸性条件的大,则C正确;
D.苯只能萃取溴水中的溴、出现分层现象、上层呈橙红色,将少量苯酚溶液滴加到足量的浓溴水中能取代反应生成2,4,6-三溴苯酚、可观察到白色沉淀,证明羟基使苯环上的氢活化了,则D正确;
答案选B。
4.B
【详解】A.乙醇能和钠反应生成乙醇钠和氢气,不能用钠除乙醇中的水,加入氧化钙后蒸馏可除去乙醇中的水,故A错误;
B.室温下苯甲酸微溶于水,而氯化钠较易溶于水,所以可利用重结晶的方法将两者分离,故B正确;
C.淀粉溶液属于胶体,淀粉、氯化钠都能透过滤纸,不能用过滤法分离淀粉和氯化钠,一般用渗析法分离淀粉和氯化钠,故C错误;
D.乙烯能被高锰酸钾氧化为二氧化碳气体,引入新杂质,一般用溴水除乙烷中的乙烯,故D错误;
选B。
5.B
【详解】A.金属在潮湿的空气中生锈,主要发生吸氧腐蚀,故A错误;
B.Ag+、Hg2+与S2-反应生成硫化物沉淀,工业废水中的Ag+、Hg2+等重金属离子可通过加适量Na2S除去,故B正确;
C.皮肤被昆虫叮咬后会产生红疹,主要是由于昆虫分泌出来的液体中含有甲酸,故C错误;
D.明矾常用于自来水的净化,利用铝离子水解生成的氢氧化铝胶体的吸附性,故D错误;
选B。
6.D
【详解】A. 软脂酸为含有16个C原子的饱和一元酸,化学式为,故A正确;
B. 蚁酸是甲酸的俗名,甲酸的化学式为,故B正确;
C. 纯碱是碳酸钠的俗称,碳酸钠的化学式为,故C正确;
D. 摩尔盐为六水合硫酸亚铁铵,化学式为,故D错误;
答案选D。
7.C
【解析】略
8.C
【详解】A.少量金属Na与蓝矾隔绝空气加热,蓝矾熔化失去结晶水,Na先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成氢氧化铜,不会出现红色固体,故A错误;
B.HCOOH溶液呈酸性,应加入氢氧化钠中和酸,变成碱性环境再加入氢氧化铜,故B错误;
C.向FeCl3和 KSCN混合溶液中加入足量维生素C,若溶液红色褪去,说明维生素C使Fe3+转化为Fe2+,表现还原性,可用作抗氧化剂,故C正确;
D.加热NaCl固体、MnO2固体与浓硫酸的混合物,NaCl固体先与浓硫酸反应生成HCl,在加热条件下,MnO2和浓盐酸反应生成黄绿色气体Cl2,浓硫酸体现的是难挥发性,不能证明浓硫酸具有强氧化性,故D错误;
答案选C。
9.C
【详解】A.浓硫酸属于混合物,电解质属于化合物,混合物既不是电解质也不是非电解质,即浓硫酸不属于电解质,故A错误;
B. 有两个苯环,与 不互为同系物,故B错误;
C.硬脂酸甘油酯为 ,故C正确;
D.氯离子没有表示最外层电子,氯化铵的电子式正确的是 ,故D错误;
答案为C。
10.C
【详解】A.多元弱酸的电离是分步进行的,草酸的电离方程式为H2C2O4H++、H++,,A错误;
B.草酸溶液滴定KMnO4属于氧化还原滴定,且不需要指示剂,B错误;
C.乙烯和氯气加成生成1,2 二氯乙烷,1,2 二氯乙烷水解生成乙二醇,乙二醇催化氧化为乙二醛,乙二醛发生氧化反应生成乙二酸,C正确;
D.乙二酸可溶于水和乙醇,D错误。
故选C。
11.A
【分析】含锰废催化剂(主要成分是)和,还含有少量的、炭黑、等)水浸过滤,得滤渣为、炭黑、,加草酸和稀硫酸进行热浸取,则、分别与草酸发生氧化还原反应,过滤的滤渣Ⅰ为炭黑,滤液含硫酸锰、硫酸亚铁,除杂通入氨水和空气得氢氧化铁沉淀,过滤,滤渣Ⅱ的主要成分为,滤液Ⅱ为硫酸锰,“炭化”时加碳酸氢铵,它与硫酸锰反应得到碳酸锰沉淀、二氧化碳气体、硫酸铵溶液,过滤即可,据此回答。
【详解】A.结合题意可知,“热浸取”时,与浓盐酸发生氧化还原反应生成氯气,污染环境,A项错误;
B.与草酸发生氧化还原反应,离子方程式为,B项正确;
C.“除杂”时,氨水和空气与硫酸亚铁溶液反应得到和硫酸铵,滤渣Ⅱ的主要成分为,C项正确;
D.“炭化”时碳酸氢铵与硫酸锰反应得到碳酸锰沉淀、二氧化碳气体、硫酸铵溶液反应的离子方程式为,滤液Ⅱ中的溶质是,D项正确;
答案选A。
12.D
【详解】A.乙酸与碳酸钠溶液反应生成乙酸钠,水,二氧化碳,醋酸属于弱酸,保留分子式,不能拆成离子形式,故A错误;
B.碱性条件下,甲酸溶液与新制氢氧化铜共热反应生成碳酸根离子、氧化亚铜沉淀和水,反应的离子方程式为HCOOH+2Cu(OH)2+2OH-+Cu2O↓+4H2O,故B错误;
C.苯酚的酸性大于碳酸氢根离子,所以苯酚钠溶液中通入少量二氧化碳反应生成碳酸氢钠,而不是碳酸钠,故C错误;
D.1个醛基还原2molAg,甲醛的结构中相当于有2个醛基,所以1mol甲醛最多还原出4molAg,自身被氧化为碳酸根离子,故D正确;
故答案为:D
13.A
【详解】A.新制氢氧化铜不与乙醇反应但不分层有蓝色沉淀;加入到乙醛中,加热有砖红色沉淀生成;加入到乙酸中,发生酸碱中和反应,得澄清的蓝色溶液;加入到甲酸溶液中,室温时发生酸碱中和反应,得澄清的蓝色溶液、加热时有砖红色沉淀生成,故A符合;
B. 浓溴水能被含醛基的乙醛、和甲酸还原而褪色、与乙醇、乙酸不反应而互溶,无法鉴别,B不符合;
C. 室温下银氨溶液在乙酸、甲酸溶液中被破坏、反应中无明显现象、银氨溶液不与乙醇反应无明显现象、难以鉴别,C不符合;
D. FeCl3溶液不与乙醇、乙醛、乙酸、甲酸反应、难以鉴别,D不符合;
答案选A。
14.C
【详解】A.①中草酸受热分解生成的气体通入澄清石灰水中产生白色浑浊,说明草酸分解生成了CO2,由价态的分析可知另一产物是CO,反应的化学方程式为,A正确;
B.②中草酸与澄清石灰水发生了酸碱中和反应生成白色CaC2O4沉淀,反应的离子方程式为Ca2++2OH-+H2C2O4=CaC2O4↓+2H2O,B正确;
C.草酸具有还原性,NaClO具有氧化性,③中草酸与NaClO发生氧化还原反应产生CO2气体,根据得失电子守恒、原子守恒,反应的化学方程式为H2C2O4+NaClO=NaCl+2CO2↑+H2O,C错误;
D.④中酸性高锰酸钾溶液褪色,说明草酸将还原成Mn2+,则草酸被氧化成CO2,反应的离子方程式为,D正确;
故选C。
15.C
【详解】A.甲醛使蛋白质发生变性,A错误;
B.甲酸(HCOOH)可认为含有醛基,但要发生银镜反应,需要首先中和羧基,使溶液显碱性,B错误;
C.向苯酚钠溶液中滴加乙酸溶液,溶液变浑浊,说明有苯酚生成,则根据强酸制备弱酸可判断相同条件下,乙酸的酸性比苯酚强,C正确;
D.用酒精灯灼烧某有机物,有刺激性气味气体产生,不能据此判断该有机物是蛋白质,例如也可能是氨基酸等,D错误;
答案选C。
16.C
【详解】A.甲酸属于羧酸,能与碳酸氢钠反应,有二氧化碳气体生成,A正确;
B.由甲醛是平面型分子和H-O单键可以旋转推测甲酸()中所有原子可能共面,B正确;
C.含有的化合物不一定可以与水任意比互溶,如苯甲酸微溶于冷水,C错误;
D.该法捕获二氧化碳生成甲酸,则可降低空气中二氧化碳含量,有利于减缓温室效应,D正确;
答案选C。
17.C
【详解】根据题干在鉴定时的实验现象可推断:(1)有银镜反应原物质中可能含有甲酸、甲酸乙酯中至少一种;(2)加入新制的氢氧化铜的悬浊液,沉淀不溶解说明原物质中不含乙酸;(3)与含酚酞的氢氧化钠溶液共热,溶液颜色逐渐变浅,说明原物质中含有甲酸乙酯,综上分析可知,原物质中一定不含乙酸,可能含有乙醇和甲酸,肯定含有甲酸乙酯,故答案为:C。
18.C
【详解】A.草酸即乙二酸,结构简式为HOOCCOOH,A错误;
B.蚁醛即甲醛,结构简式为:HCHO,B错误;
C.TNT即2,4,6-三硝基甲苯,结构简式为: ,C正确;
D.氯仿为三氯甲烷,结构简式为:CHCl3,D错误;
故答案为:C。
19.D
【详解】A.来苏水(主要成分甲酚)具有还原性,过氧乙酸具有强氧化性,二者混合使用将发生氧化还原反应,导致消毒效果变差甚至消失,A错误;
B.冰箱中放入活性炭,活性炭具有强吸附性,能起到除异味,但没有杀菌作用,B错误;
C.福尔马林具有防腐作用,可用于制作生物标本等,但由于其有致癌作用,故不作食品的保鲜剂,C错误;
D.蚊虫叮咬处出现红肿、瘙痒主要是由于甲酸的刺激作用,而肥皂水呈碱性,故肥皂水可用作蚊虫叮咬处的清洗剂,D正确;
故答案为:D。
20.B
【详解】A. 硝基苯中硝基的氮原子和碳原子之间成键,故结构简式为,A错误;
B. 甲酸的结构简式为HCOOH,则HCOOH中存在和两种官能团,B正确;
C. 二甲醚分子的球棍模型为,C错误;
D. 乙炔的电子式为,D错误;
答案选B。
21.C
【详解】要确定有机物是否为羧酸,需要看有机物中是否含有羧基,乙二酸、苯甲酸和硬脂酸均含有羧基,属于羧酸类。而石炭酸即苯酚,含有酚羟基,属于酚类,故答案选C。
22.B
【详解】A. 乙二酸由于具有还原性,能被酸性高锰酸钾溶液氧化,从而使其褪色,与其具有酸性无关,故A错误;
B. 油脂在碱性水溶液中能水解,可用于制备肥皂,故B正确;
C. 氨基酸具有氨基,因此具有碱性,具有羧基,因此具有酸性;氨基酸分子由于同时含有氨基和羧基,可发生缩聚反应制备高分子,与其具有两性无关,故C错误;
D. 葡萄糖是还原性糖,可用于在玻璃上镀银,蔗糖不具有还原性,故D错误;
故选B。
23.BD
【详解】A项、甲酸为弱酸,甲酸与碳酸钠溶液反应生成甲酸钠、二氧化碳和水,反应的离子方程式为2HCOOH+CO32-=2HCOO—+CO2↑+H2O,故A错误;
B项、醋酸为弱酸,醋酸与氢氧化铜反应生成醋酸铜和水,反应的离子方程式为2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O,故B正确;
C项、碳酸酸性大于苯酚,苯酚的酸性大于HCO3-,苯酚钠溶液中通入少量二氧化碳生成苯酚和NaHCO3,反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故C错误;
D项、甲醛溶液与足量的银氨溶液共热发生银镜反应生成碳酸铵、银、氨气和水,反应的离子方程式为HCHO +4Ag(NH3)2++4OH- CO32-+2NH4++4Ag↓ +6NH3+2H2O,故D正确。
故选BD。
【点睛】本题考查离子反应方程式的书写,明确发生的化学反应,熟悉离子反应方程式的书写方法是解答本题的关键。
24.错误
【详解】HCOOH和CH3COOH具有相同的官能团羧基,都有酸性,但是甲酸有醛基,具有醛的性质,而乙酸没有,所以性质不完全相似,故错误;
故答案为:错误。
25.错误
【详解】乙二酸、苯甲酸、硬脂酸都属于羧酸类有机物,石炭酸是苯酚,属于酚类。故答案是:错误。
26.(1)分液漏斗
(2)a→d→e→c→b
(3)
(4) 石灰水变浑浊 60% 偏大
(5)增大气体样品流速
(6)尾气出口未加防潮装置(或其他相似表述)
【分析】在通风橱中用下图装置制备一氧化碳,用A装置制取一氧化碳,该气体中含有甲酸蒸气,故用水除去甲酸,再用B装置排水收集一氧化碳气体,排出的水用E中的烧杯接收。根据气体样品通过氢氧化钠吸收空气中的二氧化碳,浓硫酸吸水,一氧化碳在H中被氧气氧化生成二氧化碳,二氧化碳能被石灰水吸收,J中的浓硫酸吸收气体中的水蒸气,干燥的一氧化碳和,进而测定生成的碘的质量,计算一氧化碳的被氧化的百分率。据此解答。
【详解】(1)装置A中盛放甲酸的仪器为分液漏斗。
(2)用C除去甲酸,B收集一氧化碳,E接收排出的水,故接口连接顺序为a→d→e→c→b→h。
(3)一氧化碳和银氨溶液反应生成黑色的银,同时生成碳酸铵和氨气,方程式为:。
(4)一氧化碳被氧气氧化生成二氧化碳,能使澄清的石灰水变浑浊。碘的物质的量为 ,则结合方程式分析,还有0.002mol一氧化碳未被氧气氧化,11.2L气体为0.5mol其中一氧化碳为0.005mol,则被氧化的一氧化碳为0.005-0.002=0.003mol,则被氧化的百分率为 。如果没有通入氮气则计算的未被氧化的一氧化碳的物质的量减少,则被氧化的百分率增大。
(5)增大气流速率可以提高催化效率。
(6):是白色固体,易吸水潮解,但该装置出气口未加防潮装置。
27. 刺激性 腐蚀 水、乙醇 无 水 乙醇 防腐剂 晶体 两分子结晶水 水 乙醇 还原剂
【解析】略
28. CH3CH(OH)COOH+2Na→CH3CH(ONa)COONa+H2↑ NaHCO3 Na CH3CH(OH)COOH+ NaHCO3→CH3CH(OH)COONa+CO2↑+H2O CH3CH(OH)COOH+CH3CH2OH CH3CH(OH)COOCH2CH3+H2O 酯化反应(或取代反应)
【分析】乳酸分子中有羟基和羧基,故其既有醇的性质,又有羧酸的性质。
【详解】(1)乳酸与足量金属钠反应的化学方程式为CH3CH(OH)COOH+2Na→CH3CH(ONa)COONa+H2↑。
(2),该反应中只有羧基参与反应,而羟基不参与,故所用的试剂a是NaHCO3;
,该反应中两种官能团均参与反应,故所用的试剂b是Na。乳酸与少量碳酸氢钠溶液反应的化学方程式为CH3CH(OH)COOH+ NaHCO3→CH3CH(OH)COONa+CO2↑+H2O。
(3)乳酸与乙醇可以发生酯化反应生成乳酸乙酯和水,该反应属于取代反应,该反应的化学方程式为:CH3CH(OH)COOH+CH3CH2OH CH3CH(OH)COOCH2CH3+H2O。
(4)乳酸在浓硫酸作用下,两分子相互反应生成六元环状结构的交酯,此交酯的结构简式为。
【点睛】有机化学实际上就是官能团的化学,要求学生要熟悉常见官能团的结构和性质。本题要注意联系醇和羧酸的化学性质进行分析。特别要注意不同官能团中H原子的活泼性的不同,会比较乙酸、碳酸、苯酚、碳酸氢根、水、乙醇等分子中羟基H原子的活泼性。
29.(1)Br
(2) 4 取代(或水解)
(3)
(4)HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag↓+2NH3↑+H2O
【分析】根据已知信息和M的转化条件,M发生水解反应生成A、B、C,A可与新制氢氧化铜悬浊液反应,可以推断出A中含有醛基,由于B经两步氧化反应得到羧酸E,且E能发生银镜反应,所以E为甲酸,则B为甲醇,进而推断出M中存在一个酯基,A应为羧酸盐,由C与硝酸银溶液反应生成不溶于稀硝酸的淡黄色沉淀,推知M中含有两个溴原子,发生水解反应生成溴离子。由A被新制Cu(OH)2氧化生成F,F与盐酸反应所得产物的结构可以推出,A、F的结构简式分别为 和 ,故M为 。
【详解】(1)结合以上分析可知,由C与硝酸银溶液反应生成不溶于稀硝酸的淡黄色沉淀,应为溴化银沉淀,所以X为Br。
(2)有机物A被新制Cu(OH)2氧化生成F,有机物B被氧化为D,D有被氧化为E, E又被银氨溶液氧化,所以上述转化中属于氧化反应的共有4步;有机物M的结构简式为 ,它与NaOH溶液共热反发生了水解反应,水解反应属于取代反应。
(3)根据以上分析可知:M的结构简式为 。
(4)有机物E为HCOOH,含有醛基,可被银氨溶液氧化,反应的化学方程为:HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag↓+2NH3↑+H2O。
【点睛】含有醛基的有机物都能和银氨溶液、氢氧化铜的悬浊液反应;甲酸结构中含有羧基,具有羧酸的性质外,还含有醛基,也具有一定的还原性,所以也能够和银氨溶液发生银镜反应。
1认识并了解常见羧酸。
2会书写相应化学方程式。
三、特殊羧酸的性质
1甲酸 (俗称蚁酸)
(1) 结构:
(2) 性质:
甲酸中既有类醛基结构又有羧基,所以兼具有类似醛基的性质和羧基的性质。
>> 注 意 <<
① 能发生银镜反应的有机物一定含有醛基,但不一定是醛,如甲酸、甲酸甲酯等。
② 甲酸具有还原性,因此甲酸也能使 KMnO4 溶液褪色。
知识精炼
1.下列各组物质可用酸性KMnO4溶液鉴别的是
A.油酸和硬脂酸 B.苯和己烷 C.乙烯和乙炔 D.甲酸和甲醛
2.用铬铁合金(含少量单质)生产硫酸铬的工艺流程如下:
下列说法错误的是
A.“浸出”产生的气体含有 B.“除杂”的目的是除去元素
C.流程中未产生六价铬化合物 D.“滤渣2”的主要成分是
3.下列实验内容不能达到实验目的的是
选项 实验内容 实验目的
A 证明苯甲酸和草酸具有酸性
B 比较乙酸、碳酸、苯酚的酸性
C 比较乙酸乙酯在碱性条件和酸性条件下水解速率的大小
D 证明羟基对苯环的活性有影响
A.A B.B C.C D.D
4.用括号内的试剂和操作除去下列各物质中的少量杂质,其中正确的是
A.乙醇中的水(钠、蒸馏)
B.苯甲酸中的氯化钠(水、重结晶)
C.淀粉中的氯化钠(水、过滤)
D.乙烷中的乙烯(酸性高锰酸钾溶液、洗气)
5.化学与生产、生活密切相关,下列说法正确的是
A.金属在潮湿的空气中生锈,主要发生析氢腐蚀
B.工业废水中的Ag+、Hg2+等重金属离子可通过加适量Na2S除去
C.皮肤被昆虫叮咬后会产生红疹,主要是由于昆虫分泌出来的液体中含有乙酸
D.明矾和漂白粉常用于自来水的净化和杀菌消毒,均利用了其氧化性
6.下列物质对应的化学式不正确的是
A.软脂酸: B.蚁酸:
C.纯碱: D.摩尔盐:
7.下列有关常见羧酸的说法正确的是
A.甲酸是一种无色有刺激性气味的气体,易溶于水
B.乙酸的沸点低于丙醇,高于乙醇
C.苯甲酸的酸性比碳酸强,可以和碳酸氢钠反应制取CO2
D.乙二酸具有酸性,因此可以使酸性KMnO4溶液褪色
8.为实现下列实验目的,实验操作和实验现象都正确的是
选项 实验目的 实验操作 实验现象
A 证明金属性Na>Cu 少量金属Na与蓝矾隔绝空气加热 有红色固体生成
B 证明HCOOH具有还原性 HCOOH溶液中加入少量新制氢氧化铜悬浊液并加热 有砖红色沉淀产生
C 证明维生素C可用作抗氧化剂 向FeCl3和 KSCN混合溶液中加入足量维生素C 溶液红色褪去
D 证明浓硫酸具有强氧化性 加热NaCl固体、MnO2固体与浓硫酸的混合物 有黄绿色气体产生
A.A B.B C.C D.D
9.正确认识化学物质是学好化学的关键,下列各组物质前后对应正确的是
A.浓硫酸:电解质 B. :与互为同系物
C. :硬脂酸甘油酯 D.氯化铵的电子式:
2乙二酸
酯化反应
缩聚反应
3 羟基酸—酯化反应
知识精炼
10.乙二酸又称草酸,通常在空气中易被氧化而变质,但H2C2O4·2H2O能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O作还原剂定量测定KMnO4的含量。下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O42H++
B.草酸溶液滴定KMnO4属于中和滴定,可用石蕊作指示剂
C.乙二酸可由乙烯经加成反应、水解反应、氧化反应制得
D.乙二酸既不溶于水也不溶于乙醇
11.以含锰废催化剂(主要成分是)和,还含有少量的、炭黑、等)为原料制备碳酸锰的工艺流程如图所示。已知:具有强氧化性,能与常见的还原剂反应。有关说法错误的是
A.“热浸取”时,稀硫酸可以用浓盐酸代替且不会造成污染
B.“热浸取”时,主要的离子反应方程式为
C.“除杂”时,滤渣Ⅱ的主要成分为氢氧化铁
D.“炭化”时,滤液Ⅱ中含有
12.下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:
B.甲酸溶液与新制氢氧化铜碱性浊液混合加热:
C.苯酚钠溶液中通入少量二氧化碳:
D.甲醛溶液与足量的银氨溶液共热:
13.试剂可以鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液
A.新制Cu(OH)2悬浊液 B.浓溴水
C.银氨溶液 D.FeCl3溶液
14.菠菜、苋菜等蔬菜富含草酸(H2C2O4)。为了探究草酸的性质,进行如下实验。
实验 装置 试剂 现象
① 澄清石灰水 产生白色浑浊
② 澄清石灰水 产生白色沉淀
③ NaClO溶液 产生无色气泡
④ 酸性KMnO4溶液 紫红色溶液褪色
对四组实验进行分析,下列由上述实验得到的反应方程式不正确的是
A.①:
B.②:
C.③:
D.④:
15.下列实验操作、现象及结论都正确的是
选项 实验操作 现象 结论
A 向两份蛋白质溶液中分别加入甲醛和(NH4)2SO4饱和溶液 均有白色沉淀 蛋白质均发生了变性
B 向甲酸中加入银氨溶液,水浴加热 有光亮的银镜产生 银氨溶液也能被羧基还原
C 向苯酚钠溶液中滴加乙酸溶液 溶液变浑浊 相同条件下,乙酸的酸性比苯酚强
D 用酒精灯灼烧某有机物 有刺激性气味气体产生 该有机物是蛋白质
A.A B.B C.C D.D
16.捕获二氧化碳生成甲酸的过程如图所示,下列说法错误的是
A.甲酸可与碳酸氢钠发生反应,有气体生成
B.甲酸分子中所有的原子可能在同一平面上
C.甲酸、醋酸都可以与水任意比互溶,所以含有的化合物都可以与水任意比互溶
D.该方法有利于减缓温室效应
17.某物质中可能有甲酸、乙酸、甲酸乙酯、乙醇中的一种或几种,在鉴定时有下列现象:(1)有银镜反应;(2)加入新制的氢氧化铜的悬浊液,沉淀不溶解;(3)与含酚酞的氢氧化钠溶液共热,溶液颜色逐渐变浅。下列判断正确的是
A.有甲酸和甲酸乙酯 B.有甲酸乙酯和乙醇
C.有甲酸乙酯,可能有乙醇 D.有甲酸和乙酸,可能有甲酸乙酯
18.下列物质与俗名对应的是
A.草酸:CH3COOH B.蚁醛:CH3CHO
C.TNT: D.氯仿:CCl4
19.化学与生产、生活、社会密切相关。下列有关说法正确的是
A.来苏水(主要成分甲酚)和过氧乙酸混合使用,消毒效果更好
B.冰箱中放入活性炭,能起到除异味和杀菌作用
C.福尔马林具有防腐作用,可用作食品的保鲜剂
D.肥皂水可用作蚊虫叮咬处的清洗剂
20.下列化学用语使用正确的是
A.硝基苯的结构简式为
B.甲酸中存在和两种官能团
C.乙醚分子的球棍模型为
D.乙炔的电子式为
21.下列有机物中,不属于羧酸的是
A.乙二酸 B.苯甲酸 C.石炭酸 D.硬脂酸
22.下面关于物质性质和用途的陈述都正确,且存在因果关系的是
A.乙二酸具有酸性,能使酸性高锰酸钾溶液褪色
B.油脂在碱性水溶液中能水解,可用于制备肥皂
C.氨基酸具有两性,可发生缩聚反应制备高分子
D.葡萄糖、蔗糖都是还原性糖,可用于在玻璃上镀银
23(多选).下列离子方程式正确的是
A.甲酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O
B.醋酸溶液与Cu(OH)2:2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
C.苯酚钠溶液通少量CO2 :2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D.甲醛溶液与足量的银氨溶液共热:HCHO +4Ag(NH3)2++4OH- CO32-+2NH4++4Ag↓ +6NH3+2H2O
24.HCOOH和CH3COOH具有相同的官能团,性质相似。(____)
25.乙二酸、苯甲酸、硬脂酸、石炭酸都属于羧酸类有机物。( )
26.某兴趣小组设计实验探究,催化空气氧化的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备(加热及夹持装置省略),反应方程式:
(1)装置A中盛放甲酸的仪器的名称是_______。
(2)从B、C、D中选择合适的装置收集,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______。
步骤Ⅲ 探究催化空气氧化的效率
将一定量与空气混合,得到体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至,按一定流速通入气体样品。(已知:是白色固体,易吸水潮解:)
(4)通入(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了。
①能证明被空气氧化的现象是_______;
②被催化氧化的百分率为_______;
③若未通入氮气,②的结果将_______(填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______。
27.常见的羧酸
典型羧酸 物理性质 主要用途
甲酸(蚁酸)HCOOH 无色、有____气味的液体,有____性,能与____等互溶 在工业上可用作还原剂,是合成医药、农药和染料等的原料
苯甲酸(安息香酸) ____色晶体,易升华,微溶于____,易溶于____ 用于合成香料、药物等,其钠盐是常用的食品____
乙二酸(草酸)HOOC—COOH 无色____,通常含有____,可溶于____和_____ 化学分析中常用的____,也是重要的化工原料
28.牛奶放置时间长了会变酸,这是因为牛奶中含有的乳糖在微生物的作用下分解变成了乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为CH3CH(OH)COOH。完成下列问题:
(1)写出乳酸与足量金属钠反应的化学方程式:__________。
(2)乳酸发生下列变化:
所用的试剂是a________,b________(写化学式);写出乳酸与少量碳酸钠溶液反应的化学方程式:___________。
(3)写出下列反应的化学方程式,并注明反应类型。
乳酸与乙醇反应:__________,________。
(4)乳酸在浓硫酸作用下,两分子相互反应生成六元环状结构的物质,写出此生成物的结构简式_______。
29.已知两个羟基同时连在同一碳原子上的结构是不稳定的,它要发生脱水反应:
现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应
试回答下列问题:
(1)X为____________________(填元素符号);
(2)上述转化中其中属于氧化反应的共有_______步(填数字);M与NaOH溶液共热反应的所属类型是_______________ 反应。
(3)M的结构简式为 ________________________________
(4)写出下列反应的化学方程:
E和银氨溶液反应的化学方程式:_______________________________________________
试卷第1页,共3页
参考答案:
1.A
【详解】A.油酸中含有碳碳双键,能使酸性高锰酸钾溶液褪色,而硬脂酸不含不饱和键,不能是酸性高锰酸钾溶液褪色,故可用酸性高锰酸钾溶液鉴别,A符合题意;
B.苯和己烷分子中均不含不饱和键,不能使酸性高锰酸钾溶液褪色,故不可用酸性高锰酸钾溶液鉴别,B不合题意;
C.乙烯和乙炔均可使酸性高锰酸钾溶液鉴别,故不可用酸性高锰酸钾溶液鉴别,C不合题意;
D.甲酸和甲醛均均有还原性,均可使酸性高锰酸钾溶液鉴别,故不可用酸性高锰酸钾溶液鉴别,D不合题意;
故答案为:A。
2.D
【分析】由流程可知,加入稀硫酸溶解,生成气体为氢气,溶液中含加入Na2S分离出滤渣1含CoS和NiS,不会沉淀,再加入草酸除铁生成FeC2O4,过滤分离出硫酸铬,以此来解答。
【详解】A.四种金属均与稀硫酸反应生成H2,A正确;
B.共有四种金属,由流程可知,沉铁后分离出硫酸铬,则“除杂"的目的是除去Ni、Co元素,B正确;
C.由上述分析可知,流程中未产生六价铬化合物,C正确;
D.“滤渣2”的主要成分是FeC2O4,D错误;
故本题选D。
3.B
【详解】A.酸性溶液能使紫色石蕊试液变红,故变红现象可证明苯甲酸和草酸具有酸性,则A正确;
B.二氧化碳通入乙酸钠溶液没有现象,不能证明二者未反应,例如二氧化碳通入氢氧化钠溶液能反应但无明显现象,故该实验不能比较乙酸的酸性大于碳酸,则B不正确;
C.相同时间内,加入稀硫酸的剩余酯层厚度大、加入氢氧化钠的剩余酯层薄甚至完全消失,乙酸乙酯在碱性条件下水解速率比酸性条件的大,则C正确;
D.苯只能萃取溴水中的溴、出现分层现象、上层呈橙红色,将少量苯酚溶液滴加到足量的浓溴水中能取代反应生成2,4,6-三溴苯酚、可观察到白色沉淀,证明羟基使苯环上的氢活化了,则D正确;
答案选B。
4.B
【详解】A.乙醇能和钠反应生成乙醇钠和氢气,不能用钠除乙醇中的水,加入氧化钙后蒸馏可除去乙醇中的水,故A错误;
B.室温下苯甲酸微溶于水,而氯化钠较易溶于水,所以可利用重结晶的方法将两者分离,故B正确;
C.淀粉溶液属于胶体,淀粉、氯化钠都能透过滤纸,不能用过滤法分离淀粉和氯化钠,一般用渗析法分离淀粉和氯化钠,故C错误;
D.乙烯能被高锰酸钾氧化为二氧化碳气体,引入新杂质,一般用溴水除乙烷中的乙烯,故D错误;
选B。
5.B
【详解】A.金属在潮湿的空气中生锈,主要发生吸氧腐蚀,故A错误;
B.Ag+、Hg2+与S2-反应生成硫化物沉淀,工业废水中的Ag+、Hg2+等重金属离子可通过加适量Na2S除去,故B正确;
C.皮肤被昆虫叮咬后会产生红疹,主要是由于昆虫分泌出来的液体中含有甲酸,故C错误;
D.明矾常用于自来水的净化,利用铝离子水解生成的氢氧化铝胶体的吸附性,故D错误;
选B。
6.D
【详解】A. 软脂酸为含有16个C原子的饱和一元酸,化学式为,故A正确;
B. 蚁酸是甲酸的俗名,甲酸的化学式为,故B正确;
C. 纯碱是碳酸钠的俗称,碳酸钠的化学式为,故C正确;
D. 摩尔盐为六水合硫酸亚铁铵,化学式为,故D错误;
答案选D。
7.C
【解析】略
8.C
【详解】A.少量金属Na与蓝矾隔绝空气加热,蓝矾熔化失去结晶水,Na先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成氢氧化铜,不会出现红色固体,故A错误;
B.HCOOH溶液呈酸性,应加入氢氧化钠中和酸,变成碱性环境再加入氢氧化铜,故B错误;
C.向FeCl3和 KSCN混合溶液中加入足量维生素C,若溶液红色褪去,说明维生素C使Fe3+转化为Fe2+,表现还原性,可用作抗氧化剂,故C正确;
D.加热NaCl固体、MnO2固体与浓硫酸的混合物,NaCl固体先与浓硫酸反应生成HCl,在加热条件下,MnO2和浓盐酸反应生成黄绿色气体Cl2,浓硫酸体现的是难挥发性,不能证明浓硫酸具有强氧化性,故D错误;
答案选C。
9.C
【详解】A.浓硫酸属于混合物,电解质属于化合物,混合物既不是电解质也不是非电解质,即浓硫酸不属于电解质,故A错误;
B. 有两个苯环,与 不互为同系物,故B错误;
C.硬脂酸甘油酯为 ,故C正确;
D.氯离子没有表示最外层电子,氯化铵的电子式正确的是 ,故D错误;
答案为C。
10.C
【详解】A.多元弱酸的电离是分步进行的,草酸的电离方程式为H2C2O4H++、H++,,A错误;
B.草酸溶液滴定KMnO4属于氧化还原滴定,且不需要指示剂,B错误;
C.乙烯和氯气加成生成1,2 二氯乙烷,1,2 二氯乙烷水解生成乙二醇,乙二醇催化氧化为乙二醛,乙二醛发生氧化反应生成乙二酸,C正确;
D.乙二酸可溶于水和乙醇,D错误。
故选C。
11.A
【分析】含锰废催化剂(主要成分是)和,还含有少量的、炭黑、等)水浸过滤,得滤渣为、炭黑、,加草酸和稀硫酸进行热浸取,则、分别与草酸发生氧化还原反应,过滤的滤渣Ⅰ为炭黑,滤液含硫酸锰、硫酸亚铁,除杂通入氨水和空气得氢氧化铁沉淀,过滤,滤渣Ⅱ的主要成分为,滤液Ⅱ为硫酸锰,“炭化”时加碳酸氢铵,它与硫酸锰反应得到碳酸锰沉淀、二氧化碳气体、硫酸铵溶液,过滤即可,据此回答。
【详解】A.结合题意可知,“热浸取”时,与浓盐酸发生氧化还原反应生成氯气,污染环境,A项错误;
B.与草酸发生氧化还原反应,离子方程式为,B项正确;
C.“除杂”时,氨水和空气与硫酸亚铁溶液反应得到和硫酸铵,滤渣Ⅱ的主要成分为,C项正确;
D.“炭化”时碳酸氢铵与硫酸锰反应得到碳酸锰沉淀、二氧化碳气体、硫酸铵溶液反应的离子方程式为,滤液Ⅱ中的溶质是,D项正确;
答案选A。
12.D
【详解】A.乙酸与碳酸钠溶液反应生成乙酸钠,水,二氧化碳,醋酸属于弱酸,保留分子式,不能拆成离子形式,故A错误;
B.碱性条件下,甲酸溶液与新制氢氧化铜共热反应生成碳酸根离子、氧化亚铜沉淀和水,反应的离子方程式为HCOOH+2Cu(OH)2+2OH-+Cu2O↓+4H2O,故B错误;
C.苯酚的酸性大于碳酸氢根离子,所以苯酚钠溶液中通入少量二氧化碳反应生成碳酸氢钠,而不是碳酸钠,故C错误;
D.1个醛基还原2molAg,甲醛的结构中相当于有2个醛基,所以1mol甲醛最多还原出4molAg,自身被氧化为碳酸根离子,故D正确;
故答案为:D
13.A
【详解】A.新制氢氧化铜不与乙醇反应但不分层有蓝色沉淀;加入到乙醛中,加热有砖红色沉淀生成;加入到乙酸中,发生酸碱中和反应,得澄清的蓝色溶液;加入到甲酸溶液中,室温时发生酸碱中和反应,得澄清的蓝色溶液、加热时有砖红色沉淀生成,故A符合;
B. 浓溴水能被含醛基的乙醛、和甲酸还原而褪色、与乙醇、乙酸不反应而互溶,无法鉴别,B不符合;
C. 室温下银氨溶液在乙酸、甲酸溶液中被破坏、反应中无明显现象、银氨溶液不与乙醇反应无明显现象、难以鉴别,C不符合;
D. FeCl3溶液不与乙醇、乙醛、乙酸、甲酸反应、难以鉴别,D不符合;
答案选A。
14.C
【详解】A.①中草酸受热分解生成的气体通入澄清石灰水中产生白色浑浊,说明草酸分解生成了CO2,由价态的分析可知另一产物是CO,反应的化学方程式为,A正确;
B.②中草酸与澄清石灰水发生了酸碱中和反应生成白色CaC2O4沉淀,反应的离子方程式为Ca2++2OH-+H2C2O4=CaC2O4↓+2H2O,B正确;
C.草酸具有还原性,NaClO具有氧化性,③中草酸与NaClO发生氧化还原反应产生CO2气体,根据得失电子守恒、原子守恒,反应的化学方程式为H2C2O4+NaClO=NaCl+2CO2↑+H2O,C错误;
D.④中酸性高锰酸钾溶液褪色,说明草酸将还原成Mn2+,则草酸被氧化成CO2,反应的离子方程式为,D正确;
故选C。
15.C
【详解】A.甲醛使蛋白质发生变性,A错误;
B.甲酸(HCOOH)可认为含有醛基,但要发生银镜反应,需要首先中和羧基,使溶液显碱性,B错误;
C.向苯酚钠溶液中滴加乙酸溶液,溶液变浑浊,说明有苯酚生成,则根据强酸制备弱酸可判断相同条件下,乙酸的酸性比苯酚强,C正确;
D.用酒精灯灼烧某有机物,有刺激性气味气体产生,不能据此判断该有机物是蛋白质,例如也可能是氨基酸等,D错误;
答案选C。
16.C
【详解】A.甲酸属于羧酸,能与碳酸氢钠反应,有二氧化碳气体生成,A正确;
B.由甲醛是平面型分子和H-O单键可以旋转推测甲酸()中所有原子可能共面,B正确;
C.含有的化合物不一定可以与水任意比互溶,如苯甲酸微溶于冷水,C错误;
D.该法捕获二氧化碳生成甲酸,则可降低空气中二氧化碳含量,有利于减缓温室效应,D正确;
答案选C。
17.C
【详解】根据题干在鉴定时的实验现象可推断:(1)有银镜反应原物质中可能含有甲酸、甲酸乙酯中至少一种;(2)加入新制的氢氧化铜的悬浊液,沉淀不溶解说明原物质中不含乙酸;(3)与含酚酞的氢氧化钠溶液共热,溶液颜色逐渐变浅,说明原物质中含有甲酸乙酯,综上分析可知,原物质中一定不含乙酸,可能含有乙醇和甲酸,肯定含有甲酸乙酯,故答案为:C。
18.C
【详解】A.草酸即乙二酸,结构简式为HOOCCOOH,A错误;
B.蚁醛即甲醛,结构简式为:HCHO,B错误;
C.TNT即2,4,6-三硝基甲苯,结构简式为: ,C正确;
D.氯仿为三氯甲烷,结构简式为:CHCl3,D错误;
故答案为:C。
19.D
【详解】A.来苏水(主要成分甲酚)具有还原性,过氧乙酸具有强氧化性,二者混合使用将发生氧化还原反应,导致消毒效果变差甚至消失,A错误;
B.冰箱中放入活性炭,活性炭具有强吸附性,能起到除异味,但没有杀菌作用,B错误;
C.福尔马林具有防腐作用,可用于制作生物标本等,但由于其有致癌作用,故不作食品的保鲜剂,C错误;
D.蚊虫叮咬处出现红肿、瘙痒主要是由于甲酸的刺激作用,而肥皂水呈碱性,故肥皂水可用作蚊虫叮咬处的清洗剂,D正确;
故答案为:D。
20.B
【详解】A. 硝基苯中硝基的氮原子和碳原子之间成键,故结构简式为,A错误;
B. 甲酸的结构简式为HCOOH,则HCOOH中存在和两种官能团,B正确;
C. 二甲醚分子的球棍模型为,C错误;
D. 乙炔的电子式为,D错误;
答案选B。
21.C
【详解】要确定有机物是否为羧酸,需要看有机物中是否含有羧基,乙二酸、苯甲酸和硬脂酸均含有羧基,属于羧酸类。而石炭酸即苯酚,含有酚羟基,属于酚类,故答案选C。
22.B
【详解】A. 乙二酸由于具有还原性,能被酸性高锰酸钾溶液氧化,从而使其褪色,与其具有酸性无关,故A错误;
B. 油脂在碱性水溶液中能水解,可用于制备肥皂,故B正确;
C. 氨基酸具有氨基,因此具有碱性,具有羧基,因此具有酸性;氨基酸分子由于同时含有氨基和羧基,可发生缩聚反应制备高分子,与其具有两性无关,故C错误;
D. 葡萄糖是还原性糖,可用于在玻璃上镀银,蔗糖不具有还原性,故D错误;
故选B。
23.BD
【详解】A项、甲酸为弱酸,甲酸与碳酸钠溶液反应生成甲酸钠、二氧化碳和水,反应的离子方程式为2HCOOH+CO32-=2HCOO—+CO2↑+H2O,故A错误;
B项、醋酸为弱酸,醋酸与氢氧化铜反应生成醋酸铜和水,反应的离子方程式为2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O,故B正确;
C项、碳酸酸性大于苯酚,苯酚的酸性大于HCO3-,苯酚钠溶液中通入少量二氧化碳生成苯酚和NaHCO3,反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故C错误;
D项、甲醛溶液与足量的银氨溶液共热发生银镜反应生成碳酸铵、银、氨气和水,反应的离子方程式为HCHO +4Ag(NH3)2++4OH- CO32-+2NH4++4Ag↓ +6NH3+2H2O,故D正确。
故选BD。
【点睛】本题考查离子反应方程式的书写,明确发生的化学反应,熟悉离子反应方程式的书写方法是解答本题的关键。
24.错误
【详解】HCOOH和CH3COOH具有相同的官能团羧基,都有酸性,但是甲酸有醛基,具有醛的性质,而乙酸没有,所以性质不完全相似,故错误;
故答案为:错误。
25.错误
【详解】乙二酸、苯甲酸、硬脂酸都属于羧酸类有机物,石炭酸是苯酚,属于酚类。故答案是:错误。
26.(1)分液漏斗
(2)a→d→e→c→b
(3)
(4) 石灰水变浑浊 60% 偏大
(5)增大气体样品流速
(6)尾气出口未加防潮装置(或其他相似表述)
【分析】在通风橱中用下图装置制备一氧化碳,用A装置制取一氧化碳,该气体中含有甲酸蒸气,故用水除去甲酸,再用B装置排水收集一氧化碳气体,排出的水用E中的烧杯接收。根据气体样品通过氢氧化钠吸收空气中的二氧化碳,浓硫酸吸水,一氧化碳在H中被氧气氧化生成二氧化碳,二氧化碳能被石灰水吸收,J中的浓硫酸吸收气体中的水蒸气,干燥的一氧化碳和,进而测定生成的碘的质量,计算一氧化碳的被氧化的百分率。据此解答。
【详解】(1)装置A中盛放甲酸的仪器为分液漏斗。
(2)用C除去甲酸,B收集一氧化碳,E接收排出的水,故接口连接顺序为a→d→e→c→b→h。
(3)一氧化碳和银氨溶液反应生成黑色的银,同时生成碳酸铵和氨气,方程式为:。
(4)一氧化碳被氧气氧化生成二氧化碳,能使澄清的石灰水变浑浊。碘的物质的量为 ,则结合方程式分析,还有0.002mol一氧化碳未被氧气氧化,11.2L气体为0.5mol其中一氧化碳为0.005mol,则被氧化的一氧化碳为0.005-0.002=0.003mol,则被氧化的百分率为 。如果没有通入氮气则计算的未被氧化的一氧化碳的物质的量减少,则被氧化的百分率增大。
(5)增大气流速率可以提高催化效率。
(6):是白色固体,易吸水潮解,但该装置出气口未加防潮装置。
27. 刺激性 腐蚀 水、乙醇 无 水 乙醇 防腐剂 晶体 两分子结晶水 水 乙醇 还原剂
【解析】略
28. CH3CH(OH)COOH+2Na→CH3CH(ONa)COONa+H2↑ NaHCO3 Na CH3CH(OH)COOH+ NaHCO3→CH3CH(OH)COONa+CO2↑+H2O CH3CH(OH)COOH+CH3CH2OH CH3CH(OH)COOCH2CH3+H2O 酯化反应(或取代反应)
【分析】乳酸分子中有羟基和羧基,故其既有醇的性质,又有羧酸的性质。
【详解】(1)乳酸与足量金属钠反应的化学方程式为CH3CH(OH)COOH+2Na→CH3CH(ONa)COONa+H2↑。
(2),该反应中只有羧基参与反应,而羟基不参与,故所用的试剂a是NaHCO3;
,该反应中两种官能团均参与反应,故所用的试剂b是Na。乳酸与少量碳酸氢钠溶液反应的化学方程式为CH3CH(OH)COOH+ NaHCO3→CH3CH(OH)COONa+CO2↑+H2O。
(3)乳酸与乙醇可以发生酯化反应生成乳酸乙酯和水,该反应属于取代反应,该反应的化学方程式为:CH3CH(OH)COOH+CH3CH2OH CH3CH(OH)COOCH2CH3+H2O。
(4)乳酸在浓硫酸作用下,两分子相互反应生成六元环状结构的交酯,此交酯的结构简式为。
【点睛】有机化学实际上就是官能团的化学,要求学生要熟悉常见官能团的结构和性质。本题要注意联系醇和羧酸的化学性质进行分析。特别要注意不同官能团中H原子的活泼性的不同,会比较乙酸、碳酸、苯酚、碳酸氢根、水、乙醇等分子中羟基H原子的活泼性。
29.(1)Br
(2) 4 取代(或水解)
(3)
(4)HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag↓+2NH3↑+H2O
【分析】根据已知信息和M的转化条件,M发生水解反应生成A、B、C,A可与新制氢氧化铜悬浊液反应,可以推断出A中含有醛基,由于B经两步氧化反应得到羧酸E,且E能发生银镜反应,所以E为甲酸,则B为甲醇,进而推断出M中存在一个酯基,A应为羧酸盐,由C与硝酸银溶液反应生成不溶于稀硝酸的淡黄色沉淀,推知M中含有两个溴原子,发生水解反应生成溴离子。由A被新制Cu(OH)2氧化生成F,F与盐酸反应所得产物的结构可以推出,A、F的结构简式分别为 和 ,故M为 。
【详解】(1)结合以上分析可知,由C与硝酸银溶液反应生成不溶于稀硝酸的淡黄色沉淀,应为溴化银沉淀,所以X为Br。
(2)有机物A被新制Cu(OH)2氧化生成F,有机物B被氧化为D,D有被氧化为E, E又被银氨溶液氧化,所以上述转化中属于氧化反应的共有4步;有机物M的结构简式为 ,它与NaOH溶液共热反发生了水解反应,水解反应属于取代反应。
(3)根据以上分析可知:M的结构简式为 。
(4)有机物E为HCOOH,含有醛基,可被银氨溶液氧化,反应的化学方程为:HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag↓+2NH3↑+H2O。
【点睛】含有醛基的有机物都能和银氨溶液、氢氧化铜的悬浊液反应;甲酸结构中含有羧基,具有羧酸的性质外,还含有醛基,也具有一定的还原性,所以也能够和银氨溶液发生银镜反应。
