广东省梅州市2022-2023学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 广东省梅州市2022-2023学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 711.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-05 08:34:22 | ||
图片预览




文档简介
梅州市2022-2023学年高二上学期期末考试
化学
本试卷共6页,20小题,满分100分。考试用时75分钟。
可能用到的相对原子质量:H1 Na23 S32
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产、生活密切相关。下列叙述不正确的是( )
A.“保暖贴”在发热过程中应用的是原电池的工作原理
B.钢铁设施在海水中的腐蚀速率比在河水中的快
C.纯碱可以用作锅炉除垢时的转化剂
D.明矾可用作净水剂和消毒剂
2.下列叙述正确的是( )
A.s区全部是金属元素 B.K层上电子的能量比L层上电子的能量高
C.2p能级有3个轨道 D.原子核外每个能层最多可容纳的电子数为
3.工业上,下列各组金属的冶炼方法相同的是( )
A.Fe和Al B.Au和Cu C.Na和Al D.K和Fe
4.古诗词蕴含丰富的化学知识,下列诗句所涉及的物质变化过程中,包含吸热反应的是( )
A.春蚕到死丝方尽,蜡炬成灰泪始干 B.爆竹声中一岁除,春风送暖入屠苏
C.千锤万凿出深山,烈火焚烧若等闲 D.开窗尽见千山雪,雪未消时月正明
5.a~e为短周期元素,其原子序数与其某种化合价的关系如图1所示。下列说法正确的是( )
A.基态a原子的轨道表示式:
B.c、e对应原子的半径:c>e
C.简单气态氢化物的稳定性:aD.基态b原子电子占据最高能级的电子云轮廓图为
6.下列化学用语对事实的表述正确的是( )
A.氢氧化镁固体溶于盐酸:
B.水溶液中的电离方程式:
C.NaHS的水解反应:
D.表示燃烧热的热化学方程式: kJ mol
7.氢能源汽车在北京冬奥会上大批量使用为减少碳排放立下了大功劳。下列关于氢氧燃料电池的说法正确的是( )
A.氢氧燃料电池工作时负极通入
B.氢氧燃料电池正极发生氧化反应
C.氢氧燃料电池客车不能在寒冷天气中使用
D.氢氧燃料电池工作时的总反应为
8.下列事实中,不能用勒夏特列原理解释的是( )
A.开启啤酒瓶后,马上泛起大量泡沫
B.在配制硫酸亚铁溶液时往往要加入少量铁粉
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
9.下列说法正确的是( )
A.自发进行的反应不需要任何条件,就可以发生反应
B.的反应一定能自发进行
C.增大反应物浓度,可增大活化分子百分数,从而增加有效碰撞的次数
D.反应,若正反应的活化能为 kJ mol,逆反应的活化能为 kJ mol,则 kJ mol
10.设为阿伏加德罗常数的值。下列说法正确的是( )
A.往密闭容器中充入1 mol 和3 mol 充分反应生成的分子数为
B.1 L 0.1 mol·L的溶液中数目为
C.电解熔融NaCl,阴极增重2.3 g,外电路中通过电子的数目为
D.0.1 mol·L的溶液中,和离子数之和等于
11.下列说法不正确的是( )
A.常温下,由水电离出的 mol L的溶液中:、、可以大量共存
B.溶液存在(蓝色)(黄色)平衡,向黄绿色的溶液中加水,溶液颜色变蓝绿色
C.中和等体积、等pH的稀硫酸和稀醋酸所消耗NaOH的物质的量:前者小于后者
D.常温下,0.1 mol L 溶液中存在:
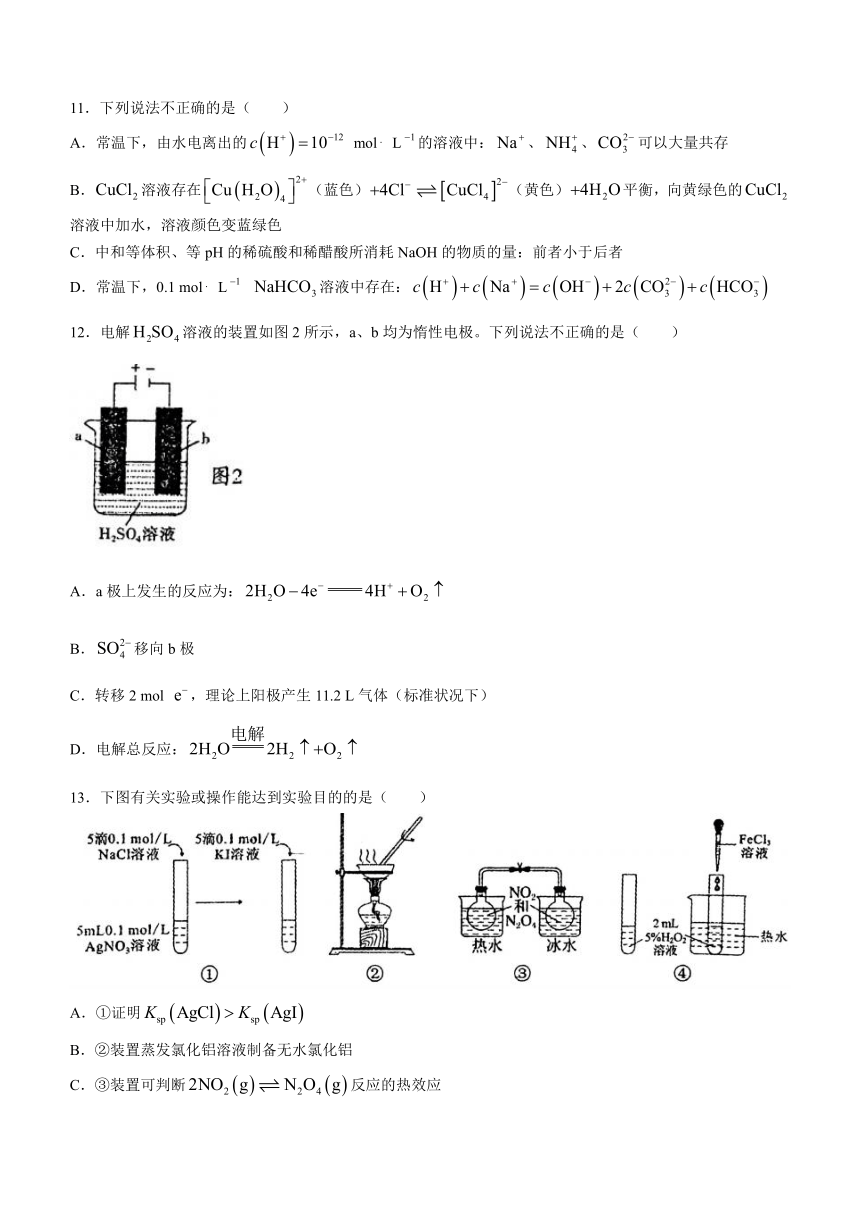
12.电解溶液的装置如图2所示,a、b均为惰性电极。下列说法不正确的是( )
A.a极上发生的反应为:
B.移向b极
C.转移2 mol ,理论上阳极产生11.2 L气体(标准状况下)
D.电解总反应:
13.下图有关实验或操作能达到实验目的的是( )
A.①证明
B.②装置蒸发氯化铝溶液制备无水氯化铝
C.③装置可判断反应的热效应
D.④验证氯化铁对过氧化氢的分解有催化作用
14.羰基硫(COS)能防止某些昆虫、线虫和真菌的危害。在容积不变的密闭容器中,将CO和混合后在催化剂作用下,加热发生反应并达到平衡。若反应前CO的物质的量为10 mol,达到平衡时CO的物质的量为8 mol,且化学平衡常数为0.1。下列说法正确的是( )
A.反应前的物质的量为7 mol
B.增大压强,化学平衡正向移动
C.增大CO浓度,正反应速率增大,逆反应速率减小
D.增大的比值,可以减小CO的转化率
15.下列实验操作、实验现象和实验结论均正确的是( )
选项 实验操作 实验现象 实验结论
A 往溶液中通入气体 有沉淀生成 沉淀是
B 往平衡体系中,加入KCl晶体 溶液颜色不变 加入少量KCl晶体,不会影响该化学平衡
C 在两个烧杯中分别盛有等体积、等浓度的烧碱溶液和氨水,插入电极,连接灯泡,接通电源,分别进行导电实验 盛有烧碱溶液的灯泡亮度大 强电解质导电能力大于弱电解质
D 相同温度下,分别向NaA和NaB稀溶液中滴加酚酞试液 NaB溶液红色更深 酸性:HA>HB
16.常温下,在体积均为20 mL、浓度均为0.1 mol·L的HX溶液、HY溶液中分别滴加浓度为0.1 mol·L的NaOH溶液,反应后溶液中水电离的表示为,与滴加氢氧化钠溶液体积的关系如图3所示。下列推断正确的是( )
A.HX、HY都是弱酸
B.常温下,的数量级
C.常温下用蒸馏水分别稀释B、D点溶液,pH都降低
D.C、D两点溶液中都有
二、非选择题:本大题共4小题,共56分。
17.(12分)光伏材料是指能将太阳能直接转换成电能的材料,又称太阳能材料,只有半导体材料具有这种功能。可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1)Ga与B同主族,基态Ga原子价电子排布式为______。
(2)Ga失去电子的逐级电离能(单位:kJ mol )的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为______和+3。
(3)下列事实能说明硫的非金属性比硒强的是______(填字母)。
A.溶解度:
B.沸点:
C.酸性:
(4)Ga、P、S的电负性从大到小的顺序为__________________。
(5)与Al元素在元素周期表中处于对角线的铍,在性质上具有相似性,写出铍的氧化物与氢氧化钠溶液反应生成的离子方程式__________________。
(6)工业上以镓粉为原料,用镍催化法生产GaN,在氨气流中于1050~1100℃下加热30 min可制得疏松的灰色粉末状GaN,同时得到一种单质,写出该反应的化学方程式__________________。
18.(14分)Ⅰ.食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。某小组研究25℃下HAc电离平衡的影响因素。
提出假设:稀释HAc溶液或改变浓度,HAc电离平衡会发生移动。
设计方案并完成实验,用浓度均为0.1mol L的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
序号 V(HAc)/mL V(NaAc)/mL /mL pH
Ⅰ 40.00 / / 0 2.86
Ⅱ 4.00 / 36.00 0 3.36
…
Ⅶ 4.00 a 33.00 4.53
Ⅷ 4.00 4.00 b 4.65
(1)根据表中信息,补充数据:______,______。
(2)由表中实验Ⅰ和Ⅱ数据,可以得出HAc是弱电解质的结论,给出判断理由:________________________。
(3)由实验Ⅱ~Ⅷ可知,增大浓度,HAc电离平衡______移动(填“正向”或“逆向”)。
Ⅱ.研究金属腐蚀和防腐的原理很有现实意义。
(4)探究钢铁吸氧腐蚀的装置如图4所示。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰地观察到液柱上升现象的有______(填字母)。
A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更大的导管,水中滴加红墨水
(5)为探究图5中铁钉腐蚀实验a、b两点所发生的反应,进行以下实验,请完成表格空白:
实验操作 实验现象 实验结论
向NaCl溶液中滴加2~3滴酚酞指示剂 a点附近溶液出现_①_ a点电极反应为_②_
然后再滴加2~3滴_③_ b点周围出现蓝色沉淀 b点电极反应为
19.(16分)有效利用二氧化碳对实现“碳中和”意义重大。
(1)现代工业技术可从空气或工业尾气中捕获,下列可作为捕获剂的是______(填字母)。
A.溶液 B.氨水 C.溶液
(2)二氧化碳加氢制甲醇的总反应可表示为:,该反应一般认为通过如下步骤来实现:
① kJ mol
kJ mol
则总反应的_______kJ mol;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______(填字母)。
A. B.
C. D.
(3)体积为1 L的密闭容器中,充入1 mol 和3 mol ,发生(2)中总反应,测得和的浓度随时间变化如图6所示:
①从3 min到9 minn,______(结果保留小数后3位);a点时v(正)______v(逆)(填>、<或=)。
②9 min时反应达到平衡,该条件下反应的平衡常数______(结果保留小数后1位)。
(4)使用惰性电极电解制取甲醇的反应装置如图7所示:电极a接电源______极(填“正”或“负”),生成甲醇的电极反应式为________________________。
(5)若用Ag负载在载体上制得催化剂,作为电极可促进还原为CO,其机理如图8所示。上述机理中还原为CO的过程可表述为:①吸附在催化剂表面形成(吸附),获得电子生成(吸附),②______,③CO(吸附)解附形成游离CO。
20.(14分)二草酸合铜酸钾是一种重要的化工原料,微溶于冷水、酒精,可溶于热水。已知,实验室制备二草酸合铜酸钾晶体可采用图9步骤:
回答下列问题:
(1)溶液显酸性的原因是_____________________(用离子方程式表示)。
(2)在常温下,胆矾溶液与氢氧化钠溶液反应生成氢氧化铜,当所得溶液的时,则溶液中_______(已知该温度下)。
(3)已知的电离平衡常数为:,,则水溶液显_______(填“酸性”或“碱性”)。
(4)操作④后得到的晶体需用少量酒精洗涤,其目的是_______。
(5)过滤时用到的玻璃仪器有漏斗、_______。
(6)原料纯度的测定
已知:。称取一定量的试样,配制成250 mL溶液,取试样溶液25.00 mL,用a mol L的酸性标准液滴定,消耗酸性标准液b mL(假设杂质不与酸性溶液反应)。
①滴定前,盛装酸性标准液的仪器在排气泡时,应选择下图中的_______(填字母)。
②滴定终点的现象为____________________________。
梅州市2022-2023学年高二上学期期末考试
化学参考答案与评分标准
说明:
1.化学专用名词出现错别字不给分。
2.书写化学方程式或离子方程式时,化学式写错不给分;配平错误、未写反应条件等合扣1分。
3.考生若写出其他合理答案,可参照评分标准给分。
一、选择题:共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。
题号 1 2 3 4 5 6 7 8
答案 D C C C B A D B
题号 9 10 11 12 13 14 15 16
答案 D C A B C A B B
二、非选择题:共56分。
17.(12分,每空2分)
(1)
(2)+1
(3)C
(4)S>P>Ga(2分;写成Ga(5)(2分;未配平扣1分)
(6)(2分;未配平扣1分;未配平和未写反应条件合扣1分)
18.(14分,除特别标注外,其余每空2分)
(1)3.00(1分)32.00(1分)
(2)实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1(2分;按划线部分各给1分)
(3)逆向
(4)AC(2分;只写1个且正确得1分,多写错误答案1个倒扣1分,扣完为止)
(5)①红色
②(2分;未配平扣1分)
③铁氰化钾溶液(或溶液)
19.(16分,除特别标注外,其余每空2分)
(1)B(1分)
(2)-49 C
(3)①0.042(2分;写成0.04、0.041、0.0416等得1分)
②(单位未写不扣分)
(4)负(1分) (2分;未配平扣1分)
(5)(吸附)在Ag表面结合 形成CO(吸附)和(2分;按划线部分各给1分)
20.(14分,每空2分)
(1)(2分;未配平扣1分;未配平和写成“”合扣1分)
(2) mol L(单位未写扣1分)
(3)酸性
(4)除去表面的可溶性杂质和水分,同时酒精易挥发,晶体易干燥(2分;按划线部分各给1分)
(5)烧杯、玻璃棒(2分;写对1个给1分,多写不倒扣)
(6)①b
②当滴入最后半滴溶液时,溶液恰好由无色变成浅紫色,(1分)
且半分钟内不褪色(1分)
化学
本试卷共6页,20小题,满分100分。考试用时75分钟。
可能用到的相对原子质量:H1 Na23 S32
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生产、生活密切相关。下列叙述不正确的是( )
A.“保暖贴”在发热过程中应用的是原电池的工作原理
B.钢铁设施在海水中的腐蚀速率比在河水中的快
C.纯碱可以用作锅炉除垢时的转化剂
D.明矾可用作净水剂和消毒剂
2.下列叙述正确的是( )
A.s区全部是金属元素 B.K层上电子的能量比L层上电子的能量高
C.2p能级有3个轨道 D.原子核外每个能层最多可容纳的电子数为
3.工业上,下列各组金属的冶炼方法相同的是( )
A.Fe和Al B.Au和Cu C.Na和Al D.K和Fe
4.古诗词蕴含丰富的化学知识,下列诗句所涉及的物质变化过程中,包含吸热反应的是( )
A.春蚕到死丝方尽,蜡炬成灰泪始干 B.爆竹声中一岁除,春风送暖入屠苏
C.千锤万凿出深山,烈火焚烧若等闲 D.开窗尽见千山雪,雪未消时月正明
5.a~e为短周期元素,其原子序数与其某种化合价的关系如图1所示。下列说法正确的是( )
A.基态a原子的轨道表示式:
B.c、e对应原子的半径:c>e
C.简单气态氢化物的稳定性:a
6.下列化学用语对事实的表述正确的是( )
A.氢氧化镁固体溶于盐酸:
B.水溶液中的电离方程式:
C.NaHS的水解反应:
D.表示燃烧热的热化学方程式: kJ mol
7.氢能源汽车在北京冬奥会上大批量使用为减少碳排放立下了大功劳。下列关于氢氧燃料电池的说法正确的是( )
A.氢氧燃料电池工作时负极通入
B.氢氧燃料电池正极发生氧化反应
C.氢氧燃料电池客车不能在寒冷天气中使用
D.氢氧燃料电池工作时的总反应为
8.下列事实中,不能用勒夏特列原理解释的是( )
A.开启啤酒瓶后,马上泛起大量泡沫
B.在配制硫酸亚铁溶液时往往要加入少量铁粉
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
9.下列说法正确的是( )
A.自发进行的反应不需要任何条件,就可以发生反应
B.的反应一定能自发进行
C.增大反应物浓度,可增大活化分子百分数,从而增加有效碰撞的次数
D.反应,若正反应的活化能为 kJ mol,逆反应的活化能为 kJ mol,则 kJ mol
10.设为阿伏加德罗常数的值。下列说法正确的是( )
A.往密闭容器中充入1 mol 和3 mol 充分反应生成的分子数为
B.1 L 0.1 mol·L的溶液中数目为
C.电解熔融NaCl,阴极增重2.3 g,外电路中通过电子的数目为
D.0.1 mol·L的溶液中,和离子数之和等于
11.下列说法不正确的是( )
A.常温下,由水电离出的 mol L的溶液中:、、可以大量共存
B.溶液存在(蓝色)(黄色)平衡,向黄绿色的溶液中加水,溶液颜色变蓝绿色
C.中和等体积、等pH的稀硫酸和稀醋酸所消耗NaOH的物质的量:前者小于后者
D.常温下,0.1 mol L 溶液中存在:
12.电解溶液的装置如图2所示,a、b均为惰性电极。下列说法不正确的是( )
A.a极上发生的反应为:
B.移向b极
C.转移2 mol ,理论上阳极产生11.2 L气体(标准状况下)
D.电解总反应:
13.下图有关实验或操作能达到实验目的的是( )
A.①证明
B.②装置蒸发氯化铝溶液制备无水氯化铝
C.③装置可判断反应的热效应
D.④验证氯化铁对过氧化氢的分解有催化作用
14.羰基硫(COS)能防止某些昆虫、线虫和真菌的危害。在容积不变的密闭容器中,将CO和混合后在催化剂作用下,加热发生反应并达到平衡。若反应前CO的物质的量为10 mol,达到平衡时CO的物质的量为8 mol,且化学平衡常数为0.1。下列说法正确的是( )
A.反应前的物质的量为7 mol
B.增大压强,化学平衡正向移动
C.增大CO浓度,正反应速率增大,逆反应速率减小
D.增大的比值,可以减小CO的转化率
15.下列实验操作、实验现象和实验结论均正确的是( )
选项 实验操作 实验现象 实验结论
A 往溶液中通入气体 有沉淀生成 沉淀是
B 往平衡体系中,加入KCl晶体 溶液颜色不变 加入少量KCl晶体,不会影响该化学平衡
C 在两个烧杯中分别盛有等体积、等浓度的烧碱溶液和氨水,插入电极,连接灯泡,接通电源,分别进行导电实验 盛有烧碱溶液的灯泡亮度大 强电解质导电能力大于弱电解质
D 相同温度下,分别向NaA和NaB稀溶液中滴加酚酞试液 NaB溶液红色更深 酸性:HA>HB
16.常温下,在体积均为20 mL、浓度均为0.1 mol·L的HX溶液、HY溶液中分别滴加浓度为0.1 mol·L的NaOH溶液,反应后溶液中水电离的表示为,与滴加氢氧化钠溶液体积的关系如图3所示。下列推断正确的是( )
A.HX、HY都是弱酸
B.常温下,的数量级
C.常温下用蒸馏水分别稀释B、D点溶液,pH都降低
D.C、D两点溶液中都有
二、非选择题:本大题共4小题,共56分。
17.(12分)光伏材料是指能将太阳能直接转换成电能的材料,又称太阳能材料,只有半导体材料具有这种功能。可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1)Ga与B同主族,基态Ga原子价电子排布式为______。
(2)Ga失去电子的逐级电离能(单位:kJ mol )的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为______和+3。
(3)下列事实能说明硫的非金属性比硒强的是______(填字母)。
A.溶解度:
B.沸点:
C.酸性:
(4)Ga、P、S的电负性从大到小的顺序为__________________。
(5)与Al元素在元素周期表中处于对角线的铍,在性质上具有相似性,写出铍的氧化物与氢氧化钠溶液反应生成的离子方程式__________________。
(6)工业上以镓粉为原料,用镍催化法生产GaN,在氨气流中于1050~1100℃下加热30 min可制得疏松的灰色粉末状GaN,同时得到一种单质,写出该反应的化学方程式__________________。
18.(14分)Ⅰ.食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。某小组研究25℃下HAc电离平衡的影响因素。
提出假设:稀释HAc溶液或改变浓度,HAc电离平衡会发生移动。
设计方案并完成实验,用浓度均为0.1mol L的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
序号 V(HAc)/mL V(NaAc)/mL /mL pH
Ⅰ 40.00 / / 0 2.86
Ⅱ 4.00 / 36.00 0 3.36
…
Ⅶ 4.00 a 33.00 4.53
Ⅷ 4.00 4.00 b 4.65
(1)根据表中信息,补充数据:______,______。
(2)由表中实验Ⅰ和Ⅱ数据,可以得出HAc是弱电解质的结论,给出判断理由:________________________。
(3)由实验Ⅱ~Ⅷ可知,增大浓度,HAc电离平衡______移动(填“正向”或“逆向”)。
Ⅱ.研究金属腐蚀和防腐的原理很有现实意义。
(4)探究钢铁吸氧腐蚀的装置如图4所示。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰地观察到液柱上升现象的有______(填字母)。
A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更大的导管,水中滴加红墨水
(5)为探究图5中铁钉腐蚀实验a、b两点所发生的反应,进行以下实验,请完成表格空白:
实验操作 实验现象 实验结论
向NaCl溶液中滴加2~3滴酚酞指示剂 a点附近溶液出现_①_ a点电极反应为_②_
然后再滴加2~3滴_③_ b点周围出现蓝色沉淀 b点电极反应为
19.(16分)有效利用二氧化碳对实现“碳中和”意义重大。
(1)现代工业技术可从空气或工业尾气中捕获,下列可作为捕获剂的是______(填字母)。
A.溶液 B.氨水 C.溶液
(2)二氧化碳加氢制甲醇的总反应可表示为:,该反应一般认为通过如下步骤来实现:
① kJ mol
kJ mol
则总反应的_______kJ mol;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______(填字母)。
A. B.
C. D.
(3)体积为1 L的密闭容器中,充入1 mol 和3 mol ,发生(2)中总反应,测得和的浓度随时间变化如图6所示:
①从3 min到9 minn,______(结果保留小数后3位);a点时v(正)______v(逆)(填>、<或=)。
②9 min时反应达到平衡,该条件下反应的平衡常数______(结果保留小数后1位)。
(4)使用惰性电极电解制取甲醇的反应装置如图7所示:电极a接电源______极(填“正”或“负”),生成甲醇的电极反应式为________________________。
(5)若用Ag负载在载体上制得催化剂,作为电极可促进还原为CO,其机理如图8所示。上述机理中还原为CO的过程可表述为:①吸附在催化剂表面形成(吸附),获得电子生成(吸附),②______,③CO(吸附)解附形成游离CO。
20.(14分)二草酸合铜酸钾是一种重要的化工原料,微溶于冷水、酒精,可溶于热水。已知,实验室制备二草酸合铜酸钾晶体可采用图9步骤:
回答下列问题:
(1)溶液显酸性的原因是_____________________(用离子方程式表示)。
(2)在常温下,胆矾溶液与氢氧化钠溶液反应生成氢氧化铜,当所得溶液的时,则溶液中_______(已知该温度下)。
(3)已知的电离平衡常数为:,,则水溶液显_______(填“酸性”或“碱性”)。
(4)操作④后得到的晶体需用少量酒精洗涤,其目的是_______。
(5)过滤时用到的玻璃仪器有漏斗、_______。
(6)原料纯度的测定
已知:。称取一定量的试样,配制成250 mL溶液,取试样溶液25.00 mL,用a mol L的酸性标准液滴定,消耗酸性标准液b mL(假设杂质不与酸性溶液反应)。
①滴定前,盛装酸性标准液的仪器在排气泡时,应选择下图中的_______(填字母)。
②滴定终点的现象为____________________________。
梅州市2022-2023学年高二上学期期末考试
化学参考答案与评分标准
说明:
1.化学专用名词出现错别字不给分。
2.书写化学方程式或离子方程式时,化学式写错不给分;配平错误、未写反应条件等合扣1分。
3.考生若写出其他合理答案,可参照评分标准给分。
一、选择题:共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。
题号 1 2 3 4 5 6 7 8
答案 D C C C B A D B
题号 9 10 11 12 13 14 15 16
答案 D C A B C A B B
二、非选择题:共56分。
17.(12分,每空2分)
(1)
(2)+1
(3)C
(4)S>P>Ga(2分;写成Ga
(6)(2分;未配平扣1分;未配平和未写反应条件合扣1分)
18.(14分,除特别标注外,其余每空2分)
(1)3.00(1分)32.00(1分)
(2)实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1(2分;按划线部分各给1分)
(3)逆向
(4)AC(2分;只写1个且正确得1分,多写错误答案1个倒扣1分,扣完为止)
(5)①红色
②(2分;未配平扣1分)
③铁氰化钾溶液(或溶液)
19.(16分,除特别标注外,其余每空2分)
(1)B(1分)
(2)-49 C
(3)①0.042(2分;写成0.04、0.041、0.0416等得1分)
②(单位未写不扣分)
(4)负(1分) (2分;未配平扣1分)
(5)(吸附)在Ag表面结合 形成CO(吸附)和(2分;按划线部分各给1分)
20.(14分,每空2分)
(1)(2分;未配平扣1分;未配平和写成“”合扣1分)
(2) mol L(单位未写扣1分)
(3)酸性
(4)除去表面的可溶性杂质和水分,同时酒精易挥发,晶体易干燥(2分;按划线部分各给1分)
(5)烧杯、玻璃棒(2分;写对1个给1分,多写不倒扣)
(6)①b
②当滴入最后半滴溶液时,溶液恰好由无色变成浅紫色,(1分)
且半分钟内不褪色(1分)
同课章节目录
