广东省深圳市罗湖区2022-2023学年高一下学期4月期中考试化学试题(含答案)
文档属性
| 名称 | 广东省深圳市罗湖区2022-2023学年高一下学期4月期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-05 08:40:39 | ||
图片预览


文档简介
深圳市罗湖区2022-2023学年高一下学期4月期中考试
化学
一、选择题(本大题共16小题,第1~10题,每小题2分,第11~16题,每小题4分,共计44分。每小题列出的4个选项中只有一个正确答案)
1.化学与人类的生产、生活密切相关,下列有关叙述正确的是( )
A.手机芯片的主要成分是二氧化硅
B.单质硅是制造光导纤维的材料
C.建造高楼所用的水泥属于硅酸盐材料
D.扬声器上使用的压电陶瓷属于传统无机非金属材料
2.下列现象或用途与浓硫酸的吸水性和脱水性无关的是( )
A.浓硫酸可作氯气的干燥剂
B.浓硫酸在加热条件下可与铜等不活泼金属反应
C.浓硫酸滴加到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸滴加到蔗糖中,蔗糖变黑
3.下列说法正确的是( )
A.放热反应全部不需要加热即可发 B.化学变化中的能量变化主要由化学键变化引起的
C.需要加热条件的化学反应都是吸热反应 D.化学反应未必伴随能量变化
4.下列关于原电池的叙述中正确的是( )
A.外电路中电子从负极流向正极 B.活泼金属作正极,不活泼金属作负极
C.把电能转化为化学能的装置 D.正极发生氧化反应
5、在一定温度下的恒压密闭容器中,能说明反应已达到平衡状态的是( )
A.容器内的总体积不随时间变化
B.反应容器内总物质的量不随时间变化而变化
C.XY的生成速率是的消耗速率的两倍
D.XY气体的物质的质量不变
6.下列说法错误的是( )
A.酸雨的主要成分为和
B.铁与水蒸气在高温下反应的产物是
C.用石灰对煤燃烧后形成的烟气脱硫,可以减少酸雨形成。
D.气体通入溶液中可生成淡黄色沉淀
7.电池的种类繁多,是未来可挖掘和开发的产品。下列关于电池的叙述,正确的是( )
A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极材料是Pb,负极材料是
8.某溶液中可能含有:、、、。为了检验其中是否含有,除溶液外,还需要的溶液是( )
A.盐酸 B. C.NaOH D.
9.某原电池的电池反应为,与此电池反应不符合的原电池是( )
A、铜片、铁片、HCl溶液组成的原电池
B、石墨、铁片、HCl溶液组成的原电池
C、银片、铁片、稀溶液组成的原电池
D、锌、铁片、稀溶液组成的原电池
10.下列叙述不正确的是( )
A.易液化,液氨常用作制冷剂
B.铵盐受热易分解,因此贮存铵态氮肥时要密封保存
C.稀硝酸和铁反应产生的氢气可为工业制氨提供原料
D.和NO都不是碱性氧化物
11.将转化为是工业冶炼金属钛的主要反应之一。
已知:
则反应的是( )
A. B. C. D.
12.反应中,若有生成,发生氧化反应的的物质的量是( )
A.3mol B.4mol C.8mol D.16mol
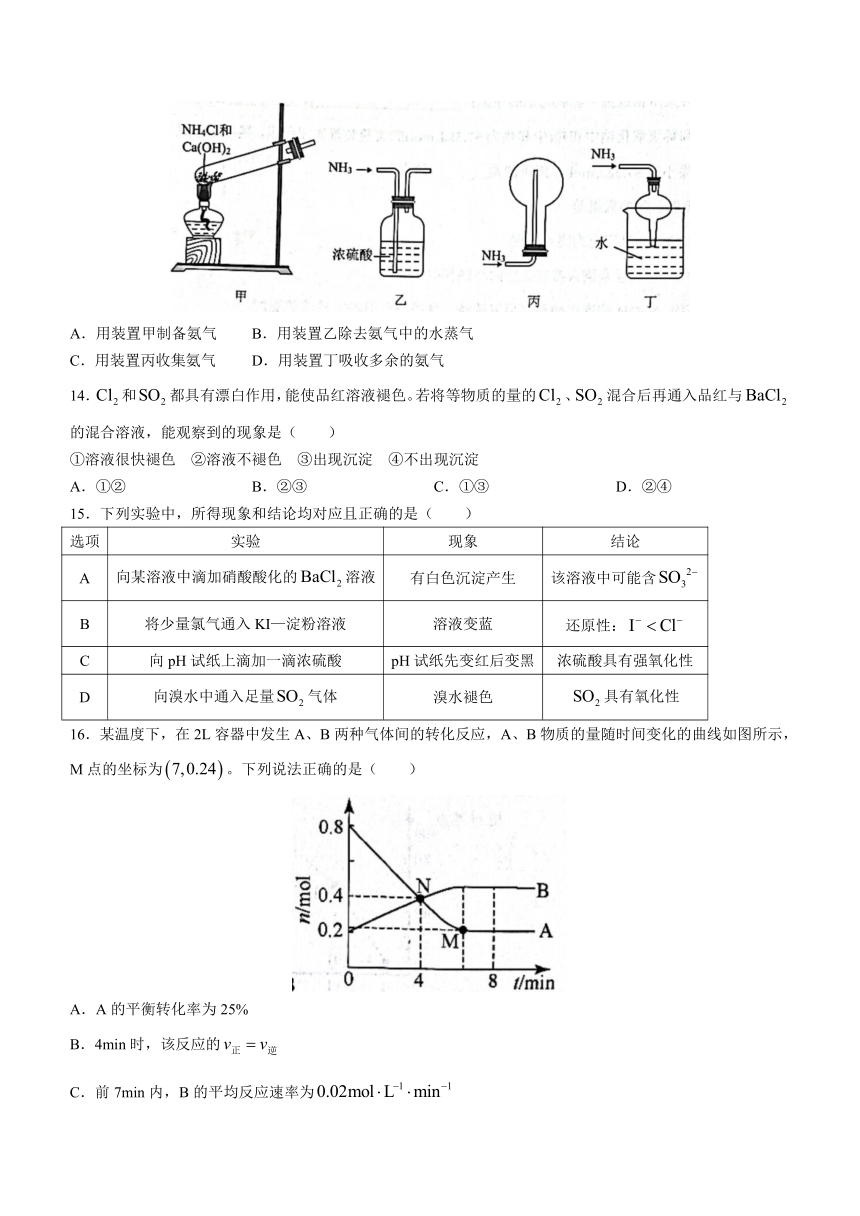
13.下列装置用于进行指定实验时,能达到实验目的的是( )
A.用装置甲制备氨气 B.用装置乙除去氨气中的水蒸气
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
14.和都具有漂白作用,能使品红溶液褪色。若将等物质的量的、混合后再通入品红与的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①② B.②③ C.①③ D.②④
15.下列实验中,所得现象和结论均对应且正确的是( )
选项 实验 现象 结论
A 向某溶液中滴加硝酸酸化的溶液 有白色沉淀产生 该溶液中可能含
B 将少量氯气通入KI—淀粉溶液 溶液变蓝 还原性:
C 向pH试纸上滴加一滴浓硫酸 pH试纸先变红后变黑 浓硫酸具有强氧化性
D 向溴水中通入足量气体 溴水褪色 具有氧化性
16.某温度下,在2L容器中发生A、B两种气体间的转化反应,A、B物质的量随时间变化的曲线如图所示,M点的坐标为。下列说法正确的是( )
A.A的平衡转化率为25%
B.4min时,该反应的
C.前7min内,B的平均反应速率为
D.通过对图像进行分析可以得出该反应化学方程式为:
二、非选择题部分(本题共4小题,每题14分,共56分)
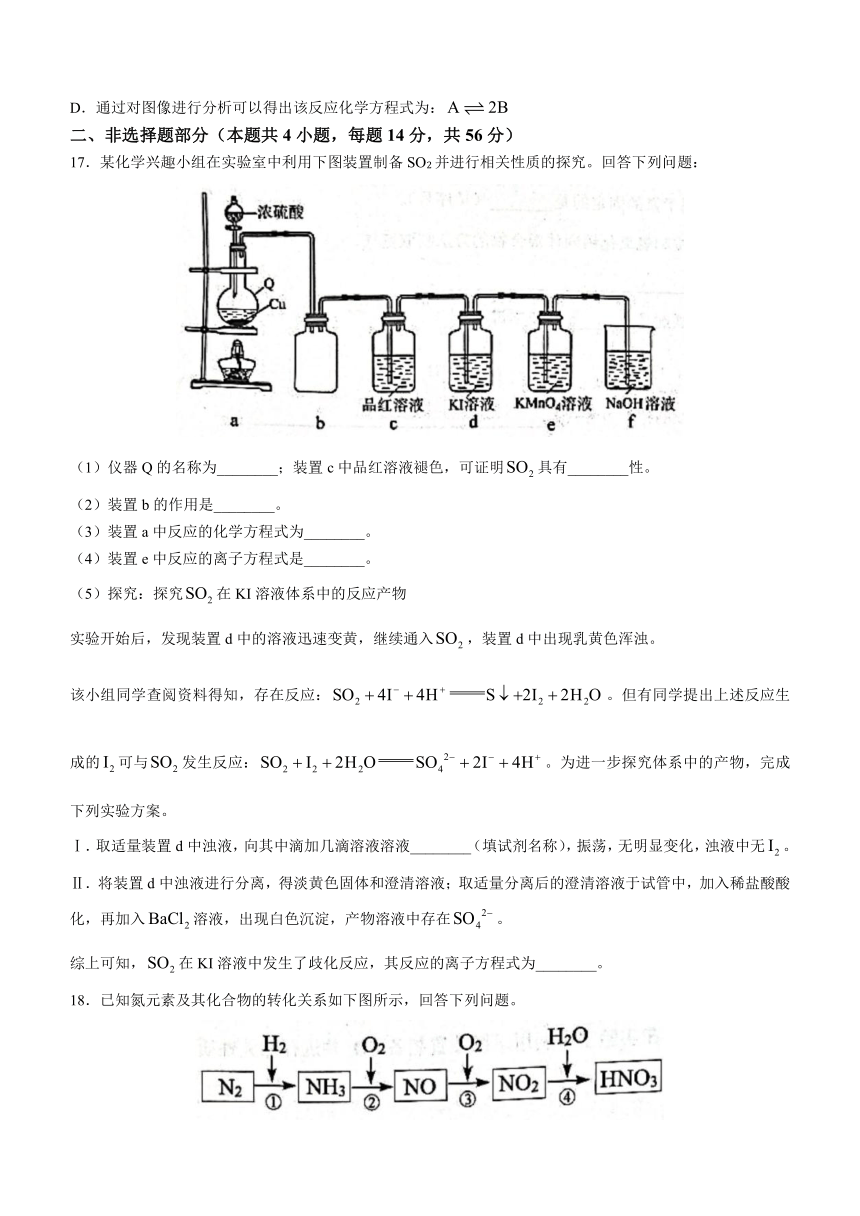
17.某化学兴趣小组在实验室中利用下图装置制备SO2并进行相关性质的探究。回答下列问题:
(1)仪器Q的名称为________;装置c中品红溶液褪色,可证明具有________性。
(2)装置b的作用是________。
(3)装置a中反应的化学方程式为________。
(4)装置e中反应的离子方程式是________。
(5)探究:探究在KI溶液体系中的反应产物
实验开始后,发现装置d中的溶液迅速变黄,继续通入,装置d中出现乳黄色浑浊。
该小组同学查阅资料得知,存在反应:。但有同学提出上述反应生成的可与发生反应:。为进一步探究体系中的产物,完成下列实验方案。
Ⅰ.取适量装置d中浊液,向其中滴加几滴溶液溶液________(填试剂名称),振荡,无明显变化,浊液中无。
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,加入稀盐酸酸化,再加入溶液,出现白色沉淀,产物溶液中存在。
综上可知,在KI溶液中发生了歧化反应,其反应的离子方程式为________。
18.已知氮元素及其化合物的转化关系如下图所示,回答下列问题。
(1)①~④各步转化中,属于氮的固定的是________(填序号)。
(2)实验室常用加热氯化铵和氢氧化钙固体混合物的方法制取氨气。
①化学方程式是________________。
②干燥氨气不可选用的试剂是________(填字母)。
a.浓硫酸 b.碱石灰 c.NaOH固体
(3)工业上用氨气制备NO的化学方程式是________________。
(4)工业制硝酸时尾气中含有NO、,可用以下方法吸收:
①水吸收法。写出与的化学方程式:________________________.
②NaOH溶液吸收法。发生的反应有:,
(填化学式,不需要配平方程式)。
③用不同浓度的NaOH溶液吸收含量不同的尾气,关系如下图:(表示尾气里NO、中的含量)根据上图得知________(填字母)。
a.NaOH溶液浓度越大,氮氧化物的吸收率越大
b.含量越大,氮氧化物的吸收率越大
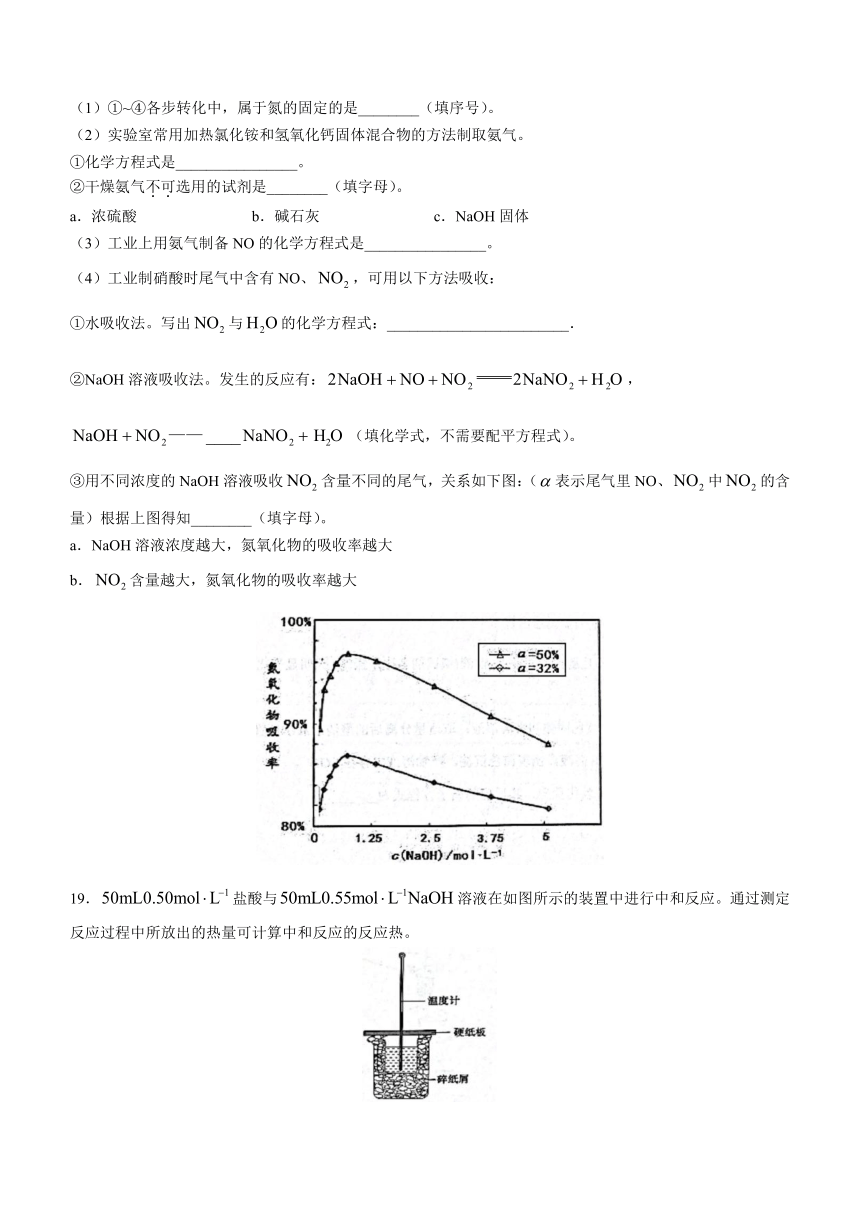
19.盐酸与溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
(1)①从实验装置看,图中还缺少的一种玻璃仪器是________________,
②中和热测定时采用稍过量的氢氧化钠的原因:________________。
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是________(填字母).
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与相比较会________(填“偏大”“偏小”或“无影响”)。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
反应Ⅰ:
反应Ⅲ:
反应Ⅱ的热化学方程式:________________________.
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
化学键 H-H N-H
键能kJ/mol a b c
则________(用小写字母表示)。
(4)一定条件下,在水溶液均为1mol以下离子、、、、的能量(kJ)相对大小如图所示,则的________。
20.在2L密闭容器中,800℃时,反应体系中,随时间的变化如下表所示。
时间/s 0 1 2 3 4 5
0.020 0.010 0.008 0.007 0.007 0.007
(1)上图中,A点处________(填“大于”“小于”或“等于”).
(2)图中表示变化的曲线是________。用表示从0~2s内该反应的平均速率v=________.
(3)下列能说明该反应已经达到平衡状态的是________(填字母,下同)。
a. b.容器内颜色保持不变
c. d.消耗同时生成
(4)下列能使该反应的反应速率增大的是________.
a.及时分离出气体 b.适当升高温度
c.加入氩气增大体系压强 d.选择高效的催化剂
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为________,若将负极材料改为,写出其负极反应方程式________。
深圳市罗湖区2022-2023学年高一下学期4月期中考试
化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
C B B A D B C A D C C B D B A C
17.(1)①圆底烧瓶 ②漂白
(2)安全瓶,防止倒吸
(3)
(4)
(5)Ⅰ.淀粉溶液 Ⅱ.
18.(1)①
(2)① ②a
(3)
(4)① ② ③b
19.(1)①环形玻璃搅拌棒 ②保证盐酸完全被中和 ③AD ④偏小
(2)
(3)3a+c-6b (4)-117
20.(1)大于 (2)b (3)bc (4)bd
(5)① ②
化学
一、选择题(本大题共16小题,第1~10题,每小题2分,第11~16题,每小题4分,共计44分。每小题列出的4个选项中只有一个正确答案)
1.化学与人类的生产、生活密切相关,下列有关叙述正确的是( )
A.手机芯片的主要成分是二氧化硅
B.单质硅是制造光导纤维的材料
C.建造高楼所用的水泥属于硅酸盐材料
D.扬声器上使用的压电陶瓷属于传统无机非金属材料
2.下列现象或用途与浓硫酸的吸水性和脱水性无关的是( )
A.浓硫酸可作氯气的干燥剂
B.浓硫酸在加热条件下可与铜等不活泼金属反应
C.浓硫酸滴加到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸滴加到蔗糖中,蔗糖变黑
3.下列说法正确的是( )
A.放热反应全部不需要加热即可发 B.化学变化中的能量变化主要由化学键变化引起的
C.需要加热条件的化学反应都是吸热反应 D.化学反应未必伴随能量变化
4.下列关于原电池的叙述中正确的是( )
A.外电路中电子从负极流向正极 B.活泼金属作正极,不活泼金属作负极
C.把电能转化为化学能的装置 D.正极发生氧化反应
5、在一定温度下的恒压密闭容器中,能说明反应已达到平衡状态的是( )
A.容器内的总体积不随时间变化
B.反应容器内总物质的量不随时间变化而变化
C.XY的生成速率是的消耗速率的两倍
D.XY气体的物质的质量不变
6.下列说法错误的是( )
A.酸雨的主要成分为和
B.铁与水蒸气在高温下反应的产物是
C.用石灰对煤燃烧后形成的烟气脱硫,可以减少酸雨形成。
D.气体通入溶液中可生成淡黄色沉淀
7.电池的种类繁多,是未来可挖掘和开发的产品。下列关于电池的叙述,正确的是( )
A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极材料是Pb,负极材料是
8.某溶液中可能含有:、、、。为了检验其中是否含有,除溶液外,还需要的溶液是( )
A.盐酸 B. C.NaOH D.
9.某原电池的电池反应为,与此电池反应不符合的原电池是( )
A、铜片、铁片、HCl溶液组成的原电池
B、石墨、铁片、HCl溶液组成的原电池
C、银片、铁片、稀溶液组成的原电池
D、锌、铁片、稀溶液组成的原电池
10.下列叙述不正确的是( )
A.易液化,液氨常用作制冷剂
B.铵盐受热易分解,因此贮存铵态氮肥时要密封保存
C.稀硝酸和铁反应产生的氢气可为工业制氨提供原料
D.和NO都不是碱性氧化物
11.将转化为是工业冶炼金属钛的主要反应之一。
已知:
则反应的是( )
A. B. C. D.
12.反应中,若有生成,发生氧化反应的的物质的量是( )
A.3mol B.4mol C.8mol D.16mol
13.下列装置用于进行指定实验时,能达到实验目的的是( )
A.用装置甲制备氨气 B.用装置乙除去氨气中的水蒸气
C.用装置丙收集氨气 D.用装置丁吸收多余的氨气
14.和都具有漂白作用,能使品红溶液褪色。若将等物质的量的、混合后再通入品红与的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①② B.②③ C.①③ D.②④
15.下列实验中,所得现象和结论均对应且正确的是( )
选项 实验 现象 结论
A 向某溶液中滴加硝酸酸化的溶液 有白色沉淀产生 该溶液中可能含
B 将少量氯气通入KI—淀粉溶液 溶液变蓝 还原性:
C 向pH试纸上滴加一滴浓硫酸 pH试纸先变红后变黑 浓硫酸具有强氧化性
D 向溴水中通入足量气体 溴水褪色 具有氧化性
16.某温度下,在2L容器中发生A、B两种气体间的转化反应,A、B物质的量随时间变化的曲线如图所示,M点的坐标为。下列说法正确的是( )
A.A的平衡转化率为25%
B.4min时,该反应的
C.前7min内,B的平均反应速率为
D.通过对图像进行分析可以得出该反应化学方程式为:
二、非选择题部分(本题共4小题,每题14分,共56分)
17.某化学兴趣小组在实验室中利用下图装置制备SO2并进行相关性质的探究。回答下列问题:
(1)仪器Q的名称为________;装置c中品红溶液褪色,可证明具有________性。
(2)装置b的作用是________。
(3)装置a中反应的化学方程式为________。
(4)装置e中反应的离子方程式是________。
(5)探究:探究在KI溶液体系中的反应产物
实验开始后,发现装置d中的溶液迅速变黄,继续通入,装置d中出现乳黄色浑浊。
该小组同学查阅资料得知,存在反应:。但有同学提出上述反应生成的可与发生反应:。为进一步探究体系中的产物,完成下列实验方案。
Ⅰ.取适量装置d中浊液,向其中滴加几滴溶液溶液________(填试剂名称),振荡,无明显变化,浊液中无。
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,加入稀盐酸酸化,再加入溶液,出现白色沉淀,产物溶液中存在。
综上可知,在KI溶液中发生了歧化反应,其反应的离子方程式为________。
18.已知氮元素及其化合物的转化关系如下图所示,回答下列问题。
(1)①~④各步转化中,属于氮的固定的是________(填序号)。
(2)实验室常用加热氯化铵和氢氧化钙固体混合物的方法制取氨气。
①化学方程式是________________。
②干燥氨气不可选用的试剂是________(填字母)。
a.浓硫酸 b.碱石灰 c.NaOH固体
(3)工业上用氨气制备NO的化学方程式是________________。
(4)工业制硝酸时尾气中含有NO、,可用以下方法吸收:
①水吸收法。写出与的化学方程式:________________________.
②NaOH溶液吸收法。发生的反应有:,
(填化学式,不需要配平方程式)。
③用不同浓度的NaOH溶液吸收含量不同的尾气,关系如下图:(表示尾气里NO、中的含量)根据上图得知________(填字母)。
a.NaOH溶液浓度越大,氮氧化物的吸收率越大
b.含量越大,氮氧化物的吸收率越大
19.盐酸与溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。
(1)①从实验装置看,图中还缺少的一种玻璃仪器是________________,
②中和热测定时采用稍过量的氢氧化钠的原因:________________。
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是________(填字母).
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与相比较会________(填“偏大”“偏小”或“无影响”)。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
反应Ⅰ:
反应Ⅲ:
反应Ⅱ的热化学方程式:________________________.
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
化学键 H-H N-H
键能kJ/mol a b c
则________(用小写字母表示)。
(4)一定条件下,在水溶液均为1mol以下离子、、、、的能量(kJ)相对大小如图所示,则的________。
20.在2L密闭容器中,800℃时,反应体系中,随时间的变化如下表所示。
时间/s 0 1 2 3 4 5
0.020 0.010 0.008 0.007 0.007 0.007
(1)上图中,A点处________(填“大于”“小于”或“等于”).
(2)图中表示变化的曲线是________。用表示从0~2s内该反应的平均速率v=________.
(3)下列能说明该反应已经达到平衡状态的是________(填字母,下同)。
a. b.容器内颜色保持不变
c. d.消耗同时生成
(4)下列能使该反应的反应速率增大的是________.
a.及时分离出气体 b.适当升高温度
c.加入氩气增大体系压强 d.选择高效的催化剂
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为________,若将负极材料改为,写出其负极反应方程式________。
深圳市罗湖区2022-2023学年高一下学期4月期中考试
化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
C B B A D B C A D C C B D B A C
17.(1)①圆底烧瓶 ②漂白
(2)安全瓶,防止倒吸
(3)
(4)
(5)Ⅰ.淀粉溶液 Ⅱ.
18.(1)①
(2)① ②a
(3)
(4)① ② ③b
19.(1)①环形玻璃搅拌棒 ②保证盐酸完全被中和 ③AD ④偏小
(2)
(3)3a+c-6b (4)-117
20.(1)大于 (2)b (3)bc (4)bd
(5)① ②
同课章节目录
