黑龙江省七台河市勃利县中2022-2023学年高一下学期4月期中考试化学试题(含答案)
文档属性
| 名称 | 黑龙江省七台河市勃利县中2022-2023学年高一下学期4月期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 731.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-05 08:57:26 | ||
图片预览




文档简介
勃利县中2022-2023学年高一下学期4月期中考试
化学
(时间:90分钟 满分:100分)
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 S-32 Cu-64
第Ⅰ卷 选择题(共50分)
一、选择题(每小题只有一个选项符合题意,1-10题每小题2分,11-20题每题3分共30分)
1.化学与生产、生活息息相关,下列叙述正确的是( )
A.是一种有毒物质,因此不能作为食品添加剂使用
B.燃煤中加入石灰石,可以减少、等污染环境的气体排放
C.泡菜中的微生物将硝酸盐还原为亚硝酸盐的过程,属于氮的固定
D.生产宇航服所用的碳化硅陶瓷和碳纤维材料,是一种新型无机非金属材料
2.下列化学用语正确的是( )
A.正丁烷的结构简式: B.丙烷分子的空间填充模型:
C.甲烷分子的球棍模型: D.羟基的电子式:
3.下列有关硝酸化学性质的叙述中,正确的是( )
A.稀硝酸遇石蕊先变红后褪色 B.硝酸能与FeO反应,只表现氧化性
C.浓硝酸保存在棕色玻璃试剂瓶中 D.硝酸可与反应制得气体
4.下列说法正确的是( )
A.浓硫酸具有吸水性,可用来干燥
B.浓硫酸与铁不反应,可用铁罐储运浓硫酸
C.具有还原性,可实验室也可用浓硫酸干燥
D.水溶液具有漂白性,可使紫色石蕊试液褪色
5.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与反应时断裂①和③
C.乙醇与浓硫酸混合迅速加热到170℃时断裂②③
D.在空气中完全燃烧时断裂①②③④⑤
6.下列离子方程式,书写正确的是( )
A.铜溶于浓硝酸:
B.溶液与过量NaOH溶液反应:
C.铁粉溶于过量稀硝酸:
D.硫化氢通入氯化铁溶液:
7.下列叙述正确的个数是( )
①向固体中滴加NaOH溶液或氢氟酸,固体均溶解,说明是两性氧化物
②、或都会导致酸雨的形成
③0℃,101 kPa含有1 mol硫原子的与的混合物,其体积小于22.4 L
④不能用澄清石灰水鉴别和⑤液氨汽化时吸收大量的热,因此,液氨常用作制冷剂
⑥制造月球探测器中的瞄准镜时使用的光导纤维,其主要成分是二氧化硅
⑦常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
A.5个 B.4个 C.3个 D.2个
8.为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2 L的己烷所含的分子数为0.5
B.56 g乙烯与CO混合气体所含分子数目为2
C.2.8 g的聚乙烯中含有的碳原子数为0.1
D.1 mol乙醇中含有碳氢键的数目为6
9.将气体X和同时通入盛有溶液的洗气瓶中(如图),均有沉淀产生。已知气体X分别为①、②、③、④。下列说法正确的是( )
A.产生沉淀的成分均相同
B.产生沉淀的颜色均相同
C.若大大过量,沉淀均无明显变化
D.在上述实验中所体现出的性质有:还原性、氧化性、酸性氧化物
10.下列有关“四同”概念的说法或者判断正确的是( )
A.通式为,且碳原子数不相等的物质一定互为同系物
B.、、互为同素异形体
C.和互为同分异构体
D.和互为同位素
11.有机化学中取代反应范畴很广。下列反应中属于取代反应的是( )
A.
B.
C.
D.
12.如图所示的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。打开止水夹,挤压滴管的胶头,下列与实验事实不相符的是[已知CuS为不溶于硫酸的黑色沉淀]( )
A.(溶液)/无色喷泉 B.(含酚成)/红色喷泉
C.(溶液)/黑色喷泉 D.HCl(溶液)/白色喷泉
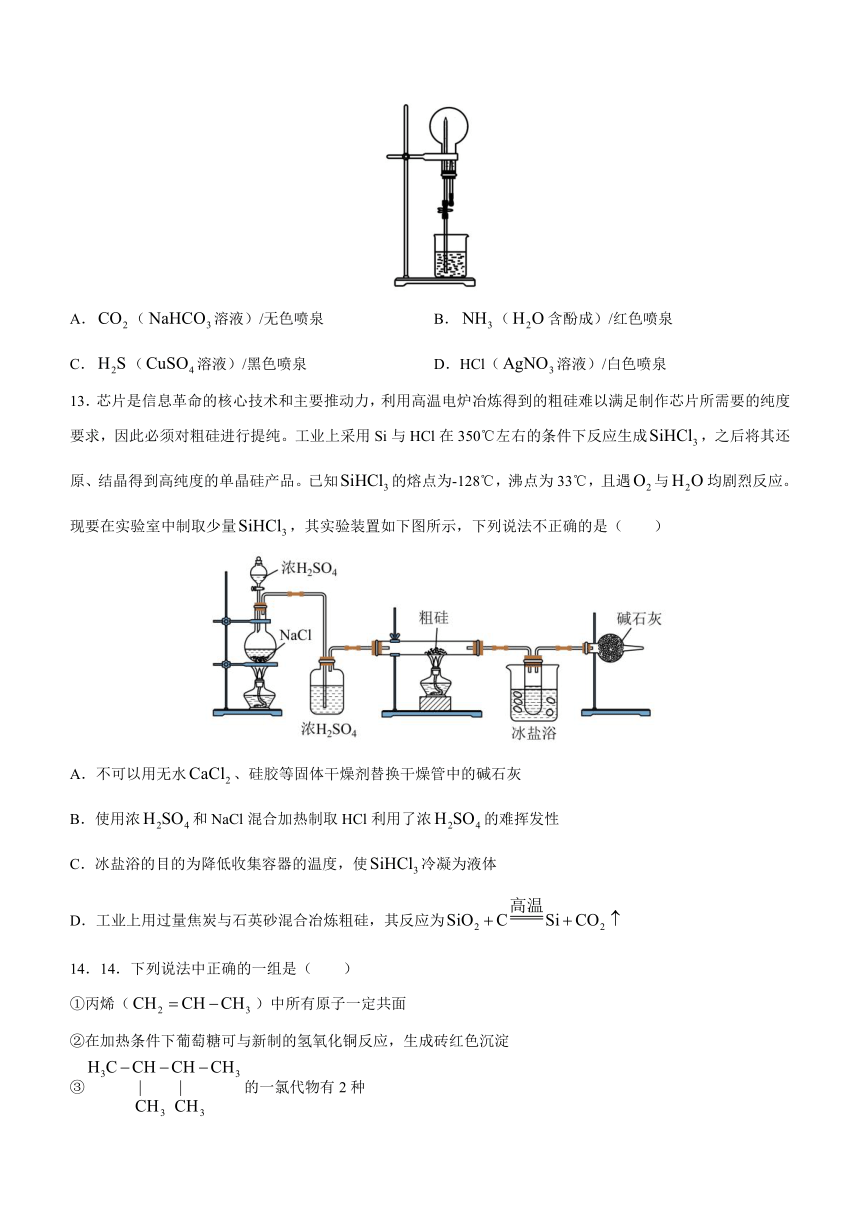
13.芯片是信息革命的核心技术和主要推动力,利用高温电炉冶炼得到的粗硅难以满足制作芯片所需要的纯度要求,因此必须对粗硅进行提纯。工业上采用Si与HCl在350℃左右的条件下反应生成,之后将其还原、结晶得到高纯度的单晶硅产品。已知的熔点为-128℃,沸点为33℃,且遇与均剧烈反应。现要在实验室中制取少量,其实验装置如下图所示,下列说法不正确的是( )
A.不可以用无水、硅胶等固体干燥剂替换干燥管中的碱石灰
B.使用浓和NaCl混合加热制取HCl利用了浓的难挥发性
C.冰盐浴的目的为降低收集容器的温度,使冷凝为液体
D.工业上用过量焦炭与石英砂混合冶炼粗硅,其反应为
14.14.下列说法中正确的一组是( )
①丙烯()中所有原子一定共面
②在加热条件下葡萄糖可与新制的氢氧化铜反应,生成砖红色沉淀
③的一氯代物有2种
④和互为同分异构体
⑤和互为同系物
⑥蛋白质、纤维素、油脂都是高分子化合物
A.②③ B.③④⑤ C.①③ D.②④⑥
15.下面实验操作能达到实验目的是( )
实验操作 目的
A 取绿豆粒大小的钠分别加入到水和乙醇中 证明乙醇羟基中氢原子比水分子中氢原子活泼
B 加入足量稀硝酸 除去铜粉中混有的铁粉
C 向蔗糖溶液中加入稀硫酸,加热后再用NaOH溶液中和并做银镜反应实验 证明蔗糖水解后产生葡萄糖
D 淀粉溶液加稀硫酸,水浴加热一段时间后,加新制的悬浊液,加热 证明淀粉水解后产生葡萄糖
A.A B.B C.C D.D
16.下列物质进行一氯取代反应后,只能生成4种沸点不同的有机产物的是( )
A. B.
C. D.
17.粗盐中含有泥沙以及、、等杂质,其提纯过程一般经过以下流程:
下列说法不正确的是( )
A.过滤需要用到的玻璃仪器有:漏斗、烧杯、玻璃棒
B.操作③中按a、b、c顺序可依次加入过量的NaOH溶液、溶液、溶液
C.进行操作⑥时,当蒸发皿中出现较多固体时,停止加热
D.操作⑤中加盐酸调pH的目的,只是为了除去过量的
18.有A、B两种烃,含碳的质量分数相等。关于A和B的下列叙述正确的是( )
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B的最简式相同
D.A和B各1mol完全燃烧后生成的质量一定相等
19.硝酸工业生产中常用纯碱溶液吸收排出的氮氧化物废气,废气中只含有NO、两种气体。将一定量废气通入到足量的溶液中被完全吸收,溶液中生成的、两种离子的物质的量与废气中的物质的量分数变化关系可用如图所示。已知溶液中可发生以下两个反应:
①
②
下列说法正确的是( )
A.图中线段a表示离子
B.随x值增大,溶液中变大
C.若测得所得溶液中为0.5 mol,则x值为0.8
D.时,反应中可收集到标准状况下22.4 L
20.硝酸是一种重要的化工原料,可用于制化肥、农药、炸药、染料等。将一定质量的镁铜合金放入到5 mL的浓硝酸溶液中恰好完全反应,共收集到(折算为标准状况下)和NO的混合气体448 mL,将混合气体倒立于水中,通入0.0075 mol 恰好使混合气体全部转化为硝酸,下列说法正确的是( )
A.该反应中硝酸只表现出强氧化性 B.混合气体中和NO的体积比为3∶1
C.镁铜合金的质量可能是1.2g D.原硝酸的物质的量浓度为6mol/L
Ⅱ卷非选择题(共50分)
21.(12分)学习小组在实验室中利用下图所示装置制备并进行相关性质的探究。回答下列问题:
(1)仪器Q的名称为______;装置c中品红溶液褪色,可证明具有______性,装置b的作用是______。
(2)向分液漏斗中滴加浓硫酸之前,需先通入一段时间,此操作的目的是______。
(3)装置a中反应的化学方程式为______。
(4)探究:探究在KI溶液体系中的反应产物实验开始后,发现装置d中的溶液迅速变黄,继续通入,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在反应:。但有同学提出上述反应生成的可与发生反应:。为进一步探究体系中的产物,完成下列实验方案。
Ⅰ.取适量装置d中浊液,向其中滴加几滴______溶液(填试剂名称),振荡,无明显变化,浊液中无。
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,______,出现白色沉淀,产物溶液中存在。
综上可知,在KI溶液中发生了歧化反应,其反应的离子方程式为______。
22.(12分)已知X和Y、Z为中学化学中的常见元素,根据如图所示转化关系(反应条件及部分产物已略去),回答以下问题。
(1)若A、B、C、D均为含X的化合物,且A常用作制冷剂,D是一种强酸,则
①写出工业制备A的化学反应方程式:______。
②将16 g铜粉与一定量的D的稀溶液反应后,收集到896 mL无色气体B(标准状况),则被还原的D的物质的量为______mol。向所得溶液中继续加稀硫酸至反应不能再进行,需加入含______mol 的稀硫酸。
(2)若A、B、C、D均为含Y的化合物,其中A是一元强碱且焰色为黄色,E是有刺激性气味的气态酸性氧化物,则B的化学式为______;A与C反应的离子方程式为______。
(3)若A、B、C、D均为含Z的化合物,其中A由两种元素组成,且A的摩尔质量为34 g/mol,D为强酸。将溶液滴加到NaClO溶液中,有淡黄色沉淀生成,请写出所发生反应的离子方程式:______。
23.(12分)习总书记提出要构建美丽中国的伟大构想,要实现这个构想,必须解决环境污染问题。拟综合处理含NH4的废水和工业废气(主要含、、、CO、NO),处理流程如图所示:
请回答下列问题:
(1)、、、CO、NO几种气体中,属于酸性氧化物的是______,捕获剂所捕获的产物(均填化学式)
(2)流程中“固体1”的主要成分的化学式是______。
(3)流程中“气体1”与适量反应的化学方程式为______。
(4)流程中处理时,发生反应的离子方程式为______。
(5)为了测定空气中的含量,某同学将空气样品经过管道通入盛有400 mL 0.1 mol/L酸性溶液的密闭容器中,发生的离子反应为。若管道中空气流量为a L/min,经过8 min溶液恰好褪色,假定样品中被充分吸收,该空气样品中的含量为______g/L。(假设空气中其他气体不与酸性溶液反应)
24.(14分)乙烯是重要有机化工原料。结合以下路线回答:
已知:
(1)反应①的反应类型为______,B的官能团是______(填名称)。
(2)乙醇在铜作催化剂时与氧气反应,反应的化学方程式为______。
(3)F是一种高分子化合物,可用于制作食品袋,其结构简式为______。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,装置如图所示。
ⅰ.反应⑥的化学方程式是______________________________。
ⅱ.乙中的试剂为饱和溶液,关于该溶液的说法正确的是______(填选项字母)。
A.它可以中和乙酸,溶解乙醇
B.它可以降低乙酸乙酯在水中的溶解度,提高水溶液的密度以加速乙酸乙酯与水溶液的分层
C.它能提高该反应的速率
D.它可以用饱和溶液或NaOH溶液代替
制法二:工业上用和E一定条件直接反应获得G。
ⅲ.该反应的的化学方程式为______________________________。
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,请计算制法一的原子利用率______(保留两位有效数字),采用(填“制法一”或“制法二”)______更环保,更经济。
勃利县中2022-2023学年高一下学期4月期中考试
化学答案
1-20题 DDCCC BBBDA DADAC BDCDB
21.(12分,除标注外每空2分)
(1)圆底烧瓶(1分) 漂白(1分) 安全瓶,防止倒吸
(2)排除空气的干扰(1分)
(3)
(4)淀粉溶液(1分) 加入稀盐酸酸化,再加入溶液(或加入盐酸酸化的溶液)
22.(12分每空2分,)
(1) 0.04 0.24
(2)
(3)
23.(12分,除标注外每空2分)
(1)、(各1分) CO
(2)、(各1分)
(3)
(4)
(5)
24.(14分,除标注外每空2分)
(1)加成反应(1分) 羟基(1分)
(2)
(3)(1分)
(4) AB
83% 制法二(1分)
化学
(时间:90分钟 满分:100分)
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 S-32 Cu-64
第Ⅰ卷 选择题(共50分)
一、选择题(每小题只有一个选项符合题意,1-10题每小题2分,11-20题每题3分共30分)
1.化学与生产、生活息息相关,下列叙述正确的是( )
A.是一种有毒物质,因此不能作为食品添加剂使用
B.燃煤中加入石灰石,可以减少、等污染环境的气体排放
C.泡菜中的微生物将硝酸盐还原为亚硝酸盐的过程,属于氮的固定
D.生产宇航服所用的碳化硅陶瓷和碳纤维材料,是一种新型无机非金属材料
2.下列化学用语正确的是( )
A.正丁烷的结构简式: B.丙烷分子的空间填充模型:
C.甲烷分子的球棍模型: D.羟基的电子式:
3.下列有关硝酸化学性质的叙述中,正确的是( )
A.稀硝酸遇石蕊先变红后褪色 B.硝酸能与FeO反应,只表现氧化性
C.浓硝酸保存在棕色玻璃试剂瓶中 D.硝酸可与反应制得气体
4.下列说法正确的是( )
A.浓硫酸具有吸水性,可用来干燥
B.浓硫酸与铁不反应,可用铁罐储运浓硫酸
C.具有还原性,可实验室也可用浓硫酸干燥
D.水溶液具有漂白性,可使紫色石蕊试液褪色
5.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
A.和金属钠反应时键①断裂
B.在铜催化共热下与反应时断裂①和③
C.乙醇与浓硫酸混合迅速加热到170℃时断裂②③
D.在空气中完全燃烧时断裂①②③④⑤
6.下列离子方程式,书写正确的是( )
A.铜溶于浓硝酸:
B.溶液与过量NaOH溶液反应:
C.铁粉溶于过量稀硝酸:
D.硫化氢通入氯化铁溶液:
7.下列叙述正确的个数是( )
①向固体中滴加NaOH溶液或氢氟酸,固体均溶解,说明是两性氧化物
②、或都会导致酸雨的形成
③0℃,101 kPa含有1 mol硫原子的与的混合物,其体积小于22.4 L
④不能用澄清石灰水鉴别和⑤液氨汽化时吸收大量的热,因此,液氨常用作制冷剂
⑥制造月球探测器中的瞄准镜时使用的光导纤维,其主要成分是二氧化硅
⑦常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
A.5个 B.4个 C.3个 D.2个
8.为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2 L的己烷所含的分子数为0.5
B.56 g乙烯与CO混合气体所含分子数目为2
C.2.8 g的聚乙烯中含有的碳原子数为0.1
D.1 mol乙醇中含有碳氢键的数目为6
9.将气体X和同时通入盛有溶液的洗气瓶中(如图),均有沉淀产生。已知气体X分别为①、②、③、④。下列说法正确的是( )
A.产生沉淀的成分均相同
B.产生沉淀的颜色均相同
C.若大大过量,沉淀均无明显变化
D.在上述实验中所体现出的性质有:还原性、氧化性、酸性氧化物
10.下列有关“四同”概念的说法或者判断正确的是( )
A.通式为,且碳原子数不相等的物质一定互为同系物
B.、、互为同素异形体
C.和互为同分异构体
D.和互为同位素
11.有机化学中取代反应范畴很广。下列反应中属于取代反应的是( )
A.
B.
C.
D.
12.如图所示的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。打开止水夹,挤压滴管的胶头,下列与实验事实不相符的是[已知CuS为不溶于硫酸的黑色沉淀]( )
A.(溶液)/无色喷泉 B.(含酚成)/红色喷泉
C.(溶液)/黑色喷泉 D.HCl(溶液)/白色喷泉
13.芯片是信息革命的核心技术和主要推动力,利用高温电炉冶炼得到的粗硅难以满足制作芯片所需要的纯度要求,因此必须对粗硅进行提纯。工业上采用Si与HCl在350℃左右的条件下反应生成,之后将其还原、结晶得到高纯度的单晶硅产品。已知的熔点为-128℃,沸点为33℃,且遇与均剧烈反应。现要在实验室中制取少量,其实验装置如下图所示,下列说法不正确的是( )
A.不可以用无水、硅胶等固体干燥剂替换干燥管中的碱石灰
B.使用浓和NaCl混合加热制取HCl利用了浓的难挥发性
C.冰盐浴的目的为降低收集容器的温度,使冷凝为液体
D.工业上用过量焦炭与石英砂混合冶炼粗硅,其反应为
14.14.下列说法中正确的一组是( )
①丙烯()中所有原子一定共面
②在加热条件下葡萄糖可与新制的氢氧化铜反应,生成砖红色沉淀
③的一氯代物有2种
④和互为同分异构体
⑤和互为同系物
⑥蛋白质、纤维素、油脂都是高分子化合物
A.②③ B.③④⑤ C.①③ D.②④⑥
15.下面实验操作能达到实验目的是( )
实验操作 目的
A 取绿豆粒大小的钠分别加入到水和乙醇中 证明乙醇羟基中氢原子比水分子中氢原子活泼
B 加入足量稀硝酸 除去铜粉中混有的铁粉
C 向蔗糖溶液中加入稀硫酸,加热后再用NaOH溶液中和并做银镜反应实验 证明蔗糖水解后产生葡萄糖
D 淀粉溶液加稀硫酸,水浴加热一段时间后,加新制的悬浊液,加热 证明淀粉水解后产生葡萄糖
A.A B.B C.C D.D
16.下列物质进行一氯取代反应后,只能生成4种沸点不同的有机产物的是( )
A. B.
C. D.
17.粗盐中含有泥沙以及、、等杂质,其提纯过程一般经过以下流程:
下列说法不正确的是( )
A.过滤需要用到的玻璃仪器有:漏斗、烧杯、玻璃棒
B.操作③中按a、b、c顺序可依次加入过量的NaOH溶液、溶液、溶液
C.进行操作⑥时,当蒸发皿中出现较多固体时,停止加热
D.操作⑤中加盐酸调pH的目的,只是为了除去过量的
18.有A、B两种烃,含碳的质量分数相等。关于A和B的下列叙述正确的是( )
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B的最简式相同
D.A和B各1mol完全燃烧后生成的质量一定相等
19.硝酸工业生产中常用纯碱溶液吸收排出的氮氧化物废气,废气中只含有NO、两种气体。将一定量废气通入到足量的溶液中被完全吸收,溶液中生成的、两种离子的物质的量与废气中的物质的量分数变化关系可用如图所示。已知溶液中可发生以下两个反应:
①
②
下列说法正确的是( )
A.图中线段a表示离子
B.随x值增大,溶液中变大
C.若测得所得溶液中为0.5 mol,则x值为0.8
D.时,反应中可收集到标准状况下22.4 L
20.硝酸是一种重要的化工原料,可用于制化肥、农药、炸药、染料等。将一定质量的镁铜合金放入到5 mL的浓硝酸溶液中恰好完全反应,共收集到(折算为标准状况下)和NO的混合气体448 mL,将混合气体倒立于水中,通入0.0075 mol 恰好使混合气体全部转化为硝酸,下列说法正确的是( )
A.该反应中硝酸只表现出强氧化性 B.混合气体中和NO的体积比为3∶1
C.镁铜合金的质量可能是1.2g D.原硝酸的物质的量浓度为6mol/L
Ⅱ卷非选择题(共50分)
21.(12分)学习小组在实验室中利用下图所示装置制备并进行相关性质的探究。回答下列问题:
(1)仪器Q的名称为______;装置c中品红溶液褪色,可证明具有______性,装置b的作用是______。
(2)向分液漏斗中滴加浓硫酸之前,需先通入一段时间,此操作的目的是______。
(3)装置a中反应的化学方程式为______。
(4)探究:探究在KI溶液体系中的反应产物实验开始后,发现装置d中的溶液迅速变黄,继续通入,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在反应:。但有同学提出上述反应生成的可与发生反应:。为进一步探究体系中的产物,完成下列实验方案。
Ⅰ.取适量装置d中浊液,向其中滴加几滴______溶液(填试剂名称),振荡,无明显变化,浊液中无。
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,______,出现白色沉淀,产物溶液中存在。
综上可知,在KI溶液中发生了歧化反应,其反应的离子方程式为______。
22.(12分)已知X和Y、Z为中学化学中的常见元素,根据如图所示转化关系(反应条件及部分产物已略去),回答以下问题。
(1)若A、B、C、D均为含X的化合物,且A常用作制冷剂,D是一种强酸,则
①写出工业制备A的化学反应方程式:______。
②将16 g铜粉与一定量的D的稀溶液反应后,收集到896 mL无色气体B(标准状况),则被还原的D的物质的量为______mol。向所得溶液中继续加稀硫酸至反应不能再进行,需加入含______mol 的稀硫酸。
(2)若A、B、C、D均为含Y的化合物,其中A是一元强碱且焰色为黄色,E是有刺激性气味的气态酸性氧化物,则B的化学式为______;A与C反应的离子方程式为______。
(3)若A、B、C、D均为含Z的化合物,其中A由两种元素组成,且A的摩尔质量为34 g/mol,D为强酸。将溶液滴加到NaClO溶液中,有淡黄色沉淀生成,请写出所发生反应的离子方程式:______。
23.(12分)习总书记提出要构建美丽中国的伟大构想,要实现这个构想,必须解决环境污染问题。拟综合处理含NH4的废水和工业废气(主要含、、、CO、NO),处理流程如图所示:
请回答下列问题:
(1)、、、CO、NO几种气体中,属于酸性氧化物的是______,捕获剂所捕获的产物(均填化学式)
(2)流程中“固体1”的主要成分的化学式是______。
(3)流程中“气体1”与适量反应的化学方程式为______。
(4)流程中处理时,发生反应的离子方程式为______。
(5)为了测定空气中的含量,某同学将空气样品经过管道通入盛有400 mL 0.1 mol/L酸性溶液的密闭容器中,发生的离子反应为。若管道中空气流量为a L/min,经过8 min溶液恰好褪色,假定样品中被充分吸收,该空气样品中的含量为______g/L。(假设空气中其他气体不与酸性溶液反应)
24.(14分)乙烯是重要有机化工原料。结合以下路线回答:
已知:
(1)反应①的反应类型为______,B的官能团是______(填名称)。
(2)乙醇在铜作催化剂时与氧气反应,反应的化学方程式为______。
(3)F是一种高分子化合物,可用于制作食品袋,其结构简式为______。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,装置如图所示。
ⅰ.反应⑥的化学方程式是______________________________。
ⅱ.乙中的试剂为饱和溶液,关于该溶液的说法正确的是______(填选项字母)。
A.它可以中和乙酸,溶解乙醇
B.它可以降低乙酸乙酯在水中的溶解度,提高水溶液的密度以加速乙酸乙酯与水溶液的分层
C.它能提高该反应的速率
D.它可以用饱和溶液或NaOH溶液代替
制法二:工业上用和E一定条件直接反应获得G。
ⅲ.该反应的的化学方程式为______________________________。
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,请计算制法一的原子利用率______(保留两位有效数字),采用(填“制法一”或“制法二”)______更环保,更经济。
勃利县中2022-2023学年高一下学期4月期中考试
化学答案
1-20题 DDCCC BBBDA DADAC BDCDB
21.(12分,除标注外每空2分)
(1)圆底烧瓶(1分) 漂白(1分) 安全瓶,防止倒吸
(2)排除空气的干扰(1分)
(3)
(4)淀粉溶液(1分) 加入稀盐酸酸化,再加入溶液(或加入盐酸酸化的溶液)
22.(12分每空2分,)
(1) 0.04 0.24
(2)
(3)
23.(12分,除标注外每空2分)
(1)、(各1分) CO
(2)、(各1分)
(3)
(4)
(5)
24.(14分,除标注外每空2分)
(1)加成反应(1分) 羟基(1分)
(2)
(3)(1分)
(4) AB
83% 制法二(1分)
同课章节目录
