专题07 NaOH变质的探究(课件)-决胜2023年中考化学二轮复习抢分秘籍(通用版)
文档属性
| 名称 | 专题07 NaOH变质的探究(课件)-决胜2023年中考化学二轮复习抢分秘籍(通用版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-06 14:45:33 | ||
图片预览





文档简介
(共19张PPT)
中考化学二轮复习
2023
专题07 NaOH变质的探究
专题考点NaOH变质的原因及检验方法01多角度切入考查碱变质的变式0204对实验方案的评价检验溶液中溶质成分的实验设计03CONTENTSwww.
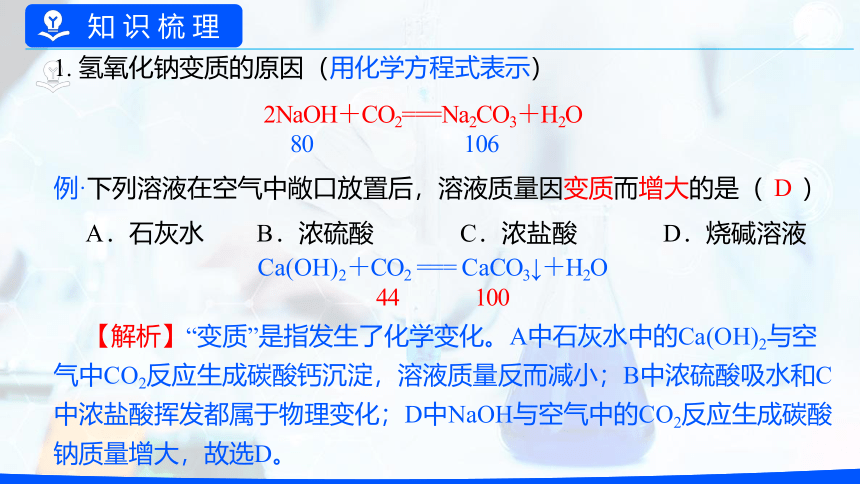
1. 氢氧化钠变质的原因(用化学方程式表示)
2NaOH+CO2===Na2CO3+H2O
80 106
例·下列溶液在空气中敞口放置后,溶液质量因变质而增大的是( )
A.石灰水 B.浓硫酸 C.浓盐酸 D.烧碱溶液
D
【解析】“变质”是指发生了化学变化。A中石灰水中的Ca(OH)2与空气中CO2反应生成碳酸钙沉淀,溶液质量反而减小;B中浓硫酸吸水和C中浓盐酸挥发都属于物理变化;D中NaOH与空气中的CO2反应生成碳酸钠质量增大,故选D。
Ca(OH)2+CO2 === CaCO3↓+H2O
44 100
2. 检验NaOH是否变质(检验是否生成了Na2CO3)
试剂选择 现象及化学方程式 结论
酸 稀盐酸 (过量) 现象: 方程式: NaOH
已变质
盐 BaCl2 CaCl2 现象: Ba(OH)2 Ca(OH)2 碱 有气泡生成
生成白色沉淀
实验设计思路:取样品→加试剂→述现象→得结论
2HCl+Na2CO3 == 2NaCl+H2O+CO2↑
Ca(OH)2+Na2CO3 == CaCO3↓+2NaOH
Na2CO3+CaCl2 == 2NaCl+CaCO3↓
为何要用过量的稀盐酸
例.向NaOH和Na2CO3的混合溶液中加入稀盐酸:
曲线0~a:①NaOH+HCl=NaCl+H2O
曲线a~b:②Na2CO3+2HCl=2NaCl+CO2↑+H2O
【解析】若反应②与反应①同时发生,反应②生成的CO2会与NaOH反应重新生成Na2CO3:CO2+2NaOH=Na2CO3+H2O,相当于反应②没有发生,必须等到反应①将NaOH完全消耗后,即反应②才能进行。所以该反应中气体质量的起点不应从原点开始,而应该从a点开始。
复分解反应的优先原则之一:酸和碱优先反应
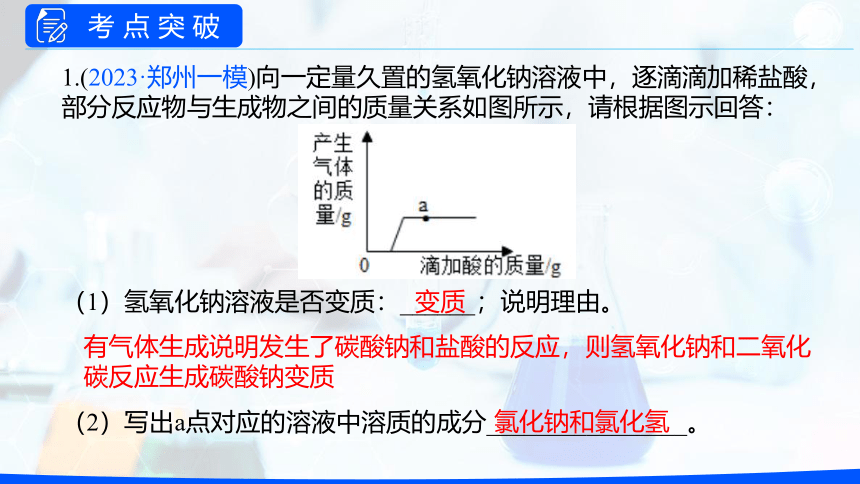
1.(2023·郑州一模)向一定量久置的氢氧化钠溶液中,逐滴滴加稀盐酸,部分反应物与生成物之间的质量关系如图所示,请根据图示回答:
(1)氢氧化钠溶液是否变质:______;说明理由。
(2)写出a点对应的溶液中溶质的成分________________。
变质
有气体生成说明发生了碳酸钠和盐酸的反应,则氢氧化钠和二氧化碳反应生成碳酸钠变质
氯化钠和氯化氢
2. 检验NaOH是部分变质还是全部变质(检验是否还有NaOH)
变质情况 成分分析
部分变质(含有NaOH) Na2CO3、NaOH
全部变质(不含NaOH) Na2CO3
【实验设计思路】先除去Na2CO3→再检验NaOH
【思考】能否直接向样品溶液中直接滴加酚酞?
不能,Na2CO3溶液呈碱性,也能使无色酚酞变红。
取少量样品溶液于试管中,向其中滴加足量的BaCl2/CaCl2溶液,静置,向上层清夜中滴加酚酞溶液,若溶液变红,则有NaOH。
检验是否完全变质时试剂的选择
1.除去Na2CO3时,能否用稀盐酸、Ba(OH)2/Ca(OH)2
2.完全除去Na2CO3后,除了用酚酞,还能用什么试剂来检验NaOH?
不能。(1)稀盐酸不仅能与Na2CO3反应,还能与NaOH反应;
(2)Ba(OH)2/Ca(OH)2与Na2CO3反应会生成NaOH,对实验造成干扰。
氯化铜溶液(产生蓝色沉淀)、氯化铁溶液(产生红褐色沉淀)、氯化镁溶液(产生白色沉淀)
1.②为探究足量NaOH溶液吸收CO2后溶液中溶质成分,某同学设计了如下方案:取少量溶液,加入足量Ca(OH)2溶液,反应后静置,取上层清液滴加酚酞溶液。若溶液变红,溶质为Na2CO3和 NaOH。请指出该方案中的错误并加以改正。
加入Ca(OH)2溶液错误,应改用CaCl2溶液或Ca(NO3)2溶液等。
变式一:与粗盐提纯结合
例·为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了以下方案:
(1)写出加入Ba(OH)2溶液时反应的化学方程式。
(2)溶液X中含有哪些杂质?请设计实验加以证明。
含有NaOH和Na2CO3。取少量溶液X,滴加足量的CaCl2(或BaCl2等)溶液,有白色沉淀产生,证明含有Na2CO3;静置(或过滤),向上层清液(或滤液)中滴加酚酞溶液,溶液变红,证明含有NaOH。
MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓
【解析】该题既要检验NaOH又要Na2CO3。
1.为除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;⑤蒸发、结晶。
请设计实验证明操作③所得溶液含有NaOH。(写出实验步骤和现象)
取少量溶液,加入足量的CaCl2(或BaCl2等)溶液,静置,向上层清液其中滴加酚酞溶液,溶液变红。
【解析】该题只需检验NaOH即可。
变式二:与气体净化结合
例·下图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案。(提示:Na2CO3溶液呈碱性)
取少量A装置中的溶液,加入足量CaCl2溶液(或BaCl2溶液等),静置,取上层清液,向其中滴加几滴酚酞溶液。若溶液变成红色,则溶质为Na2CO3和NaOH;若溶液没有变成红色,则溶质为Na2CO3。
【解析】该题只需检验NaOH即可。
变式三:与过氧化钠变质结合
例·已知:2Na2O2+2CO2=== 2Na2CO3+O2;2Na2O2+2H2O=== 4NaOH+O2↑。为了证明过氧化钠(Na2O2)固体可在呼吸面具和潜水艇中做供氧剂,某化学兴趣小组的同学利用下图所示实验装置进行探究活动(铁架台等已略去)。
变式三:与过氧化钠变质结合
为了达到实验的目的,将A图补充完整后:仪器连接的顺序为a→e→f→c→d→h→g→b。实验结束后,取C装置中固体溶于水,无气泡产生。请设计实验,检验C装置中固体的成分(简要写出实验步骤、现象和结论)。
答:取少量C装置中固体溶于水,加入足量CaCl2溶液(或BaCl2溶液),有白色沉淀产生;静置,向上层清液中滴加酚酞溶液,若溶液变红,固体成分为Na2CO3、NaOH;若溶液未变红,固体成分为Na2CO3。
【解析】该题既要检验NaOH又要Na2CO3。
变式四:与物质的检验结合
例·有一包白色固体,可能是Cu(NO3)2、Ba(NO3)2、Na2SO4、Na2CO3、NaOH中的一种或者几种,某同学对其组成进行了探究,实验过程如下:
①该白色固体中一定含有什么物质___________________________
②写出上述实验中反应生成白色沉淀的化学方程式。(一个即可)
③设计实验确定该白色固体中可能存在的物质(操作、现象、结论)。
Ba(NO3)2、Na2SO4、Na2CO3
取少量无色滤液,加入足量氯化钙溶液,静置取上层清夜滴加无色酚酞溶液。若溶液变红,说明含氢氧化钠,反之则不含
1.实验室许多药品都需密封保存,对下列药品密封保存原因的解释错误的是( )
A.浓盐酸--防止挥发
B.浓硫酸-防止吸水
C.生石灰--防止氧化
D.氢氧化钠固体--防止潮解和与二氧化碳反
C
2.呼吸面具中“氧气再生剂”的主要成分是淡黄色固体过氧化钠Na2O2,使用后变成白色固体。某兴趣小组对白色固体的成分进行探究:
【资料】2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑
【猜想】对白色固体作出如下猜想:
猜想Ⅰ:氢氧化钠
猜想Ⅱ:碳酸钠
你的猜想: 氢氧化钠和碳_
氢氧化钠和碳酸钠
【实验验证】
实验操作 实验现象 实验结论
(1)取少量样品溶于水,加入适量 CaCl2溶— ; 产生白色沉淀 含有 碳酸钠(
(2)将上述反应后的混合物过滤,取滤液加入 酚酞溶液 酚酞变红 证明你的猜想正确
CaCl2溶液
Na2CO3
酚酞溶液
酚酞变红
【拓展应用】“氧气再生剂”的保存方法是 密封保存 。
Na2CO3+CaCl2=CaCO3↓+2NaCl
密封保存
写出该实验中发生反应的化学方程式
Have a rest
中考化学二轮复习
2023
专题07 NaOH变质的探究
专题考点NaOH变质的原因及检验方法01多角度切入考查碱变质的变式0204对实验方案的评价检验溶液中溶质成分的实验设计03CONTENTSwww.
1. 氢氧化钠变质的原因(用化学方程式表示)
2NaOH+CO2===Na2CO3+H2O
80 106
例·下列溶液在空气中敞口放置后,溶液质量因变质而增大的是( )
A.石灰水 B.浓硫酸 C.浓盐酸 D.烧碱溶液
D
【解析】“变质”是指发生了化学变化。A中石灰水中的Ca(OH)2与空气中CO2反应生成碳酸钙沉淀,溶液质量反而减小;B中浓硫酸吸水和C中浓盐酸挥发都属于物理变化;D中NaOH与空气中的CO2反应生成碳酸钠质量增大,故选D。
Ca(OH)2+CO2 === CaCO3↓+H2O
44 100
2. 检验NaOH是否变质(检验是否生成了Na2CO3)
试剂选择 现象及化学方程式 结论
酸 稀盐酸 (过量) 现象: 方程式: NaOH
已变质
盐 BaCl2 CaCl2 现象: Ba(OH)2 Ca(OH)2 碱 有气泡生成
生成白色沉淀
实验设计思路:取样品→加试剂→述现象→得结论
2HCl+Na2CO3 == 2NaCl+H2O+CO2↑
Ca(OH)2+Na2CO3 == CaCO3↓+2NaOH
Na2CO3+CaCl2 == 2NaCl+CaCO3↓
为何要用过量的稀盐酸
例.向NaOH和Na2CO3的混合溶液中加入稀盐酸:
曲线0~a:①NaOH+HCl=NaCl+H2O
曲线a~b:②Na2CO3+2HCl=2NaCl+CO2↑+H2O
【解析】若反应②与反应①同时发生,反应②生成的CO2会与NaOH反应重新生成Na2CO3:CO2+2NaOH=Na2CO3+H2O,相当于反应②没有发生,必须等到反应①将NaOH完全消耗后,即反应②才能进行。所以该反应中气体质量的起点不应从原点开始,而应该从a点开始。
复分解反应的优先原则之一:酸和碱优先反应
1.(2023·郑州一模)向一定量久置的氢氧化钠溶液中,逐滴滴加稀盐酸,部分反应物与生成物之间的质量关系如图所示,请根据图示回答:
(1)氢氧化钠溶液是否变质:______;说明理由。
(2)写出a点对应的溶液中溶质的成分________________。
变质
有气体生成说明发生了碳酸钠和盐酸的反应,则氢氧化钠和二氧化碳反应生成碳酸钠变质
氯化钠和氯化氢
2. 检验NaOH是部分变质还是全部变质(检验是否还有NaOH)
变质情况 成分分析
部分变质(含有NaOH) Na2CO3、NaOH
全部变质(不含NaOH) Na2CO3
【实验设计思路】先除去Na2CO3→再检验NaOH
【思考】能否直接向样品溶液中直接滴加酚酞?
不能,Na2CO3溶液呈碱性,也能使无色酚酞变红。
取少量样品溶液于试管中,向其中滴加足量的BaCl2/CaCl2溶液,静置,向上层清夜中滴加酚酞溶液,若溶液变红,则有NaOH。
检验是否完全变质时试剂的选择
1.除去Na2CO3时,能否用稀盐酸、Ba(OH)2/Ca(OH)2
2.完全除去Na2CO3后,除了用酚酞,还能用什么试剂来检验NaOH?
不能。(1)稀盐酸不仅能与Na2CO3反应,还能与NaOH反应;
(2)Ba(OH)2/Ca(OH)2与Na2CO3反应会生成NaOH,对实验造成干扰。
氯化铜溶液(产生蓝色沉淀)、氯化铁溶液(产生红褐色沉淀)、氯化镁溶液(产生白色沉淀)
1.②为探究足量NaOH溶液吸收CO2后溶液中溶质成分,某同学设计了如下方案:取少量溶液,加入足量Ca(OH)2溶液,反应后静置,取上层清液滴加酚酞溶液。若溶液变红,溶质为Na2CO3和 NaOH。请指出该方案中的错误并加以改正。
加入Ca(OH)2溶液错误,应改用CaCl2溶液或Ca(NO3)2溶液等。
变式一:与粗盐提纯结合
例·为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了以下方案:
(1)写出加入Ba(OH)2溶液时反应的化学方程式。
(2)溶液X中含有哪些杂质?请设计实验加以证明。
含有NaOH和Na2CO3。取少量溶液X,滴加足量的CaCl2(或BaCl2等)溶液,有白色沉淀产生,证明含有Na2CO3;静置(或过滤),向上层清液(或滤液)中滴加酚酞溶液,溶液变红,证明含有NaOH。
MgSO4+Ba(OH)2=BaSO4↓+Mg(OH)2↓
【解析】该题既要检验NaOH又要Na2CO3。
1.为除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加适量盐酸;⑤蒸发、结晶。
请设计实验证明操作③所得溶液含有NaOH。(写出实验步骤和现象)
取少量溶液,加入足量的CaCl2(或BaCl2等)溶液,静置,向上层清液其中滴加酚酞溶液,溶液变红。
【解析】该题只需检验NaOH即可。
变式二:与气体净化结合
例·下图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案。(提示:Na2CO3溶液呈碱性)
取少量A装置中的溶液,加入足量CaCl2溶液(或BaCl2溶液等),静置,取上层清液,向其中滴加几滴酚酞溶液。若溶液变成红色,则溶质为Na2CO3和NaOH;若溶液没有变成红色,则溶质为Na2CO3。
【解析】该题只需检验NaOH即可。
变式三:与过氧化钠变质结合
例·已知:2Na2O2+2CO2=== 2Na2CO3+O2;2Na2O2+2H2O=== 4NaOH+O2↑。为了证明过氧化钠(Na2O2)固体可在呼吸面具和潜水艇中做供氧剂,某化学兴趣小组的同学利用下图所示实验装置进行探究活动(铁架台等已略去)。
变式三:与过氧化钠变质结合
为了达到实验的目的,将A图补充完整后:仪器连接的顺序为a→e→f→c→d→h→g→b。实验结束后,取C装置中固体溶于水,无气泡产生。请设计实验,检验C装置中固体的成分(简要写出实验步骤、现象和结论)。
答:取少量C装置中固体溶于水,加入足量CaCl2溶液(或BaCl2溶液),有白色沉淀产生;静置,向上层清液中滴加酚酞溶液,若溶液变红,固体成分为Na2CO3、NaOH;若溶液未变红,固体成分为Na2CO3。
【解析】该题既要检验NaOH又要Na2CO3。
变式四:与物质的检验结合
例·有一包白色固体,可能是Cu(NO3)2、Ba(NO3)2、Na2SO4、Na2CO3、NaOH中的一种或者几种,某同学对其组成进行了探究,实验过程如下:
①该白色固体中一定含有什么物质___________________________
②写出上述实验中反应生成白色沉淀的化学方程式。(一个即可)
③设计实验确定该白色固体中可能存在的物质(操作、现象、结论)。
Ba(NO3)2、Na2SO4、Na2CO3
取少量无色滤液,加入足量氯化钙溶液,静置取上层清夜滴加无色酚酞溶液。若溶液变红,说明含氢氧化钠,反之则不含
1.实验室许多药品都需密封保存,对下列药品密封保存原因的解释错误的是( )
A.浓盐酸--防止挥发
B.浓硫酸-防止吸水
C.生石灰--防止氧化
D.氢氧化钠固体--防止潮解和与二氧化碳反
C
2.呼吸面具中“氧气再生剂”的主要成分是淡黄色固体过氧化钠Na2O2,使用后变成白色固体。某兴趣小组对白色固体的成分进行探究:
【资料】2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑
【猜想】对白色固体作出如下猜想:
猜想Ⅰ:氢氧化钠
猜想Ⅱ:碳酸钠
你的猜想: 氢氧化钠和碳_
氢氧化钠和碳酸钠
【实验验证】
实验操作 实验现象 实验结论
(1)取少量样品溶于水,加入适量 CaCl2溶— ; 产生白色沉淀 含有 碳酸钠(
(2)将上述反应后的混合物过滤,取滤液加入 酚酞溶液 酚酞变红 证明你的猜想正确
CaCl2溶液
Na2CO3
酚酞溶液
酚酞变红
【拓展应用】“氧气再生剂”的保存方法是 密封保存 。
Na2CO3+CaCl2=CaCO3↓+2NaCl
密封保存
写出该实验中发生反应的化学方程式
Have a rest
同课章节目录
