4.1.2元素周期表课件(共28张PPT)2022-2023学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.2元素周期表课件(共28张PPT)2022-2023学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | zip | ||
| 文件大小 | 28.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-05 19:36:03 | ||
图片预览






文档简介
(共28张PPT)
第一节 原子结构与元素周期表
第二课时 元素周期表
第四章 物质结构 元素周期律
(2)元素周期表的演变
①演变:随着科学发展,为__________留下的空位先后被填满。
②编排依据:由相对原子质量改为原子的_________。
1.元素周期表的发展历程
(1)第一张元素周期表
①诞生:1869年,俄国化学家_________制出。
②绘制依据:将元素按照_____________由小到大的顺序排列,将_______________的元素放在一个纵行。
门捷列夫
相对原子质量
化学性质相似
未知元素
核电荷数
二、元素周期表
阅读课本P88第1、2自然段
按照元素在周期表中的顺序给元素编号,得到原子序数。
结合1-18号元素原子的结构示意图和元素周期表中1-18号元素的排列,分析一下我们现在使用的元素周期表的排列规律。
原子序数=核电荷数=质子数=核外电子数
元素周期表排列的规律:
⑴ 按原子序数递增的顺序从左到右排列
⑵ 将电子层数相同的元素排列成一个横行
⑶ 把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行。
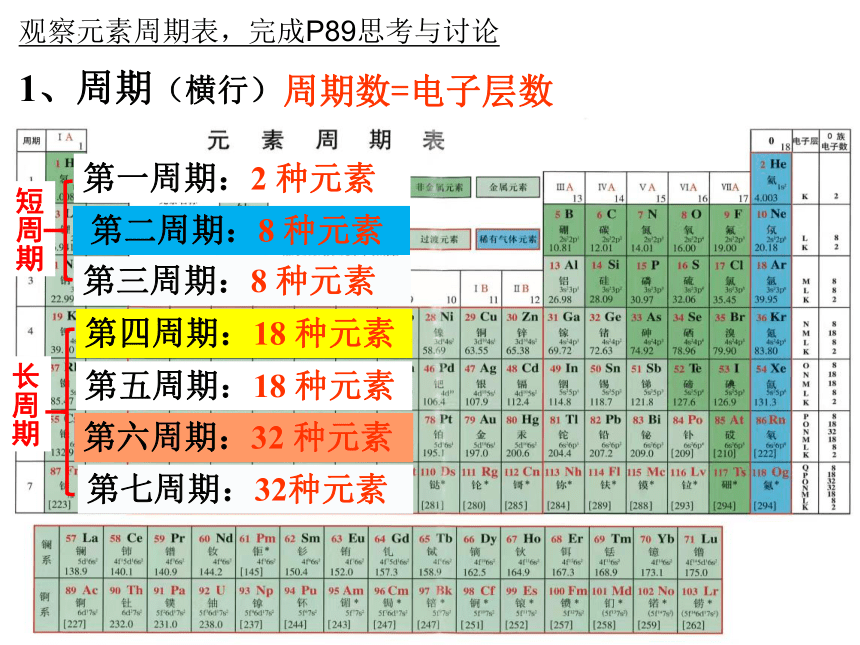
1、周期(横行)
第一周期:2 种元素
第二周期:8 种元素
第三周期:8 种元素
第四周期:18 种元素
第五周期:18 种元素
第六周期:32 种元素
第七周期:32种元素
长周期
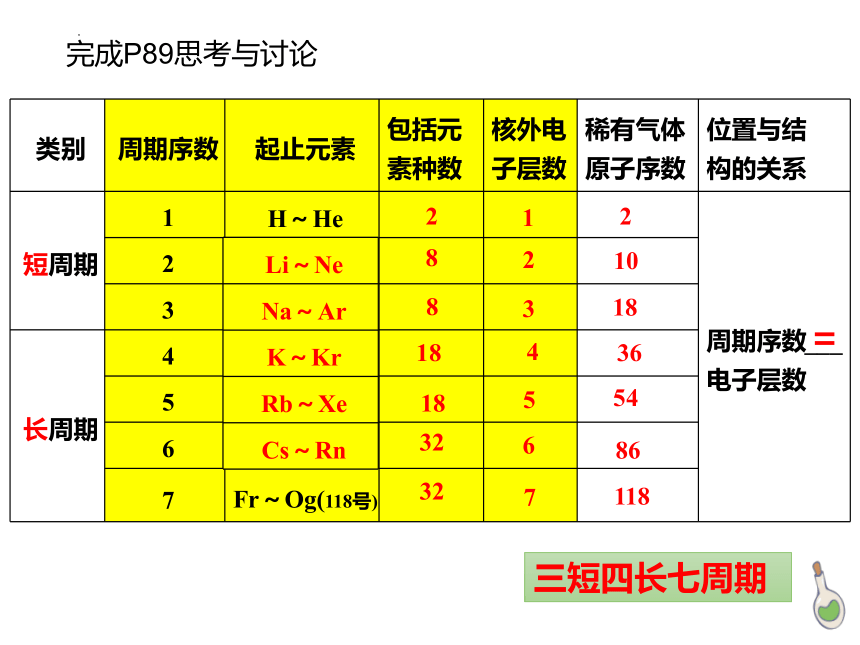
观察元素周期表,完成P89思考与讨论
周期数=电子层数
短周期
类别 周期序数 起止元素 包括元 素种数 核外电 子层数 稀有气体 原子序数 位置与结
构的关系
短周期 1 H~He 周期序数___电子层数
2
3
长周期 4
5
6
7 Fr~Og(118号)
2
1
2
8
2
10
8
3
18
18
4
36
18
5
54
32
6
86
32
7
118
=
完成P89思考与讨论
Li~Ne
Na~Ar
K~Kr
Rb~Xe
Cs~Rn
三短四长七周期
族
主族:
副族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
稀有气体元素
0族:
共七个主族
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB,
共八个副族
三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间
主族序数=最外层电子数
2、族(纵行)
七主八副与零族
碱金属元素
卤族元素
稀有气体元素
Ⅷ族
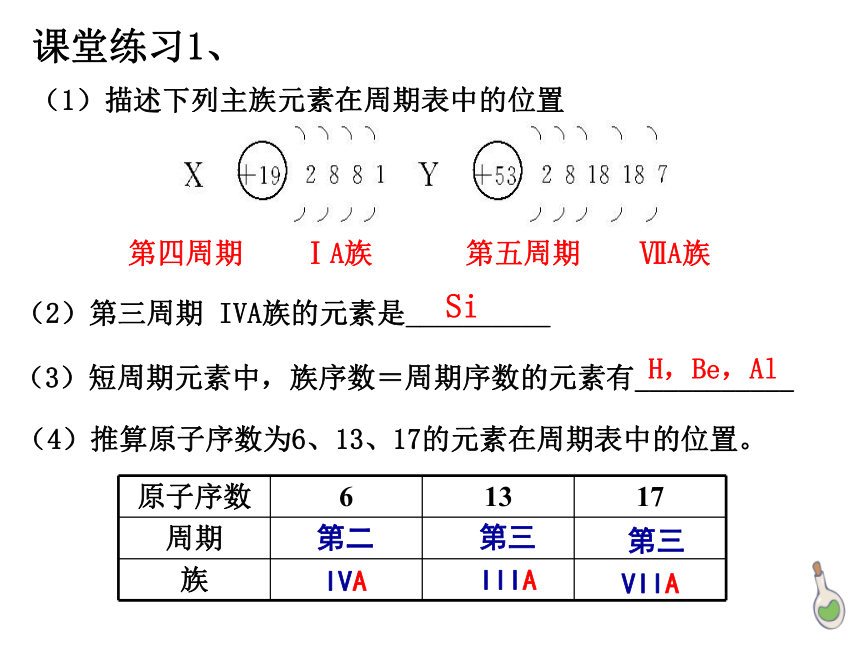
(1)描述下列主族元素在周期表中的位置
第四周期 ⅠA族
第五周期 ⅦA族
(2)第三周期 IVA族的元素是__________
(3)短周期元素中,族序数=周期序数的元素有___________
H,Be,Al
Si
课堂练习1、
(4)推算原子序数为6、13、17的元素在周期表中的位置。
原子序数 6 13 17
周期
族
第二
第三
第三
IVA
IIIA
VIIA
镧系元素:57—71号 锕系元素:89—103号
思考:哪周期元素种类最多?族呢?
第六周期、第七周期
第ⅢB
过渡元素
找出过渡元素、金属、非金属元素分界线
1 H氢
1s1
1.008
原子序数
元素名称
元素符号
价层电子排布
相对原子质量
周期表中每一个小格中的符号和数字代表什么意义呢?
课堂练习2.
(1)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是________。
(2)若甲、乙分别是同一周期的ⅡA族和ⅦA族元素,原子序数分别为m和n,则m和n可能的关系为_____
同周期相邻元素之间的关系(原子序数相差)
ⅡA、ⅢA
二、三周期
四、五周期
六、七周期
1
11
25
同主族相邻元素之间的关系(原子序数相差)
ⅠA、ⅡA 其他族
二三周期
三四周期
四五周期
五六周期
六七周期
8
8
18
18
18
32
32
解题思路:
左右相邻
上下相邻
课堂练习3:根据“原子序数”推导下列元素
(1)35号元素位于第________周期________族。
(2)87号元素位于第________周期________族。
解题思路:利用稀有气体元素确定主族元素在周期表中的位置
原子序数-最邻近的稀有气体元素的原子序数=ΔZ。
例如:(1)35号元素(相邻近的是36Kr),则ΔZ =35-36=-1,故周期数为四,族序数为8-|-1|=7,即第四周期第ⅦA族,即溴元素;
(2)87号元素(相邻近的是86Rn),则ΔZ =87-86=1,故周期数为七,族序数为1,即第七周期第ⅠA族,即钫元素。
四
ⅦA
七
ⅠA
课堂小结
元素周期表
周期
族
一、二、三周期
四、五、六、七周期
短周期
长周期
主族(A)
副族(B)
0族
ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、ⅠB、ⅡB
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
由短周期元素和长周期元素共同构成
完全由长周期元素构成
主族元素序数 = 最外层电子数
元素的化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0
2
8
32
18
18
8
32
周期:三短四长七周期
族:七主七副八与零
第Ⅷ族
由第8、9、10三个纵行构成
2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数
B
课堂达标
1.下列选项各截取了元素周期表的一部分,数字为原子序数,其中M的原子序数为37的是
C
一、元素、核素、同位素
1)元素:
具有相同 的一类原子的总称。
质子数(核电荷数)
——质量数
氢元素的原子核 原子名称 原子符号
质量数(A) 质子数(Z) 中子数(N)
1
2
3
1
1
1
0
1
2
氕(pie)
氘(dao)
氚(chuan)
H
1
1
H或D
2
1
H或T
3
1
2)核素:
具有一定数目 和一定数目的 的一种原子。
质子数
中子数
习题巩固
C
习题巩固
B
二、元素、核素、同位素之间关系
元素
具有相同的质子数
不同的中子数
中子数1
中子数2
… …
核素1
核素2
… …
互称同位素
具体质子数
一类原子的总称
具体质子数和中子数
不同原子
化学性质相同
物理性质不同
习题巩固
A
三、元素、核素、同位素概念辨析
三、元素、核素、同位素概念辨析
元素 核素 同位素 同素异形体
本质
范畴
特性
决定因素
举例
质子数相同的一类原子
同类原子
只有种类,没有个数
质子数
H、C、O三种元素
质子数、中子数都一定的原子
原子
化学反应中的最小粒子
质子数、中子数
三种核素
互为同位素
质子数相同而中子数不同的核素
原子
化学性质几乎相同
质子数、中子数
同种元素形成的不同单质
单质
组成元素相同、性质不同
组成元素、结构
O2与O3互为同素异形体
习题巩固
6
四、同位素的应用
核燃料
放射线治癌症
辐射育种
金属探伤
环保治污:辐射消毒(如紫外线、γ射线)
天然存在的同位素,相互间保持着一定的比率。元素的相对原子质量,就是按照该元素各种核素所占的一定百分比计算出来的平均值。许多元素都存在同位素,此外,科学家还通过核反应人工制造出很多种同位素。同位素中,有些具有放射性,成为放射性同位素。同位素在生活生产、科学研究中有着重要用途。
习题巩固
第一节 原子结构与元素周期表
第二课时 元素周期表
第四章 物质结构 元素周期律
(2)元素周期表的演变
①演变:随着科学发展,为__________留下的空位先后被填满。
②编排依据:由相对原子质量改为原子的_________。
1.元素周期表的发展历程
(1)第一张元素周期表
①诞生:1869年,俄国化学家_________制出。
②绘制依据:将元素按照_____________由小到大的顺序排列,将_______________的元素放在一个纵行。
门捷列夫
相对原子质量
化学性质相似
未知元素
核电荷数
二、元素周期表
阅读课本P88第1、2自然段
按照元素在周期表中的顺序给元素编号,得到原子序数。
结合1-18号元素原子的结构示意图和元素周期表中1-18号元素的排列,分析一下我们现在使用的元素周期表的排列规律。
原子序数=核电荷数=质子数=核外电子数
元素周期表排列的规律:
⑴ 按原子序数递增的顺序从左到右排列
⑵ 将电子层数相同的元素排列成一个横行
⑶ 把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行。
1、周期(横行)
第一周期:2 种元素
第二周期:8 种元素
第三周期:8 种元素
第四周期:18 种元素
第五周期:18 种元素
第六周期:32 种元素
第七周期:32种元素
长周期
观察元素周期表,完成P89思考与讨论
周期数=电子层数
短周期
类别 周期序数 起止元素 包括元 素种数 核外电 子层数 稀有气体 原子序数 位置与结
构的关系
短周期 1 H~He 周期序数___电子层数
2
3
长周期 4
5
6
7 Fr~Og(118号)
2
1
2
8
2
10
8
3
18
18
4
36
18
5
54
32
6
86
32
7
118
=
完成P89思考与讨论
Li~Ne
Na~Ar
K~Kr
Rb~Xe
Cs~Rn
三短四长七周期
族
主族:
副族:
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
稀有气体元素
0族:
共七个主族
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB,
共八个副族
三个纵行(8、9、10),位于Ⅶ B 与ⅠB中间
主族序数=最外层电子数
2、族(纵行)
七主八副与零族
碱金属元素
卤族元素
稀有气体元素
Ⅷ族
(1)描述下列主族元素在周期表中的位置
第四周期 ⅠA族
第五周期 ⅦA族
(2)第三周期 IVA族的元素是__________
(3)短周期元素中,族序数=周期序数的元素有___________
H,Be,Al
Si
课堂练习1、
(4)推算原子序数为6、13、17的元素在周期表中的位置。
原子序数 6 13 17
周期
族
第二
第三
第三
IVA
IIIA
VIIA
镧系元素:57—71号 锕系元素:89—103号
思考:哪周期元素种类最多?族呢?
第六周期、第七周期
第ⅢB
过渡元素
找出过渡元素、金属、非金属元素分界线
1 H氢
1s1
1.008
原子序数
元素名称
元素符号
价层电子排布
相对原子质量
周期表中每一个小格中的符号和数字代表什么意义呢?
课堂练习2.
(1)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是________。
(2)若甲、乙分别是同一周期的ⅡA族和ⅦA族元素,原子序数分别为m和n,则m和n可能的关系为_____
同周期相邻元素之间的关系(原子序数相差)
ⅡA、ⅢA
二、三周期
四、五周期
六、七周期
1
11
25
同主族相邻元素之间的关系(原子序数相差)
ⅠA、ⅡA 其他族
二三周期
三四周期
四五周期
五六周期
六七周期
8
8
18
18
18
32
32
解题思路:
左右相邻
上下相邻
课堂练习3:根据“原子序数”推导下列元素
(1)35号元素位于第________周期________族。
(2)87号元素位于第________周期________族。
解题思路:利用稀有气体元素确定主族元素在周期表中的位置
原子序数-最邻近的稀有气体元素的原子序数=ΔZ。
例如:(1)35号元素(相邻近的是36Kr),则ΔZ =35-36=-1,故周期数为四,族序数为8-|-1|=7,即第四周期第ⅦA族,即溴元素;
(2)87号元素(相邻近的是86Rn),则ΔZ =87-86=1,故周期数为七,族序数为1,即第七周期第ⅠA族,即钫元素。
四
ⅦA
七
ⅠA
课堂小结
元素周期表
周期
族
一、二、三周期
四、五、六、七周期
短周期
长周期
主族(A)
副族(B)
0族
ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、ⅠB、ⅡB
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
由短周期元素和长周期元素共同构成
完全由长周期元素构成
主族元素序数 = 最外层电子数
元素的化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为0
2
8
32
18
18
8
32
周期:三短四长七周期
族:七主七副八与零
第Ⅷ族
由第8、9、10三个纵行构成
2.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数
B
课堂达标
1.下列选项各截取了元素周期表的一部分,数字为原子序数,其中M的原子序数为37的是
C
一、元素、核素、同位素
1)元素:
具有相同 的一类原子的总称。
质子数(核电荷数)
——质量数
氢元素的原子核 原子名称 原子符号
质量数(A) 质子数(Z) 中子数(N)
1
2
3
1
1
1
0
1
2
氕(pie)
氘(dao)
氚(chuan)
H
1
1
H或D
2
1
H或T
3
1
2)核素:
具有一定数目 和一定数目的 的一种原子。
质子数
中子数
习题巩固
C
习题巩固
B
二、元素、核素、同位素之间关系
元素
具有相同的质子数
不同的中子数
中子数1
中子数2
… …
核素1
核素2
… …
互称同位素
具体质子数
一类原子的总称
具体质子数和中子数
不同原子
化学性质相同
物理性质不同
习题巩固
A
三、元素、核素、同位素概念辨析
三、元素、核素、同位素概念辨析
元素 核素 同位素 同素异形体
本质
范畴
特性
决定因素
举例
质子数相同的一类原子
同类原子
只有种类,没有个数
质子数
H、C、O三种元素
质子数、中子数都一定的原子
原子
化学反应中的最小粒子
质子数、中子数
三种核素
互为同位素
质子数相同而中子数不同的核素
原子
化学性质几乎相同
质子数、中子数
同种元素形成的不同单质
单质
组成元素相同、性质不同
组成元素、结构
O2与O3互为同素异形体
习题巩固
6
四、同位素的应用
核燃料
放射线治癌症
辐射育种
金属探伤
环保治污:辐射消毒(如紫外线、γ射线)
天然存在的同位素,相互间保持着一定的比率。元素的相对原子质量,就是按照该元素各种核素所占的一定百分比计算出来的平均值。许多元素都存在同位素,此外,科学家还通过核反应人工制造出很多种同位素。同位素中,有些具有放射性,成为放射性同位素。同位素在生活生产、科学研究中有着重要用途。
习题巩固
