第1章《原子结构与元素性质》课后练习(含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第1章《原子结构与元素性质》课后练习(含解析)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 429.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-06 08:57:06 | ||
图片预览



文档简介
第1章《 原子结构与元素性质》课后练习
一、单选题
1.已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
A.Z元素的原子半径可能比Y元素的小
B.W的原子序数可能是Y的原子序数的2倍
C.W的气态氢化物的稳定性一定比Y的强
D.Z的化学活泼性一定比X强
2.下列电子排布式或外围电子轨道表示式不能表示基态粒子的是
A.K B.P
C.F D.
3.下列有说法正确的是
A.氮原子的轨道表示式是:
B.NH4Cl电子式为
C.F-离子结构示意图:
D.基态Fe2+的价层电子排布式为3d6
4.下列化学用语的表述不正确的是
A.35Cl和37Cl的原子结构示意图均可表示为:
B.HClO的结构式:H-O-Cl
C.基态碳原子的轨道表示式:
D.HF的电子式:
5.现有三种元素的基态原子的电子排布式如下:①;②;③,下列排序正确的是
A.第一电离能:③>①>②
B.简单氢化物的稳定性:①>②>③
C.元素的非金属性:②>①>③
D.原子半径:①>③>②
6.下列化学用语或图示表达正确的是
A.HCN的结构式:H-C≡N
B.质量数为3的氢原子:3H
C.NaOH的电子式:
D.基态Cr原子的价层电子的轨道表示式:
7.钛酸钙矿物的晶胞结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中A为,另两种离子为和。下列说法错误的是
A.钛酸钙晶体中距离最近的有8个
B.图(b)中,X为
C.电负性:O>N>C
D.钛酸钙晶胞中距离最近的形成了正八面体,位于其中心
8.下列原子或离子的基态电子排布式正确的是
A.Ni2+:[Ar]3d8 B.Cu:[Ar]3d94s2
C.S2-:[Ne]2s23p6 D.Si:[Ar]3s23p2
9.在对电子运动状态的描述中,确定一个“轨道”的方面包括
①电子层 ②轨道类型 ③轨道的空间伸展方向 ④电子的自旋状态
A.①②③④ B.①②③ C.①② D.①
10.一种元素原子的价电子构型为2s22p5,下列有关它的描述正确的有
A.在周期表中电负性最大 B.在周期表中第一电离能最大
C.在周期表中原子半径最小 D.核外电子只有7种运动状态
11.短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的s电子数和p电子数相等,W和Z位于同一主族,X原子的价电子排布式为3s1,Y的最外层电子数比Z的最外层电子数少1,下列说法正确的是
A.原子半径:X>Y>Z>W
B.W、Z具有相同的最高正价
C.Y的最简单氢化物的热稳定性比Z的强
D.X、Z形成的化合物中各微粒的电子层结构相同
12.元素周期表中共有18纵列,从左到右排为18列,第1列为碱金属元素(氢元素除外),第18列为稀有气体元素,则下列说法正确的是
A.第9列元素中没有非金属元素
B.第15列元素原子的最外层电子排布式是
C.最外层电子排布式为的元素一定在第2列
D.第14列元素原子的未成对电子数是同周期元素中最多的
13.下列说法正确的是
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1过渡到ns2np6
B.所有的非金属元素都分布在p区
C.核外电子排布式为1s2的原子与核外电子排布式为1s22s2的原子的化学性质相似
D.元素周期表中IIIB族到IIB族的10个纵列的元素都是金属元素
14.A、B、C、D、E五种主族元素的相关信息如表所示:
元素 信息
A 宇宙中最丰富的元素
B 基态原子的价层电子排布为nsn-1npn+1
C 能层数与B相同,且电负性比B大
D 元素的主族序数比周期序数大1,且第一电离能比同周期相邻两种元素都大
E 前四周期中电负性最小的元素
下列说法正确的是A.最高价氧化物对应水化物的酸性:D>B
B.E的单质可将Cu从CuSO4溶液中置换出来
C.A的基态原子的电子云轮廓图有两种形状
D.C的基态原子的核外电子排布式是1s22s22p63s23p5
15.不能说明X的电负性比Y的大的是
A.X的氢化物比Y的氢化物稳定
B.X的最高价氧化物对应水化物的酸性比Y的强
C.X原子的最外层电子数比Y原子的多
D.X单质可以把Y从其氢化物中置换出来
二、填空题
16.请按要求回答问题。
(1)Si的基态原子核外电子排布式____,S的基态原子核外有____个未成对电子
(2)用“<”“>”填空
离子半径 电负性 熔点 酸性
O2-____Na+ N___O 金刚石_____晶体硅 硫酸___高氯酸
(3)第三周期某元素的电离能情况如图所示,则该元素位于元素周期表第____列
(4)Mn、Fe均为第4周期的过渡元素,两元素的部分电离能数据列于下表:
元素 Mn Fe
电离能/kJ·mol-1 I1 717 759
I2 1509 1561
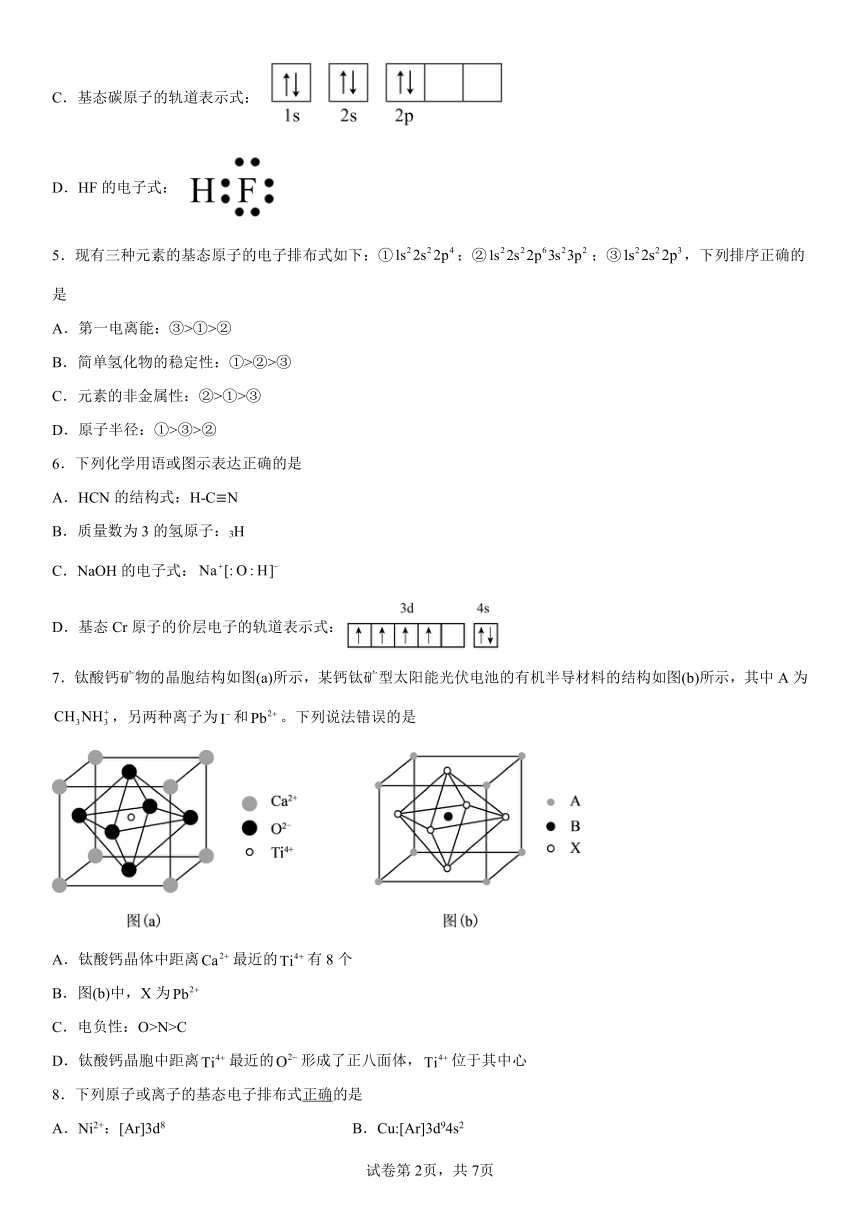
I3 3248 2957
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是______。
(5)下图能表示HF分子形成的是( )
a. b.
c. d.
17.硬铝(含少量铜、镁、锰和硅)有良好的机械性能,是制造飞机的理想材料。
(1)写出硅原子最外层电子排布式__________;短周期元素A与硅元素同主族,能与氧元素组成化合物AO2,写出AO2的电子式:__________。
(2)上述硬铝中所含的主族元素的原子半径由大到小的顺序为:__________。
(3)请阐述硬铝是制造飞机的理想材料的原因有:__________、__________。
(4)工业上可用镁真空炼铷,方程式为2RbCl+Mg MgCl2+2Rb(g),对于此反应能够进行正确的解释是 __________。
a.Rb比Mg金属性强
b.MgCl2的热稳定性比RbCl 弱
c.高温下Mg2+得电子能力比Rb+弱
d.Rb的沸点比Mg低,当把Rb(g)抽走时,平衡向正反应方向移动
18.根据题给信息回答问题
(1)某元素原子的价电子构型为4s24p1,它属于第___________周期第___________族,属于___________区元素。
(2)在1~18号元素中,除稀有气体元素外,原子半径最大的元素是___________(用元素符号表示,下同),电负性最大的元素是___________;第一电离能最大的元素是___________。第三周期原子半径最小的主族元素的价电子排布式为___________。
(3)写出Cu+的核外电子排布式:___________。按电子排布,可将周期表中的元素划分成五个区域,第四周期元素中属于s区的元素有___________种,
(4)某元素原子的3p轨道有1个未成对电子,该元素为___________(用元素符号表示)。
19.请参照图所示的元素的第一电离能的周期性曲线,画出前三周期元素的原子半径和电负性的变化曲线_____。
20.根据信息回答下列问题:不同元素的原子在分子内吸引键合电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7通常形成共价键。下表是某些元素的电负性值:
元素符号 Li Be B C O F Na Al Si P S Cl
电负性值 1.0 1.5 2.0 2.5 3.5 4.0 0.9 1.5 1.8 2.1 2.5 3.0
(1)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围:___________。
(2)请归纳元素的电负性和金属性、非金属性的关系是___________。
(3)推测AlF3、AlCl3、AlBr3是离子化合物还是共价化合物:AlF3___________,AlCl3___________, AlBr3___________。
21.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。请用元素符号或化学式填空:
(1)所示元素中
①非金属性最强的元素是:_________
②金属性最强的元素是:___________
③原子半径最小的是:___________
④最高价含氧酸酸性最强的是______________
⑤经常用作半导体材料的元素是:___________(只写一种)
⑥阴影部分属于元素周期表中的_________族,该族元素的最高正价均为_________
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 _________H3PO4(用“>”或“<”表示,下同);
②稳定性:H2S__________HCl
③沸点:HF_____HCl
④还原性:I-_______Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:__________
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:________
A.常温下Se单质是气体
B.Se最高价氧化物的水化物能和NaOH发生反应
C.氢化物的化学式为H2Se
D.常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________
22.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子核外电子排布式是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2→6CaSiO3+P4O10 10C+P4O10→P4+10CO,每生成1 mol P4时,就有________mol电子发生转移。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.同一主族的元素,原子序数越大,原子半径越大,因此Z元素的原子半径比Y元素的大,故A错误;
B.根据元素在周期表中的位置,若Y原子序数是a,则W原子序数是a+9,a+9=2a,则a=9,a+9=18,它们分别是F元素和Ar元素,W的原子序数是Y的原子序数的2倍 ,故B正确;
C.如H2O的稳定性比HCl强,因此W的气态氢化物的稳定性不一定比Y的强,故C错误;
D.若X是氮元素,则Z是S元素,氮的非金属性比硫强,故D错误;
答案选B。
2.A
【详解】A. K的基态电子排布式为,故A错误;
B. P 是15号元素,基态电子排布式为,故B正确;
C. F为9号元素,基态电子排布式为 , 表示基态P原子价层电子轨道表示式,故C正确;
D. Na 是11号元素,最外层电子有8个,轨道表示式为 ,故D正确;
故选A。
3.D
【详解】A.氮原子的电子排布式为1s22s22p3,p轨道数为3,则氮原子的电子轨道表示式为,故A错误;
B.氯化铵为离子化合物,铵根离子与氯离子之间通过离子键结合,电子式为,故B错误;
C.氟离子是由氟原子得一个电子形成的,故氟离子的核外有10个电子,核内有9个质子,故结构示意图为,故C错误;
D.Fe是26号元素,外围电子排布式为3d64s2,失去4s能级2个电子形成Fe2+,基态Fe2+的价层电子排布式为3d6,故D正确,
故选:D。
4.C
【详解】A.35Cl和37Cl均为氯元素,核内含有17个质子,核外有17个电子,原子结构示意图为 ,A正确;
B.HClO中O原子分别与H、Cl原子共用一对电子,结构式为H-O-Cl,B正确;
C.图中2p轨道上的2个电子没有分占不同的轨道,违背了洪特规则,基态碳原子的轨道表示式为,C错误;
D.HF为共价化合物,电子式为 ,D正确;
综上所述答案为C。
5.A
【分析】①;②;③分别为O、Si、N。
【详解】A.元素周期表中,同一主族元素的第一电离能从上到下逐渐降低,同一周期从左到右有增大的趋势,由于第ⅤA族的原子最外层的p轨道处于较稳定的半充满状态,所以其第一电离能比第ⅥA的高,则第一电离能:,A正确;
B.元素的非金属性越强,简单氢化物的稳定性越强,非金属性:,所以简单氢化物的稳定性:,B错误;
C.元素周期表中,同一主族元素的非金属性从上到下逐渐减弱,同一周期从左到右逐渐增强,元素的非金属性:,C错误;
D.元素周期表中,元素的原子半径从上到下逐渐增大,从左到右逐渐减小,原子半径:,D错误;
故选A。
6.A
【详解】A.HCN的电子式为,则结构式为H-C≡N,A正确;
B.氢原子的质子数为1,则质量数为3的氢原子为,B不正确;
C.NaOH为离子化合物,O、H原子间通过一对共用电子构成OH-,电子式为,C不正确;
D.基态Cr原子的价层电子排布式为3d54s1,则其轨道表示式为,D不正确;
故选A。
7.B
【详解】A.以顶点的为研究对象,离最近的钛离子位于晶胞的体心,所以晶体中离最近的有8个,A项正确;
B.晶胞图b中含有1个A,3个X,1个B,且A为,根据电中性原理可推知,X为,B项错误;
C.同一周期元素,电负性从左到右逐渐增强,则电负性:O>N>C,C项正确;
D.由晶胞图a可知,钛酸钙晶体中离最近的氧离子形成了正八面体,钛离子位于其中心,D项正确;
故选B。
8.A
【详解】A.Ni含有28个核外电子,Ni2+离子核外有26个电子,离子电子排布式为:[Ar]3d8,故A正确;
B.3d能级处于全满时具有较低能量,因此Cu基态电子排布式为:[Ar]3d104s1,故B错误;
C.S2-离子核外电子数为18,排满3s再排3p,电子排布式为:[Ne]3s23p6,故C错误;
D.Si原子核外电子数为14,核外电子排布式为:[Ne]3s23p2,故D错误;
故选A。
9.B
【详解】在对电子运动状态的描述中,确定一个“轨道”的方面包括①电子层、②轨道类型、③轨道的空间伸展方向三个方面,④每个轨道中电子自旋状态最多两个,不能确定轨道的相关信息,故选B。
10.A
【分析】元素原子的价电子构型为2s22p5,则其核外电子数为9,其为氟元素。
【详解】A.氟的非金属性最强,在周期表中电负性最大,A正确;
B.虽然氟的非金属性最强,但周期表中第一电离能并不是最大的,因为有些稀有气体的第一电离能可能更大,B不正确;
C.氟的原子半径比氢大,所以氟在周期表中原子半径并不是最小的,C不正确;
D.氟的核外电子数为9,其核外电子有9种运动状态,D不正确;
故选A。
11.A
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的s电子数和p电子数相等,则W为O元素或Mg元素;W和Z位于同一主族,则W为O元素,Z为S元素;X原子的价电子排布式为3s1,则X元素为Na元素;Y的最外层电子数比Z的最外层电子数少1,则Y为P元素,据此分析作答。
【详解】A.一般来说,原子核外电子层数越多,其原子半径越大,同一周期元素原子半径随着原子序数增大而减小,所以原子半径:Na>P>Cl>O,A项正确;
B.W为O元素,没有+6价,S元素最高正价为+6,所以二者没有相同的最高正价,B项错误;
C.元素的非金属性越强,其简单氢化物的稳定性越强,非金属性:S>P,所以Y的最简单氢化物的热稳定性Y比Z的弱,C项错误;
D.X、Z形成的化合物为Na2S,Na+有2个电子层、S2-有3个电子层,所以两种离子电子层结构不同,D项错误;
答案选A。
12.A
【详解】A.元素周期表中,第9列为第Ⅷ族,全部为金属元素,A项正确;
B.第15列为第ⅤA族,其元素原子的最外层电子排布式为,B项错误;
C.He的最外层电子排布式为,却在第18列,C项错误;
D.第14列(碳族)元素原子的价层电子排布式为,未成对电子数为2,第15列(氨族)元素原子的价层电子排布式为,未成对电子数为3,D项错误;
故选A。
13.D
【详解】A.第一周期最外层电子排布是从ns1过渡到ns2,故A错误;
B.非金属元素H元素位于s区,故B错误;
C.1s2是He元素属于0族元素,1s22s2是Be元素属于第IIA族元素,He是稀有气体元素,Be为金属元素,二者性质不相似,故C错误;
D.过渡元素包括副族与第Ⅷ族,为元素周期表中的第3列到12列,即ⅢB到ⅡB的10个纵行,都是金属元素,故D正确;
故答案选D。
14.D
【分析】A为宇宙中最丰富的元素,则推出A为H;B的基态原子的价层电子排布为nsn-1npn+1,则n-1=2,即n=3,所以其价层电子排布式为3s23p4,推知B为S,C的能层数与B的相同,且电负性比B的大,则推知C为Cl,D的第一电离能比同周期相邻两种元素都大,则D位于第IIA族或第VA族,又元素的主族序数比周期序数大1,则D只能位于第四周期第V族,则D是As,则前四周期中电负性最小的元素,则E为K元素,据此分析解答。
【详解】A.最高价氧化物对应水化物的酸性:H2SO4>H3PO4>H3AsO4,A项错误;
B.K的金属性很强,能与水剧烈反应,故K先和水反应生成KOH和H2,然后KOH和CuSO4反应,不能置换出Cu,B项错误;
C.H原子核外只有1个电子,电子云轮廓图只有一种为球形,C项错误;
D.基态Cl原子的核外电子排布式是1s22s22p63s23p5,D项正确。
答案选D。
15.C
【详解】A.X的氢化物比Y的氢化物稳定,则X的非金属性强于Y,元素非金属性越强电负性越大,能说明X的电负性比Y大,A不符合题意;
B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强,则X的非金属性强于Y,元素非金属性越强电负性越大,能说明X的电负性比Y大,B不符合题意;
C.X原子的最外层电子数比Y原子的最外层电子数多不能说明X的电负性比Y大,如Si的电负性比H小,C符合题意;
D.X单质可以把Y从其氢化物中置换出来,则X的非金属性强于Y,元素非金属性越强电负性越大,能说明X的电负性比Y大,D不符合题意;
故选C。
16. 1s22s22p63s23p2 2 > < > < 3 Mn2+的价电子排布式为3d5,原子轨道处于半满状态,能量低更稳定,而Fe2+的价电子排布式为3d6,3d能级有6个电子,失去一个电子就达到3d5半充满稳定结构,故Fe2+容易再失去一个电子 b
【详解】(1)Si是14号元素,其基态原子核外电子排布式1s22s22p63s23p2,S为16号元素,其基态原子核外电子排布式1s22s22p63s23p4,有2个未成对电子;答案:1s22s22p63s23p2;2。
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+;同周期自左而右,元素电负性增大,所以电负性N;<;>;<。
(3)由图表可知该元素的各级电离能逐级增大,I1和I2、I3差别较小,但I4 I3,I4突跃式变大,即失去3个电子后,再失去电子变为+4价阳离子非常困难,该元素的核外电子排布为1s22s22p63s23p1,说明该元素为第IIIA族,在元素周期表的第3列。答案:3。
(4)原子轨道处于半满、全满、全空时,能量更低、更稳定,Mn2+的价电子排布式为3d5,3d能级有5个电子,为半充满状态,能量低更稳定,所以难再失去一个电子,而Fe2+的价电子排布式为3d6,3d能级有6个电子,失去一个电子就达到3d5半充满稳定结构,故Fe2+容易再失去一个电子。答案:Mn2+的价电子排布式为3d5,原子轨道处于半满状态,能量低更稳定,而Fe2+的价电子排布式为3d6,3d能级有6个电子,失去一个电子就达到3d5半充满稳定结构,故Fe2+容易再失去一个电子。
(5)HF是双原子分子,两个原子共用一对电子形成共价键,键角为180,因为F的电负性很大,容易形成氢键,氟原子和另外一个分子中的氢原子形成氢键,所以b符合题意;答案:b。
17. 3s23p2 Mg>A1>Si 密度小(轻巧) 硬度大(坚硬)或耐用等 d
【详解】(1)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的最外层电子排布式为3s23p2;A是碳,AO2是二氧化碳,二氧化碳的电子式为;
(2)铜、锰是过渡元素,镁、铝、硅位于同同期主族元素,在元素周期律中,同一周期元素的原子半径随着原子序数的增大而减小,则Mg、A1、Si 元素的原子半径由大到小的顺序为Mg>A1>Si;
(3)硬铝合金的机械性能好,密度小(轻巧),硬度大(坚硬)或耐用,是制造飞机的理想材料,
(4)a.铷的金属活动性大于Na,Na的活泼性大于金属Mg,故Rb的活泼性大于Mg,故a错误;
b.MgCl2的离子键比RbCl强,MgCl2的热稳定性比RbCl强,且两者稳定性与真空炼铷的原理无关,故b错误;
c.活泼性越强,对应离子的氧化性越弱,则得电子能力越弱,由于Rb的活泼性大于Mg,则Mg2+得电子的能力比Rb+强,故c错误;
d.已知真空炼铷的原理如下:2RbCl+Mg=MgCl2+2Rb(气),该条件下,生成物Rb为气态,把铷蒸气抽出,则减少了生成物的浓度,平衡向正方向移动,所以反应可以不断向生成Rb(气)方向进行,故d正确;
答案为:d。
18. 四 ⅢA p Na F F 3s23p5 [Ar]3d10 2 Al或Cl
【分析】根据核外电子排布确定原子结构的特点,确定元素在周期表中的位置;Cu的原子序数为29,核外电子排布式为1s22s22p63s23p63d104s1,Cu原子失去4s能级电子形成Cu+;结合元素周期表的分区方法分析解答;原子基态时3p轨道有1个未成对,电子排布式为3p1或3p5,据此分析解答。
【详解】(1)某元素的原子的价电子构型为4s24p1,它在周期表中位于第4周期ⅢA族,属于p区元素,故答案为:四;ⅢA;p;
(2)在1~18号元素中,除稀有气体元素外,原子半径最大的元素是Na,电负性最大的是F,元素的第一电离能是指气态原子失去1个电子形成气态阳离子克服原子核的引力而消耗的能量,原子越稳定其第一电离能越大,第一电离能最大的元素是F,同周期从左到右原子半径依次减小,所以第三周期原子半径最小的元素为Cl,其价电子排布式为3s23p5,故答案为:Na;F; F;3s23p5;
(3)Cu的原子序数为29,核外电子排布式为1s22s22p63s23p63d104s1,Cu+失去最外层电子,即失去了4s轨道的电子,Cu+的核外电子排布式为1s22s22p63s23p63d10;s区包括第ⅠA、ⅡA族,第四周期只有K、Ca两种元素,故答案为:1s22s22p63s23p63d10;2;
(4)原子基态时3p轨道有1个未成对电子的元素的电子排布式为1s22s22p63s23p1或1s22s22p63s23p5,为Al或Cl元素的原子,故答案为:Al或Cl。
19.
【详解】同周期从左至右,元素的第一电离能总体上呈增大的趋势。同主族,自上而下,元素的第一电离能逐渐减小。电负性与电离能的变化趋势类似,也是同周期从左至右,主族元素的电负性逐渐增大,同主族,自上而下,主族元素的电负性逐渐减小。原子半径的变化趋势与之相反,同周期,从左至右,原子半径逐渐减小;同主族,自上而下,原子半径逐渐增大,故答案为:
。
20.(1)0.9~1.5
(2)非金属性越强,电负性越大;金属性越强,电负性越小
(3) 离子化合物 共价化合物 共价化合物
【详解】(1)根据电负性的递变规律:同周期从左至右电负性逐渐增大,同主族元素从上到下电负性逐渐减小,可知在同周期中电负性Na<Mg<Al,同主族Be>Mg>Ca,结合表中数据Be、Na、Al的电负性分别为0.9、1.5、1.5,则Mg的电负性范围为0.9~1.5,故答案为:0.9~1.5;
(2)由表中数据可知,F的电负性最强,其非金属性也最强;Na的电负性最弱,但其金属性最强,因此可得到非金属性越强,电负性越大,金属性越强,电负性越小,故答案为:非金属性越强,电负性越大,金属性越强,电负性越小;
(3)AlF3中Al、F的电负性分别为1.5、4.0,则其电负性差值为:4.0-1.5=2.5>1.7,则形成离子键,所以AlF3为离子化合物;AlCl3中Al、Cl的电负性分别为1.5、3.0,则其电负性差值为:3.0-1.5=1.5<1.7,则形成共价键,所以AlCl3为共价化合物;Br的非金属性比Cl弱,则Br的电负性比Cl小,所以Al和Br的电负性差值比Al和Cl的电负性差值小,小于1.7,所以形成共价键,所以AlBr3为共价化合物。
21. F Pb F HClO4 Si或Ge ⅤA +5 < < > > D BC Br2+2H2O+SO2=4H+ + SO42-+2Br-
【分析】(1)①同周期自左而右元素的非金属性增强,同主族自上而下元素的非金属性减弱;
②同周期自左而右元素的金属性减弱,同主族自上而下元素的金属性增强;
③同周期自左而右原子半径减小,同主族自上而下原子半径增大;
④最高价含氧酸酸性最强的是高氯酸;
⑤在金属和非金属分界线处的元素单质能作半导体;
⑥主族元素中,原子最外层电子数与其族序数、最高化合价数相等;
(2)①元素的非金属性越强,其最高价氧化物的水化物酸性越强;
②元素的金属性越强,其氢化物越稳定;
③含有氢键的物质沸点较高;
④非金属性越强,阴离子还原性越弱;
⑤电负性相近的元素,其非金属性相近;
(3)①根据同一主族元素性质的相似性和递变性解答;
②溴和二氧化硫反应氧化还原反应生成硫酸和氢溴酸。
【详解】(1)①同周期自左而右元素的非金属性增强,同主族自上而下元素的非金属性减弱,非金属性最强的元素在元素周期表右上角,为F元素;
②同周期自左而右元素的金属性减弱,同主族自上而下元素的金属性增强,金属性最强的元素在元素周期表左下角,为Pb元素;
③同周期自左而右原子半径减小,同主族自上而下原子半径增大,原子半径最小的元素在元素周期表右上角,为F元素;
④元素的非金属性越强,其最高价氧化物的水化物酸性越强,F和O元素没有最高价含氧酸,所以最高价含氧酸酸性最强的是HClO4;
⑤在金属和非金属分界线处的元素单质能作半导体,如Si;
⑥主族元素中,原子最外层电子数与其族序数、最高化合价数相等,这几种元素原子的最外层电子数是5,所以这几种元素位于第VA族,形成的最高化合价为+5;
(2)①元素的非金属性越强,其最高价氧化物的水化物酸性越强,P元素的非金属性大于As元素,所以酸性强弱:H3AsO4<H3PO4;
②元素的金属性越强,其氢化物越稳定,S的非金属性小于Cl元素,所以稳定性:H2S<HCl;
③同一主族中,含有氢键的物质沸点大于其相邻元素氢化物的沸点,HF中含有氢键,HCl中没有氢键,所以沸点HF>HCl;
④同一主族中,阴离子的还原性随着原子序数的增大而增强,所以还原性I->Br-;
⑤电负性相近的元素,其非金属性相近,O元素和Cl元素的电负性接近,所以其非金属性接近,故答案为D;
(3)①A.硫为固体,所以常温下Se单质是固体,故A错误;
B.Se最高价氧化物的水化物为酸,能和NaOH发生中和反应,故B正确;
C.同一主族中,其氢化物的化学式相同,所以Se氢化物的化学式为H2Se,故C正确;
D.根据硫的氧化物知,常见的氧化物有SeO3和SeO2,故D错误;
故答案为BC;
②溴具有强氧化性,能将二氧化硫氧化为硫酸,同时自身被还原为氢溴酸,离子反应方程式为Br2+2H2O+SO2═4H++SO42-+2Br-。
22. 1s22s22p63s23p3 20
【分析】(1)磷元素为15号元素的原子核外有15个电子;
(2)反应中P元素化合价由+5价降低到0价,结合化合价的变化计算。
【详解】(1) 磷元素为15号元素的原子核外有15个电子,原子核外电子排布式1s22s22p63s23p3,
故答案为:1s22s22p63s23p3;
(2)反应中P元素化合价由+5价降低到0价,则每生成1mol P4,转移的电子的物质的量为1mol×4×5=20mol,
故答案为:20。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
A.Z元素的原子半径可能比Y元素的小
B.W的原子序数可能是Y的原子序数的2倍
C.W的气态氢化物的稳定性一定比Y的强
D.Z的化学活泼性一定比X强
2.下列电子排布式或外围电子轨道表示式不能表示基态粒子的是
A.K B.P
C.F D.
3.下列有说法正确的是
A.氮原子的轨道表示式是:
B.NH4Cl电子式为
C.F-离子结构示意图:
D.基态Fe2+的价层电子排布式为3d6
4.下列化学用语的表述不正确的是
A.35Cl和37Cl的原子结构示意图均可表示为:
B.HClO的结构式:H-O-Cl
C.基态碳原子的轨道表示式:
D.HF的电子式:
5.现有三种元素的基态原子的电子排布式如下:①;②;③,下列排序正确的是
A.第一电离能:③>①>②
B.简单氢化物的稳定性:①>②>③
C.元素的非金属性:②>①>③
D.原子半径:①>③>②
6.下列化学用语或图示表达正确的是
A.HCN的结构式:H-C≡N
B.质量数为3的氢原子:3H
C.NaOH的电子式:
D.基态Cr原子的价层电子的轨道表示式:
7.钛酸钙矿物的晶胞结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中A为,另两种离子为和。下列说法错误的是
A.钛酸钙晶体中距离最近的有8个
B.图(b)中,X为
C.电负性:O>N>C
D.钛酸钙晶胞中距离最近的形成了正八面体,位于其中心
8.下列原子或离子的基态电子排布式正确的是
A.Ni2+:[Ar]3d8 B.Cu:[Ar]3d94s2
C.S2-:[Ne]2s23p6 D.Si:[Ar]3s23p2
9.在对电子运动状态的描述中,确定一个“轨道”的方面包括
①电子层 ②轨道类型 ③轨道的空间伸展方向 ④电子的自旋状态
A.①②③④ B.①②③ C.①② D.①
10.一种元素原子的价电子构型为2s22p5,下列有关它的描述正确的有
A.在周期表中电负性最大 B.在周期表中第一电离能最大
C.在周期表中原子半径最小 D.核外电子只有7种运动状态
11.短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的s电子数和p电子数相等,W和Z位于同一主族,X原子的价电子排布式为3s1,Y的最外层电子数比Z的最外层电子数少1,下列说法正确的是
A.原子半径:X>Y>Z>W
B.W、Z具有相同的最高正价
C.Y的最简单氢化物的热稳定性比Z的强
D.X、Z形成的化合物中各微粒的电子层结构相同
12.元素周期表中共有18纵列,从左到右排为18列,第1列为碱金属元素(氢元素除外),第18列为稀有气体元素,则下列说法正确的是
A.第9列元素中没有非金属元素
B.第15列元素原子的最外层电子排布式是
C.最外层电子排布式为的元素一定在第2列
D.第14列元素原子的未成对电子数是同周期元素中最多的
13.下列说法正确的是
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1过渡到ns2np6
B.所有的非金属元素都分布在p区
C.核外电子排布式为1s2的原子与核外电子排布式为1s22s2的原子的化学性质相似
D.元素周期表中IIIB族到IIB族的10个纵列的元素都是金属元素
14.A、B、C、D、E五种主族元素的相关信息如表所示:
元素 信息
A 宇宙中最丰富的元素
B 基态原子的价层电子排布为nsn-1npn+1
C 能层数与B相同,且电负性比B大
D 元素的主族序数比周期序数大1,且第一电离能比同周期相邻两种元素都大
E 前四周期中电负性最小的元素
下列说法正确的是A.最高价氧化物对应水化物的酸性:D>B
B.E的单质可将Cu从CuSO4溶液中置换出来
C.A的基态原子的电子云轮廓图有两种形状
D.C的基态原子的核外电子排布式是1s22s22p63s23p5
15.不能说明X的电负性比Y的大的是
A.X的氢化物比Y的氢化物稳定
B.X的最高价氧化物对应水化物的酸性比Y的强
C.X原子的最外层电子数比Y原子的多
D.X单质可以把Y从其氢化物中置换出来
二、填空题
16.请按要求回答问题。
(1)Si的基态原子核外电子排布式____,S的基态原子核外有____个未成对电子
(2)用“<”“>”填空
离子半径 电负性 熔点 酸性
O2-____Na+ N___O 金刚石_____晶体硅 硫酸___高氯酸
(3)第三周期某元素的电离能情况如图所示,则该元素位于元素周期表第____列
(4)Mn、Fe均为第4周期的过渡元素,两元素的部分电离能数据列于下表:
元素 Mn Fe
电离能/kJ·mol-1 I1 717 759
I2 1509 1561
I3 3248 2957
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是______。
(5)下图能表示HF分子形成的是( )
a. b.
c. d.
17.硬铝(含少量铜、镁、锰和硅)有良好的机械性能,是制造飞机的理想材料。
(1)写出硅原子最外层电子排布式__________;短周期元素A与硅元素同主族,能与氧元素组成化合物AO2,写出AO2的电子式:__________。
(2)上述硬铝中所含的主族元素的原子半径由大到小的顺序为:__________。
(3)请阐述硬铝是制造飞机的理想材料的原因有:__________、__________。
(4)工业上可用镁真空炼铷,方程式为2RbCl+Mg MgCl2+2Rb(g),对于此反应能够进行正确的解释是 __________。
a.Rb比Mg金属性强
b.MgCl2的热稳定性比RbCl 弱
c.高温下Mg2+得电子能力比Rb+弱
d.Rb的沸点比Mg低,当把Rb(g)抽走时,平衡向正反应方向移动
18.根据题给信息回答问题
(1)某元素原子的价电子构型为4s24p1,它属于第___________周期第___________族,属于___________区元素。
(2)在1~18号元素中,除稀有气体元素外,原子半径最大的元素是___________(用元素符号表示,下同),电负性最大的元素是___________;第一电离能最大的元素是___________。第三周期原子半径最小的主族元素的价电子排布式为___________。
(3)写出Cu+的核外电子排布式:___________。按电子排布,可将周期表中的元素划分成五个区域,第四周期元素中属于s区的元素有___________种,
(4)某元素原子的3p轨道有1个未成对电子,该元素为___________(用元素符号表示)。
19.请参照图所示的元素的第一电离能的周期性曲线,画出前三周期元素的原子半径和电负性的变化曲线_____。
20.根据信息回答下列问题:不同元素的原子在分子内吸引键合电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7通常形成共价键。下表是某些元素的电负性值:
元素符号 Li Be B C O F Na Al Si P S Cl
电负性值 1.0 1.5 2.0 2.5 3.5 4.0 0.9 1.5 1.8 2.1 2.5 3.0
(1)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围:___________。
(2)请归纳元素的电负性和金属性、非金属性的关系是___________。
(3)推测AlF3、AlCl3、AlBr3是离子化合物还是共价化合物:AlF3___________,AlCl3___________, AlBr3___________。
21.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。请用元素符号或化学式填空:
(1)所示元素中
①非金属性最强的元素是:_________
②金属性最强的元素是:___________
③原子半径最小的是:___________
④最高价含氧酸酸性最强的是______________
⑤经常用作半导体材料的元素是:___________(只写一种)
⑥阴影部分属于元素周期表中的_________族,该族元素的最高正价均为_________
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 _________H3PO4(用“>”或“<”表示,下同);
②稳定性:H2S__________HCl
③沸点:HF_____HCl
④还原性:I-_______Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:__________
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:________
A.常温下Se单质是气体
B.Se最高价氧化物的水化物能和NaOH发生反应
C.氢化物的化学式为H2Se
D.常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________
22.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子核外电子排布式是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2→6CaSiO3+P4O10 10C+P4O10→P4+10CO,每生成1 mol P4时,就有________mol电子发生转移。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.同一主族的元素,原子序数越大,原子半径越大,因此Z元素的原子半径比Y元素的大,故A错误;
B.根据元素在周期表中的位置,若Y原子序数是a,则W原子序数是a+9,a+9=2a,则a=9,a+9=18,它们分别是F元素和Ar元素,W的原子序数是Y的原子序数的2倍 ,故B正确;
C.如H2O的稳定性比HCl强,因此W的气态氢化物的稳定性不一定比Y的强,故C错误;
D.若X是氮元素,则Z是S元素,氮的非金属性比硫强,故D错误;
答案选B。
2.A
【详解】A. K的基态电子排布式为,故A错误;
B. P 是15号元素,基态电子排布式为,故B正确;
C. F为9号元素,基态电子排布式为 , 表示基态P原子价层电子轨道表示式,故C正确;
D. Na 是11号元素,最外层电子有8个,轨道表示式为 ,故D正确;
故选A。
3.D
【详解】A.氮原子的电子排布式为1s22s22p3,p轨道数为3,则氮原子的电子轨道表示式为,故A错误;
B.氯化铵为离子化合物,铵根离子与氯离子之间通过离子键结合,电子式为,故B错误;
C.氟离子是由氟原子得一个电子形成的,故氟离子的核外有10个电子,核内有9个质子,故结构示意图为,故C错误;
D.Fe是26号元素,外围电子排布式为3d64s2,失去4s能级2个电子形成Fe2+,基态Fe2+的价层电子排布式为3d6,故D正确,
故选:D。
4.C
【详解】A.35Cl和37Cl均为氯元素,核内含有17个质子,核外有17个电子,原子结构示意图为 ,A正确;
B.HClO中O原子分别与H、Cl原子共用一对电子,结构式为H-O-Cl,B正确;
C.图中2p轨道上的2个电子没有分占不同的轨道,违背了洪特规则,基态碳原子的轨道表示式为,C错误;
D.HF为共价化合物,电子式为 ,D正确;
综上所述答案为C。
5.A
【分析】①;②;③分别为O、Si、N。
【详解】A.元素周期表中,同一主族元素的第一电离能从上到下逐渐降低,同一周期从左到右有增大的趋势,由于第ⅤA族的原子最外层的p轨道处于较稳定的半充满状态,所以其第一电离能比第ⅥA的高,则第一电离能:,A正确;
B.元素的非金属性越强,简单氢化物的稳定性越强,非金属性:,所以简单氢化物的稳定性:,B错误;
C.元素周期表中,同一主族元素的非金属性从上到下逐渐减弱,同一周期从左到右逐渐增强,元素的非金属性:,C错误;
D.元素周期表中,元素的原子半径从上到下逐渐增大,从左到右逐渐减小,原子半径:,D错误;
故选A。
6.A
【详解】A.HCN的电子式为,则结构式为H-C≡N,A正确;
B.氢原子的质子数为1,则质量数为3的氢原子为,B不正确;
C.NaOH为离子化合物,O、H原子间通过一对共用电子构成OH-,电子式为,C不正确;
D.基态Cr原子的价层电子排布式为3d54s1,则其轨道表示式为,D不正确;
故选A。
7.B
【详解】A.以顶点的为研究对象,离最近的钛离子位于晶胞的体心,所以晶体中离最近的有8个,A项正确;
B.晶胞图b中含有1个A,3个X,1个B,且A为,根据电中性原理可推知,X为,B项错误;
C.同一周期元素,电负性从左到右逐渐增强,则电负性:O>N>C,C项正确;
D.由晶胞图a可知,钛酸钙晶体中离最近的氧离子形成了正八面体,钛离子位于其中心,D项正确;
故选B。
8.A
【详解】A.Ni含有28个核外电子,Ni2+离子核外有26个电子,离子电子排布式为:[Ar]3d8,故A正确;
B.3d能级处于全满时具有较低能量,因此Cu基态电子排布式为:[Ar]3d104s1,故B错误;
C.S2-离子核外电子数为18,排满3s再排3p,电子排布式为:[Ne]3s23p6,故C错误;
D.Si原子核外电子数为14,核外电子排布式为:[Ne]3s23p2,故D错误;
故选A。
9.B
【详解】在对电子运动状态的描述中,确定一个“轨道”的方面包括①电子层、②轨道类型、③轨道的空间伸展方向三个方面,④每个轨道中电子自旋状态最多两个,不能确定轨道的相关信息,故选B。
10.A
【分析】元素原子的价电子构型为2s22p5,则其核外电子数为9,其为氟元素。
【详解】A.氟的非金属性最强,在周期表中电负性最大,A正确;
B.虽然氟的非金属性最强,但周期表中第一电离能并不是最大的,因为有些稀有气体的第一电离能可能更大,B不正确;
C.氟的原子半径比氢大,所以氟在周期表中原子半径并不是最小的,C不正确;
D.氟的核外电子数为9,其核外电子有9种运动状态,D不正确;
故选A。
11.A
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的s电子数和p电子数相等,则W为O元素或Mg元素;W和Z位于同一主族,则W为O元素,Z为S元素;X原子的价电子排布式为3s1,则X元素为Na元素;Y的最外层电子数比Z的最外层电子数少1,则Y为P元素,据此分析作答。
【详解】A.一般来说,原子核外电子层数越多,其原子半径越大,同一周期元素原子半径随着原子序数增大而减小,所以原子半径:Na>P>Cl>O,A项正确;
B.W为O元素,没有+6价,S元素最高正价为+6,所以二者没有相同的最高正价,B项错误;
C.元素的非金属性越强,其简单氢化物的稳定性越强,非金属性:S>P,所以Y的最简单氢化物的热稳定性Y比Z的弱,C项错误;
D.X、Z形成的化合物为Na2S,Na+有2个电子层、S2-有3个电子层,所以两种离子电子层结构不同,D项错误;
答案选A。
12.A
【详解】A.元素周期表中,第9列为第Ⅷ族,全部为金属元素,A项正确;
B.第15列为第ⅤA族,其元素原子的最外层电子排布式为,B项错误;
C.He的最外层电子排布式为,却在第18列,C项错误;
D.第14列(碳族)元素原子的价层电子排布式为,未成对电子数为2,第15列(氨族)元素原子的价层电子排布式为,未成对电子数为3,D项错误;
故选A。
13.D
【详解】A.第一周期最外层电子排布是从ns1过渡到ns2,故A错误;
B.非金属元素H元素位于s区,故B错误;
C.1s2是He元素属于0族元素,1s22s2是Be元素属于第IIA族元素,He是稀有气体元素,Be为金属元素,二者性质不相似,故C错误;
D.过渡元素包括副族与第Ⅷ族,为元素周期表中的第3列到12列,即ⅢB到ⅡB的10个纵行,都是金属元素,故D正确;
故答案选D。
14.D
【分析】A为宇宙中最丰富的元素,则推出A为H;B的基态原子的价层电子排布为nsn-1npn+1,则n-1=2,即n=3,所以其价层电子排布式为3s23p4,推知B为S,C的能层数与B的相同,且电负性比B的大,则推知C为Cl,D的第一电离能比同周期相邻两种元素都大,则D位于第IIA族或第VA族,又元素的主族序数比周期序数大1,则D只能位于第四周期第V族,则D是As,则前四周期中电负性最小的元素,则E为K元素,据此分析解答。
【详解】A.最高价氧化物对应水化物的酸性:H2SO4>H3PO4>H3AsO4,A项错误;
B.K的金属性很强,能与水剧烈反应,故K先和水反应生成KOH和H2,然后KOH和CuSO4反应,不能置换出Cu,B项错误;
C.H原子核外只有1个电子,电子云轮廓图只有一种为球形,C项错误;
D.基态Cl原子的核外电子排布式是1s22s22p63s23p5,D项正确。
答案选D。
15.C
【详解】A.X的氢化物比Y的氢化物稳定,则X的非金属性强于Y,元素非金属性越强电负性越大,能说明X的电负性比Y大,A不符合题意;
B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强,则X的非金属性强于Y,元素非金属性越强电负性越大,能说明X的电负性比Y大,B不符合题意;
C.X原子的最外层电子数比Y原子的最外层电子数多不能说明X的电负性比Y大,如Si的电负性比H小,C符合题意;
D.X单质可以把Y从其氢化物中置换出来,则X的非金属性强于Y,元素非金属性越强电负性越大,能说明X的电负性比Y大,D不符合题意;
故选C。
16. 1s22s22p63s23p2 2 > < > < 3 Mn2+的价电子排布式为3d5,原子轨道处于半满状态,能量低更稳定,而Fe2+的价电子排布式为3d6,3d能级有6个电子,失去一个电子就达到3d5半充满稳定结构,故Fe2+容易再失去一个电子 b
【详解】(1)Si是14号元素,其基态原子核外电子排布式1s22s22p63s23p2,S为16号元素,其基态原子核外电子排布式1s22s22p63s23p4,有2个未成对电子;答案:1s22s22p63s23p2;2。
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+;同周期自左而右,元素电负性增大,所以电负性N
(3)由图表可知该元素的各级电离能逐级增大,I1和I2、I3差别较小,但I4 I3,I4突跃式变大,即失去3个电子后,再失去电子变为+4价阳离子非常困难,该元素的核外电子排布为1s22s22p63s23p1,说明该元素为第IIIA族,在元素周期表的第3列。答案:3。
(4)原子轨道处于半满、全满、全空时,能量更低、更稳定,Mn2+的价电子排布式为3d5,3d能级有5个电子,为半充满状态,能量低更稳定,所以难再失去一个电子,而Fe2+的价电子排布式为3d6,3d能级有6个电子,失去一个电子就达到3d5半充满稳定结构,故Fe2+容易再失去一个电子。答案:Mn2+的价电子排布式为3d5,原子轨道处于半满状态,能量低更稳定,而Fe2+的价电子排布式为3d6,3d能级有6个电子,失去一个电子就达到3d5半充满稳定结构,故Fe2+容易再失去一个电子。
(5)HF是双原子分子,两个原子共用一对电子形成共价键,键角为180,因为F的电负性很大,容易形成氢键,氟原子和另外一个分子中的氢原子形成氢键,所以b符合题意;答案:b。
17. 3s23p2 Mg>A1>Si 密度小(轻巧) 硬度大(坚硬)或耐用等 d
【详解】(1)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的最外层电子排布式为3s23p2;A是碳,AO2是二氧化碳,二氧化碳的电子式为;
(2)铜、锰是过渡元素,镁、铝、硅位于同同期主族元素,在元素周期律中,同一周期元素的原子半径随着原子序数的增大而减小,则Mg、A1、Si 元素的原子半径由大到小的顺序为Mg>A1>Si;
(3)硬铝合金的机械性能好,密度小(轻巧),硬度大(坚硬)或耐用,是制造飞机的理想材料,
(4)a.铷的金属活动性大于Na,Na的活泼性大于金属Mg,故Rb的活泼性大于Mg,故a错误;
b.MgCl2的离子键比RbCl强,MgCl2的热稳定性比RbCl强,且两者稳定性与真空炼铷的原理无关,故b错误;
c.活泼性越强,对应离子的氧化性越弱,则得电子能力越弱,由于Rb的活泼性大于Mg,则Mg2+得电子的能力比Rb+强,故c错误;
d.已知真空炼铷的原理如下:2RbCl+Mg=MgCl2+2Rb(气),该条件下,生成物Rb为气态,把铷蒸气抽出,则减少了生成物的浓度,平衡向正方向移动,所以反应可以不断向生成Rb(气)方向进行,故d正确;
答案为:d。
18. 四 ⅢA p Na F F 3s23p5 [Ar]3d10 2 Al或Cl
【分析】根据核外电子排布确定原子结构的特点,确定元素在周期表中的位置;Cu的原子序数为29,核外电子排布式为1s22s22p63s23p63d104s1,Cu原子失去4s能级电子形成Cu+;结合元素周期表的分区方法分析解答;原子基态时3p轨道有1个未成对,电子排布式为3p1或3p5,据此分析解答。
【详解】(1)某元素的原子的价电子构型为4s24p1,它在周期表中位于第4周期ⅢA族,属于p区元素,故答案为:四;ⅢA;p;
(2)在1~18号元素中,除稀有气体元素外,原子半径最大的元素是Na,电负性最大的是F,元素的第一电离能是指气态原子失去1个电子形成气态阳离子克服原子核的引力而消耗的能量,原子越稳定其第一电离能越大,第一电离能最大的元素是F,同周期从左到右原子半径依次减小,所以第三周期原子半径最小的元素为Cl,其价电子排布式为3s23p5,故答案为:Na;F; F;3s23p5;
(3)Cu的原子序数为29,核外电子排布式为1s22s22p63s23p63d104s1,Cu+失去最外层电子,即失去了4s轨道的电子,Cu+的核外电子排布式为1s22s22p63s23p63d10;s区包括第ⅠA、ⅡA族,第四周期只有K、Ca两种元素,故答案为:1s22s22p63s23p63d10;2;
(4)原子基态时3p轨道有1个未成对电子的元素的电子排布式为1s22s22p63s23p1或1s22s22p63s23p5,为Al或Cl元素的原子,故答案为:Al或Cl。
19.
【详解】同周期从左至右,元素的第一电离能总体上呈增大的趋势。同主族,自上而下,元素的第一电离能逐渐减小。电负性与电离能的变化趋势类似,也是同周期从左至右,主族元素的电负性逐渐增大,同主族,自上而下,主族元素的电负性逐渐减小。原子半径的变化趋势与之相反,同周期,从左至右,原子半径逐渐减小;同主族,自上而下,原子半径逐渐增大,故答案为:
。
20.(1)0.9~1.5
(2)非金属性越强,电负性越大;金属性越强,电负性越小
(3) 离子化合物 共价化合物 共价化合物
【详解】(1)根据电负性的递变规律:同周期从左至右电负性逐渐增大,同主族元素从上到下电负性逐渐减小,可知在同周期中电负性Na<Mg<Al,同主族Be>Mg>Ca,结合表中数据Be、Na、Al的电负性分别为0.9、1.5、1.5,则Mg的电负性范围为0.9~1.5,故答案为:0.9~1.5;
(2)由表中数据可知,F的电负性最强,其非金属性也最强;Na的电负性最弱,但其金属性最强,因此可得到非金属性越强,电负性越大,金属性越强,电负性越小,故答案为:非金属性越强,电负性越大,金属性越强,电负性越小;
(3)AlF3中Al、F的电负性分别为1.5、4.0,则其电负性差值为:4.0-1.5=2.5>1.7,则形成离子键,所以AlF3为离子化合物;AlCl3中Al、Cl的电负性分别为1.5、3.0,则其电负性差值为:3.0-1.5=1.5<1.7,则形成共价键,所以AlCl3为共价化合物;Br的非金属性比Cl弱,则Br的电负性比Cl小,所以Al和Br的电负性差值比Al和Cl的电负性差值小,小于1.7,所以形成共价键,所以AlBr3为共价化合物。
21. F Pb F HClO4 Si或Ge ⅤA +5 < < > > D BC Br2+2H2O+SO2=4H+ + SO42-+2Br-
【分析】(1)①同周期自左而右元素的非金属性增强,同主族自上而下元素的非金属性减弱;
②同周期自左而右元素的金属性减弱,同主族自上而下元素的金属性增强;
③同周期自左而右原子半径减小,同主族自上而下原子半径增大;
④最高价含氧酸酸性最强的是高氯酸;
⑤在金属和非金属分界线处的元素单质能作半导体;
⑥主族元素中,原子最外层电子数与其族序数、最高化合价数相等;
(2)①元素的非金属性越强,其最高价氧化物的水化物酸性越强;
②元素的金属性越强,其氢化物越稳定;
③含有氢键的物质沸点较高;
④非金属性越强,阴离子还原性越弱;
⑤电负性相近的元素,其非金属性相近;
(3)①根据同一主族元素性质的相似性和递变性解答;
②溴和二氧化硫反应氧化还原反应生成硫酸和氢溴酸。
【详解】(1)①同周期自左而右元素的非金属性增强,同主族自上而下元素的非金属性减弱,非金属性最强的元素在元素周期表右上角,为F元素;
②同周期自左而右元素的金属性减弱,同主族自上而下元素的金属性增强,金属性最强的元素在元素周期表左下角,为Pb元素;
③同周期自左而右原子半径减小,同主族自上而下原子半径增大,原子半径最小的元素在元素周期表右上角,为F元素;
④元素的非金属性越强,其最高价氧化物的水化物酸性越强,F和O元素没有最高价含氧酸,所以最高价含氧酸酸性最强的是HClO4;
⑤在金属和非金属分界线处的元素单质能作半导体,如Si;
⑥主族元素中,原子最外层电子数与其族序数、最高化合价数相等,这几种元素原子的最外层电子数是5,所以这几种元素位于第VA族,形成的最高化合价为+5;
(2)①元素的非金属性越强,其最高价氧化物的水化物酸性越强,P元素的非金属性大于As元素,所以酸性强弱:H3AsO4<H3PO4;
②元素的金属性越强,其氢化物越稳定,S的非金属性小于Cl元素,所以稳定性:H2S<HCl;
③同一主族中,含有氢键的物质沸点大于其相邻元素氢化物的沸点,HF中含有氢键,HCl中没有氢键,所以沸点HF>HCl;
④同一主族中,阴离子的还原性随着原子序数的增大而增强,所以还原性I->Br-;
⑤电负性相近的元素,其非金属性相近,O元素和Cl元素的电负性接近,所以其非金属性接近,故答案为D;
(3)①A.硫为固体,所以常温下Se单质是固体,故A错误;
B.Se最高价氧化物的水化物为酸,能和NaOH发生中和反应,故B正确;
C.同一主族中,其氢化物的化学式相同,所以Se氢化物的化学式为H2Se,故C正确;
D.根据硫的氧化物知,常见的氧化物有SeO3和SeO2,故D错误;
故答案为BC;
②溴具有强氧化性,能将二氧化硫氧化为硫酸,同时自身被还原为氢溴酸,离子反应方程式为Br2+2H2O+SO2═4H++SO42-+2Br-。
22. 1s22s22p63s23p3 20
【分析】(1)磷元素为15号元素的原子核外有15个电子;
(2)反应中P元素化合价由+5价降低到0价,结合化合价的变化计算。
【详解】(1) 磷元素为15号元素的原子核外有15个电子,原子核外电子排布式1s22s22p63s23p3,
故答案为:1s22s22p63s23p3;
(2)反应中P元素化合价由+5价降低到0价,则每生成1mol P4,转移的电子的物质的量为1mol×4×5=20mol,
故答案为:20。
答案第1页,共2页
答案第1页,共2页
