专题7初识酸、碱和盐检测题(含答案) ---2022-2023学年九年级化学仁爱版下册
文档属性
| 名称 | 专题7初识酸、碱和盐检测题(含答案) ---2022-2023学年九年级化学仁爱版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 166.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-04 19:57:51 | ||
图片预览



文档简介
专题7《初识酸、碱和盐》检测题
一、单选题
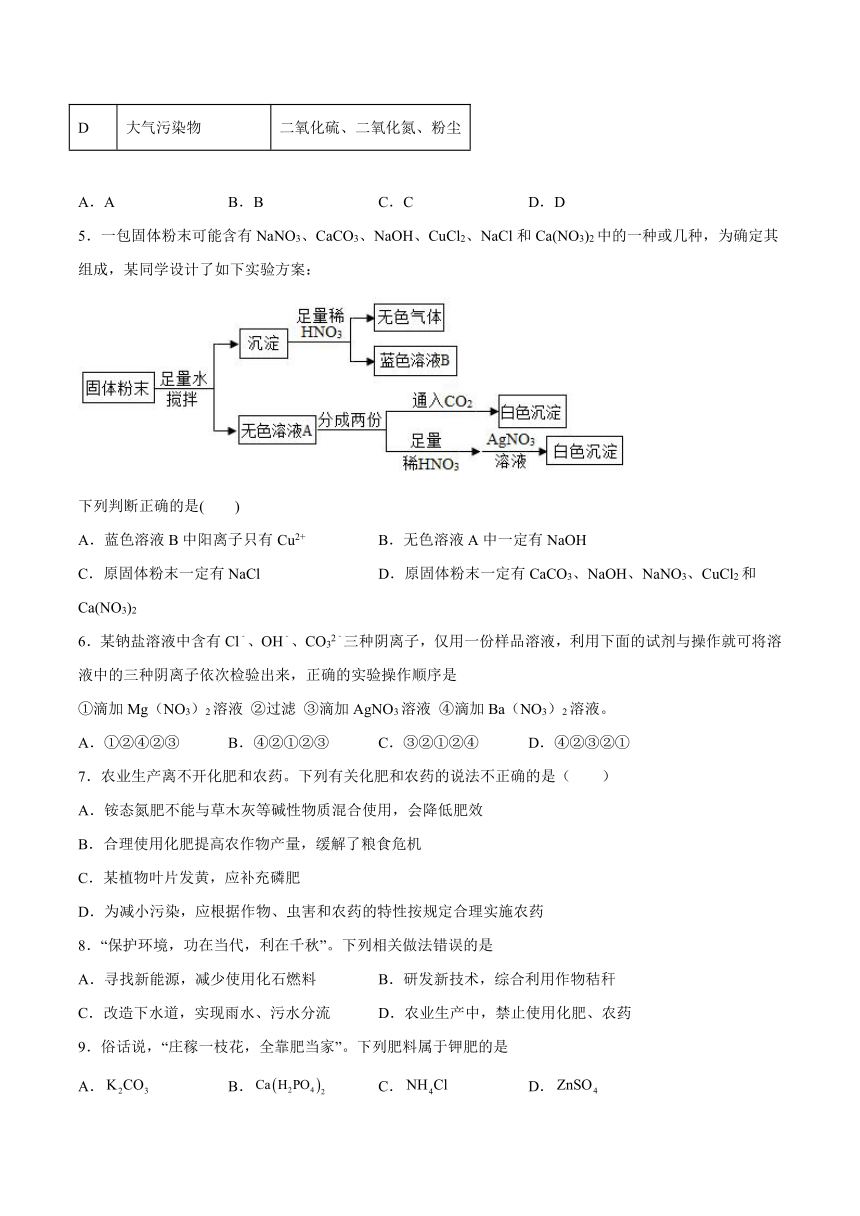
1.下列图象能正确反映对应变化关系的是
A.镁条在盛有氧气的密闭容器中燃烧 B.分别向等质量的锌、铁中滴加等质量分数的稀硫酸 C.氧气在不同温度下的溶解度随压强的变化关系 D.往AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
A.A B.B C.C D.D
2.溶液在生产、生活中应用广泛。下列有关溶液的说法不正确的是
A.1g生石灰加入99g水中,溶质质量分数一定为1%
B.溶液一定是均一的、稳定的混合物
C.气体、液体、固体均可作为溶质
D.氯化钠溶于水是钠离子和氯离子在水分子作用下均匀扩散到水中的过程
3.观察和实验是学习科学的重要方式,下列实验中观察到的颜色正确的是
A.铁锈放入稀盐酸中溶液变黄色
B.酚酞试液滴入硫酸溶液中变红色
C.硫在氧气中燃烧发出微弱的淡蓝色火焰
D.铁钉放在稀硫酸中,溶液变蓝色
4.下列归类正确的是
选项 归类 举例
A 构成物质的基本微粒 分子、原子、离子、元素
B 常见的碱 烧碱、熟石灰、纯碱
C 常见干燥剂 生石灰、烧碱、熟石灰
D 大气污染物 二氧化硫、二氧化氮、粉尘
A.A B.B C.C D.D
5.一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+ B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
6.某钠盐溶液中含有Cl﹣、OH﹣、CO32﹣三种阴离子,仅用一份样品溶液,利用下面的试剂与操作就可将溶液中的三种阴离子依次检验出来,正确的实验操作顺序是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液。
A.①②④②③ B.④②①②③ C.③②①②④ D.④②③②①
7.农业生产离不开化肥和农药。下列有关化肥和农药的说法不正确的是( )
A.铵态氮肥不能与草木灰等碱性物质混合使用,会降低肥效
B.合理使用化肥提高农作物产量,缓解了粮食危机
C.某植物叶片发黄,应补充磷肥
D.为减小污染,应根据作物、虫害和农药的特性按规定合理实施农药
8.“保护环境,功在当代,利在千秋”。下列相关做法错误的是
A.寻找新能源,减少使用化石燃料 B.研发新技术,综合利用作物秸秆
C.改造下水道,实现雨水、污水分流 D.农业生产中,禁止使用化肥、农药
9.俗话说,“庄稼一枝花,全靠肥当家”。下列肥料属于钾肥的是
A. B. C. D.
10.下列物质的性质和用途表述没有直接联系的是
选项 性质 用途
A 活性炭有吸附性 脱色制白糖
B 小苏打能与盐酸反应 治疗胃酸过多
C 碳酸氢铵受热易分解 作化肥
D 氢气具有可燃性 做火箭的燃料
A.A B.B C.C D.D
11.下列选项中物质的名称、俗名、化学式和类别完全一致的是
选项 名称 俗名 化学式 类别
A 氧化钙 熟石灰 CaO 氧化物
B 氯化钠 盐 NaCl 盐类
C 过氧化氢 双氧水 H2O2 水
D 氢氧化钙 消石灰 Ca(OH)2 碱
A.A B.B C.C D.D
二、填空题
12.酸、盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)叠氮酸(HN3)常温下是一种无色液体,其水溶液具有酸性,可与NaOH溶液反应得到叠氮化钠(NaN3)。某些汽车安全气囊中装有叠氮化钠。
①叠氮酸在水溶液中解离出H+和_____(填化学符号)。
②叠氮酸与NaOH溶液的反应属于_____(填基本反应类型)。
③叠氮化钠受热分解时产生两种单质,该反应的化学方程式为_____。
(2)盐酸是一种重要的酸,用于制药、除锈等。
①盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式_____。
②利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图。当滴入溶液为V2mL时,形成溶液中所含溶质化学式为_____,所得溶液能使紫色石蕊溶液变成_____色。
(3)家庭加工馒头、面包等食品时,常在面粉中加入膨松剂(如图),蒸制或烘焙食品时膨松剂会产生大量气体,使面团疏松、多孔,制作的食品松软或酥脆,易于消化吸收。
①信息中提供的膨松剂是_____(填化学式);
②信息中的膨松剂能使蒸制或烘焙的食品疏松多孔,原理是_____(用化学方程式解释)。
13.从、、、、、、给定化合价的六种元素中,选择适当的元素,按下列要求组成物质(填写化学式)。
(1)单质___________;
(2)氧化物___________、___________;
(3)酸___________
(4)金属元素和非金属元素组成的化合物___________。
14.化学实验小组三位同学在完成稀盐酸与氢氧化钠反应后,从三个不同角度对其进行描述。图A是实际操作图,图B是反应过程中溶液的酸碱度变化曲线,图C是微观粒子结合过程的图示。根据要求回答下列问题:
(1)该变化对应的实验操作是将_____滴加到_____中;
(2)当滴入溶液的质量为ag时,溶液中溶质为_____(填化学式);
(3)b点溶液中主要的离子是_____(填离子符号);
(4)图C表示二者恰好完全反应的微观图示, 中应分别填写的粒子符号为____、____。
三、简答题
15.下图是实验室制取气体的常用装置。
(1)实验室用石灰石与盐酸制取CO2,反应的化学方程式为______;制得的二氧化碳中常混有少量的氯化氢气体和水蒸气,若要制取一瓶较为纯净、干燥的CO2,所选用图1装置的导管接口从左到右的正确连接顺序为:______接______、______接______、______接______。
(2)若将B装置中的长颈漏斗换为分液漏斗(如图2),其优点是什么?
16.用化学方法鉴别氯化铵和氯化钠,选用的试剂是_______;用化学方法除去盐酸中的少量硫酸,选用的试剂是_______;用向上排空气法收集CO2气体,验满方法是_______。
四、实验题
17.为验证水的组成元素及探究水在电极端所发生的变化,兴趣小组用如图1所示装置(夹持仪器省略)进行实验:
Ⅰ.验证水的组成元素
步骤一:向长颈漏斗中加水(含少量Na2SO4)至充满管a和管b.关闭活塞,接通电源,一段时间后关闭电源。
步骤二:检验管中气体。
(1)Na2SO4在水中能解离出______,增强了水的导电性。
(2)电解时观察到的现象有:______。
(3)用燃着的木条分别置于玻璃管尖嘴口,打开活塞,若观察到____,则证明气体为H2;若观察到______,则证明气体为O2。
(4)某同学提出实验后还需检验Na2SO4的质量是否发生变化,其原因是______。
(5)若要确定水中氢、氧元素的原子个数比,需要测定_____。
Ⅱ.探究水在电极端所发生的变化
步骤一:向装置中重新加水(含少量Na2SO4)至充满管a和管b,保持活塞打开,接通电源,一段时间后关闭电源。
步骤二:分别取出管a和管b电极附近的溶液,并测定溶液的pH。
(1)测定溶液pH的方法是:用玻璃棒蘸取溶液,滴到pH试纸上,把试纸显示的颜色与______,读取pH。经测定:管a中溶液pH小于7,管b中溶液液pH大于7。
(2)管b溶液呈_______性,若向溶液中加入______,溶液变为红色,也能得出此结论。
(3)图2中能表示电解时管a中水在电极端所发生变化的结果的是______(填对应选项的字母)。
五、计算题
18.将50gCaCl2溶液与77gNa2CO3溶液混合后,恰好完全反应,过滤 洗涤 烘干后,得到 10g白色固体 请计算:
(1)Na2CO3属于那一类物质_____(填“酸”、“碱”、“盐”、“氧化物”)
(2)过滤后所得溶液中溶质的质量分数(质量分数保留到小数点后一位)
参考答案:
1.B 2.A 3.A 4.D 5.B 6.B 7.C 8.D 9.A 10.C 11.D
12.(1) N 复分解反应 2NaN3 2Na+3N2↑
(2) Fe2O3+6HCl=2FeCl3+3H2O NaCl、HCl 红
(3) NaHCO3 2NaHCO3Na2CO3+H2O+CO2↑
13.(1)Cu
(2) CaO H2O
(3)HCl
(4)CaO
14.(1) 稀盐酸 氢氧化钠
(2)NaCl、NaOH
(3)Na+、Cl-
(4) H2O Na+
15.(1) b f e c d g
(2)可以控制反应速率
16. 氢氧化钠(或氢氧化钾、氢氧化钙等碱类物质) 氯化钡溶液/ 将燃着的木条置于集气瓶口,若熄灭,则已满
17. Na+、SO42﹣ 连接电源两极的电极上有气泡产生,且管a与管b产生气体体积比为1:2 气体燃烧产生淡蓝色火焰 木条燃烧更旺盛 排除硫酸钠反应产生气体的可能 管a与管b产生气体的体积以及该温度下氢气和氧气的密度 标准比色卡对照 碱 无色酚酞 C
18.(1)盐
(2)设反应生成的氯化钠的质量为x
故过滤后所得溶液的溶质质量分数为
答:过滤后所得溶液的溶质质量分数为10%
一、单选题
1.下列图象能正确反映对应变化关系的是
A.镁条在盛有氧气的密闭容器中燃烧 B.分别向等质量的锌、铁中滴加等质量分数的稀硫酸 C.氧气在不同温度下的溶解度随压强的变化关系 D.往AgNO3和Cu(NO3)2的混合溶液中加入锌粉至过量
A.A B.B C.C D.D
2.溶液在生产、生活中应用广泛。下列有关溶液的说法不正确的是
A.1g生石灰加入99g水中,溶质质量分数一定为1%
B.溶液一定是均一的、稳定的混合物
C.气体、液体、固体均可作为溶质
D.氯化钠溶于水是钠离子和氯离子在水分子作用下均匀扩散到水中的过程
3.观察和实验是学习科学的重要方式,下列实验中观察到的颜色正确的是
A.铁锈放入稀盐酸中溶液变黄色
B.酚酞试液滴入硫酸溶液中变红色
C.硫在氧气中燃烧发出微弱的淡蓝色火焰
D.铁钉放在稀硫酸中,溶液变蓝色
4.下列归类正确的是
选项 归类 举例
A 构成物质的基本微粒 分子、原子、离子、元素
B 常见的碱 烧碱、熟石灰、纯碱
C 常见干燥剂 生石灰、烧碱、熟石灰
D 大气污染物 二氧化硫、二氧化氮、粉尘
A.A B.B C.C D.D
5.一包固体粉末可能含有NaNO3、CaCO3、NaOH、CuCl2、NaCl和Ca(NO3)2中的一种或几种,为确定其组成,某同学设计了如下实验方案:
下列判断正确的是( )
A.蓝色溶液B中阳离子只有Cu2+ B.无色溶液A中一定有NaOH
C.原固体粉末一定有NaCl D.原固体粉末一定有CaCO3、NaOH、NaNO3、CuCl2和Ca(NO3)2
6.某钠盐溶液中含有Cl﹣、OH﹣、CO32﹣三种阴离子,仅用一份样品溶液,利用下面的试剂与操作就可将溶液中的三种阴离子依次检验出来,正确的实验操作顺序是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液。
A.①②④②③ B.④②①②③ C.③②①②④ D.④②③②①
7.农业生产离不开化肥和农药。下列有关化肥和农药的说法不正确的是( )
A.铵态氮肥不能与草木灰等碱性物质混合使用,会降低肥效
B.合理使用化肥提高农作物产量,缓解了粮食危机
C.某植物叶片发黄,应补充磷肥
D.为减小污染,应根据作物、虫害和农药的特性按规定合理实施农药
8.“保护环境,功在当代,利在千秋”。下列相关做法错误的是
A.寻找新能源,减少使用化石燃料 B.研发新技术,综合利用作物秸秆
C.改造下水道,实现雨水、污水分流 D.农业生产中,禁止使用化肥、农药
9.俗话说,“庄稼一枝花,全靠肥当家”。下列肥料属于钾肥的是
A. B. C. D.
10.下列物质的性质和用途表述没有直接联系的是
选项 性质 用途
A 活性炭有吸附性 脱色制白糖
B 小苏打能与盐酸反应 治疗胃酸过多
C 碳酸氢铵受热易分解 作化肥
D 氢气具有可燃性 做火箭的燃料
A.A B.B C.C D.D
11.下列选项中物质的名称、俗名、化学式和类别完全一致的是
选项 名称 俗名 化学式 类别
A 氧化钙 熟石灰 CaO 氧化物
B 氯化钠 盐 NaCl 盐类
C 过氧化氢 双氧水 H2O2 水
D 氢氧化钙 消石灰 Ca(OH)2 碱
A.A B.B C.C D.D
二、填空题
12.酸、盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)叠氮酸(HN3)常温下是一种无色液体,其水溶液具有酸性,可与NaOH溶液反应得到叠氮化钠(NaN3)。某些汽车安全气囊中装有叠氮化钠。
①叠氮酸在水溶液中解离出H+和_____(填化学符号)。
②叠氮酸与NaOH溶液的反应属于_____(填基本反应类型)。
③叠氮化钠受热分解时产生两种单质,该反应的化学方程式为_____。
(2)盐酸是一种重要的酸,用于制药、除锈等。
①盐酸可用于金属表面除锈,请写出盐酸除铁锈的化学方程式_____。
②利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图。当滴入溶液为V2mL时,形成溶液中所含溶质化学式为_____,所得溶液能使紫色石蕊溶液变成_____色。
(3)家庭加工馒头、面包等食品时,常在面粉中加入膨松剂(如图),蒸制或烘焙食品时膨松剂会产生大量气体,使面团疏松、多孔,制作的食品松软或酥脆,易于消化吸收。
①信息中提供的膨松剂是_____(填化学式);
②信息中的膨松剂能使蒸制或烘焙的食品疏松多孔,原理是_____(用化学方程式解释)。
13.从、、、、、、给定化合价的六种元素中,选择适当的元素,按下列要求组成物质(填写化学式)。
(1)单质___________;
(2)氧化物___________、___________;
(3)酸___________
(4)金属元素和非金属元素组成的化合物___________。
14.化学实验小组三位同学在完成稀盐酸与氢氧化钠反应后,从三个不同角度对其进行描述。图A是实际操作图,图B是反应过程中溶液的酸碱度变化曲线,图C是微观粒子结合过程的图示。根据要求回答下列问题:
(1)该变化对应的实验操作是将_____滴加到_____中;
(2)当滴入溶液的质量为ag时,溶液中溶质为_____(填化学式);
(3)b点溶液中主要的离子是_____(填离子符号);
(4)图C表示二者恰好完全反应的微观图示, 中应分别填写的粒子符号为____、____。
三、简答题
15.下图是实验室制取气体的常用装置。
(1)实验室用石灰石与盐酸制取CO2,反应的化学方程式为______;制得的二氧化碳中常混有少量的氯化氢气体和水蒸气,若要制取一瓶较为纯净、干燥的CO2,所选用图1装置的导管接口从左到右的正确连接顺序为:______接______、______接______、______接______。
(2)若将B装置中的长颈漏斗换为分液漏斗(如图2),其优点是什么?
16.用化学方法鉴别氯化铵和氯化钠,选用的试剂是_______;用化学方法除去盐酸中的少量硫酸,选用的试剂是_______;用向上排空气法收集CO2气体,验满方法是_______。
四、实验题
17.为验证水的组成元素及探究水在电极端所发生的变化,兴趣小组用如图1所示装置(夹持仪器省略)进行实验:
Ⅰ.验证水的组成元素
步骤一:向长颈漏斗中加水(含少量Na2SO4)至充满管a和管b.关闭活塞,接通电源,一段时间后关闭电源。
步骤二:检验管中气体。
(1)Na2SO4在水中能解离出______,增强了水的导电性。
(2)电解时观察到的现象有:______。
(3)用燃着的木条分别置于玻璃管尖嘴口,打开活塞,若观察到____,则证明气体为H2;若观察到______,则证明气体为O2。
(4)某同学提出实验后还需检验Na2SO4的质量是否发生变化,其原因是______。
(5)若要确定水中氢、氧元素的原子个数比,需要测定_____。
Ⅱ.探究水在电极端所发生的变化
步骤一:向装置中重新加水(含少量Na2SO4)至充满管a和管b,保持活塞打开,接通电源,一段时间后关闭电源。
步骤二:分别取出管a和管b电极附近的溶液,并测定溶液的pH。
(1)测定溶液pH的方法是:用玻璃棒蘸取溶液,滴到pH试纸上,把试纸显示的颜色与______,读取pH。经测定:管a中溶液pH小于7,管b中溶液液pH大于7。
(2)管b溶液呈_______性,若向溶液中加入______,溶液变为红色,也能得出此结论。
(3)图2中能表示电解时管a中水在电极端所发生变化的结果的是______(填对应选项的字母)。
五、计算题
18.将50gCaCl2溶液与77gNa2CO3溶液混合后,恰好完全反应,过滤 洗涤 烘干后,得到 10g白色固体 请计算:
(1)Na2CO3属于那一类物质_____(填“酸”、“碱”、“盐”、“氧化物”)
(2)过滤后所得溶液中溶质的质量分数(质量分数保留到小数点后一位)
参考答案:
1.B 2.A 3.A 4.D 5.B 6.B 7.C 8.D 9.A 10.C 11.D
12.(1) N 复分解反应 2NaN3 2Na+3N2↑
(2) Fe2O3+6HCl=2FeCl3+3H2O NaCl、HCl 红
(3) NaHCO3 2NaHCO3Na2CO3+H2O+CO2↑
13.(1)Cu
(2) CaO H2O
(3)HCl
(4)CaO
14.(1) 稀盐酸 氢氧化钠
(2)NaCl、NaOH
(3)Na+、Cl-
(4) H2O Na+
15.(1) b f e c d g
(2)可以控制反应速率
16. 氢氧化钠(或氢氧化钾、氢氧化钙等碱类物质) 氯化钡溶液/ 将燃着的木条置于集气瓶口,若熄灭,则已满
17. Na+、SO42﹣ 连接电源两极的电极上有气泡产生,且管a与管b产生气体体积比为1:2 气体燃烧产生淡蓝色火焰 木条燃烧更旺盛 排除硫酸钠反应产生气体的可能 管a与管b产生气体的体积以及该温度下氢气和氧气的密度 标准比色卡对照 碱 无色酚酞 C
18.(1)盐
(2)设反应生成的氯化钠的质量为x
故过滤后所得溶液的溶质质量分数为
答:过滤后所得溶液的溶质质量分数为10%
