第二章 分子结构与性质 测试题(含解析) 2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章 分子结构与性质 测试题(含解析) 2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 740.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-06 14:52:08 | ||
图片预览




文档简介
第二章 分子结构与性质 测试题
一、单选题(共15题)
1.下列叙述中,排列顺序正确的是:
①氧化性:KMnO4>MnO2>Cl2 ②单质的密度:NaS2->F- ④物质的熔点:Li>Na>K ⑤氢化物的沸点:H2Se>H2S>H2O
A.①③ B.②④ C.①④ D.③⑤
2.向CuSO4溶液中通入H2S,会生成CuS沉淀,反应为CuSO4+H2S=CuS↓+H2SO4。下列有关说法正确的是
A.SO的空间构型为三角锥形 B.H2S属于电解质
C.Cu在周期表中位于d区 D.S2-的结构示意图为
3.法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法错误的是
A.该分子中所含元素中电负性最小的是H
B.该分子中C﹣F键的键能大于C﹣N键的键能
C.该分子中所有C原子都为sp2杂化
D.该分子中σ键与π键数目之比为7:2
4.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,双氧水、75%乙醇、含氯消毒剂、氯仿()等均可有效灭活病毒。下列说错误的是
A.HClO的电子式
B.是共价化合物
C.NaClO是含有共价键的离子化合物
D.分子所有原子均满足稳定结构
5.已知W、X、Y、Z均为短周期主族元素,W与X同周期且相邻,W与Y同主族,W、X与Y的原子序数之和为31, Z与其他三种元素既不同周期、也不同主族。下列说法中,正确的是
A.原子半径大小顺序为ZB.四种元素中,X元素的非金属性最强
C.常温常压下,四种元素各自形成的单质均为气体
D.W、X、Z三种元素可形成化学式为Z4X2W3型的离子化合物
6.短周期元素X、Y、Z、W原子序数依次增大。X的质子数与电子层数相同,Y、Z同周期且相邻,Z的最外层电子数是其内层电子数的3倍,元素W在地壳中的含量仅次于氧。下列说法正确的是
A.原子半径:r(W)>r(Y)>r(Z)>r(X)
B.X、Y、Z三种元素形成的化合物中只有共价键
C.最高价氧化物对应水化物的酸性:W>Y
D.气态简单氢化物的热稳定性:Y>Z
7.用价层电子对互斥理论预测H2Se和NF3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B.V形;平面三角形
C.直线形;平面三角形 D.V形;三角锥形
8.氨气溶于水中,大部分与以氢键结合形成。根据氨水的性质可推知的结构式为(易错)
A. B. C.D.
9.下列对分子性质的解释中,不正确的是
A.F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
B.乳酸()分子中含有2个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.氨气极易溶于水、邻羟基苯甲醛的沸点低于对羟基苯甲醛都能用氢键来解释
10.CO2和甲醇在Ru-Rh(釨铑)基催化剂表面加氢可以制取乙酸,其反应机理如图所示。下列说法错误的是
A.LiI也是该反应的催化剂
B.反应①是取代反应
C.反应④中有非极性键的断裂和极性键的形成
D.根据该反应机理,可以由制备CH3CH2CH2COOH
11.下列说法中正确的是( )
A.分子的结构是由键角决定的
B.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
C.CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等
D.H2O分子中两个O—H键的键角为180°
12.某有机超强碱结构如图所示。下列说法错误的是
A.该有机物存在对映异构
B.该有机物核磁共振氢谱有12组峰
C.该有机物中C和N均有sp3和sp2两种杂化方式
D.该有机物中C、N、O三种元素形成的最简单氢化物分子的键角依次减小
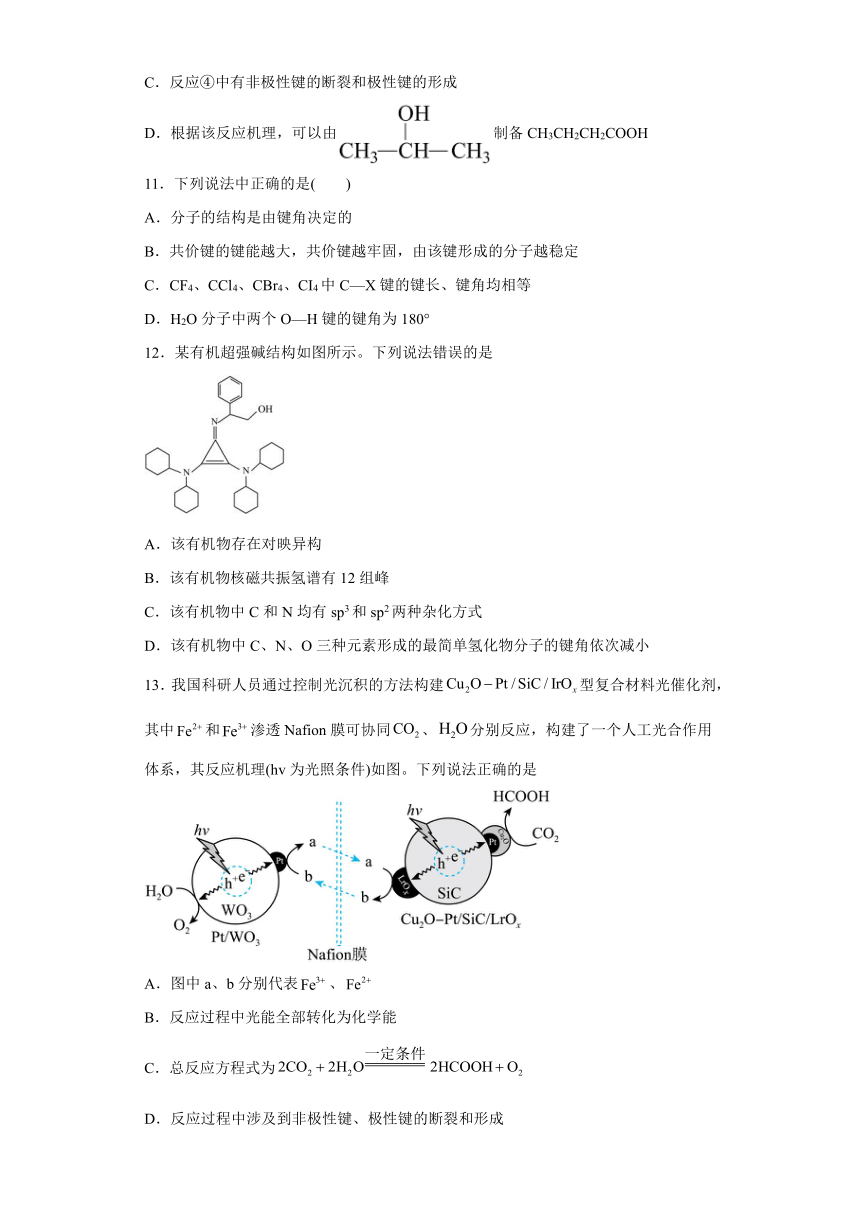
13.我国科研人员通过控制光沉积的方法构建型复合材料光催化剂,其中和渗透Nafion膜可协同、分别反应,构建了一个人工光合作用体系,其反应机理(hv为光照条件)如图。下列说法正确的是
A.图中a、b分别代表、
B.反应过程中光能全部转化为化学能
C.总反应方程式为
D.反应过程中涉及到非极性键、极性键的断裂和形成
14.下列有关O、S及其化合物的说法错误的是
A.的成键电子对间排斥力较大,可以推断的键角比的大
B.分子间存在氢键,可以推断的熔点比的高
C.O的电负性比S大,可以推断的酸性比强
D.的分子间作用力较小,可以推断的熔点比的低
15.汽车尾气中通常含有CO、NOx等气体,为减轻污染,现在的汽车加装了三元催化转换器,此转换器可将汽车尾气中的有毒气体转化为无污染的气体,下图为该转换器中发生反应的微观示意图(未配平),其中不同颜色的球代表不同原子。下列说法不正确的是
A.可用饱和Na2CO3溶液除去丙中混有的HCl
B.乙和丁互为等电子体
C.甲与丙的空间构型不相同
D.丙、丁分子中各原子最外电子层均达到8电子稳定结构
二、填空题(共8题)
16.纳米级是一种光催化材料,可用于处理甲醛、氮氧化物等污染物,工业上也可用其催化乙醇脱氢制备乙醛:。
(1)Ti原子基态核外电子排布式为_________。
(2)分子中含有键的数目为_________。
17.原子序数小于36的X、Y、Z、W、Q五种元素,X原子核外电子运动状态是所有原子中最少的,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W是第三周期中电负性最大的元素,Q的原子序数为33。回答下列问题:
(1)链状化合物Y3X6分子中σ键与π键的数目比为________。
(2)ZX3极易溶于水而YX4难溶于水的主要原因是________________________________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,这两种氧化物的分子式分别是________。
(4)W与Q能形成两种分子,其中属于非极性分子的是________,另一种分子的空间构型是________。
(5)W可以分别与Z、Q形成原子个数比为1∶3的两种化合物,则这种化合物沸点的相对高低为________。
18.(1)在物质CO2、P2O5、CaO、SO2中,有一种物质在某些化学性质或分类上与其他几种物质不同,这种物质是__。
(2)气态氢化物热稳定性HF大于HCl的主要原因是__。
(3)常温下,一体积的水可以溶解700体积的氨气,原因是_。
(4)根据现有元素周期律推算,Mc位于元素周期表的第__周期第__族。
(5)已知2K2S+K2SO3+3H2SO4=3K2SO4+3S↓+3H2O,若氧化产物比还原产物多8.0g,则转移电子的数目为__。
(6)以物质的类别为横坐标,化合价为纵坐标绘制的图象叫价类图。如图是铁的价类图,写出Y在潮湿的空气中转化为图中同类别物质的化学方程式__。
(7)铝制品表面有致密的氧化物薄膜。将一小块铝制品废弃物放入足量的浓NaOH溶液后所发生的氧化还原反应的离子方程式为__。
19.A、B、C、D是元素周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化。请回答下列问题。
(1)A、B、C的第一电离能由小到大的顺序为____________________(用元素符号表示)。
(2)M是含有__________键(填“极性”或“非极性”)的__________分子(填“极性”或“非极性”)。
(3)N是一种易液化的气体,请简述其易液化的原因: __________________________。
(4)W分子的VSEPR模型的空间构型为________,W分子的空间构型为________。
(5)AB-离子中和B2分子的π键数目比为____________。
20.有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),原因是_______________。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。
21.(1)酸性强弱比较:苯酚___________碳酸(填“>”、“=”或“<”),原因(用相应的离子方程式表示):___________。
(2)沸点:H2O___________H2S(填“>”、“=”或“<”),原因___________。
(3)实验室欲测定Na2CO3和NaCl混合物中Na2CO3的质量分数ω(Na2CO3),实验步骤如下:称取此固体样品4.350g,溶于适量的水中,配成50mL溶液。取出25mL溶液,加入足量的AgNO3溶液充分反应,得到沉淀的质量为5.575g.则原混合物中ω(Na2CO3)=___________(保留4位有效数字)。写出简要的计算过程。
22.现有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知B元素是地壳中含量最高的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。
回答下列问题:
(1)用电子式表示C和E形成化合物的过程:______。
(2)写出基态F原子的核外电子排布式:______。
(3)A2D的电子式为______,其分子中______(填“含”或“不含”,下同)键,______π键。
(4)A、B、C共同形成的化合物中化学键的类型有______。
23.是制备铁催化剂的主要原料,某化学小组利用莫尔盐制备的实验流程如下:
已知:氧化操作中除生成外,另一部分铁元素转化为红褐色沉淀。
(1)的空间构型为___________。
(2)“酸溶”时,莫尔盐___________(填“能”或“不能”)用的溶解,原因是___________。
(3)第一次“煮沸”时,生成的离子方程式为___________。
(4)“氧化”时所用的实验装置如图所示(夹持装置略去),导管a的作用是___________;“氧化”时反应液应保持温度在40℃左右,则适宜的加热方式为___________(填“直接加热”或“水浴加热”)。
(5)测定产品中铁的含量。
步骤ⅰ:称量mg样品,加水溶解,加入稀硫酸,再滴入的溶液使其恰好反应完全。
步骤ⅱ:向步骤ⅰ所得的溶液中加入过量Cu粉,反应完全后,滤去不溶物,向溶液中滴入酸化的的溶液,滴定至终点,消耗溶液。
①步骤ⅰ中,若加入的溶液过量,则所测的铁元素的含量___________(填“偏大”、“偏小”或“不变”,下同),若步骤ⅱ中不滤去不溶物,则所测的铁元素的含量___________。
②该样品中铁元素的质量分数为___________(用含m、y、z的代数式表示)。
参考答案:
1.C
【解析】①由氧化剂的氧化性大于氧化产物的氧化性,高锰酸钾分解生成二氧化锰,故氧化性:KMnO4>MnO2,二氧化锰与浓盐酸反应生成氯气,故氧化性:MnO2>Cl2,氧化性:KMnO4>MnO2>Cl2,故正确;
②碱金属元素从上到下,金属的密度呈增大趋势,钾反常,所以单质的密度:K<Na<Rb,故错误;
③核外电子排布相同的离子,核电荷数越大,离子半径越小,离子的核外电子层数越多,离子半径越大,应为S2->K+>F-,故错误;
④碱金属元素从上到下,金属的熔点逐渐降低,应为Li>Na>K,故正确;
⑤水中存在氢键,沸点最高,H2Se和H2S结构相似,分子间只存在范德华力,相对分子质量越大,沸点越高,故正确顺序为H2O>H2Se>H2S,故错误;
故选C。
【点睛】本题涉及氧化性的比较、离子半径的比较以及金属的性质等知识。注意把握元素周期律的递变规律。本题的易错点为碱金属的密度,要注意钾反常。
2.B
【解析】A.SO中S成4个键,价层电子对为4,采取sp3杂化,空间构型为四面体形,故A错误;
B.在水溶液或熔融态能导电的化合物属于电解质,H2S的水溶液可以导电,属于电解质,故B正确;
C.Cu的价电子排布为3d104s1,在周期表中位于ds区,故C错误;
D.S2-核外有18个电子,S2-的结构示意图为,故D错误;
故答案为B。
3.D
【解析】A.非金属性越强,电负性越大,C、N、O、F、H电负性由大到小为F>O>N>C>H,故A正确;
B.键长越短,键能越大,该分子中C﹣F键的键能大于C﹣N键的键能,故B正确;
C.含有N=C、C=O、C=C键的C原子中均形成3个σ犍,为sp2杂化,故所有C原子都为sp2杂化,故C正确;
D.单键均为σ键,双键是一个σ键和1个π键,该分子中含有σ键15个,π键数目为4个,σ键与π键数目之比为15:4,故D错误;
故选D。
4.D
【解析】A.HClO为共价化合物,分子中H最外层1个电子,Cl最外层7个电子,O最外层6个电子,O与Cl、H分别形成一个共价键,电子式为,故A正确;
B.绝大多数有机物都是共价化合物,是有机物,属于共价化合物,故B正确;
C.由活泼金属离子与酸根离子形成的化合物是离子化合物,NaClO是离子化合物,一定含有离子键,次氯酸根离子中含有共价键,故C正确;
D.分子含有氢原子,不满足稳定结构,故D错误;
答案选D。
5.D
【解析】略
6.A
短周期元素X、Y、Z、W原子序数依次增大,X的质子数与电子层数相同,故X为H元素,Y、Z同周期且相邻,Z的最外层电子数是其内层电子数的3倍,则Z为O元素,Y为N元素,元素W在地壳中的含量仅次于氧,则W为Al元素。
【解析】A.四种元素中Al的电子层数为3,O、N电子层数为2且核电荷数O>N,H元素电子层数为1,故半径大小为r(Al)>r(N)>r(O)>r(H),故A项正确;
B.X、Y、Z三种元素形成的化合物可以是HNO3或NH4NO3,HNO3为共价化合物,NH4NO3为离子化合物,故B项错误;
C.Al的最高价氧化物对应水化物为Al(OH)3,属于两性氢氧化物,N的最高价氧化物对应水化物为HNO3,为强酸,故最高价氧化物对应水化物的酸性HNO3> Al(OH)3,C项错误;
D.O的非金属性大于N,故气态简单氢化物的热稳定性:H2O>NH3,D项错误;
本题选A。
7.D
【解析】H2Se中Se的孤电子对数为×(6-2×1)=2,σ键电子对数为2,Se的价层电子对数为4,VSEPR模型为四面体型,去掉孤电子对,H2Se的立体构型为V形;NF3中N的孤电子对数为×(5-3×1)=1,σ键电子对数为3,N的价层电子对数为4,VSEPR模型为四面体型,去掉孤电子对, NF3的立体构型为三角锥形;答案选D。
【点睛】易错点是不能熟练判断中心原子的价层电子对数。分子的中心原子价层电子对数=σ键个数+孤电子对数,如果价层电子对数是4且不含孤电子对,则为正四面体结构,如果价层电子对数是4且含有一个孤电子对,则为三角锥形结构,如果价电子对数是4且含有2个孤电子对,则为V形。
8.B
【解析】①从氢键的形成原理上讲,A、B都成立;②但从空间构型上讲,由于氨分子是三角锥形,易于提供孤对电子,所以以B方式结合空间阻碍最小,结构最稳定;③从氨水的性质讲,依据,只有B成立;
故答案选B。
9.B
【解析】A.F2、Cl2、Br2、I2是组成和结构相似的分子,熔点随相对分子质量增大而升高,故A正确;
B.中间碳原子上连有四个不一样的基团:氢原子、甲基、羧基和羟基,是手性碳原子,只有1个,故B错误;
C.碘、四氯化碳、甲烷都为非极性分子,水为极性分子,分子极性相似的分子易溶,故C正确;
D.氨气分子和水分子之间能形成氢键,所以氨气极易溶于水,邻羟基苯甲醛分子内存在氢键,而对羟基苯甲醛分子间存在氢键,所以邻羟基苯甲醛的沸点低于对羟基苯甲醛,故D正确;
故选:B。
10.D
【解析】A.LiI在反应①中作反应物、反应⑤作生成物,所以LiI是该反应是催化剂,A正确;
B.根据图示可知:反应①是CH3OH+LiI→LiOH+CH3I,因此反应①属于取代反应,B正确;
C.反应④中Rh*-I键、O- Rh*键的断裂、有H- H键的断裂和O-H键、H- I键的形成,有非极性键的断裂和极性键的生成,C正确;
D.运用该反应机理可由异丙醇制备异丁酸,而不是正丁酸CH3CH2CH2COOH,D错误;
故合理选项是D。
11.B
【解析】A.分子的结构是由键角和键长决定的,A错误;
B.共价键的键能越大,断裂时需要的能量越大,共价键越牢固,由该键形成的分子越稳定,B正确;
C.四种化合物中C-X键的键长依次增大,键角相等,C错误 ;
D.H2O分子中两个O—H键的键角为105°,D错误;
正确答案B。
12.B
【解析】A. 连接4个不同基团的C为手性碳,只有与苯环直接相连的C具有手性,该有机物存在对映异构,故A正确;
B. 由结构可知含四个环己烷基相同,共含10种H,核磁共振氢谱有10组峰,故B错误;
C. 苯环上C、双键上N为sp2杂化,亚甲基、次甲基及与环己烷基相连的N均为sp3杂化,该有机物中C和N均有sp3和sp2两种杂化方式,故C正确;
D. 该有机物中C、N、O三种元素形成的最简单氢化物分子的中心原子均为sp3杂化,三种氢化物的VSEPR模型均为四面体形,水分子中含有2对孤对电子,氨气分子含有1对孤对电子,甲烷分子没有孤对电子,孤对电子之间排斥作用>孤对电子与成键电子对之间排斥>成键电子对之间排斥,键角:CH4>NH3>H2O,键角依次减小,故D正确;
故选B。
13.C
【解析】A.观察图中物质转化关系可知,b代表,用于氧化生成,a代表,用于还原生成HCOOH,A项错误;
B.反应过程中能量的转化形式是光能转化为化学能,但不是全部转化,B项错误;
C.由图可知反应物为和,生成物为HCOOH和,C项正确;
D.反应过程中没有非极性键的断裂,D项错误。
答案选C。
14.C
【解析】A.O和S属于同主族,因此与中心原子中所含孤电子对数目均为2,氧原子的半径小于S原子半径,H2O成键电子对间排斥力越大,键角越大,故A说法正确;
B.由于分子间存在氢键,H2S不存在分子间氢键,因此的熔点比的高,故B说法正确;
C.由于原子半径O小于S,的酸性比弱,故C说法错误;
D.由于相对分子质量小于,分子间作用力小于,因此 的熔点比的低,故D说法正确;
答案为C。
15.A
【解析】根据微观示意图可知,甲为NO2,乙为CO,丙为CO2,丁为N2,
A. CO2也能与Na2CO3溶液反应,则不能用饱和Na2CO3溶液除去CO2中混有的HCl,应用饱和NaHCO3溶液,A错误;
B. 乙和丁的原子总数和价电子总数相同,故二者互为等电子体,B正确;
C. NO2的空间构型为V形,CO2的空间构型为直线形,C正确;
D. CO2的电子式为,N2的电子式为,分子中各原子最外电子层均达到8电子稳定结构,D正确;
答案选A。
16.(1)
(2)
【解析】(1)
是22号元素,所以Ti原子基态核外电子排布式为。
(2)
单键全部为键,双键有1个键,根据乙醛的结构式可知分子中含有键的数目为。
17. 8∶1 NH3和H2O均是极性分子,二者相似相溶,且二者分子间可形成氢键,故NH3极易溶于水;CH4是非极性分子,不易溶于极性溶剂水 CO2、N2O AsCl5 三角锥形 AsCl3>NCl3
【解析】X原子核外电子运动状态是所有原子中最少的,X是H。Y原子基态时最外层电子数是其内层电子数的2倍,因此Y是C。Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N。W是第三周期中电负性最大的元素,W是Cl,Q的原子序数为33,Q是As。(3)C3H6是丙烯,分子中有8个σ键,1个π键,即σ键与π键的数目比为8∶1。(2)NH3和H2O均是极性分子,二者相似相溶,且二者分子间可形成氢键,故NH3极易溶于水;CH4是非极性分子,在极性分子H2O中的溶解性较小。(3)原子数和价电子数分别都相等的互为等电子体,则CO2与N2O是等电子体。(4)As和Cl可形成AsCl3和AsCl5两种分子,其中AsCl3是三角锥形极性分子,AsCl5是三角双锥非极性分子。(5)AsCl3与NCl3形成的晶体均是分子晶体,由于AsCl3比NCl3的相对分子质量大,故AsCl3的熔沸点较高。
18. CaO F的非金属性比Cl强 氨分子和水分子间可以形成氢键 七 Ⅴ NA 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 2Al + 2H2O + 2OH- = 2 + 3H2↑
【解析】(1)在物质CO2、P2O5、CaO、SO2中,CaO是金属氧化物,在化学性质上与其余非金属氧化物不同。
(2)元素的非金属性越强,其气态氢化物越稳定,气态氢化物热稳定性HF大于HCl的主要原因是F的非金属性比Cl强。
(3)常温下,氨气极易溶于水的主要原因是氨分子和水分子间可以形成氢键,大大增强溶解能力。
(4) Mc的质子数为115,根据现有元素周期律推算,118号元素属于第七周零族,那么115号元素就属于第七周期,ⅤA族。
(5) 在2K2S+K2SO3+3H2SO4=3K2SO4+3S↓+3H2O反应中,硫既是氧化产物,又是还原产物,其物质的量比为2:1,质量比也为2:1,若氧化产物比还原产物多8.0g,即生成硫24g,换算成物质的量为0.75mol,根据化学方程式可知,转移电子物质的量为4 mol,生成3 mol硫,那么生成0.75mol硫,则转移电子为1mol,则转移电子数量为NA。
(6)通过价类图可知,Y是氢氧化亚铁,Y在潮湿的空气中转化为图中同类别物质应该是氢氧化铁,转化的化学方程式为4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。
(7)铝制品表面有致密的氧化物薄膜,其放入足量的浓NaOH溶液后,薄膜被腐蚀,其过程是非氧化还原反应,内部的铝会和氢氧化钠发生氧化还原反应,则其离子方程式为2Al + 2H2O + 2OH- = 2 + 3H2↑。
19.(1)C<O<N
(2) 极性 非极性
(3)NH3易形成分子间氢键
(4) 四面体形 V形
(5)1∶1
A、B、C、D是周期表中前10号元素,它们的原子半径依次减小;D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化,则D是H元素、A是C、B是N、C是O元素,M、N、W分别是CH4、NH3、H2O。
【解析】(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但N原子2p能级半充满,结构稳定,第一电离能大于其相邻元素,所以第一电离能由小到大的顺序为C<O<N;
(2)M是CH4,为正四面体结构,甲烷分子中C-H原子之间存在极性键,甲烷分子正负电荷重心重合,为非极性分子。
(3)N为NH3,氨分子间能形成氢键,分子间作用力大,因而易液化;
(4)W是H2O,H2O分子中O原子价层电子对个数是4,含2个孤电子对,根据价层电子对互斥理论判断其VSEPR模型为正四面体结构、空间构型为V形;
(5)CN-离子与N2互为等电子体,二者结构相似,CN-的电子式为,N2的电子式为,叁键中有1个σ键、2个π键 ,则π键数目比=2:2=1:1。
20.(1)1s22s22p63s23p2
(2)
(3) N O N原子最外层的电子处于半充满状态,比较稳定
(4) 三角锥形 sp3杂化
(5) 2 H2O SiH4
A原子最外层p能级的电子数等于次外层的电子总数,A为C元素;A属于第二周期,A、B、C属于同一周期,B原子最外层中有两个不成对的电子,B为O元素;B元素可与A、C、D、E生成RB2型化合物,则C为N元素;DB2中D与B的质量比为7:8,D的相对原子质量为28,D原子核内质子数与中子数相等,D的质子数为14,D为Si元素;EB2中E与B的质量比为1:1,E的相对原子质量为32,E原子核内质子数与中子数相等,E的质子数为16,E为S元素。
【解析】(1)D为Si元素,基态Si原子核外有14个电子,根据构造原理,基态硅原子的电子排布式为1s22s22p63s23p2;
(2)AB2为CO2,CO2的电子式为,结构式为O=C=O,路易斯结构式为;
(3)B为O元素,C为N元素,O和N两元素中第一电离能:NO,原因是:N原子的价电子排布为2s22p3,N原子最外层的电子处于半充满状态,比较稳定;
(4)C的氢化物为NH3,N上的孤电子对数为(5-31)=1,成键电子对数为3,价层电子对数为4,VSEPR模型为四面体,略去孤电子对,NH3的立体结构为三角锥形。中心原子N的杂化轨道类型为sp3杂化;
(5)C的单质为N2,N2的结构式为NN,三键中含1个σ键和2个π键,N2分子中有2个π键。B为O元素,D为Si元素,非金属性:OSi,B、D两元素的气态氢化物稳定性:H2OSiH4。
21. < C6H5O-+CO2+H2O=C6H5OH+ > 水分子之间存在氢键 73.10%
【解析】(1)我们可利用强酸制弱酸的原理比较酸性强弱,根据苯酚钠与碳酸反应生成苯酚和碳酸氢钠可以判断出酸性:苯酚<碳酸,原因:C6H5O-+CO2+H2O=C6H5OH+。答案为:<;C6H5O-+CO2+H2O=C6H5OH+;
(2)H2O和H2S都形成分子晶体,沸点的高低取决于分子间作用力的大小,若分子间形成氢键,熔沸点会出现反常,水分子间存在氢键,则沸点:H2O>H2S;答案为:>;水分子之间存在氢键;
(3)加入AgNO3后,发生如下反应:NaCl+AgNO3=AgCl↓+NaNO3,Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3
设4.350g样品中含有Na2CO3为xmol,NaCl为ymol,则可得以下等量关系式:
①106x+58.5y=4.350 ;②276x+143.5y=5.575×2;解得x=0.03mol,y=0.02mol;ω(Na2CO3)==73.10%。答案为:73.10%。
【点睛】5.575g是从50mL溶液中取出25mL的那部分与AgNO3溶液反应产生的沉淀质量,计算时需注意与原混合物中的x、y相对应。
22. 1s22s22p63s23p64s1 含 不含 离子键、极性共价键
现有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知B元素是地壳中含量最高的元素,则B是O元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的;则A是H,C是Na,D是S;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个,则E是Cl元素;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族,则F是K元素;然后根据元素周期律及元素、化合物的性质分析解答。
【解析】根据上述分析可知:A是H,B是O,C是Na,D是S,E是Cl,F是K元素。
(1)C是Na,E是Cl,二者形成的化合物NaCl是离子化合物,用电子式表示其形成过程为:;
(2)F是K元素,根据构造原理,可知基态K原子的核外电子排布式是1s22s22p63s23p64s1;
(3)A是H,D是S,S原子最外层有6个电子,与2个H原子的电子形成2个共价键,使分子中每个原子都达到稳定结构,其电子式为:;H2S结构式为:H-S-H,在分子,S、H原子形成的是共价单键,共价单键属于σ键,而不含π键;
(4)A是H,B是O,C是Na,这三种元素形成的化合物是NaOH,为离子化合物,Na+与OH-之间以离子键结合,在阳离子OH-中H、O原子之间以共价键结合,因此NaOH中含有离子键和极性共价键。
23. V形 不能 会与反应生成污染环境的气体(或会消耗更多的等合理答案) 平衡气压,使液体顺利滴下 水浴加热 偏小 偏大
由实验流程可知,用硫酸溶解后,加入草酸溶液煮沸生成,加入H2O2溶液进行氧化将Fe元素转化为+3价,加入饱和草酸钾和草酸溶液煮沸得到溶液,经过一系列操作得到产品
【解析】(1)H2O分子,中心原子的价层电子对数: ,孤电子对数为2,则水的空间构型为:V形;
(2)HNO3具有氧化性,会将Fe2+氧化为Fe3+,不能得到预期产物,故:“酸溶”时,莫尔盐不能用的溶解,原因是:会与反应生成污染环境的气体(或会消耗更多的等合理答案);
(3)H2C2O4与Fe2+反应生成,非氧化还原反应,根据元素守恒,反应的离子方程式为:;
(4)漏斗需要和外界气压平衡,里面的液体才能顺利流下,故作用为:平衡气体,使液体顺利流下;需要保持40℃温度加热,温度较低且要控制温度,所以采用水浴加热;
(5)①步骤ⅰ加入溶液时发生反应的离子方程式为,无色草酸根和有色高锰酸钾氧化还原反应,计算草酸根含量,步骤ii发生的反应为:Cu+2Fe3+=Cu2++2Fe2+,5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,Fe3+氧化Cu得到还原性Fe2+,通过Fe2+和MnO4-反应来计算铁元素的含量,步骤ⅰ中,若加入的溶液过量,使步骤ii中消耗的减少,计算的铁元素偏小;若步骤ⅱ中不滤去不溶物Cu,会和生成的Fe3+继续反应生成Fe2+,使消耗偏多,测得铁元素含量偏大;②根据关系式,可以得出,铁的质量为:0.28xyg,该样品中铁元素的质量分数为
一、单选题(共15题)
1.下列叙述中,排列顺序正确的是:
①氧化性:KMnO4>MnO2>Cl2 ②单质的密度:Na
A.①③ B.②④ C.①④ D.③⑤
2.向CuSO4溶液中通入H2S,会生成CuS沉淀,反应为CuSO4+H2S=CuS↓+H2SO4。下列有关说法正确的是
A.SO的空间构型为三角锥形 B.H2S属于电解质
C.Cu在周期表中位于d区 D.S2-的结构示意图为
3.法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法错误的是
A.该分子中所含元素中电负性最小的是H
B.该分子中C﹣F键的键能大于C﹣N键的键能
C.该分子中所有C原子都为sp2杂化
D.该分子中σ键与π键数目之比为7:2
4.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,双氧水、75%乙醇、含氯消毒剂、氯仿()等均可有效灭活病毒。下列说错误的是
A.HClO的电子式
B.是共价化合物
C.NaClO是含有共价键的离子化合物
D.分子所有原子均满足稳定结构
5.已知W、X、Y、Z均为短周期主族元素,W与X同周期且相邻,W与Y同主族,W、X与Y的原子序数之和为31, Z与其他三种元素既不同周期、也不同主族。下列说法中,正确的是
A.原子半径大小顺序为Z
C.常温常压下,四种元素各自形成的单质均为气体
D.W、X、Z三种元素可形成化学式为Z4X2W3型的离子化合物
6.短周期元素X、Y、Z、W原子序数依次增大。X的质子数与电子层数相同,Y、Z同周期且相邻,Z的最外层电子数是其内层电子数的3倍,元素W在地壳中的含量仅次于氧。下列说法正确的是
A.原子半径:r(W)>r(Y)>r(Z)>r(X)
B.X、Y、Z三种元素形成的化合物中只有共价键
C.最高价氧化物对应水化物的酸性:W>Y
D.气态简单氢化物的热稳定性:Y>Z
7.用价层电子对互斥理论预测H2Se和NF3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B.V形;平面三角形
C.直线形;平面三角形 D.V形;三角锥形
8.氨气溶于水中,大部分与以氢键结合形成。根据氨水的性质可推知的结构式为(易错)
A. B. C.D.
9.下列对分子性质的解释中,不正确的是
A.F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
B.乳酸()分子中含有2个手性碳原子
C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D.氨气极易溶于水、邻羟基苯甲醛的沸点低于对羟基苯甲醛都能用氢键来解释
10.CO2和甲醇在Ru-Rh(釨铑)基催化剂表面加氢可以制取乙酸,其反应机理如图所示。下列说法错误的是
A.LiI也是该反应的催化剂
B.反应①是取代反应
C.反应④中有非极性键的断裂和极性键的形成
D.根据该反应机理,可以由制备CH3CH2CH2COOH
11.下列说法中正确的是( )
A.分子的结构是由键角决定的
B.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
C.CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等
D.H2O分子中两个O—H键的键角为180°
12.某有机超强碱结构如图所示。下列说法错误的是
A.该有机物存在对映异构
B.该有机物核磁共振氢谱有12组峰
C.该有机物中C和N均有sp3和sp2两种杂化方式
D.该有机物中C、N、O三种元素形成的最简单氢化物分子的键角依次减小
13.我国科研人员通过控制光沉积的方法构建型复合材料光催化剂,其中和渗透Nafion膜可协同、分别反应,构建了一个人工光合作用体系,其反应机理(hv为光照条件)如图。下列说法正确的是
A.图中a、b分别代表、
B.反应过程中光能全部转化为化学能
C.总反应方程式为
D.反应过程中涉及到非极性键、极性键的断裂和形成
14.下列有关O、S及其化合物的说法错误的是
A.的成键电子对间排斥力较大,可以推断的键角比的大
B.分子间存在氢键,可以推断的熔点比的高
C.O的电负性比S大,可以推断的酸性比强
D.的分子间作用力较小,可以推断的熔点比的低
15.汽车尾气中通常含有CO、NOx等气体,为减轻污染,现在的汽车加装了三元催化转换器,此转换器可将汽车尾气中的有毒气体转化为无污染的气体,下图为该转换器中发生反应的微观示意图(未配平),其中不同颜色的球代表不同原子。下列说法不正确的是
A.可用饱和Na2CO3溶液除去丙中混有的HCl
B.乙和丁互为等电子体
C.甲与丙的空间构型不相同
D.丙、丁分子中各原子最外电子层均达到8电子稳定结构
二、填空题(共8题)
16.纳米级是一种光催化材料,可用于处理甲醛、氮氧化物等污染物,工业上也可用其催化乙醇脱氢制备乙醛:。
(1)Ti原子基态核外电子排布式为_________。
(2)分子中含有键的数目为_________。
17.原子序数小于36的X、Y、Z、W、Q五种元素,X原子核外电子运动状态是所有原子中最少的,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W是第三周期中电负性最大的元素,Q的原子序数为33。回答下列问题:
(1)链状化合物Y3X6分子中σ键与π键的数目比为________。
(2)ZX3极易溶于水而YX4难溶于水的主要原因是________________________________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,这两种氧化物的分子式分别是________。
(4)W与Q能形成两种分子,其中属于非极性分子的是________,另一种分子的空间构型是________。
(5)W可以分别与Z、Q形成原子个数比为1∶3的两种化合物,则这种化合物沸点的相对高低为________。
18.(1)在物质CO2、P2O5、CaO、SO2中,有一种物质在某些化学性质或分类上与其他几种物质不同,这种物质是__。
(2)气态氢化物热稳定性HF大于HCl的主要原因是__。
(3)常温下,一体积的水可以溶解700体积的氨气,原因是_。
(4)根据现有元素周期律推算,Mc位于元素周期表的第__周期第__族。
(5)已知2K2S+K2SO3+3H2SO4=3K2SO4+3S↓+3H2O,若氧化产物比还原产物多8.0g,则转移电子的数目为__。
(6)以物质的类别为横坐标,化合价为纵坐标绘制的图象叫价类图。如图是铁的价类图,写出Y在潮湿的空气中转化为图中同类别物质的化学方程式__。
(7)铝制品表面有致密的氧化物薄膜。将一小块铝制品废弃物放入足量的浓NaOH溶液后所发生的氧化还原反应的离子方程式为__。
19.A、B、C、D是元素周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化。请回答下列问题。
(1)A、B、C的第一电离能由小到大的顺序为____________________(用元素符号表示)。
(2)M是含有__________键(填“极性”或“非极性”)的__________分子(填“极性”或“非极性”)。
(3)N是一种易液化的气体,请简述其易液化的原因: __________________________。
(4)W分子的VSEPR模型的空间构型为________,W分子的空间构型为________。
(5)AB-离子中和B2分子的π键数目比为____________。
20.有A、B、C、D、E五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号),原因是_______________。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。
21.(1)酸性强弱比较:苯酚___________碳酸(填“>”、“=”或“<”),原因(用相应的离子方程式表示):___________。
(2)沸点:H2O___________H2S(填“>”、“=”或“<”),原因___________。
(3)实验室欲测定Na2CO3和NaCl混合物中Na2CO3的质量分数ω(Na2CO3),实验步骤如下:称取此固体样品4.350g,溶于适量的水中,配成50mL溶液。取出25mL溶液,加入足量的AgNO3溶液充分反应,得到沉淀的质量为5.575g.则原混合物中ω(Na2CO3)=___________(保留4位有效数字)。写出简要的计算过程。
22.现有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知B元素是地壳中含量最高的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。
回答下列问题:
(1)用电子式表示C和E形成化合物的过程:______。
(2)写出基态F原子的核外电子排布式:______。
(3)A2D的电子式为______,其分子中______(填“含”或“不含”,下同)键,______π键。
(4)A、B、C共同形成的化合物中化学键的类型有______。
23.是制备铁催化剂的主要原料,某化学小组利用莫尔盐制备的实验流程如下:
已知:氧化操作中除生成外,另一部分铁元素转化为红褐色沉淀。
(1)的空间构型为___________。
(2)“酸溶”时,莫尔盐___________(填“能”或“不能”)用的溶解,原因是___________。
(3)第一次“煮沸”时,生成的离子方程式为___________。
(4)“氧化”时所用的实验装置如图所示(夹持装置略去),导管a的作用是___________;“氧化”时反应液应保持温度在40℃左右,则适宜的加热方式为___________(填“直接加热”或“水浴加热”)。
(5)测定产品中铁的含量。
步骤ⅰ:称量mg样品,加水溶解,加入稀硫酸,再滴入的溶液使其恰好反应完全。
步骤ⅱ:向步骤ⅰ所得的溶液中加入过量Cu粉,反应完全后,滤去不溶物,向溶液中滴入酸化的的溶液,滴定至终点,消耗溶液。
①步骤ⅰ中,若加入的溶液过量,则所测的铁元素的含量___________(填“偏大”、“偏小”或“不变”,下同),若步骤ⅱ中不滤去不溶物,则所测的铁元素的含量___________。
②该样品中铁元素的质量分数为___________(用含m、y、z的代数式表示)。
参考答案:
1.C
【解析】①由氧化剂的氧化性大于氧化产物的氧化性,高锰酸钾分解生成二氧化锰,故氧化性:KMnO4>MnO2,二氧化锰与浓盐酸反应生成氯气,故氧化性:MnO2>Cl2,氧化性:KMnO4>MnO2>Cl2,故正确;
②碱金属元素从上到下,金属的密度呈增大趋势,钾反常,所以单质的密度:K<Na<Rb,故错误;
③核外电子排布相同的离子,核电荷数越大,离子半径越小,离子的核外电子层数越多,离子半径越大,应为S2->K+>F-,故错误;
④碱金属元素从上到下,金属的熔点逐渐降低,应为Li>Na>K,故正确;
⑤水中存在氢键,沸点最高,H2Se和H2S结构相似,分子间只存在范德华力,相对分子质量越大,沸点越高,故正确顺序为H2O>H2Se>H2S,故错误;
故选C。
【点睛】本题涉及氧化性的比较、离子半径的比较以及金属的性质等知识。注意把握元素周期律的递变规律。本题的易错点为碱金属的密度,要注意钾反常。
2.B
【解析】A.SO中S成4个键,价层电子对为4,采取sp3杂化,空间构型为四面体形,故A错误;
B.在水溶液或熔融态能导电的化合物属于电解质,H2S的水溶液可以导电,属于电解质,故B正确;
C.Cu的价电子排布为3d104s1,在周期表中位于ds区,故C错误;
D.S2-核外有18个电子,S2-的结构示意图为,故D错误;
故答案为B。
3.D
【解析】A.非金属性越强,电负性越大,C、N、O、F、H电负性由大到小为F>O>N>C>H,故A正确;
B.键长越短,键能越大,该分子中C﹣F键的键能大于C﹣N键的键能,故B正确;
C.含有N=C、C=O、C=C键的C原子中均形成3个σ犍,为sp2杂化,故所有C原子都为sp2杂化,故C正确;
D.单键均为σ键,双键是一个σ键和1个π键,该分子中含有σ键15个,π键数目为4个,σ键与π键数目之比为15:4,故D错误;
故选D。
4.D
【解析】A.HClO为共价化合物,分子中H最外层1个电子,Cl最外层7个电子,O最外层6个电子,O与Cl、H分别形成一个共价键,电子式为,故A正确;
B.绝大多数有机物都是共价化合物,是有机物,属于共价化合物,故B正确;
C.由活泼金属离子与酸根离子形成的化合物是离子化合物,NaClO是离子化合物,一定含有离子键,次氯酸根离子中含有共价键,故C正确;
D.分子含有氢原子,不满足稳定结构,故D错误;
答案选D。
5.D
【解析】略
6.A
短周期元素X、Y、Z、W原子序数依次增大,X的质子数与电子层数相同,故X为H元素,Y、Z同周期且相邻,Z的最外层电子数是其内层电子数的3倍,则Z为O元素,Y为N元素,元素W在地壳中的含量仅次于氧,则W为Al元素。
【解析】A.四种元素中Al的电子层数为3,O、N电子层数为2且核电荷数O>N,H元素电子层数为1,故半径大小为r(Al)>r(N)>r(O)>r(H),故A项正确;
B.X、Y、Z三种元素形成的化合物可以是HNO3或NH4NO3,HNO3为共价化合物,NH4NO3为离子化合物,故B项错误;
C.Al的最高价氧化物对应水化物为Al(OH)3,属于两性氢氧化物,N的最高价氧化物对应水化物为HNO3,为强酸,故最高价氧化物对应水化物的酸性HNO3> Al(OH)3,C项错误;
D.O的非金属性大于N,故气态简单氢化物的热稳定性:H2O>NH3,D项错误;
本题选A。
7.D
【解析】H2Se中Se的孤电子对数为×(6-2×1)=2,σ键电子对数为2,Se的价层电子对数为4,VSEPR模型为四面体型,去掉孤电子对,H2Se的立体构型为V形;NF3中N的孤电子对数为×(5-3×1)=1,σ键电子对数为3,N的价层电子对数为4,VSEPR模型为四面体型,去掉孤电子对, NF3的立体构型为三角锥形;答案选D。
【点睛】易错点是不能熟练判断中心原子的价层电子对数。分子的中心原子价层电子对数=σ键个数+孤电子对数,如果价层电子对数是4且不含孤电子对,则为正四面体结构,如果价层电子对数是4且含有一个孤电子对,则为三角锥形结构,如果价电子对数是4且含有2个孤电子对,则为V形。
8.B
【解析】①从氢键的形成原理上讲,A、B都成立;②但从空间构型上讲,由于氨分子是三角锥形,易于提供孤对电子,所以以B方式结合空间阻碍最小,结构最稳定;③从氨水的性质讲,依据,只有B成立;
故答案选B。
9.B
【解析】A.F2、Cl2、Br2、I2是组成和结构相似的分子,熔点随相对分子质量增大而升高,故A正确;
B.中间碳原子上连有四个不一样的基团:氢原子、甲基、羧基和羟基,是手性碳原子,只有1个,故B错误;
C.碘、四氯化碳、甲烷都为非极性分子,水为极性分子,分子极性相似的分子易溶,故C正确;
D.氨气分子和水分子之间能形成氢键,所以氨气极易溶于水,邻羟基苯甲醛分子内存在氢键,而对羟基苯甲醛分子间存在氢键,所以邻羟基苯甲醛的沸点低于对羟基苯甲醛,故D正确;
故选:B。
10.D
【解析】A.LiI在反应①中作反应物、反应⑤作生成物,所以LiI是该反应是催化剂,A正确;
B.根据图示可知:反应①是CH3OH+LiI→LiOH+CH3I,因此反应①属于取代反应,B正确;
C.反应④中Rh*-I键、O- Rh*键的断裂、有H- H键的断裂和O-H键、H- I键的形成,有非极性键的断裂和极性键的生成,C正确;
D.运用该反应机理可由异丙醇制备异丁酸,而不是正丁酸CH3CH2CH2COOH,D错误;
故合理选项是D。
11.B
【解析】A.分子的结构是由键角和键长决定的,A错误;
B.共价键的键能越大,断裂时需要的能量越大,共价键越牢固,由该键形成的分子越稳定,B正确;
C.四种化合物中C-X键的键长依次增大,键角相等,C错误 ;
D.H2O分子中两个O—H键的键角为105°,D错误;
正确答案B。
12.B
【解析】A. 连接4个不同基团的C为手性碳,只有与苯环直接相连的C具有手性,该有机物存在对映异构,故A正确;
B. 由结构可知含四个环己烷基相同,共含10种H,核磁共振氢谱有10组峰,故B错误;
C. 苯环上C、双键上N为sp2杂化,亚甲基、次甲基及与环己烷基相连的N均为sp3杂化,该有机物中C和N均有sp3和sp2两种杂化方式,故C正确;
D. 该有机物中C、N、O三种元素形成的最简单氢化物分子的中心原子均为sp3杂化,三种氢化物的VSEPR模型均为四面体形,水分子中含有2对孤对电子,氨气分子含有1对孤对电子,甲烷分子没有孤对电子,孤对电子之间排斥作用>孤对电子与成键电子对之间排斥>成键电子对之间排斥,键角:CH4>NH3>H2O,键角依次减小,故D正确;
故选B。
13.C
【解析】A.观察图中物质转化关系可知,b代表,用于氧化生成,a代表,用于还原生成HCOOH,A项错误;
B.反应过程中能量的转化形式是光能转化为化学能,但不是全部转化,B项错误;
C.由图可知反应物为和,生成物为HCOOH和,C项正确;
D.反应过程中没有非极性键的断裂,D项错误。
答案选C。
14.C
【解析】A.O和S属于同主族,因此与中心原子中所含孤电子对数目均为2,氧原子的半径小于S原子半径,H2O成键电子对间排斥力越大,键角越大,故A说法正确;
B.由于分子间存在氢键,H2S不存在分子间氢键,因此的熔点比的高,故B说法正确;
C.由于原子半径O小于S,的酸性比弱,故C说法错误;
D.由于相对分子质量小于,分子间作用力小于,因此 的熔点比的低,故D说法正确;
答案为C。
15.A
【解析】根据微观示意图可知,甲为NO2,乙为CO,丙为CO2,丁为N2,
A. CO2也能与Na2CO3溶液反应,则不能用饱和Na2CO3溶液除去CO2中混有的HCl,应用饱和NaHCO3溶液,A错误;
B. 乙和丁的原子总数和价电子总数相同,故二者互为等电子体,B正确;
C. NO2的空间构型为V形,CO2的空间构型为直线形,C正确;
D. CO2的电子式为,N2的电子式为,分子中各原子最外电子层均达到8电子稳定结构,D正确;
答案选A。
16.(1)
(2)
【解析】(1)
是22号元素,所以Ti原子基态核外电子排布式为。
(2)
单键全部为键,双键有1个键,根据乙醛的结构式可知分子中含有键的数目为。
17. 8∶1 NH3和H2O均是极性分子,二者相似相溶,且二者分子间可形成氢键,故NH3极易溶于水;CH4是非极性分子,不易溶于极性溶剂水 CO2、N2O AsCl5 三角锥形 AsCl3>NCl3
【解析】X原子核外电子运动状态是所有原子中最少的,X是H。Y原子基态时最外层电子数是其内层电子数的2倍,因此Y是C。Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N。W是第三周期中电负性最大的元素,W是Cl,Q的原子序数为33,Q是As。(3)C3H6是丙烯,分子中有8个σ键,1个π键,即σ键与π键的数目比为8∶1。(2)NH3和H2O均是极性分子,二者相似相溶,且二者分子间可形成氢键,故NH3极易溶于水;CH4是非极性分子,在极性分子H2O中的溶解性较小。(3)原子数和价电子数分别都相等的互为等电子体,则CO2与N2O是等电子体。(4)As和Cl可形成AsCl3和AsCl5两种分子,其中AsCl3是三角锥形极性分子,AsCl5是三角双锥非极性分子。(5)AsCl3与NCl3形成的晶体均是分子晶体,由于AsCl3比NCl3的相对分子质量大,故AsCl3的熔沸点较高。
18. CaO F的非金属性比Cl强 氨分子和水分子间可以形成氢键 七 Ⅴ NA 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 2Al + 2H2O + 2OH- = 2 + 3H2↑
【解析】(1)在物质CO2、P2O5、CaO、SO2中,CaO是金属氧化物,在化学性质上与其余非金属氧化物不同。
(2)元素的非金属性越强,其气态氢化物越稳定,气态氢化物热稳定性HF大于HCl的主要原因是F的非金属性比Cl强。
(3)常温下,氨气极易溶于水的主要原因是氨分子和水分子间可以形成氢键,大大增强溶解能力。
(4) Mc的质子数为115,根据现有元素周期律推算,118号元素属于第七周零族,那么115号元素就属于第七周期,ⅤA族。
(5) 在2K2S+K2SO3+3H2SO4=3K2SO4+3S↓+3H2O反应中,硫既是氧化产物,又是还原产物,其物质的量比为2:1,质量比也为2:1,若氧化产物比还原产物多8.0g,即生成硫24g,换算成物质的量为0.75mol,根据化学方程式可知,转移电子物质的量为4 mol,生成3 mol硫,那么生成0.75mol硫,则转移电子为1mol,则转移电子数量为NA。
(6)通过价类图可知,Y是氢氧化亚铁,Y在潮湿的空气中转化为图中同类别物质应该是氢氧化铁,转化的化学方程式为4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。
(7)铝制品表面有致密的氧化物薄膜,其放入足量的浓NaOH溶液后,薄膜被腐蚀,其过程是非氧化还原反应,内部的铝会和氢氧化钠发生氧化还原反应,则其离子方程式为2Al + 2H2O + 2OH- = 2 + 3H2↑。
19.(1)C<O<N
(2) 极性 非极性
(3)NH3易形成分子间氢键
(4) 四面体形 V形
(5)1∶1
A、B、C、D是周期表中前10号元素,它们的原子半径依次减小;D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化,则D是H元素、A是C、B是N、C是O元素,M、N、W分别是CH4、NH3、H2O。
【解析】(1)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但N原子2p能级半充满,结构稳定,第一电离能大于其相邻元素,所以第一电离能由小到大的顺序为C<O<N;
(2)M是CH4,为正四面体结构,甲烷分子中C-H原子之间存在极性键,甲烷分子正负电荷重心重合,为非极性分子。
(3)N为NH3,氨分子间能形成氢键,分子间作用力大,因而易液化;
(4)W是H2O,H2O分子中O原子价层电子对个数是4,含2个孤电子对,根据价层电子对互斥理论判断其VSEPR模型为正四面体结构、空间构型为V形;
(5)CN-离子与N2互为等电子体,二者结构相似,CN-的电子式为,N2的电子式为,叁键中有1个σ键、2个π键 ,则π键数目比=2:2=1:1。
20.(1)1s22s22p63s23p2
(2)
(3) N O N原子最外层的电子处于半充满状态,比较稳定
(4) 三角锥形 sp3杂化
(5) 2 H2O SiH4
A原子最外层p能级的电子数等于次外层的电子总数,A为C元素;A属于第二周期,A、B、C属于同一周期,B原子最外层中有两个不成对的电子,B为O元素;B元素可与A、C、D、E生成RB2型化合物,则C为N元素;DB2中D与B的质量比为7:8,D的相对原子质量为28,D原子核内质子数与中子数相等,D的质子数为14,D为Si元素;EB2中E与B的质量比为1:1,E的相对原子质量为32,E原子核内质子数与中子数相等,E的质子数为16,E为S元素。
【解析】(1)D为Si元素,基态Si原子核外有14个电子,根据构造原理,基态硅原子的电子排布式为1s22s22p63s23p2;
(2)AB2为CO2,CO2的电子式为,结构式为O=C=O,路易斯结构式为;
(3)B为O元素,C为N元素,O和N两元素中第一电离能:NO,原因是:N原子的价电子排布为2s22p3,N原子最外层的电子处于半充满状态,比较稳定;
(4)C的氢化物为NH3,N上的孤电子对数为(5-31)=1,成键电子对数为3,价层电子对数为4,VSEPR模型为四面体,略去孤电子对,NH3的立体结构为三角锥形。中心原子N的杂化轨道类型为sp3杂化;
(5)C的单质为N2,N2的结构式为NN,三键中含1个σ键和2个π键,N2分子中有2个π键。B为O元素,D为Si元素,非金属性:OSi,B、D两元素的气态氢化物稳定性:H2OSiH4。
21. < C6H5O-+CO2+H2O=C6H5OH+ > 水分子之间存在氢键 73.10%
【解析】(1)我们可利用强酸制弱酸的原理比较酸性强弱,根据苯酚钠与碳酸反应生成苯酚和碳酸氢钠可以判断出酸性:苯酚<碳酸,原因:C6H5O-+CO2+H2O=C6H5OH+。答案为:<;C6H5O-+CO2+H2O=C6H5OH+;
(2)H2O和H2S都形成分子晶体,沸点的高低取决于分子间作用力的大小,若分子间形成氢键,熔沸点会出现反常,水分子间存在氢键,则沸点:H2O>H2S;答案为:>;水分子之间存在氢键;
(3)加入AgNO3后,发生如下反应:NaCl+AgNO3=AgCl↓+NaNO3,Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3
设4.350g样品中含有Na2CO3为xmol,NaCl为ymol,则可得以下等量关系式:
①106x+58.5y=4.350 ;②276x+143.5y=5.575×2;解得x=0.03mol,y=0.02mol;ω(Na2CO3)==73.10%。答案为:73.10%。
【点睛】5.575g是从50mL溶液中取出25mL的那部分与AgNO3溶液反应产生的沉淀质量,计算时需注意与原混合物中的x、y相对应。
22. 1s22s22p63s23p64s1 含 不含 离子键、极性共价键
现有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知B元素是地壳中含量最高的元素,则B是O元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的;则A是H,C是Na,D是S;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子比D原子的p轨道上电子多1个,则E是Cl元素;六种元素的基态原子中,F原子的电子层数最多且和A处于同一主族,则F是K元素;然后根据元素周期律及元素、化合物的性质分析解答。
【解析】根据上述分析可知:A是H,B是O,C是Na,D是S,E是Cl,F是K元素。
(1)C是Na,E是Cl,二者形成的化合物NaCl是离子化合物,用电子式表示其形成过程为:;
(2)F是K元素,根据构造原理,可知基态K原子的核外电子排布式是1s22s22p63s23p64s1;
(3)A是H,D是S,S原子最外层有6个电子,与2个H原子的电子形成2个共价键,使分子中每个原子都达到稳定结构,其电子式为:;H2S结构式为:H-S-H,在分子,S、H原子形成的是共价单键,共价单键属于σ键,而不含π键;
(4)A是H,B是O,C是Na,这三种元素形成的化合物是NaOH,为离子化合物,Na+与OH-之间以离子键结合,在阳离子OH-中H、O原子之间以共价键结合,因此NaOH中含有离子键和极性共价键。
23. V形 不能 会与反应生成污染环境的气体(或会消耗更多的等合理答案) 平衡气压,使液体顺利滴下 水浴加热 偏小 偏大
由实验流程可知,用硫酸溶解后,加入草酸溶液煮沸生成,加入H2O2溶液进行氧化将Fe元素转化为+3价,加入饱和草酸钾和草酸溶液煮沸得到溶液,经过一系列操作得到产品
【解析】(1)H2O分子,中心原子的价层电子对数: ,孤电子对数为2,则水的空间构型为:V形;
(2)HNO3具有氧化性,会将Fe2+氧化为Fe3+,不能得到预期产物,故:“酸溶”时,莫尔盐不能用的溶解,原因是:会与反应生成污染环境的气体(或会消耗更多的等合理答案);
(3)H2C2O4与Fe2+反应生成,非氧化还原反应,根据元素守恒,反应的离子方程式为:;
(4)漏斗需要和外界气压平衡,里面的液体才能顺利流下,故作用为:平衡气体,使液体顺利流下;需要保持40℃温度加热,温度较低且要控制温度,所以采用水浴加热;
(5)①步骤ⅰ加入溶液时发生反应的离子方程式为,无色草酸根和有色高锰酸钾氧化还原反应,计算草酸根含量,步骤ii发生的反应为:Cu+2Fe3+=Cu2++2Fe2+,5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,Fe3+氧化Cu得到还原性Fe2+,通过Fe2+和MnO4-反应来计算铁元素的含量,步骤ⅰ中,若加入的溶液过量,使步骤ii中消耗的减少,计算的铁元素偏小;若步骤ⅱ中不滤去不溶物Cu,会和生成的Fe3+继续反应生成Fe2+,使消耗偏多,测得铁元素含量偏大;②根据关系式,可以得出,铁的质量为:0.28xyg,该样品中铁元素的质量分数为
