广西钦州市第六中学2022-2023学年高二下学期4月份考试化学试卷(含答案)
文档属性
| 名称 | 广西钦州市第六中学2022-2023学年高二下学期4月份考试化学试卷(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 558.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-06 15:37:35 | ||
图片预览



文档简介
钦州市第六中学2022-2023学年高二下学期4月份考试化学试卷
一、单选题(本大题共20小题,共40分)
1. 下列物质的熔、沸点高低顺序正确的是( )
A. 金刚石晶体硅碳化硅 B.
C. D. 金刚石生铁钠纯铁
2. 下列说法中,正确的是( )
A. 电子气理论可以解释金属晶体锗的延展性,导电性和导热性
B. 共价晶体可能含有离子键C. 分子晶体中一定存在分子间作用力和共价键
D. 石墨转化为金刚石有共价键的断裂和生成,没有分子间作用力的破坏
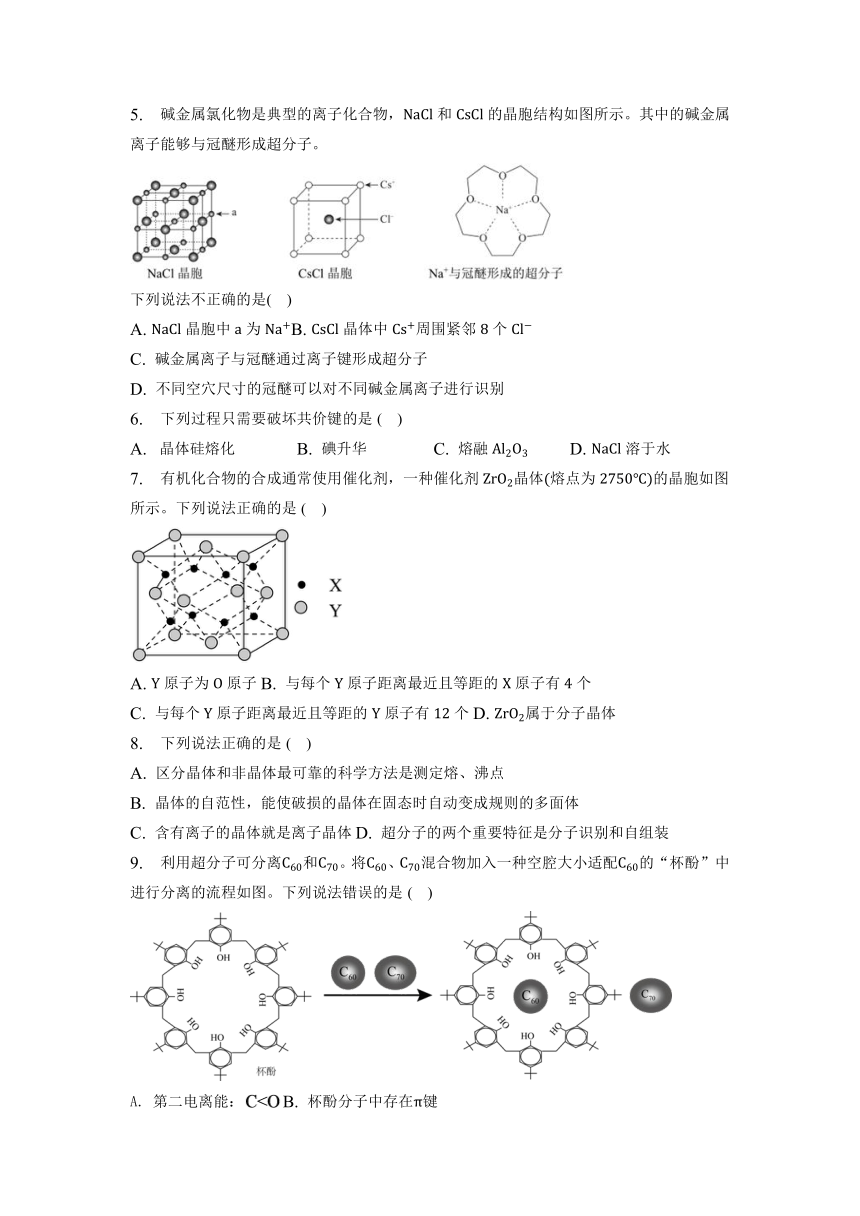
3. 已知有如图晶体结构:
下列有关晶体的叙述中,错误的是( )
A. 在冰中,一个水分子周围有个紧邻的水分子
B. 金刚石晶体中碳原子所连接的最小环为六元环
C. 石墨晶体的二维结构,碳原子的配位数是,采取杂化
D. 在晶体里,每个周围有个距离最近且相等的
4. 有一种蓝色晶体可表示为,经射线研究发现,它的结构特征是和互相占据立方体互不相邻的顶点,而位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示。下列说法不正确的是( )
A. 该晶体的化学式为B. 该晶体属于离子晶体
C. 该晶体中呈价D. 晶体中与每个 距离最近且等距离的 为个
5. 碱金属氯化物是典型的离子化合物,和的晶胞结构如图所示。其中的碱金属离子能够与冠醚形成超分子。
下列说法不正确的是( )
A. 晶胞中为B. 晶体中周围紧邻个
C. 碱金属离子与冠醚通过离子键形成超分子
D. 不同空穴尺寸的冠醚可以对不同碱金属离子进行识别
6. 下列过程只需要破坏共价键的是( )
A. 晶体硅熔化 B. 碘升华 C. 熔融 D. 溶于水
7. 有机化合物的合成通常使用催化剂,一种催化剂晶体熔点为的晶胞如图所示。下列说法正确的是( )
A. 原子为原子B. 与每个原子距离最近且等距的原子有个
C. 与每个原子距离最近且等距的原子有个D. 属于分子晶体
8. 下列说法正确的是( )
A. 区分晶体和非晶体最可靠的科学方法是测定熔、沸点
B. 晶体的自范性,能使破损的晶体在固态时自动变成规则的多面体
C. 含有离子的晶体就是离子晶体D. 超分子的两个重要特征是分子识别和自组装
9. 利用超分子可分离和。将、混合物加入一种空腔大小适配的“杯酚”中进行分离的流程如图。下列说法错误的是( )
第二电离能:B. 杯酚分子中存在键
C. 杯酚与形成氢键D. 与金刚石晶体类型不同
10. 下列各物质的晶体中,晶体类型相同的是( )
A. 和 B. 和 C. 和 D. 和
11. 下列有机物中,沸点最高的是( )
A. 甲烷 B. 丙烷 C. 甲醇 D. 丙三醇
12. 功能陶瓷材料氮化硼晶体有多种结构。立方相氮化硼是超硬材料,其结构与金刚石相似。六方相氮化硼与石墨相似,具有层状结构,层间是分子间作用力。它们的晶体结构如图。下列说法不正确的是( )
A. 立方相氮化硼属于共价晶体B. 立方相氮化硼中存在配位键
C. 六方相氮化硼含 共价键
D. 六方相氮化硼中原子和原子的杂化轨道类型均为杂化
13. 下列叙述中正确的是( )
A. 共价晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B. 晶体在受热熔化过程中一定存在化学键的断裂
C. 共价晶体的熔点不一定比金属晶体的高,分子晶体的熔点不一定比金属晶体的低
D. 已知金刚石中含有个键,则中也含有个键
14. 下列晶体中,加热熔融时无化学键断裂的是( )
A. 硫酸钠 B. 金刚砂 C. 铝 D. 冰
15. 下列关于化学键的说法正确的个数是( )
所有物质都有化学键
金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性
金属的导电、导热性都跟金属键理论有关
配位键是一种特殊的共价键,配位化合物中的配体可以是分子也可以是阴离子
由非金属元素形成的化合物中一定有共价键,一定没有离子键
因为离子键无方向性,故阴、阳离子的排列是没有规律的,是随意的
当阴阳离子的静电作用中引力和斥力达到平衡时,体系能量最低,形成稳定的离子化合物
A. 个 B. 个 C. 个 D. 个
16. 下列说法正确的是( )
A. 分子晶体中一定存在共价键
B. 在晶体中只要有阳离子就一定有阴离子
C. 细胞和细胞器的双分子膜体现了超分子“自组装”特征
D. 区分晶体和非晶体最可靠的方法是看其是否具有自范性
17. 等离子体的用途十分广泛。运用等离子体束来切割金属或者进行外科手术,利用了等离子体的特点是( )
A. 微粒带有电荷B. 高能量C. 基本构成微粒多样化D. 准电中性
18. 有关液晶的叙述不正确的是( )
A. 液晶既具有液体的可流动性,又具有晶体的各向异性
B. 液晶最重要的用途是制造液晶显示器C. 液晶不是物质的一种聚集状态
D. 液晶分子聚集在一起时,其分子间相互作用很容易受温度、压力和电场的影响
19. 下列叙述不属于晶体特点的是( )
A. 有规则的几何外形B. 具有各向异性 C. 有自范性 D. 没有固定熔点
20. 离子晶体熔点的高低取决于晶体中阳离子与阴离子之间的静电作用,静电作用大则熔点高,静电作用小则熔点低。试根据学过的知识,判断、、、四种晶体熔点的高低顺序是( )
A. B.
C. D.
二、填空题(本大题共5小题,共52分)
21. 分析下列物质的物理性质,判断其晶体类型。
碳化铝,黄色晶体,熔点,熔融态不导电: ;
溴化铝,无色晶体,熔点,熔融态不导电: ;
五氟化钒,无色晶体,熔点,易溶于乙醇、氯仿、丙酮: ;
溴化钾,无色晶体,熔融时或溶于水中都能导电: 。
三氯化铁常温下为固体,熔点,沸点,在以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 。
金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。两种晶胞中实际含有的铁原子个数之比为 。
22. 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:
回答下列问题:
合成氨反应在常温下___________填“能”或“不能”自发。
___________温填“高”或“低”,下同有利于提高反应速率,___________温有利于提高平衡转化率,综合考虑催化剂铁触媒活性等因素,工业常采用。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案二:复合催化剂。
下列说法正确的是___________。
时,复合催化剂比单一催化剂效率更高
同温同压下,复合催化剂有利于提高氨的平衡产率
温度越高,复合催化剂活性一定越高
某合成氨速率方程为:,根据表中数据,___________;
实验
在合成氨过程中,需要不断分离出氨的原因为___________。
有利于平衡正向移动 防止催化剂中毒 提高正反应速率
某种新型储氢材料的晶胞如图,八面体中心为金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为,则元素为___________填元素符号;在该化合物中,离子的价电子排布式为___________。
23. A、、、为原子序数依次增大的四种元素,和具有相同的电子构型,、为同周期元素,核外电子总数是最外层电子数的倍;元素最外层有一个未成对电子。回答下列问题:
四种元素中电负性最大的是_______________________________________填元素符号,
其中原子的核外电子排布式为_______________________________________。
单质有两种同素异形体,其中沸点高的是________填分子式,原因是______________;
和的氢化物所属的晶体类型分别为________和________。
和反应可生成组成比为的化合物,的立体构型为________,中心原子的杂化轨道类型为________。
化合物的立体构型为________,中心原子的价层电子对数为________,单质与湿润的反应可制备,其化学方程式为_____________________
和能够形成化合物,其晶胞结构如图所示,晶胞参数,的化学式为________;晶胞中原子的配位数为________;列式计算晶体的密度________。
24. 下图表示一些晶体中的某些结构,它们分别是、、干冰、金刚石、石墨结构中的某一种的某一部分:
代表金刚石的是 填字母,下同,其中每个碳原子与 个碳原子最接近。金刚石属于 晶体。
代表石墨的是 ,每个正六边形占有的碳原子数平均为 个。
代表的是 ,每个周围与它最接近的有 个。
代表的是 ,它属于 晶体,每个与 个紧邻。
代表干冰的是 ,它属于 晶体,每个分子与 个分子紧邻。
25. 一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中原子处于面心,原子处于顶点,则该合金中原子与原子数量之比为________;该晶体中原子之间的作用力是________。
上述晶体具有储氢功能,氢原子可进入到由原子与原子构成的四面体空隙中。若将原子与原子等同看待,该晶体储氢后的晶胞结构与见图的结构相似,该晶体储氢后的化学式应为________。
立方磷化硼的晶胞结构如图所示,晶胞中含原子数目为________。
铁有、、三种同素异形体,晶体晶胞中所含有的铁原子数为________,、两种晶胞中铁原子的配位数之比为________。
简答题(本大题共1小题,共8分)
26. 硼及其化合物在新材料、工农业生产等方面用途广泛。
氮化硼存在不同的变体,如六方氮化硼、立方氮化硼等,其结构如图。
六方氮化硼的晶体结构类似石墨,则六方氮化硼的晶体类型属于 ____________。
高温高压下,六方氮化硼可转化为立方氮化硼,立方氮化硼的结构与金刚石类似,每个立方氮化硼晶胞中硼原子和氮原子的个数比为 ____________。
氨硼烷是极具潜力的高性能储氢材料,其晶体结构之一如图。已知电负性:,,
氨硼烷分子为 ______填“极性”或“非极性”分子。
氨硼烷分子中,键为配位键,由原子的价层电子排布特点分析该配位键的形成过程:_______________。
氨硼烷常温下为固态,它的熔点比乙烷的熔点高近,是由于其分子间除了分子间作用力,还存在正电性和负电性的相互作用,这种作用称为“双氢键”。仿照氢键的表示方法:“”,上述双氢键可表示为 ______式中用“”及“”表示氢的带电情况。
氨硼烷常温下稳定,加热到左右分解产生,若该反应中只有氢元素的化合价发生变化,则每产生,反应转移的电子的物质的量是 ______。
由氨硼:烷的组成或性质分析,氨硼烷作为储氢材料的优势有 ____________________________________。
参考答案
1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20.
21.共价晶体 分子晶体 分子晶体 离子晶体 分子晶体
22.能高;低 ; ;
23.或
相对分子质量较大,范德华力大分子晶体离子晶体
三角锥形 形
24. 共价 离子 分子
25.金属键
26.混合型晶体;:
极性;
、原子为杂化,原子价层个电子,与个原子形成键,还有一对孤对电子占据个轨道;原子价层个电子,与个原子形成键后,还有一空轨道,提供孤电子对、提供空轨道而形成配位键;
;
;
氨硼烷中元素的质量分数含氢量大;常温下固态、稳定,便于储存运输
一、单选题(本大题共20小题,共40分)
1. 下列物质的熔、沸点高低顺序正确的是( )
A. 金刚石晶体硅碳化硅 B.
C. D. 金刚石生铁钠纯铁
2. 下列说法中,正确的是( )
A. 电子气理论可以解释金属晶体锗的延展性,导电性和导热性
B. 共价晶体可能含有离子键C. 分子晶体中一定存在分子间作用力和共价键
D. 石墨转化为金刚石有共价键的断裂和生成,没有分子间作用力的破坏
3. 已知有如图晶体结构:
下列有关晶体的叙述中,错误的是( )
A. 在冰中,一个水分子周围有个紧邻的水分子
B. 金刚石晶体中碳原子所连接的最小环为六元环
C. 石墨晶体的二维结构,碳原子的配位数是,采取杂化
D. 在晶体里,每个周围有个距离最近且相等的
4. 有一种蓝色晶体可表示为,经射线研究发现,它的结构特征是和互相占据立方体互不相邻的顶点,而位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示。下列说法不正确的是( )
A. 该晶体的化学式为B. 该晶体属于离子晶体
C. 该晶体中呈价D. 晶体中与每个 距离最近且等距离的 为个
5. 碱金属氯化物是典型的离子化合物,和的晶胞结构如图所示。其中的碱金属离子能够与冠醚形成超分子。
下列说法不正确的是( )
A. 晶胞中为B. 晶体中周围紧邻个
C. 碱金属离子与冠醚通过离子键形成超分子
D. 不同空穴尺寸的冠醚可以对不同碱金属离子进行识别
6. 下列过程只需要破坏共价键的是( )
A. 晶体硅熔化 B. 碘升华 C. 熔融 D. 溶于水
7. 有机化合物的合成通常使用催化剂,一种催化剂晶体熔点为的晶胞如图所示。下列说法正确的是( )
A. 原子为原子B. 与每个原子距离最近且等距的原子有个
C. 与每个原子距离最近且等距的原子有个D. 属于分子晶体
8. 下列说法正确的是( )
A. 区分晶体和非晶体最可靠的科学方法是测定熔、沸点
B. 晶体的自范性,能使破损的晶体在固态时自动变成规则的多面体
C. 含有离子的晶体就是离子晶体D. 超分子的两个重要特征是分子识别和自组装
9. 利用超分子可分离和。将、混合物加入一种空腔大小适配的“杯酚”中进行分离的流程如图。下列说法错误的是( )
第二电离能:B. 杯酚分子中存在键
C. 杯酚与形成氢键D. 与金刚石晶体类型不同
10. 下列各物质的晶体中,晶体类型相同的是( )
A. 和 B. 和 C. 和 D. 和
11. 下列有机物中,沸点最高的是( )
A. 甲烷 B. 丙烷 C. 甲醇 D. 丙三醇
12. 功能陶瓷材料氮化硼晶体有多种结构。立方相氮化硼是超硬材料,其结构与金刚石相似。六方相氮化硼与石墨相似,具有层状结构,层间是分子间作用力。它们的晶体结构如图。下列说法不正确的是( )
A. 立方相氮化硼属于共价晶体B. 立方相氮化硼中存在配位键
C. 六方相氮化硼含 共价键
D. 六方相氮化硼中原子和原子的杂化轨道类型均为杂化
13. 下列叙述中正确的是( )
A. 共价晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B. 晶体在受热熔化过程中一定存在化学键的断裂
C. 共价晶体的熔点不一定比金属晶体的高,分子晶体的熔点不一定比金属晶体的低
D. 已知金刚石中含有个键,则中也含有个键
14. 下列晶体中,加热熔融时无化学键断裂的是( )
A. 硫酸钠 B. 金刚砂 C. 铝 D. 冰
15. 下列关于化学键的说法正确的个数是( )
所有物质都有化学键
金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性
金属的导电、导热性都跟金属键理论有关
配位键是一种特殊的共价键,配位化合物中的配体可以是分子也可以是阴离子
由非金属元素形成的化合物中一定有共价键,一定没有离子键
因为离子键无方向性,故阴、阳离子的排列是没有规律的,是随意的
当阴阳离子的静电作用中引力和斥力达到平衡时,体系能量最低,形成稳定的离子化合物
A. 个 B. 个 C. 个 D. 个
16. 下列说法正确的是( )
A. 分子晶体中一定存在共价键
B. 在晶体中只要有阳离子就一定有阴离子
C. 细胞和细胞器的双分子膜体现了超分子“自组装”特征
D. 区分晶体和非晶体最可靠的方法是看其是否具有自范性
17. 等离子体的用途十分广泛。运用等离子体束来切割金属或者进行外科手术,利用了等离子体的特点是( )
A. 微粒带有电荷B. 高能量C. 基本构成微粒多样化D. 准电中性
18. 有关液晶的叙述不正确的是( )
A. 液晶既具有液体的可流动性,又具有晶体的各向异性
B. 液晶最重要的用途是制造液晶显示器C. 液晶不是物质的一种聚集状态
D. 液晶分子聚集在一起时,其分子间相互作用很容易受温度、压力和电场的影响
19. 下列叙述不属于晶体特点的是( )
A. 有规则的几何外形B. 具有各向异性 C. 有自范性 D. 没有固定熔点
20. 离子晶体熔点的高低取决于晶体中阳离子与阴离子之间的静电作用,静电作用大则熔点高,静电作用小则熔点低。试根据学过的知识,判断、、、四种晶体熔点的高低顺序是( )
A. B.
C. D.
二、填空题(本大题共5小题,共52分)
21. 分析下列物质的物理性质,判断其晶体类型。
碳化铝,黄色晶体,熔点,熔融态不导电: ;
溴化铝,无色晶体,熔点,熔融态不导电: ;
五氟化钒,无色晶体,熔点,易溶于乙醇、氯仿、丙酮: ;
溴化钾,无色晶体,熔融时或溶于水中都能导电: 。
三氯化铁常温下为固体,熔点,沸点,在以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 。
金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。两种晶胞中实际含有的铁原子个数之比为 。
22. 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:
回答下列问题:
合成氨反应在常温下___________填“能”或“不能”自发。
___________温填“高”或“低”,下同有利于提高反应速率,___________温有利于提高平衡转化率,综合考虑催化剂铁触媒活性等因素,工业常采用。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
方案二:复合催化剂。
下列说法正确的是___________。
时,复合催化剂比单一催化剂效率更高
同温同压下,复合催化剂有利于提高氨的平衡产率
温度越高,复合催化剂活性一定越高
某合成氨速率方程为:,根据表中数据,___________;
实验
在合成氨过程中,需要不断分离出氨的原因为___________。
有利于平衡正向移动 防止催化剂中毒 提高正反应速率
某种新型储氢材料的晶胞如图,八面体中心为金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为,则元素为___________填元素符号;在该化合物中,离子的价电子排布式为___________。
23. A、、、为原子序数依次增大的四种元素,和具有相同的电子构型,、为同周期元素,核外电子总数是最外层电子数的倍;元素最外层有一个未成对电子。回答下列问题:
四种元素中电负性最大的是_______________________________________填元素符号,
其中原子的核外电子排布式为_______________________________________。
单质有两种同素异形体,其中沸点高的是________填分子式,原因是______________;
和的氢化物所属的晶体类型分别为________和________。
和反应可生成组成比为的化合物,的立体构型为________,中心原子的杂化轨道类型为________。
化合物的立体构型为________,中心原子的价层电子对数为________,单质与湿润的反应可制备,其化学方程式为_____________________
和能够形成化合物,其晶胞结构如图所示,晶胞参数,的化学式为________;晶胞中原子的配位数为________;列式计算晶体的密度________。
24. 下图表示一些晶体中的某些结构,它们分别是、、干冰、金刚石、石墨结构中的某一种的某一部分:
代表金刚石的是 填字母,下同,其中每个碳原子与 个碳原子最接近。金刚石属于 晶体。
代表石墨的是 ,每个正六边形占有的碳原子数平均为 个。
代表的是 ,每个周围与它最接近的有 个。
代表的是 ,它属于 晶体,每个与 个紧邻。
代表干冰的是 ,它属于 晶体,每个分子与 个分子紧邻。
25. 一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中原子处于面心,原子处于顶点,则该合金中原子与原子数量之比为________;该晶体中原子之间的作用力是________。
上述晶体具有储氢功能,氢原子可进入到由原子与原子构成的四面体空隙中。若将原子与原子等同看待,该晶体储氢后的晶胞结构与见图的结构相似,该晶体储氢后的化学式应为________。
立方磷化硼的晶胞结构如图所示,晶胞中含原子数目为________。
铁有、、三种同素异形体,晶体晶胞中所含有的铁原子数为________,、两种晶胞中铁原子的配位数之比为________。
简答题(本大题共1小题,共8分)
26. 硼及其化合物在新材料、工农业生产等方面用途广泛。
氮化硼存在不同的变体,如六方氮化硼、立方氮化硼等,其结构如图。
六方氮化硼的晶体结构类似石墨,则六方氮化硼的晶体类型属于 ____________。
高温高压下,六方氮化硼可转化为立方氮化硼,立方氮化硼的结构与金刚石类似,每个立方氮化硼晶胞中硼原子和氮原子的个数比为 ____________。
氨硼烷是极具潜力的高性能储氢材料,其晶体结构之一如图。已知电负性:,,
氨硼烷分子为 ______填“极性”或“非极性”分子。
氨硼烷分子中,键为配位键,由原子的价层电子排布特点分析该配位键的形成过程:_______________。
氨硼烷常温下为固态,它的熔点比乙烷的熔点高近,是由于其分子间除了分子间作用力,还存在正电性和负电性的相互作用,这种作用称为“双氢键”。仿照氢键的表示方法:“”,上述双氢键可表示为 ______式中用“”及“”表示氢的带电情况。
氨硼烷常温下稳定,加热到左右分解产生,若该反应中只有氢元素的化合价发生变化,则每产生,反应转移的电子的物质的量是 ______。
由氨硼:烷的组成或性质分析,氨硼烷作为储氢材料的优势有 ____________________________________。
参考答案
1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20.
21.共价晶体 分子晶体 分子晶体 离子晶体 分子晶体
22.能高;低 ; ;
23.或
相对分子质量较大,范德华力大分子晶体离子晶体
三角锥形 形
24. 共价 离子 分子
25.金属键
26.混合型晶体;:
极性;
、原子为杂化,原子价层个电子,与个原子形成键,还有一对孤对电子占据个轨道;原子价层个电子,与个原子形成键后,还有一空轨道,提供孤电子对、提供空轨道而形成配位键;
;
;
氨硼烷中元素的质量分数含氢量大;常温下固态、稳定,便于储存运输
同课章节目录
