安徽省无为襄安高级中学2022-2023学年高一下学期4月期中考试化学试题(含答案)
文档属性
| 名称 | 安徽省无为襄安高级中学2022-2023学年高一下学期4月期中考试化学试题(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 353.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-06 15:50:06 | ||
图片预览



文档简介
襄安高级中学2022-2023学年高一下学期4月期中考试
化学试题卷
考试时间:90分钟;分值100分。
注意事项:
1.答卷前,考生将自己的姓名、准考证号填写在答题卷上。
2.答题时用黑色中性笔将答案写在答题卷上,未在答题卷上作答的一律无效。
3.考试结束后,上交答题卷。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Si:28 S:32 Cu:64 Zn:65
第I卷(选择题)
一、单项选择题(本题共15道小题,每题3分,共45分)
1.下列指定反应的离子方程式书写正确的是( )
A.向Na2SiO3溶液中通入过量CO2气体:+2
B.酸性介质中KMnO4氧化H2O2:2
C.将铝片加入氢氧化钠溶液中:2+2H2↑
D.向溴化亚铁中通入足量的氯气:
2.硫元素的价类二维图如图所示。下列说法错误的是
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e,溶液的酸性增强
C.盐g与盐f之间也可能发生反应
D.铜与c的浓溶液共热产生的气体通入Ba(NO3)2液中,无明显现象
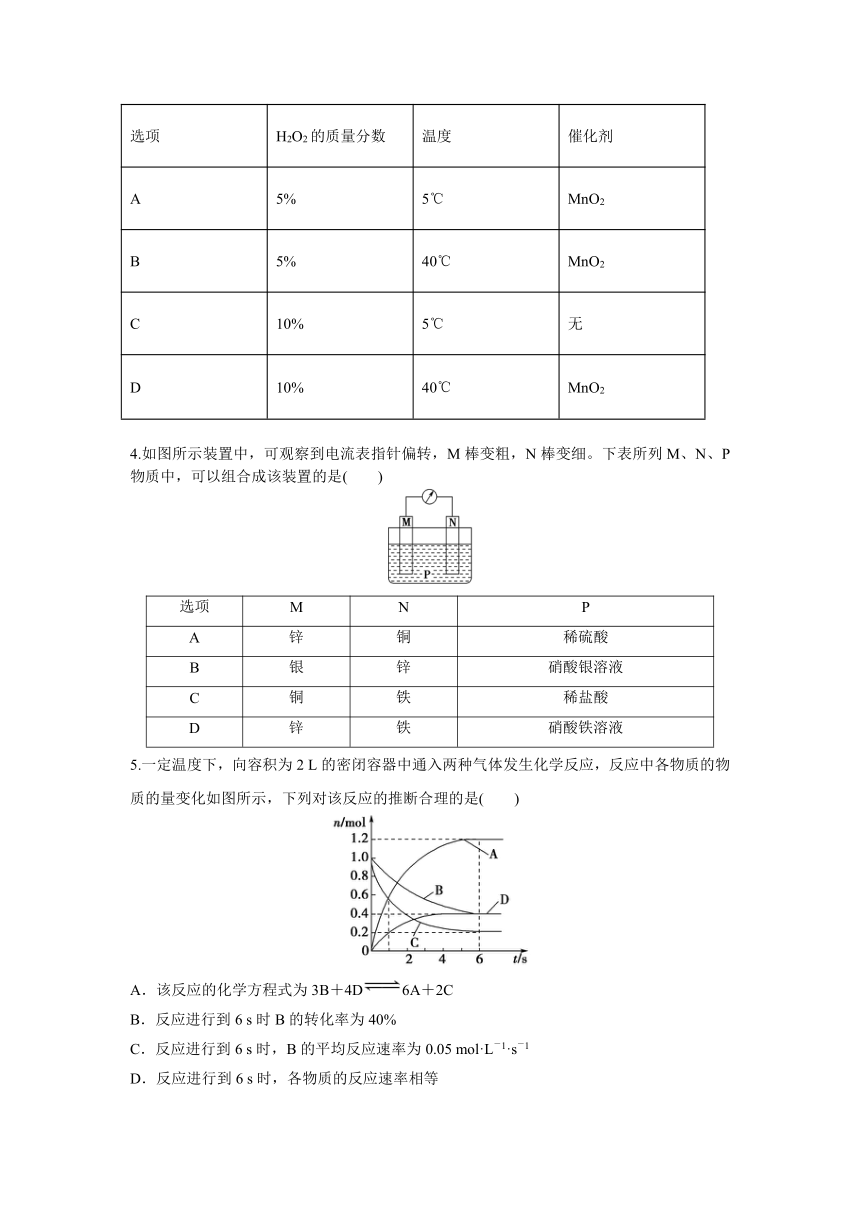
实验室制取氧气的反应为2H2O2=2H2O+O2↑。在下列条件下,反应的速率最快的是( )
选项 H2O2的质量分数 温度 催化剂
A 5% 5℃ MnO2
B 5% 40℃ MnO2
C 10% 5℃ 无
D 10% 40℃ MnO2
4.如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是( )
选项 M N P
A 锌 铜 稀硫酸
B 银 锌 硝酸银溶液
C 铜 铁 稀盐酸
D 锌 铁 硝酸铁溶液
5.一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,下列对该反应的推断合理的是( )
A.该反应的化学方程式为3B+4D6A+2C
B.反应进行到6 s时B的转化率为40%
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
6.化学反应:A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )
A.断裂2 mol A—B需要吸收y kJ的能量
B.断裂1 mol A—A和1 mol B—B放出x kJ的能量
C.1 mol A2和1 mol B2完全反应吸收(y-x)kJ热量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
7.工业上用洗净的废铜屑作原料制取硝酸铜。为节约原料和防止环境污染,宜采取的方法是( )
A.Cu+HNO3(浓)―→Cu(NO3)2 B.Cu+HNO3(稀)―→Cu(NO3)2
C.Cu CuO Cu(NO3)2
D.Cu CuSO4 Cu(NO3)2
8.将SO2气体通入BaCl2溶液,无明显现象,然后再通入X气体或加入X溶液,有白色沉淀生成,X不可能是( )
A.Cl2 B.CO2 C.H2O2 D.NH3·H2O
9.在一定条件下,对于密闭容器中进行的反应:X(g) + Y(g)2Z(g),下列说法能充分说明该反应已达到化学平衡状态的是 ( )
A. X、Y、Z的浓度相等 B. 正、逆反应速率均等于零
C. X、Y、Z在容器中共存 D. X、Y、Z的浓度均不再改变
10.用20 mL 18.4 mol·L-1的浓硫酸与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液加水稀释到100 mL,所得溶液中SO的浓度为3.18 mol·L-1,则此时溶液中CuSO4的物质的量浓度为( )
A.0.50 mol·L-1 B.0.75 mol·L-1 C.1.00 mol·L-1 D.3.18 mol·L-1
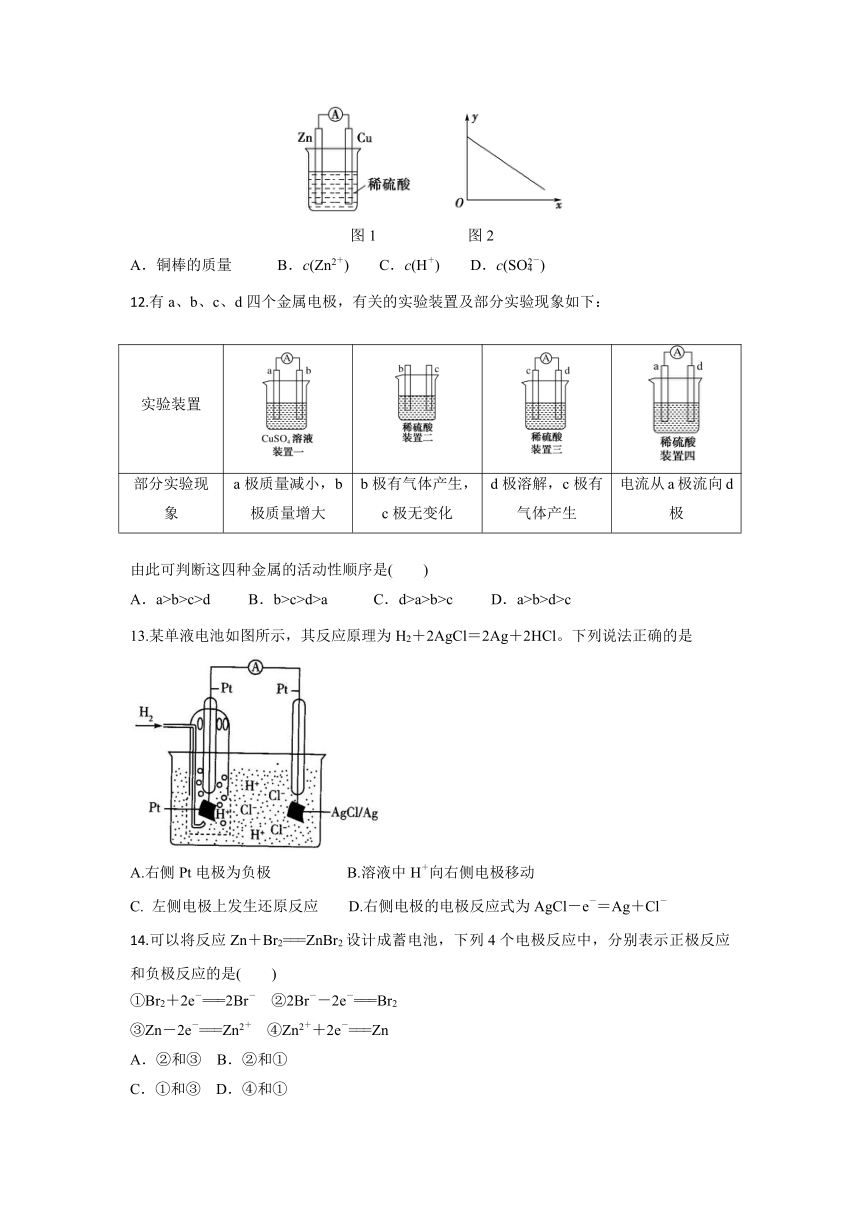
图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
图1 图2
A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO)
12.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
部分实验现象 a极质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
13.某单液电池如图所示,其反应原理为H2+2AgCl=2Ag+2HCl。下列说法正确的是
A.右侧Pt电极为负极 B.溶液中H+向右侧电极移动
C. 左侧电极上发生还原反应 D.右侧电极的电极反应式为AgCl-e-=Ag+Cl-
14.可以将反应Zn+Br2===ZnBr2设计成蓄电池,下列4个电极反应中,分别表示正极反应和负极反应的是( )
①Br2+2e-===2Br- ②2Br--2e-===Br2
③Zn-2e-===Zn2+ ④Zn2++2e-===Zn
A.②和③ B.②和①
C.①和③ D.④和①
15.硅谷是世界上最知名的电子工业集中地,以硅芯片的设计与制造著称于世。下列有关硅的说法正确的是( )
A.硅既不易失去电子又不易得到电子,所以既不能作氧化剂,又不能作还原剂
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量居第一位
C.硅的化学性质不活泼,在自然界中以游离态的形式存在
D.在电子工业中,硅是最重要的半导体材料
第II卷(非选择题 共55分)
16.(除说明外,每空2分,共 9分)化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如下(所取溶液体积均为2 mL):
实验编号 温度/℃ c(Na2S2O3)/mol·L-1 c(H2SO4)/mol·L-1
Ⅰ 25 0.1 0.1
Ⅱ 25 0.2 0.1
Ⅲ 50 0.2 0.1
①上述实验中溶液最先变浑浊的是______(填实验编号,下同)。(1分)
②为探究浓度对化学反应速率的影响,应选择______和______。(每空1分)
(2)某温度下,在1 L密闭容器中,发生反应:2X(g)+Y(g)2Z(g),X的物质的量随时间的变化如下表:
时间/s 0 1 2 3 4 5
X的物质的量/mol 0.02 0.01 0.008 0.007 0.007 0.007
①用X的浓度变化表示0~2 s的平均化学反应速率为______mol/(L·s)。
②在3 s以后X的浓度不再改变,反应达到了______状态。
③能说明该反应已达到化学平衡状态的是______(填序号)。
A.v正(X)=v逆(X)
B.单位时间内有2 mol X生成同时有1 mol Y生成
C.X、Y、Z的分子数之比为2∶1∶2
17.(每空2分,共10分) H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化I、II____________(填“吸收”或“放出”,下同)能量,完成转化III____________能量。
(2)H2和F2反应能量变化图可用____________(填“A”或“B”)表示。
(3)如图是宇宙飞船上使用的一种新型电池装置。A、B两个电极均由多孔的碳块组成,该电池正极的电极反应式为____________;若将该装置中的氢气换成甲烷,其余都不改变,对应装置的负极电极反应式为____________。
18.(除说明外,每空2分,共 11分)非金属单质A经下图所示的过程可转化为含氧酸D,已知D为强酸。请回答下列问题。
ABCD
(1)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是_________。
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为________;体现D的什么性质________。
(2)氮化硅Si3N4)可由石英与焦炭在高温的氮气流中通过以下反应制备:
3SiO2+ 6C+ 2N2Si3N4 + 6CO
①请写出氮化硅中氮元素的化合价是________,以上反应中的氧化剂是________,还原剂是________。(每空1分)
②若该反应生成11.2L一氧化碳(标准状况),则生成氮化硅的质量是________ ( 保留小数点后一位)。
19.(除说明外,每空2分,共 12分)在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从3min到9min,v(H2)=___________。
(2)若降低温度,则该反应的正反应速率___________(填“加快”“减慢”或“不变”。下同),逆反应速率___________。(每空1分)
(3)第4min时,正、逆反应速率的大小关系为___________(填“>““<”“=”)。
(4)能说明上述反应达到平衡状态的是___________(填字母)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体中CO2的浓度不再改变
C.单位时间内生成1mol H2,同时生成1mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(5)平衡时CO2的转化率为___________。
(6)反应达到平衡,此时体系内压强与开始时的压强之比为___________。
20.(除说明外,每空2分,共 13分)某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该发生装置略去),试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为______________________________________。
(2)乙同学认为还可能产生氢气的理由是_______________________________。
(3)A中加入的试剂可能是________(1分),作用是__________________________;
B中加入的试剂可能是________(1分);E中加入的试剂可能是________(1分),作用是_____________________________。
(4)可以证明气体X中含有氢气的实验现象是C中:________________(1分),D中:_______________(1分)。
参考答案
选择题
题号 1 2 3 4 5 6 7 8
选项 B D D B C A C B
题号 9 10 11 12 13 14 15
选项 D A C C B C D
16、(1) ① Ⅲ ②Ⅰ;Ⅱ (2)① 0.006 ②平衡 ③ A
17、(1)吸收 放出 (2)A
(3)O2+4e-+2H2O=4OH-
CH4-8e-+10OH-=CO32-+7H2O
18.(1)①N2 NO2
②Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 氧化性、酸性
(2)①-3 N2 C ②11.7
19、(1)0.126 (2) 减慢 减慢 (3)> (4)BD
(5)75% (6) 3:4
20、(1)Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O
(2)Zn与浓硫酸反应过程中,浓硫酸逐渐变稀,Zn与稀硫酸反应可产生H2
(3)品红溶液 检验SO2 浓硫酸 碱石灰 防止空气中水蒸气进入D中
(4)黑色固体变成红色 白色粉末变成蓝色
化学试题卷
考试时间:90分钟;分值100分。
注意事项:
1.答卷前,考生将自己的姓名、准考证号填写在答题卷上。
2.答题时用黑色中性笔将答案写在答题卷上,未在答题卷上作答的一律无效。
3.考试结束后,上交答题卷。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Si:28 S:32 Cu:64 Zn:65
第I卷(选择题)
一、单项选择题(本题共15道小题,每题3分,共45分)
1.下列指定反应的离子方程式书写正确的是( )
A.向Na2SiO3溶液中通入过量CO2气体:+2
B.酸性介质中KMnO4氧化H2O2:2
C.将铝片加入氢氧化钠溶液中:2+2H2↑
D.向溴化亚铁中通入足量的氯气:
2.硫元素的价类二维图如图所示。下列说法错误的是
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e,溶液的酸性增强
C.盐g与盐f之间也可能发生反应
D.铜与c的浓溶液共热产生的气体通入Ba(NO3)2液中,无明显现象
实验室制取氧气的反应为2H2O2=2H2O+O2↑。在下列条件下,反应的速率最快的是( )
选项 H2O2的质量分数 温度 催化剂
A 5% 5℃ MnO2
B 5% 40℃ MnO2
C 10% 5℃ 无
D 10% 40℃ MnO2
4.如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是( )
选项 M N P
A 锌 铜 稀硫酸
B 银 锌 硝酸银溶液
C 铜 铁 稀盐酸
D 锌 铁 硝酸铁溶液
5.一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,下列对该反应的推断合理的是( )
A.该反应的化学方程式为3B+4D6A+2C
B.反应进行到6 s时B的转化率为40%
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
6.化学反应:A2+B2===2AB的能量变化如图所示,则下列说法正确的是( )
A.断裂2 mol A—B需要吸收y kJ的能量
B.断裂1 mol A—A和1 mol B—B放出x kJ的能量
C.1 mol A2和1 mol B2完全反应吸收(y-x)kJ热量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
7.工业上用洗净的废铜屑作原料制取硝酸铜。为节约原料和防止环境污染,宜采取的方法是( )
A.Cu+HNO3(浓)―→Cu(NO3)2 B.Cu+HNO3(稀)―→Cu(NO3)2
C.Cu CuO Cu(NO3)2
D.Cu CuSO4 Cu(NO3)2
8.将SO2气体通入BaCl2溶液,无明显现象,然后再通入X气体或加入X溶液,有白色沉淀生成,X不可能是( )
A.Cl2 B.CO2 C.H2O2 D.NH3·H2O
9.在一定条件下,对于密闭容器中进行的反应:X(g) + Y(g)2Z(g),下列说法能充分说明该反应已达到化学平衡状态的是 ( )
A. X、Y、Z的浓度相等 B. 正、逆反应速率均等于零
C. X、Y、Z在容器中共存 D. X、Y、Z的浓度均不再改变
10.用20 mL 18.4 mol·L-1的浓硫酸与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液加水稀释到100 mL,所得溶液中SO的浓度为3.18 mol·L-1,则此时溶液中CuSO4的物质的量浓度为( )
A.0.50 mol·L-1 B.0.75 mol·L-1 C.1.00 mol·L-1 D.3.18 mol·L-1
图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
图1 图2
A.铜棒的质量 B.c(Zn2+) C.c(H+) D.c(SO)
12.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
部分实验现象 a极质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
13.某单液电池如图所示,其反应原理为H2+2AgCl=2Ag+2HCl。下列说法正确的是
A.右侧Pt电极为负极 B.溶液中H+向右侧电极移动
C. 左侧电极上发生还原反应 D.右侧电极的电极反应式为AgCl-e-=Ag+Cl-
14.可以将反应Zn+Br2===ZnBr2设计成蓄电池,下列4个电极反应中,分别表示正极反应和负极反应的是( )
①Br2+2e-===2Br- ②2Br--2e-===Br2
③Zn-2e-===Zn2+ ④Zn2++2e-===Zn
A.②和③ B.②和①
C.①和③ D.④和①
15.硅谷是世界上最知名的电子工业集中地,以硅芯片的设计与制造著称于世。下列有关硅的说法正确的是( )
A.硅既不易失去电子又不易得到电子,所以既不能作氧化剂,又不能作还原剂
B.硅是构成矿物和岩石的主要元素,硅在地壳中的含量居第一位
C.硅的化学性质不活泼,在自然界中以游离态的形式存在
D.在电子工业中,硅是最重要的半导体材料
第II卷(非选择题 共55分)
16.(除说明外,每空2分,共 9分)化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如下(所取溶液体积均为2 mL):
实验编号 温度/℃ c(Na2S2O3)/mol·L-1 c(H2SO4)/mol·L-1
Ⅰ 25 0.1 0.1
Ⅱ 25 0.2 0.1
Ⅲ 50 0.2 0.1
①上述实验中溶液最先变浑浊的是______(填实验编号,下同)。(1分)
②为探究浓度对化学反应速率的影响,应选择______和______。(每空1分)
(2)某温度下,在1 L密闭容器中,发生反应:2X(g)+Y(g)2Z(g),X的物质的量随时间的变化如下表:
时间/s 0 1 2 3 4 5
X的物质的量/mol 0.02 0.01 0.008 0.007 0.007 0.007
①用X的浓度变化表示0~2 s的平均化学反应速率为______mol/(L·s)。
②在3 s以后X的浓度不再改变,反应达到了______状态。
③能说明该反应已达到化学平衡状态的是______(填序号)。
A.v正(X)=v逆(X)
B.单位时间内有2 mol X生成同时有1 mol Y生成
C.X、Y、Z的分子数之比为2∶1∶2
17.(每空2分,共10分) H2与O2、F2均能发生反应,如图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答下列问题:
(1)完成转化I、II____________(填“吸收”或“放出”,下同)能量,完成转化III____________能量。
(2)H2和F2反应能量变化图可用____________(填“A”或“B”)表示。
(3)如图是宇宙飞船上使用的一种新型电池装置。A、B两个电极均由多孔的碳块组成,该电池正极的电极反应式为____________;若将该装置中的氢气换成甲烷,其余都不改变,对应装置的负极电极反应式为____________。
18.(除说明外,每空2分,共 11分)非金属单质A经下图所示的过程可转化为含氧酸D,已知D为强酸。请回答下列问题。
ABCD
(1)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是_________。
②D的浓溶液在常温下可与铜反应并生成C气体,该反应的化学方程式为________;体现D的什么性质________。
(2)氮化硅Si3N4)可由石英与焦炭在高温的氮气流中通过以下反应制备:
3SiO2+ 6C+ 2N2Si3N4 + 6CO
①请写出氮化硅中氮元素的化合价是________,以上反应中的氧化剂是________,还原剂是________。(每空1分)
②若该反应生成11.2L一氧化碳(标准状况),则生成氮化硅的质量是________ ( 保留小数点后一位)。
19.(除说明外,每空2分,共 12分)在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从3min到9min,v(H2)=___________。
(2)若降低温度,则该反应的正反应速率___________(填“加快”“减慢”或“不变”。下同),逆反应速率___________。(每空1分)
(3)第4min时,正、逆反应速率的大小关系为___________(填“>““<”“=”)。
(4)能说明上述反应达到平衡状态的是___________(填字母)。
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体中CO2的浓度不再改变
C.单位时间内生成1mol H2,同时生成1mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(5)平衡时CO2的转化率为___________。
(6)反应达到平衡,此时体系内压强与开始时的压强之比为___________。
20.(除说明外,每空2分,共 13分)某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该发生装置略去),试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为______________________________________。
(2)乙同学认为还可能产生氢气的理由是_______________________________。
(3)A中加入的试剂可能是________(1分),作用是__________________________;
B中加入的试剂可能是________(1分);E中加入的试剂可能是________(1分),作用是_____________________________。
(4)可以证明气体X中含有氢气的实验现象是C中:________________(1分),D中:_______________(1分)。
参考答案
选择题
题号 1 2 3 4 5 6 7 8
选项 B D D B C A C B
题号 9 10 11 12 13 14 15
选项 D A C C B C D
16、(1) ① Ⅲ ②Ⅰ;Ⅱ (2)① 0.006 ②平衡 ③ A
17、(1)吸收 放出 (2)A
(3)O2+4e-+2H2O=4OH-
CH4-8e-+10OH-=CO32-+7H2O
18.(1)①N2 NO2
②Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 氧化性、酸性
(2)①-3 N2 C ②11.7
19、(1)0.126 (2) 减慢 减慢 (3)> (4)BD
(5)75% (6) 3:4
20、(1)Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O
(2)Zn与浓硫酸反应过程中,浓硫酸逐渐变稀,Zn与稀硫酸反应可产生H2
(3)品红溶液 检验SO2 浓硫酸 碱石灰 防止空气中水蒸气进入D中
(4)黑色固体变成红色 白色粉末变成蓝色
同课章节目录
