【全国百强校】江西省南昌二中2013-2014学年高中化学选修4第三章第二节《溶液的pH和pH的计算》教学课件(人教版,21张PPT)
文档属性
| 名称 | 【全国百强校】江西省南昌二中2013-2014学年高中化学选修4第三章第二节《溶液的pH和pH的计算》教学课件(人教版,21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 996.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-06-27 11:04:49 | ||
图片预览





文档简介
课件21张PPT。版本 学段 学科 模块南昌二中 刘 勇水溶液中的离子平衡第三章水的电离和溶液的酸碱性第二节第二课时
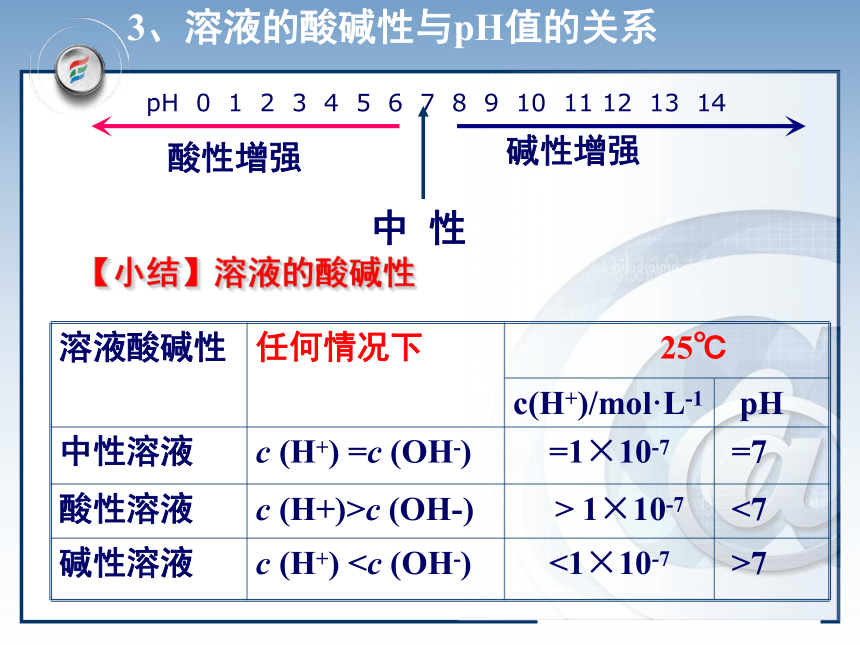
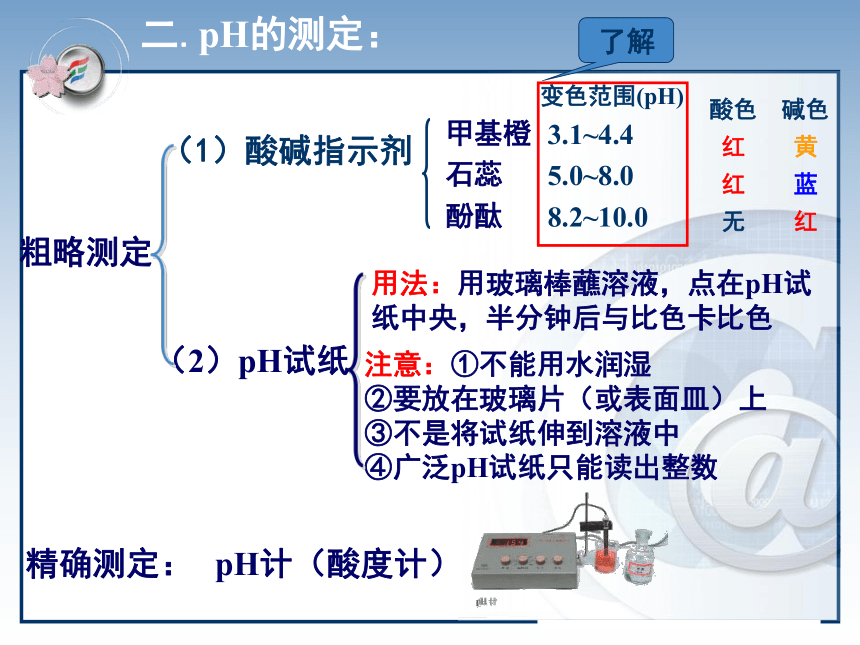
溶液的pH和pH计算溶液的酸碱性C(H+)=C(OH-)=1×10-7mol/LC(H+)>C(OH-) C(H+)>1×10-7mol/LC(H+) 的稀溶液的酸碱性。说明:(2)pH的数值范围:0~14之间 (3)C(H+) ﹥ 1mol/L或C(OH-) ﹥ 1mol/L时,可直接用C(H+) 或C(OH-)表示溶液的酸碱性。一定温度下C(H+)越大,溶液酸性越强。 C(OH-)越大,溶液碱性越强,酸性越弱。 (4)一定温度下,pH越小,则C(H+) 越大,溶液酸性越强,碱性越弱。反之,pH越大,则C(OH-)越大,溶液碱性越强,酸性越弱。【小结】溶液的酸碱性 pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 酸性增强碱性增强中 性3、溶液的酸碱性与pH值的关系二.pH的测定:pH计(酸度计)(2)pH试纸注意:①不能用水润湿
②要放在玻璃片(或表面皿)上
③不是将试纸伸到溶液中
④广泛pH试纸只能读出整数粗略测定(1)酸碱指示剂甲基橙
石蕊
酚酞酸色 碱色
红 黄
红 蓝
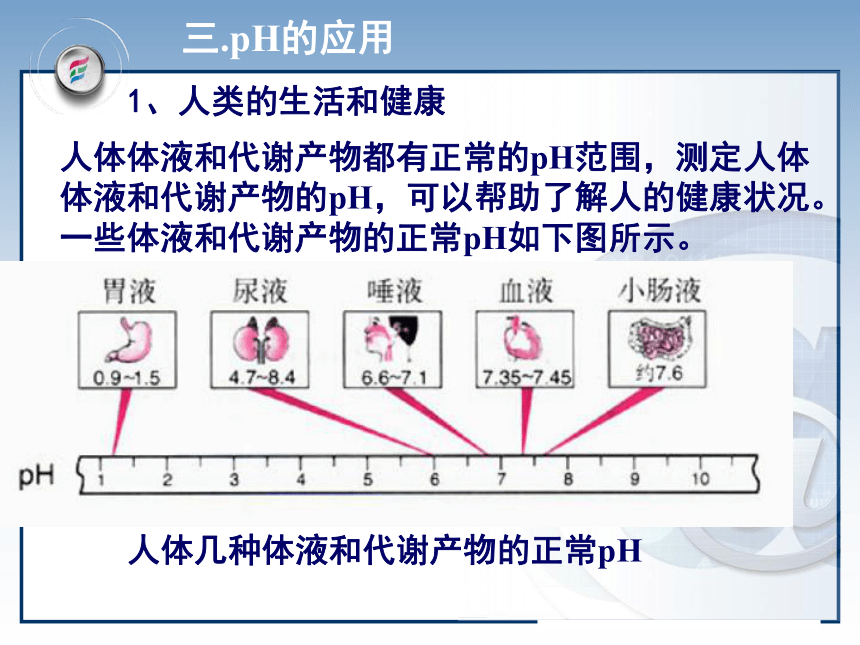
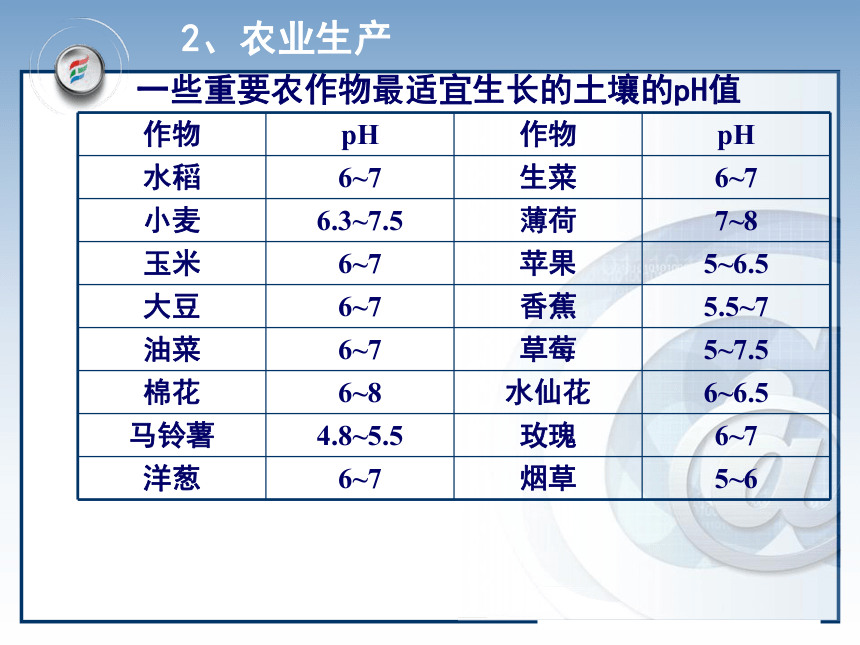
无 红精确测定:用法:用玻璃棒蘸溶液,点在pH试纸中央,半分钟后与比色卡比色人体几种体液和代谢产物的正常pH人体体液和代谢产物都有正常的pH范围,测定人体体液和代谢产物的pH,可以帮助了解人的健康状况。一些体液和代谢产物的正常pH如下图所示。 三.pH的应用1、人类的生活和健康一些重要农作物最适宜生长的土壤的pH值2、农业生产3、环境保护 环保领域,用PH自动仪进行监测和控制废水的排放。4、科学实验 测定酸碱浓度的酸碱中和滴定中,溶液PH的变化是判断滴定终点的依据5、工业生产 控制溶液的PH是影响实验结果或产品质量、产量的一个关键因素四、溶液pH的计算1.溶液pH的计算的思路:(1)强酸溶液由C(H+)直接求出pH (2)强碱溶液 C(OH-) C(H+) pH。例1:计算250C时0.01 mol/L的盐酸溶液的pH。例2:计算250C时0.01 mol/L的NaOH溶液的pH。判断溶液酸碱性解:C(H+)=C(HCl)= 0.01 mol/L ∴ pH= -lg{c(H+)}= -lg 0.01=2分析: NaOH溶液呈碱性,先计算溶液中OH-浓度。解:C(OH-)=C(NaOH)= 0.01 mol/LC(H+)=KWC(OH-)=1×10-140.01 =10-12∴ pH=122、有关几种常见PH的计算:pH=-lg{c(H+)}1、溶液的稀释2、强酸与强酸的混合
强碱与强碱的混合3、强酸、强碱混合pH计算1— 酸的稀释例题:①在25℃时,pH等于2的盐酸溶液稀释到原来的10倍,pH等于多少?稀释到1000倍后, pH等于多少?解:pH=-lgc(H+)=-lg10-2/10=-lg10-3=3此时不能忽视H2O的电离产生的H+。
设水产生的c(H+)=c(OH-)=x,则有:(10-8+x)·x=10-14
x≈0.95×10-7mol/L c(H+)=KW/c(OH-)
pH=-lg 10-14 /0.95×10-8 =14-8+0.98=6.98由HCl 产生的c(H+)=10-5/1000=10-8mol/L. ②在25℃时,pH等于5的盐酸溶液稀释到原来的1000倍后, pH等于多少?解:pH=-lgc(H+)=-lg10-2/1000=-lg10-5=5pH计算2—— 碱的稀释例题:在25℃时,pH等于9的强碱溶液稀释到原来的10倍,pH等于多少?稀释到1000倍后, pH等于多少?解:①c(OH-)=10—5/10≈10-6pH=-lgc(H+)=-lgKW/c(OH-)=-lg10-14/10-6=8②c(OH-)=10-5/1000=10-8mol/L设溶液中c(H+)=x,则有: x(x+10-8)=10-14
解得:x=0.95×10-7mol/L
pH=-lg0.95×10-7
=8-0.98
=7.02=lg10-8pH的计算3—强酸与强酸的混合(抓住H+计算)例、pH=4和pH=5的两种盐酸溶液等体积混合,求混合溶液的pH值。 PH=4.3pH=4的盐酸,C(H+)=10-4mol/L解:pH=5的盐酸,C(H+)=10-5mol/L设盐酸的体积为V L,则混合溶液的C(H+)为:pH=-lgc(H+)= =-lg (5.5×10-5)pH的计算4—强碱与强碱混合(抓住OH-计算)例1、pH=10和pH=8的两种NaOH溶液等体积混合,
求混合溶液的pH值。PH=9.7解:pH=10的NaOH溶液,C(OH-)=10-4mol/LpH=8的NaOH溶液,C(OH-)=10-6mol/L设NaOH溶液的体积为V L,则混合溶液的C(OH-)为:pH=-lgc(H+)= =-lgKWC(OH-)=5.05×10-51×10-14例2:在25℃时,pH=10与pH=12氢氧化钠溶液等体积混合后,溶液中c(H+)等于多少?解:①c(H+)=(10-10+10-12)mol/(1+1)L=0.5×10-10 mol/L正确的是 。②c(OH-)=(10-4+10-2)mol/(1+1)L= 0.5×10-2 mol/Lc(H+)=10-14/ 0.5×10-2=2×10-12 mol/L关键:碱性溶液中抓住OH-进行计算②pH值计算5——强酸、强碱的混合例1、0.1L pH=2盐酸和0.1L pH=11的NaOH溶液相混合,求混合后溶液的pH值。
?
?
?
例2、pH=2盐酸和pH=13的Ba(OH)2溶液等体积相混合,求混合后溶液的pH值。pH=2.35pH=12.66pH计算5—— 强酸与强碱混合2.室温时将pH=3的强酸与pH=12的强碱混合,当混合液的pH =7时,强酸与强碱的体积比为 ( )
A 10:1 B 3:1 C 1:2 D 2:5A1.下列溶液肯定是酸性的是: ( )
A 含H+的溶液 B 能使酚酞显无色的溶液 C pH ﹤7的溶液 D C (OH-) ﹤C (H+) 的溶液D 3、60mL0.5mol·L-1NaOH溶液和40mL0.4mol·L-1的H2SO4相混合后,溶液的pH约为 ( ) A.0.5 B.1.7 C.2 D.13.2B4、有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用纯净干燥的玻璃棒蘸取试样进行检测。该学生的操作方法___________(填“正确”或“不正确”),理由是:_______________________________________________________________ ;?分析此操作方法,_____(填“一定”或“不一定”)会产生误差,理由是
不正确若溶液不显中性,则H+和OH-均被稀释,测出的不是原溶液对应的pH。当溶液为中性时则不产生误差。不一定谢谢大家!
溶液的pH和pH计算溶液的酸碱性C(H+)=C(OH-)=1×10-7mol/LC(H+)>C(OH-) C(H+)>1×10-7mol/LC(H+)
②要放在玻璃片(或表面皿)上
③不是将试纸伸到溶液中
④广泛pH试纸只能读出整数粗略测定(1)酸碱指示剂甲基橙
石蕊
酚酞酸色 碱色
红 黄
红 蓝
无 红精确测定:用法:用玻璃棒蘸溶液,点在pH试纸中央,半分钟后与比色卡比色人体几种体液和代谢产物的正常pH人体体液和代谢产物都有正常的pH范围,测定人体体液和代谢产物的pH,可以帮助了解人的健康状况。一些体液和代谢产物的正常pH如下图所示。 三.pH的应用1、人类的生活和健康一些重要农作物最适宜生长的土壤的pH值2、农业生产3、环境保护 环保领域,用PH自动仪进行监测和控制废水的排放。4、科学实验 测定酸碱浓度的酸碱中和滴定中,溶液PH的变化是判断滴定终点的依据5、工业生产 控制溶液的PH是影响实验结果或产品质量、产量的一个关键因素四、溶液pH的计算1.溶液pH的计算的思路:(1)强酸溶液由C(H+)直接求出pH (2)强碱溶液 C(OH-) C(H+) pH。例1:计算250C时0.01 mol/L的盐酸溶液的pH。例2:计算250C时0.01 mol/L的NaOH溶液的pH。判断溶液酸碱性解:C(H+)=C(HCl)= 0.01 mol/L ∴ pH= -lg{c(H+)}= -lg 0.01=2分析: NaOH溶液呈碱性,先计算溶液中OH-浓度。解:C(OH-)=C(NaOH)= 0.01 mol/LC(H+)=KWC(OH-)=1×10-140.01 =10-12∴ pH=122、有关几种常见PH的计算:pH=-lg{c(H+)}1、溶液的稀释2、强酸与强酸的混合
强碱与强碱的混合3、强酸、强碱混合pH计算1— 酸的稀释例题:①在25℃时,pH等于2的盐酸溶液稀释到原来的10倍,pH等于多少?稀释到1000倍后, pH等于多少?解:pH=-lgc(H+)=-lg10-2/10=-lg10-3=3此时不能忽视H2O的电离产生的H+。
设水产生的c(H+)=c(OH-)=x,则有:(10-8+x)·x=10-14
x≈0.95×10-7mol/L c(H+)=KW/c(OH-)
pH=-lg 10-14 /0.95×10-8 =14-8+0.98=6.98由HCl 产生的c(H+)=10-5/1000=10-8mol/L. ②在25℃时,pH等于5的盐酸溶液稀释到原来的1000倍后, pH等于多少?解:pH=-lgc(H+)=-lg10-2/1000=-lg10-5=5pH计算2—— 碱的稀释例题:在25℃时,pH等于9的强碱溶液稀释到原来的10倍,pH等于多少?稀释到1000倍后, pH等于多少?解:①c(OH-)=10—5/10≈10-6pH=-lgc(H+)=-lgKW/c(OH-)=-lg10-14/10-6=8②c(OH-)=10-5/1000=10-8mol/L设溶液中c(H+)=x,则有: x(x+10-8)=10-14
解得:x=0.95×10-7mol/L
pH=-lg0.95×10-7
=8-0.98
=7.02=lg10-8pH的计算3—强酸与强酸的混合(抓住H+计算)例、pH=4和pH=5的两种盐酸溶液等体积混合,求混合溶液的pH值。 PH=4.3pH=4的盐酸,C(H+)=10-4mol/L解:pH=5的盐酸,C(H+)=10-5mol/L设盐酸的体积为V L,则混合溶液的C(H+)为:pH=-lgc(H+)= =-lg (5.5×10-5)pH的计算4—强碱与强碱混合(抓住OH-计算)例1、pH=10和pH=8的两种NaOH溶液等体积混合,
求混合溶液的pH值。PH=9.7解:pH=10的NaOH溶液,C(OH-)=10-4mol/LpH=8的NaOH溶液,C(OH-)=10-6mol/L设NaOH溶液的体积为V L,则混合溶液的C(OH-)为:pH=-lgc(H+)= =-lgKWC(OH-)=5.05×10-51×10-14例2:在25℃时,pH=10与pH=12氢氧化钠溶液等体积混合后,溶液中c(H+)等于多少?解:①c(H+)=(10-10+10-12)mol/(1+1)L=0.5×10-10 mol/L正确的是 。②c(OH-)=(10-4+10-2)mol/(1+1)L= 0.5×10-2 mol/Lc(H+)=10-14/ 0.5×10-2=2×10-12 mol/L关键:碱性溶液中抓住OH-进行计算②pH值计算5——强酸、强碱的混合例1、0.1L pH=2盐酸和0.1L pH=11的NaOH溶液相混合,求混合后溶液的pH值。
?
?
?
例2、pH=2盐酸和pH=13的Ba(OH)2溶液等体积相混合,求混合后溶液的pH值。pH=2.35pH=12.66pH计算5—— 强酸与强碱混合2.室温时将pH=3的强酸与pH=12的强碱混合,当混合液的pH =7时,强酸与强碱的体积比为 ( )
A 10:1 B 3:1 C 1:2 D 2:5A1.下列溶液肯定是酸性的是: ( )
A 含H+的溶液 B 能使酚酞显无色的溶液 C pH ﹤7的溶液 D C (OH-) ﹤C (H+) 的溶液D 3、60mL0.5mol·L-1NaOH溶液和40mL0.4mol·L-1的H2SO4相混合后,溶液的pH约为 ( ) A.0.5 B.1.7 C.2 D.13.2B4、有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用纯净干燥的玻璃棒蘸取试样进行检测。该学生的操作方法___________(填“正确”或“不正确”),理由是:_______________________________________________________________ ;?分析此操作方法,_____(填“一定”或“不一定”)会产生误差,理由是
不正确若溶液不显中性,则H+和OH-均被稀释,测出的不是原溶液对应的pH。当溶液为中性时则不产生误差。不一定谢谢大家!
