【全国百强校】江西省南昌二中2013-2014学年高中化学选修4第三章第二节《水的电离和溶液的酸碱性》教学课件(人教版,18张PPT)
文档属性
| 名称 | 【全国百强校】江西省南昌二中2013-2014学年高中化学选修4第三章第二节《水的电离和溶液的酸碱性》教学课件(人教版,18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 720.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-06-27 11:06:22 | ||
图片预览


文档简介
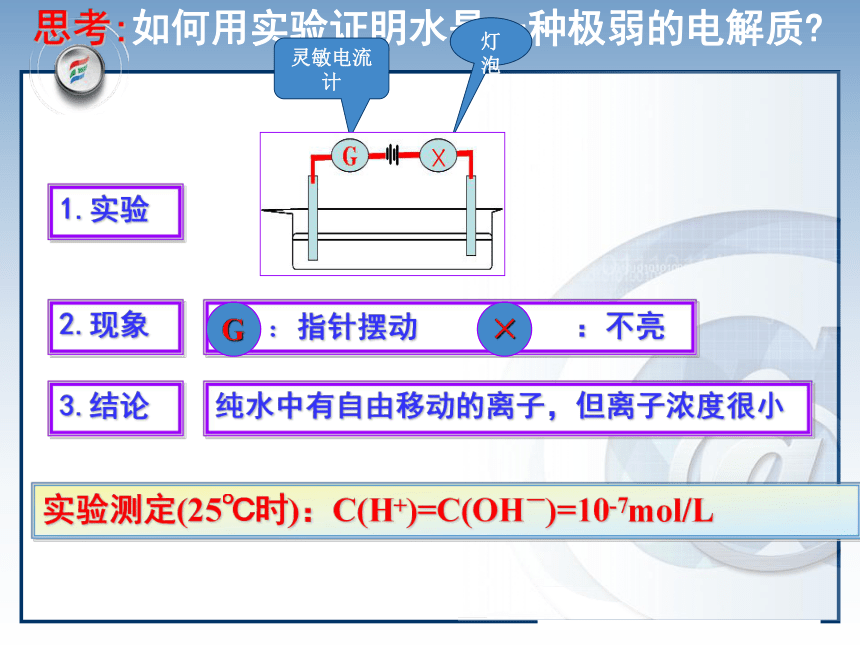
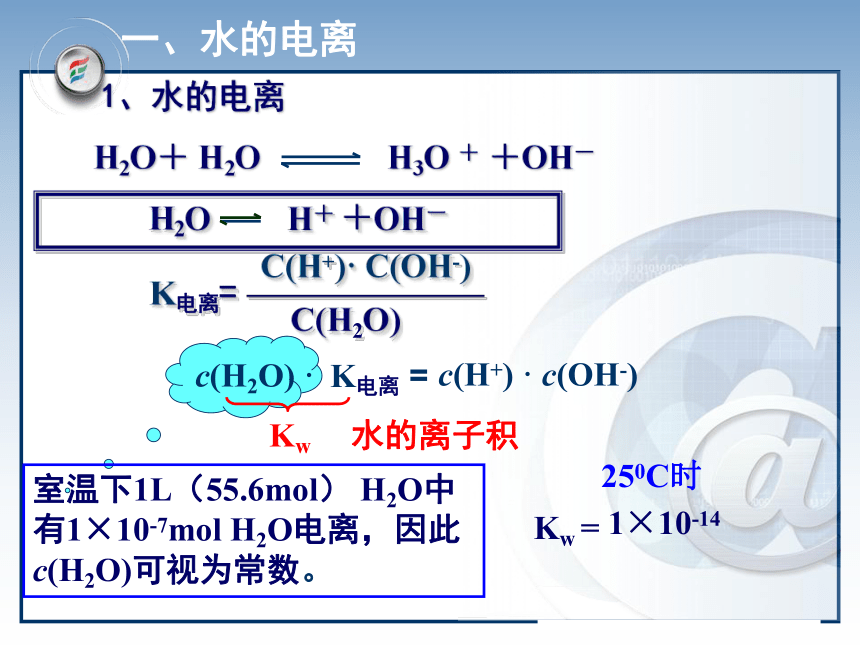
课件18张PPT。版本 学段 学科 模块南昌二中 刘 勇水溶液中的离子平衡第三章水的电离和溶液的酸碱性第二节第一课时 水的电离和溶液的酸碱性思考:如何用实验证明水是一种极弱的电解质?1.实验2.现象3.结论纯水中有自由移动的离子,但离子浓度很小实验测定(25℃时):C(H+)=C(OH-)=10-7mol/L灵敏电流计灯泡一、水的电离室温下1L(55.6mol) H2O中
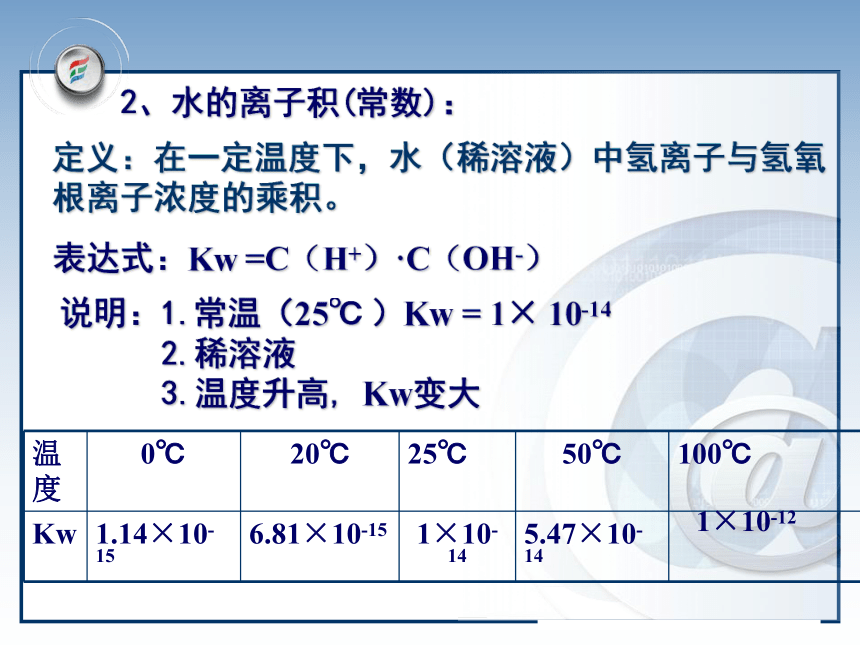
有1×10-7mol H2O电离,因此c(H2O)可视为常数。 水的离子积1×10-14H2O+ H2O H3O + +OH-K电离=C(H+)· C(OH-)C(H2O)1、水的电离2、水的离子积(常数):定义:在一定温度下,水(稀溶液)中氢离子与氢氧根离子浓度的乘积。表达式:Kw =C(H+)·C(OH-)说明:1.常温(25℃ )Kw = 1× 10-14 2.稀溶液
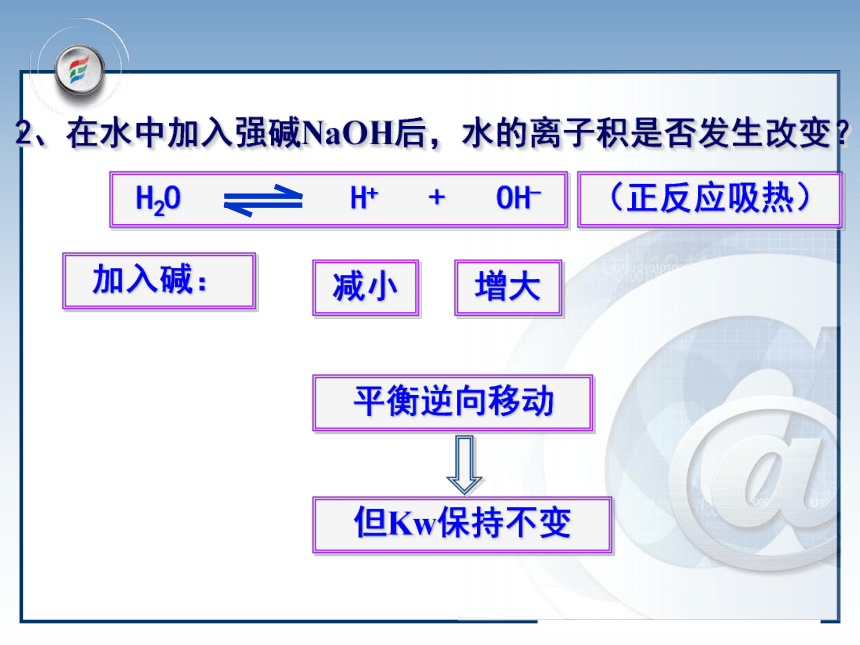
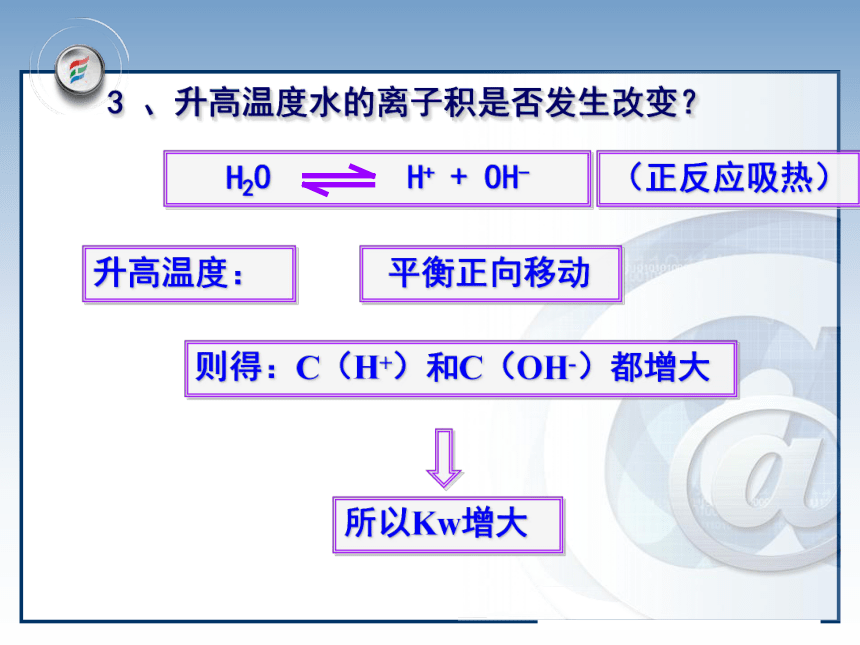
3.温度升高, Kw变大1×10-12加入酸:增大减少平衡逆向移动但Kw保持不变(正反应吸热) 1、在水中加入盐酸后,水的离子积是否发生改变?问题与讨论加入碱:减小增大平衡逆向移动但Kw保持不变(正反应吸热)2、在水中加入强碱NaOH后,水的离子积是否发生改变?升高温度: 平衡正向移动则得:C(H+)和C(OH-)都增大所以Kw增大(正反应吸热)3 、升高温度水的离子积是否发生改变?1、酸2、碱3、温度抑制水的电离,Kw保持不变升高温度促进水的电离,Kw增大 注意:Kw是一个温度函数,只随温度的升高而增大二、影响水的电离平衡的因素讨论:对常温下的纯水进行下列操作,完成下表: 中性正反应增大增大C(H+)=C(OH-)增大酸性逆反应增大减小C(H+)>C(OH-)不变碱性逆反应减小增大C(H+) Kw= C(H+)×C(OH-)=1×10-14(3)在溶液中,Kw中的C(OH-) 、C(H+)指溶液中 总的离子浓度.(4)不论是在中性溶液还是在酸碱性溶液中,C(H+)与C(OH-)可能相等也可能不等,但由水电离出的C(H+)水=C(OH-)水三.溶液的酸碱性与C(H+) 、C(OH-)的关系1.关系(25℃):C(H+)=C(OH-)=1×10-7mol/LC(H+)>C(OH-) C(H+)>1×10-7mol/LC(H+)意①水溶液中H+与OH-始终共存②酸性溶液:C(H+)>C(OH-) ;C(H+)越大酸性越强③碱性溶液:C(H+)一.水的电离:
1、水是一种极弱的电解质,能微弱的电离;
2、水的离子积常数Kw ;
3、影响水电离的因素。
二.判断溶液酸碱性
三.计算酸溶液或碱溶液中水电离出的C(H+)和C(OH-)课堂小结本节课我主要学习了:谢谢大家!
有1×10-7mol H2O电离,因此c(H2O)可视为常数。 水的离子积1×10-14H2O+ H2O H3O + +OH-K电离=C(H+)· C(OH-)C(H2O)1、水的电离2、水的离子积(常数):定义:在一定温度下,水(稀溶液)中氢离子与氢氧根离子浓度的乘积。表达式:Kw =C(H+)·C(OH-)说明:1.常温(25℃ )Kw = 1× 10-14 2.稀溶液
3.温度升高, Kw变大1×10-12加入酸:增大减少平衡逆向移动但Kw保持不变(正反应吸热) 1、在水中加入盐酸后,水的离子积是否发生改变?问题与讨论加入碱:减小增大平衡逆向移动但Kw保持不变(正反应吸热)2、在水中加入强碱NaOH后,水的离子积是否发生改变?升高温度: 平衡正向移动则得:C(H+)和C(OH-)都增大所以Kw增大(正反应吸热)3 、升高温度水的离子积是否发生改变?1、酸2、碱3、温度抑制水的电离,Kw保持不变升高温度促进水的电离,Kw增大 注意:Kw是一个温度函数,只随温度的升高而增大二、影响水的电离平衡的因素讨论:对常温下的纯水进行下列操作,完成下表: 中性正反应增大增大C(H+)=C(OH-)增大酸性逆反应增大减小C(H+)>C(OH-)不变碱性逆反应减小增大C(H+)
1、水是一种极弱的电解质,能微弱的电离;
2、水的离子积常数Kw ;
3、影响水电离的因素。
二.判断溶液酸碱性
三.计算酸溶液或碱溶液中水电离出的C(H+)和C(OH-)课堂小结本节课我主要学习了:谢谢大家!
