【全国百强校】江西省南昌二中2013-2014学年高中化学选修4第三章第三节《pH的应用:酸碱中和滴定》教学课件(人教版,30张PPT)
文档属性
| 名称 | 【全国百强校】江西省南昌二中2013-2014学年高中化学选修4第三章第三节《pH的应用:酸碱中和滴定》教学课件(人教版,30张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 848.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-06-27 11:09:16 | ||
图片预览











文档简介
课件30张PPT。版本 学段 学科 模块南昌二中 刘 勇水溶液中的离子平衡第三章第一课时第三节 pH的应用酸碱中和滴定化学分析:第一类:定性分析:鉴定物质成分组成
(1)焰色反应检验金属元素
(2)通过化学反应检验离子、分子等
第二类:定量分析:测定各物质成分的含量
酸碱中和滴定 是一种常用的定量分析方法化学研究物质的方法 一、酸碱中和滴定原理 1、 定义:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。 2、 原理:以酸碱中和反应为基础,
H+ + OH- = H2O
在滴定达到终点(即酸碱恰好反应)时: 1mol1mol 有 n(H+) = n(OH-) 在反应时,酸和碱起反应的物质的量之比等于它们的化学计量数之比。例如:
HCl + NaOH = NaCl + H2O
H2SO4 + 2NaOH = Na2 SO4 + 2H2O
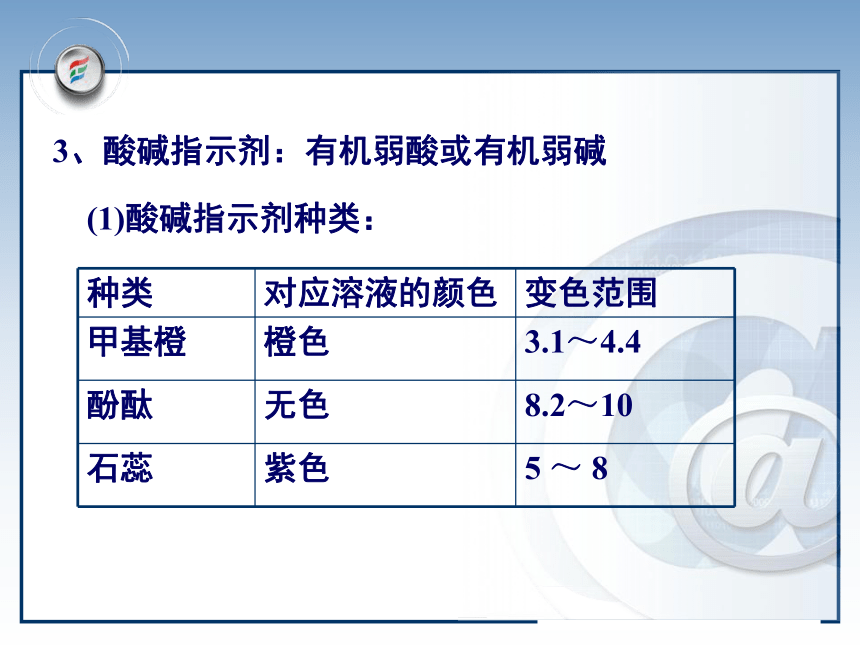
H3PO4 + 3NaOH = Na3PO4 + 3H2O 因为:则:所以:当:一元酸和一元碱进行中和滴定时:例:测B溶液浓度C(B)滴入A溶液 消耗VA L取B溶液 VB L代入即可求出B溶液浓度C(B)例题1: 用 0.1032mol/L的HCl溶液滴定25.00mL未知浓度的NaOH溶液,滴定完成时,用去HCl溶液27.84mL。通过中和滴定测得NaOH的物质的量浓度是多少?解:这是一元酸和一元碱的中和滴定,据:= 0.1149mol/L答:测得NaOH的物质的量浓度为0.1149mol/L。例题2:用0.1230mol/L的NaOH溶液滴定25.00mL未知浓度的盐酸酸溶液,滴定完成时用去NaOH溶液26.50mL。计算待测盐酸溶液的物质的量浓度。解:这是一元酸和一元碱的中和滴定,据:= 0.1160mol/L答:测得HCl的物质的量浓度为0.1160mol/L。 用中和反应进行中和滴定必须解决的关键问题是什么? ①准确测量参加反应的两种溶液的体积——选用更加精确仪器:酸式滴定管、碱式滴定管、移液管。 ②准确判断中和反应什么时候“恰好” 完全(即准确判断滴定终点) 方法:在待测溶液中加入酸碱指示剂(如酚酞,甲基橙)。3、酸碱指示剂:有机弱酸或有机弱碱(1)酸碱指示剂种类:甲基橙——— 3.1 ——— 4.4 ———酸性 中间色 碱性红色 橙色——— 5.0 ——— 8.0 —————— 8.2 ——— 10.0 ———红色 紫色 蓝色粉红色无色红色黄色石 蕊酚 酞(2)常用指示剂的变色范围内颜色(a)滴定前,加入滴定剂(HCl)的体积为0.00ml时:
0.1000mol/L的NaOH溶液中的氢离子浓度:算一算通过计算了解滴定过程中的pH。pH = -lg(1.0×10-13) = 13c(H+) = 1.0×10-14 / 1.0×10- 1 =1.0×10-13 用 0.1000mol/L的HCl溶液滴定20ml0.1000mol/L NaOH溶液(b)滴定中,(pH取决于剩余NaOH的量)
如:加入滴定剂体积为18.00ml时:c(OH-) =0.1000×(20.00-18.00)20.00+18.00= 5.3×10-3 mol/Lc(H+) = 1.0×10-14 / 5.3×10- 3 =1.9×10-11pH = -lg(1.9×10-11) = 11.72c(OH-) =0.1000×(20.00-19.96)20.00+19.96= 1.0×10-4 mol/L 当加入滴定剂体积为19.96ml时(滴定时,每滴 溶液的体积约为0.04ml):c(H+) = 1.0×10-14 / 1.0×10- 4 =1.0×10-10pH = -lg(1.0×10-10) = 10(c)当酸和碱刚好反应完全时(即加入滴定剂HCl的体积刚好为20.00ml时):pH =7(d)当滴定剂HCl过量时
假设刚好多滴加一滴HCl(即HCl过量0.04ml)c(H+) =0.1000×0.0420.00 + 20.04= 1.0×10-4 mol/LpH = -lg(1.0×10-10) = 4 由于指示剂的变色范围不是7所引起的误差是很小的。结论滴加体积:0.00~19.96ml,
△pH = 13 - 10 = 3滴加体积:19.96~20.04ml,
△pH = 10 - 4 = 6,发生滴定突越。计算出不同滴定点时溶液的pH值,部分结果列于表PH1210864210203040突变范围反应终点加入盐酸(ml)中和滴定曲线 滴定曲线不仅说明了滴定时溶液pH值的变化方向,而且也说明了各个阶段的变化速度。 在化学计量点附近pH值有一个突变过程, 这种pH值突变称之为滴定突跃,突跃所在的pH值范围称为滴定突跃范围 (常用化学计量点前后各0.1%的pH范围表示),本例的突跃范围是(4.30-9.70) 二、指示剂的选择 最理想的指示剂应该能恰好在反应的化学计量点发生颜色变化。 指示剂的选择主要以滴定的突跃范围为依据,通常选取变色范围全部或部分处在突跃范围内的指示剂滴定终点,这样产生的误差不会超过±0.1% 指示剂的选择原则 (1)终点时,指示剂的颜色变化明显(2)变色范围越窄越好,对溶液的酸碱性变化较灵敏 ①甲基橙和酚酞的变色范围较小:4.4-3.1=1.3
10-8=2 对溶液的酸碱性变化较灵敏说明:②一般不用石蕊作指示剂,主要原因是:石蕊的“红色→紫色”、“紫色→蓝色”的颜色变化不够明显;且变色范围较大:8-5=3,不利于及时、准确地作出酸碱是否恰好完全中和的判断。(3)指示剂的变色范围与恰好中和时的pH要吻合 ③指示剂用量常用2—3滴,因指示剂本身也是弱酸或弱碱。若用量过多,会使滴定时酸或碱的消耗量增加。 ④pH突跃范围:等当点前后1%相对误差范围内溶液pH的变化,称为“pH突跃范围”。【总结】
⑴在滴定终点前后,溶液的pH发生突跃。
⑵甲基橙和酚酞的变色点落在溶液pH的突跃范围内。
⑶按pH突跃范围内的体积计算,结果可以达到足够的准确度。在突跃范围内能引起指示剂变色的指示剂可以作为该滴定的指示剂。酸碱中和滴定是一个非常精确的定量实验。 说明:在突跃范围内停止滴定,测定结果有足够的准确度。4.滴定终点的判断例:用0.1mol·L-1 NaOH溶液的滴定25mL未知浓度的盐酸。求(1)下列情况时溶液的pH :①多加1滴NaOH ② 少加1滴NaOH(设1滴为1/20 mL)②少加1滴NaOH,此时盐酸过量,溶液呈酸性C(H+)=0.1mol/L×1/2050=10-4mol/L解(1) ①多加1滴NaOH,此时NaOH过量,溶液呈碱性pH=4C(OH-)=0.1mol/L×1/2050=10-4mol/LpH=10【课堂练习】⑵ 若少加一滴NaOH溶液,计算所测盐酸的物质的量浓度是多少?并跟实际浓度相比较。解:c(HCl)=C(NaOH)·V[NaOH(aq)]V[HCl(aq)]0.1000mol/L×(0.0250-1/20×10-3)L0.0250 L= 0.0998mol/L跟实际浓度0.1000mol/L相比,误差很小。=【本课小结】本节课我主要学习了:1.酸碱中和滴定原理及计算方法
2.酸碱指示剂变色范围及选择
3.滴定终点的判断谢谢大家! 0 10 20 30 40 V(NaOH)mL 12 10 8 6 4 2
PH颜色突变范围中和滴定曲线7酚 酞强碱滴定强酸 0 10 20 30 40 V(NaOH)mL 12 10 8 6 4 2
PH颜色突变范围中和滴定曲线
74.4甲基橙
(1)焰色反应检验金属元素
(2)通过化学反应检验离子、分子等
第二类:定量分析:测定各物质成分的含量
酸碱中和滴定 是一种常用的定量分析方法化学研究物质的方法 一、酸碱中和滴定原理 1、 定义:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。 2、 原理:以酸碱中和反应为基础,
H+ + OH- = H2O
在滴定达到终点(即酸碱恰好反应)时: 1mol1mol 有 n(H+) = n(OH-) 在反应时,酸和碱起反应的物质的量之比等于它们的化学计量数之比。例如:
HCl + NaOH = NaCl + H2O
H2SO4 + 2NaOH = Na2 SO4 + 2H2O
H3PO4 + 3NaOH = Na3PO4 + 3H2O 因为:则:所以:当:一元酸和一元碱进行中和滴定时:例:测B溶液浓度C(B)滴入A溶液 消耗VA L取B溶液 VB L代入即可求出B溶液浓度C(B)例题1: 用 0.1032mol/L的HCl溶液滴定25.00mL未知浓度的NaOH溶液,滴定完成时,用去HCl溶液27.84mL。通过中和滴定测得NaOH的物质的量浓度是多少?解:这是一元酸和一元碱的中和滴定,据:= 0.1149mol/L答:测得NaOH的物质的量浓度为0.1149mol/L。例题2:用0.1230mol/L的NaOH溶液滴定25.00mL未知浓度的盐酸酸溶液,滴定完成时用去NaOH溶液26.50mL。计算待测盐酸溶液的物质的量浓度。解:这是一元酸和一元碱的中和滴定,据:= 0.1160mol/L答:测得HCl的物质的量浓度为0.1160mol/L。 用中和反应进行中和滴定必须解决的关键问题是什么? ①准确测量参加反应的两种溶液的体积——选用更加精确仪器:酸式滴定管、碱式滴定管、移液管。 ②准确判断中和反应什么时候“恰好” 完全(即准确判断滴定终点) 方法:在待测溶液中加入酸碱指示剂(如酚酞,甲基橙)。3、酸碱指示剂:有机弱酸或有机弱碱(1)酸碱指示剂种类:甲基橙——— 3.1 ——— 4.4 ———酸性 中间色 碱性红色 橙色——— 5.0 ——— 8.0 —————— 8.2 ——— 10.0 ———红色 紫色 蓝色粉红色无色红色黄色石 蕊酚 酞(2)常用指示剂的变色范围内颜色(a)滴定前,加入滴定剂(HCl)的体积为0.00ml时:
0.1000mol/L的NaOH溶液中的氢离子浓度:算一算通过计算了解滴定过程中的pH。pH = -lg(1.0×10-13) = 13c(H+) = 1.0×10-14 / 1.0×10- 1 =1.0×10-13 用 0.1000mol/L的HCl溶液滴定20ml0.1000mol/L NaOH溶液(b)滴定中,(pH取决于剩余NaOH的量)
如:加入滴定剂体积为18.00ml时:c(OH-) =0.1000×(20.00-18.00)20.00+18.00= 5.3×10-3 mol/Lc(H+) = 1.0×10-14 / 5.3×10- 3 =1.9×10-11pH = -lg(1.9×10-11) = 11.72c(OH-) =0.1000×(20.00-19.96)20.00+19.96= 1.0×10-4 mol/L 当加入滴定剂体积为19.96ml时(滴定时,每滴 溶液的体积约为0.04ml):c(H+) = 1.0×10-14 / 1.0×10- 4 =1.0×10-10pH = -lg(1.0×10-10) = 10(c)当酸和碱刚好反应完全时(即加入滴定剂HCl的体积刚好为20.00ml时):pH =7(d)当滴定剂HCl过量时
假设刚好多滴加一滴HCl(即HCl过量0.04ml)c(H+) =0.1000×0.0420.00 + 20.04= 1.0×10-4 mol/LpH = -lg(1.0×10-10) = 4 由于指示剂的变色范围不是7所引起的误差是很小的。结论滴加体积:0.00~19.96ml,
△pH = 13 - 10 = 3滴加体积:19.96~20.04ml,
△pH = 10 - 4 = 6,发生滴定突越。计算出不同滴定点时溶液的pH值,部分结果列于表PH1210864210203040突变范围反应终点加入盐酸(ml)中和滴定曲线 滴定曲线不仅说明了滴定时溶液pH值的变化方向,而且也说明了各个阶段的变化速度。 在化学计量点附近pH值有一个突变过程, 这种pH值突变称之为滴定突跃,突跃所在的pH值范围称为滴定突跃范围 (常用化学计量点前后各0.1%的pH范围表示),本例的突跃范围是(4.30-9.70) 二、指示剂的选择 最理想的指示剂应该能恰好在反应的化学计量点发生颜色变化。 指示剂的选择主要以滴定的突跃范围为依据,通常选取变色范围全部或部分处在突跃范围内的指示剂滴定终点,这样产生的误差不会超过±0.1% 指示剂的选择原则 (1)终点时,指示剂的颜色变化明显(2)变色范围越窄越好,对溶液的酸碱性变化较灵敏 ①甲基橙和酚酞的变色范围较小:4.4-3.1=1.3
10-8=2 对溶液的酸碱性变化较灵敏说明:②一般不用石蕊作指示剂,主要原因是:石蕊的“红色→紫色”、“紫色→蓝色”的颜色变化不够明显;且变色范围较大:8-5=3,不利于及时、准确地作出酸碱是否恰好完全中和的判断。(3)指示剂的变色范围与恰好中和时的pH要吻合 ③指示剂用量常用2—3滴,因指示剂本身也是弱酸或弱碱。若用量过多,会使滴定时酸或碱的消耗量增加。 ④pH突跃范围:等当点前后1%相对误差范围内溶液pH的变化,称为“pH突跃范围”。【总结】
⑴在滴定终点前后,溶液的pH发生突跃。
⑵甲基橙和酚酞的变色点落在溶液pH的突跃范围内。
⑶按pH突跃范围内的体积计算,结果可以达到足够的准确度。在突跃范围内能引起指示剂变色的指示剂可以作为该滴定的指示剂。酸碱中和滴定是一个非常精确的定量实验。 说明:在突跃范围内停止滴定,测定结果有足够的准确度。4.滴定终点的判断例:用0.1mol·L-1 NaOH溶液的滴定25mL未知浓度的盐酸。求(1)下列情况时溶液的pH :①多加1滴NaOH ② 少加1滴NaOH(设1滴为1/20 mL)②少加1滴NaOH,此时盐酸过量,溶液呈酸性C(H+)=0.1mol/L×1/2050=10-4mol/L解(1) ①多加1滴NaOH,此时NaOH过量,溶液呈碱性pH=4C(OH-)=0.1mol/L×1/2050=10-4mol/LpH=10【课堂练习】⑵ 若少加一滴NaOH溶液,计算所测盐酸的物质的量浓度是多少?并跟实际浓度相比较。解:c(HCl)=C(NaOH)·V[NaOH(aq)]V[HCl(aq)]0.1000mol/L×(0.0250-1/20×10-3)L0.0250 L= 0.0998mol/L跟实际浓度0.1000mol/L相比,误差很小。=【本课小结】本节课我主要学习了:1.酸碱中和滴定原理及计算方法
2.酸碱指示剂变色范围及选择
3.滴定终点的判断谢谢大家! 0 10 20 30 40 V(NaOH)mL 12 10 8 6 4 2
PH颜色突变范围中和滴定曲线7酚 酞强碱滴定强酸 0 10 20 30 40 V(NaOH)mL 12 10 8 6 4 2
PH颜色突变范围中和滴定曲线
74.4甲基橙
