【全国百强校】江西省南昌二中2013-2014学年高中化学必修1第一章第一节《混合物的分离与提纯(二)》教学课件(人教版)
文档属性
| 名称 | 【全国百强校】江西省南昌二中2013-2014学年高中化学必修1第一章第一节《混合物的分离与提纯(二)》教学课件(人教版) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-06-27 11:16:57 | ||
图片预览






文档简介
课件22张PPT。第一章 从实验学化学第一节
化学实验基本方法第三课时:
混合物的分离与提纯(2)南昌二中:刘勇一、蒸馏 用蒸馏原理进行多种液体的分离
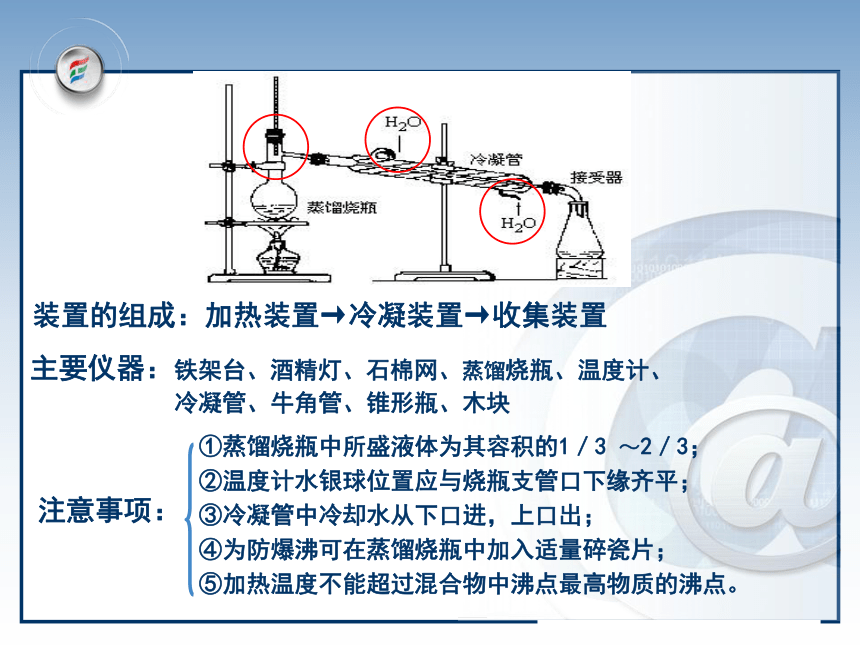
蒸馏:提纯或分离沸点不同的液体混合物的方法。分馏:除去酒精中的醋酸---加入生石灰后再蒸馏从石油中分离出汽油和柴油---分馏概念辨析装置的组成:加热装置→冷凝装置→收集装置主要仪器:铁架台、酒精灯、石棉网、蒸馏烧瓶、温度计、
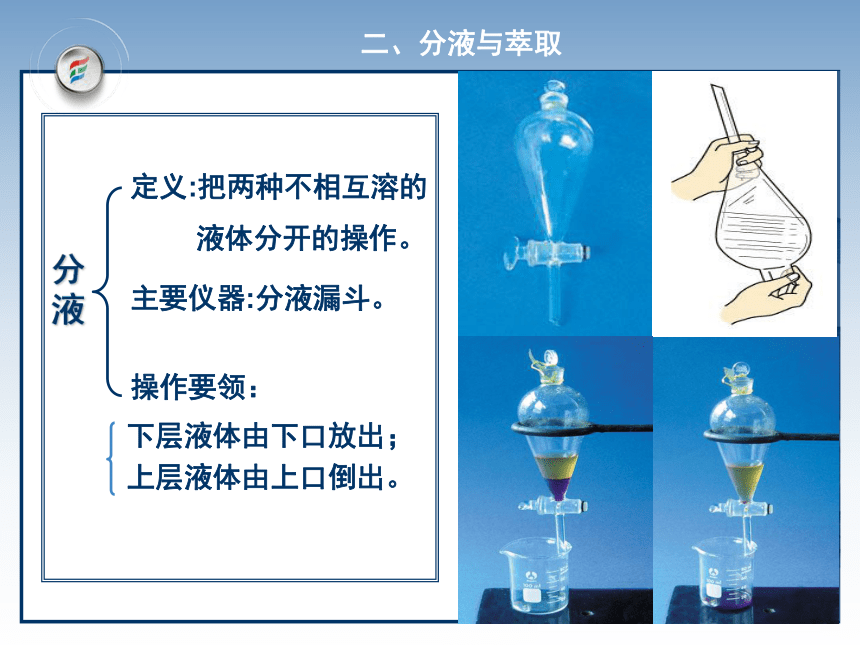
冷凝管、牛角管、锥形瓶、木块实验1-3 (1)自来水中Cl-的检验(2)蒸馏,制蒸馏水Cl-的检验:未知液AgNO3溶液白色沉淀稀HNO3沉淀不溶解结论:未知液中含有Cl-二、分液与萃取定义:把两种不相互溶的
液体分开的操作。
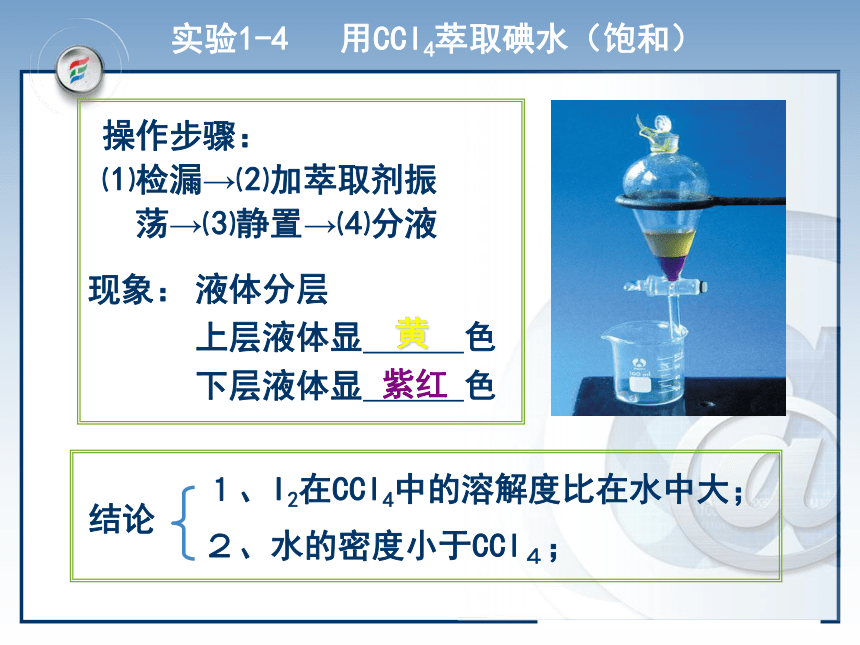
主要仪器:分液漏斗。下层液体由下口放出;上层液体由上口倒出。操作要领:分液定义:用一种溶剂把溶质从它与另一种溶剂所用仪器:分液漏斗、铁架台、烧杯 萃取所组成的溶液中提取出来的方法。应用:天然香料、药物的提取、核燃料的处理等例如:提取碘水中的碘实验1-4 用CCl4萃取碘水(饱和)现象:液体分层
上层液体显 色
下层液体显 色黄紫红操作步骤:
⑴检漏→⑵加萃取剂振
荡→⑶静置→⑷分液 在分液漏斗中完成萃取操作,静置分层后,如果不知道哪一层是“水层”,试设计一种简便的方法加以判断。取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中下层是“水层”;反之,则上层是水层。 思考与交流混合物的分离提纯归纳与整理
离子的检验CO32- +2H+=H2O+CO2↑
CO2+Ca2++2OH- = CaCO3↓+H2OAg++Cl-=AgCl↓1.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A . 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C . 分液、蒸馏、萃取 D. 蒸馏、萃取、分液C2.已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g/mL ,沸点约为55℃。要从水与丙酮的混合液里将丙酮分离出来,下列方法中最合理的是( )
A. 蒸馏 B. 分液 C.过滤 D.蒸发B课堂练习 3.下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是( )
A、蒸发 B、蒸馏 C、过滤 D、萃取 C4.选用萃取剂将溴水中的溴萃取出来,这种萃取剂必须具备的性质是( )
A、不溶于水,但必须与溴发生反应
B、不溶于水,但比水更容易溶解溴
C、不溶于水,且密度必须比水大
D、不溶于水,且密度必须比水小 B 地球上水的储量很大,但淡水只占2.5%,其中易供人类使用的淡水不足1% 海水淡化工厂蒸馏在日常生活中的应用酒精的提纯
石油的分馏
海水的淡化蒸馏在日常生活中的应用蒸馏 :加热液体使变成蒸气,再使蒸气冷却凝成液体。 蒸发 :液体蒸腾挥发为水汽的现象。 蒸发是一种物理现象, 蒸馏是一种提纯物质的方法。 在蒸馏的过程中一定有蒸发现象存在,但蒸发的过程不一定是蒸馏。 思考与讨论蒸馏与蒸发的区别一、蒸馏 蒸馏定义:提纯或分离沸点不同的液体混合物的方法。用蒸馏原理进行多种液体的分离,叫分馏。装置的组成:加热装置→冷凝装置→收集装置主要仪器:铁架台、酒精灯、石棉网、蒸馏烧瓶、温度计、
冷凝管、牛角管、锥形瓶、木块注意事项:①蒸馏烧瓶中所盛液体为其容积的1/3 ~2/3;
②温度计水银球位置应与烧瓶支管口下缘齐平;
③冷凝管中冷却水从下口进,上口出;
④为防爆沸可在蒸馏烧瓶中加入适量碎瓷片;
⑤加热温度不能超过混合物中沸点最高物质的沸点。定义:用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法。所用仪器:分液漏斗、铁架台、烧杯 萃取1、用前检漏
2、充分振荡,适当放气,充分静止,
然后分液;
3、分液时保持漏斗内与大气压一致;
4、下层溶液下口出,上层溶液上口出注意事项1、与原溶剂互不相溶
2、溶解溶质的能力大于原溶剂
3、不与被萃取的物质反应萃取剂
的选择谢谢大家!
化学实验基本方法第三课时:
混合物的分离与提纯(2)南昌二中:刘勇一、蒸馏 用蒸馏原理进行多种液体的分离
蒸馏:提纯或分离沸点不同的液体混合物的方法。分馏:除去酒精中的醋酸---加入生石灰后再蒸馏从石油中分离出汽油和柴油---分馏概念辨析装置的组成:加热装置→冷凝装置→收集装置主要仪器:铁架台、酒精灯、石棉网、蒸馏烧瓶、温度计、
冷凝管、牛角管、锥形瓶、木块实验1-3 (1)自来水中Cl-的检验(2)蒸馏,制蒸馏水Cl-的检验:未知液AgNO3溶液白色沉淀稀HNO3沉淀不溶解结论:未知液中含有Cl-二、分液与萃取定义:把两种不相互溶的
液体分开的操作。
主要仪器:分液漏斗。下层液体由下口放出;上层液体由上口倒出。操作要领:分液定义:用一种溶剂把溶质从它与另一种溶剂所用仪器:分液漏斗、铁架台、烧杯 萃取所组成的溶液中提取出来的方法。应用:天然香料、药物的提取、核燃料的处理等例如:提取碘水中的碘实验1-4 用CCl4萃取碘水(饱和)现象:液体分层
上层液体显 色
下层液体显 色黄紫红操作步骤:
⑴检漏→⑵加萃取剂振
荡→⑶静置→⑷分液 在分液漏斗中完成萃取操作,静置分层后,如果不知道哪一层是“水层”,试设计一种简便的方法加以判断。取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中下层是“水层”;反之,则上层是水层。 思考与交流混合物的分离提纯归纳与整理
离子的检验CO32- +2H+=H2O+CO2↑
CO2+Ca2++2OH- = CaCO3↓+H2OAg++Cl-=AgCl↓1.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A . 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C . 分液、蒸馏、萃取 D. 蒸馏、萃取、分液C2.已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g/mL ,沸点约为55℃。要从水与丙酮的混合液里将丙酮分离出来,下列方法中最合理的是( )
A. 蒸馏 B. 分液 C.过滤 D.蒸发B课堂练习 3.下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是( )
A、蒸发 B、蒸馏 C、过滤 D、萃取 C4.选用萃取剂将溴水中的溴萃取出来,这种萃取剂必须具备的性质是( )
A、不溶于水,但必须与溴发生反应
B、不溶于水,但比水更容易溶解溴
C、不溶于水,且密度必须比水大
D、不溶于水,且密度必须比水小 B 地球上水的储量很大,但淡水只占2.5%,其中易供人类使用的淡水不足1% 海水淡化工厂蒸馏在日常生活中的应用酒精的提纯
石油的分馏
海水的淡化蒸馏在日常生活中的应用蒸馏 :加热液体使变成蒸气,再使蒸气冷却凝成液体。 蒸发 :液体蒸腾挥发为水汽的现象。 蒸发是一种物理现象, 蒸馏是一种提纯物质的方法。 在蒸馏的过程中一定有蒸发现象存在,但蒸发的过程不一定是蒸馏。 思考与讨论蒸馏与蒸发的区别一、蒸馏 蒸馏定义:提纯或分离沸点不同的液体混合物的方法。用蒸馏原理进行多种液体的分离,叫分馏。装置的组成:加热装置→冷凝装置→收集装置主要仪器:铁架台、酒精灯、石棉网、蒸馏烧瓶、温度计、
冷凝管、牛角管、锥形瓶、木块注意事项:①蒸馏烧瓶中所盛液体为其容积的1/3 ~2/3;
②温度计水银球位置应与烧瓶支管口下缘齐平;
③冷凝管中冷却水从下口进,上口出;
④为防爆沸可在蒸馏烧瓶中加入适量碎瓷片;
⑤加热温度不能超过混合物中沸点最高物质的沸点。定义:用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法。所用仪器:分液漏斗、铁架台、烧杯 萃取1、用前检漏
2、充分振荡,适当放气,充分静止,
然后分液;
3、分液时保持漏斗内与大气压一致;
4、下层溶液下口出,上层溶液上口出注意事项1、与原溶剂互不相溶
2、溶解溶质的能力大于原溶剂
3、不与被萃取的物质反应萃取剂
的选择谢谢大家!
