第八章常见的酸、碱、盐测试题(含答案)---2022-2023学年九年级化学科粤版(2012)下册
文档属性
| 名称 | 第八章常见的酸、碱、盐测试题(含答案)---2022-2023学年九年级化学科粤版(2012)下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 245.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-05 09:44:07 | ||
图片预览



文档简介
第八章《常见的酸、碱、盐》测试题
一、单选题
1.变化观念是化学学科核心素养之一。下列变化中,属于化学变化的是
A.研碎胆矾 B.食盐溶解 C.对干冷玻璃片哈气 D.红磷燃烧
2.分类是化学学习的重要方法之一。下列各组物质按照单质、盐、混合物的顺序排列的是( )
A.生铁、熟石灰、冰水混合物 B.液氧、硫酸钡、粗盐
C.天然气、纯碱、石油 D.钙片、氯化镁、海水
3.下列各组实验方法能达到实验目的是
实验目的 A.检验NaOH溶液是否变质 B.探究氧气是燃烧发生的条件之一
操作
现象 产生红褐色沉淀 推注射器活塞后,水中的白磷开始燃烧
结论 NaOH溶液已变质 一般情况下,可燃物燃烧需要氧气
实验目的 C.比较Zn、Cu、Ag的金属活动性 D.验证质量守恒定律
操作
现象 Zn和Cu表面均有固体生成 两种溶液混合后,天平仍然平衡
结论 金属活动性:Zn>Cu>Ag 化学反应前后质量守恒
A.A B.B C.C D.D
4.下列依据实验目的所设计的实验操作中,正确的是
选项 实验目的 实验操作
A 分离 NaCl 和 Na2CO3 固体 加入适量氯化钙溶液、过滤
B 鉴别 NaOH 和 Na2CO3 溶液 滴加无色酚酞
C 检验 CaO 中的 CaCO3 加入少量水
D 除去 CO 中的少量 CO2 通入足量的 NaOH 溶液
A.A B.B C.C D.D
5.除去下列物质中的少量杂质(括号内为杂质)的方法错误的是
A.O2(H2O)﹣用生石灰 B.NaCl溶液(KNO3)﹣降温结晶
C.CaCO3粉末(Na2CO3)﹣加水过滤 D.KCl溶液(K2CO3)﹣加适量盐酸
6.下列说法中,正确的是
A.Fe、Fe2O3都能与稀盐酸反应,都属于置换反应
B.CaO、NaOH固体都能与水反应,都能作干燥剂
C.浓盐酸、浓硫酸都有挥发性,敞口放置浓度都会变小
D.NH4Cl、(NH4)2SO4都含有NH4+,都能与熟石灰反应生成NH3
7.下列有关叙述,对应的化学方程式书写,所属基本反应类型都正确的是( )
选项 叙述 化学方程式 基本反应类型
A 铝的自我保护 化合反应
B 工业上制CO2 分解反应
C 铁与盐酸混合 置换反应
D 硫在空气中燃烧 化合反应
A.A B.B C.C D.D
8.下列属于物理变化的是
A.干冰升华 B.铝箔发暗 C.烧碱变质 D.镁带变黑
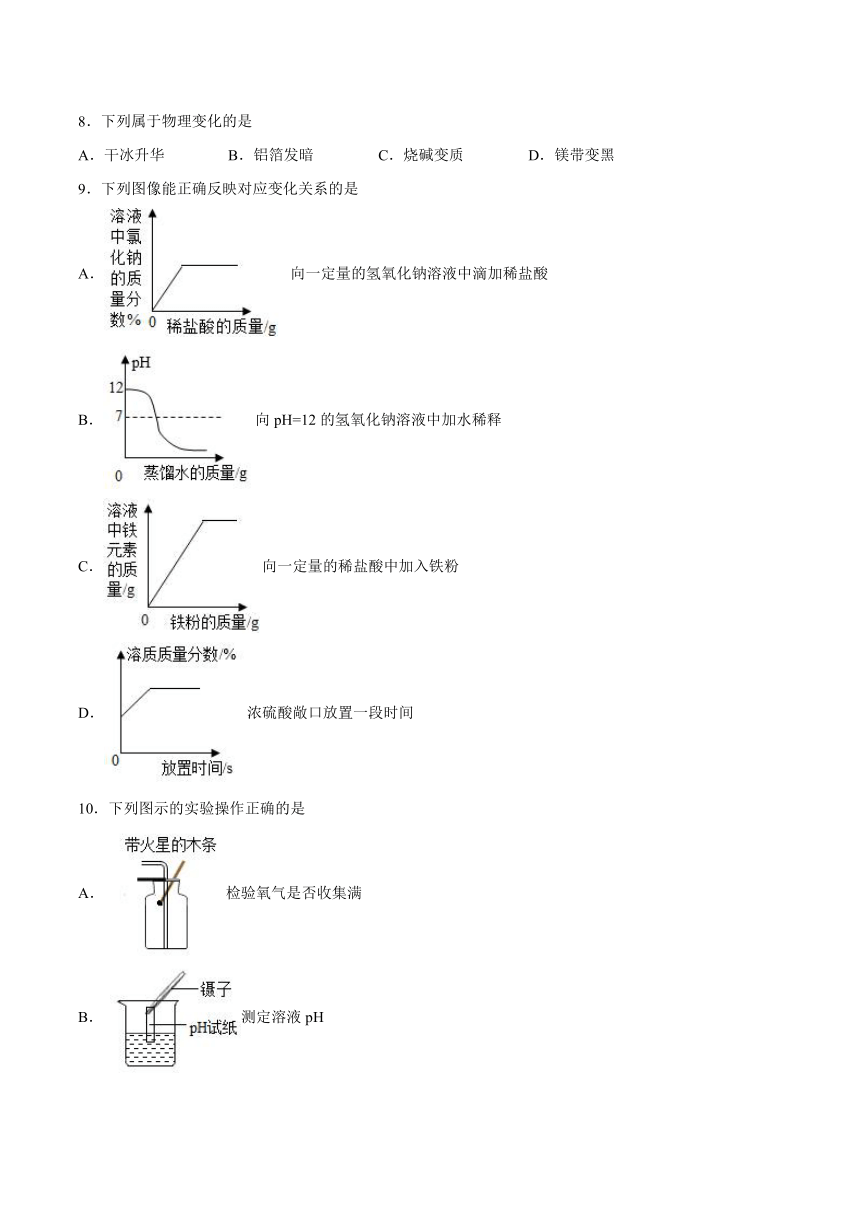
9.下列图像能正确反映对应变化关系的是
A.向一定量的氢氧化钠溶液中滴加稀盐酸
B.向pH=12的氢氧化钠溶液中加水稀释
C.向一定量的稀盐酸中加入铁粉
D.浓硫酸敞口放置一段时间
10.下列图示的实验操作正确的是
A. 检验氧气是否收集满
B. 测定溶液pH
C. 加热液体药品
D.取用固体药品
11.某兴趣小组的同学利用下图探究化学反应前后物质的质量是否守恒,应选用的药品是
A.二氧化锰和过氧化氢溶液
B.铝片和硫酸铜溶液
C.碳酸钠粉末和稀盐酸
D.氯化钠固体和水
12.关于溶液pH的说法,正确的是
A.酸和碱混合后,溶液的pH一定等于7
B.氢氧化钠溶液加水后pH降低
C.用 pH试纸测定溶液的酸碱度时,先用水湿润
D.在pH=1的盐酸中加入等体积pH=5的盐酸,混合后溶液pH=6
二、填空题
13.按要求完成下列方程式的书写。
(1)有复合肥生成的中和反应(方程式表示)_____________
(2)某些金属氢化物(其中氢显-l价)与水反应可生成碱和氢气,如NaH+H2O =NaOH+H2↑。试用一个化学方程式表示CaH2与Na2CO3水溶液之间发生的化学反应(方程式表示)___________
(3)Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2后,溶液很快变蓝色,试写出该反应的化学方程式 ___________________________
(4)仿照下列化学方程式:2H2S+SO2=3S↓+2H2O,试完成化学方程式的书写:NH3和NO2反应 ___________________________________________
14.“波尔多液”能杀死葡萄、柑橘表皮的寄生虫,它是用CuSO4溶液与石灰水混合而成的,其化学方程式为:__________________________;若喷洒“波尔多液”不久就采摘的柑橘、葡萄,表皮上常会残留一些水洗不掉的蓝色斑点,这些蓝色斑点属于_________(填“酸”、“碱”、“盐”、或“氧化物”),这时可在厨房用品中选用_________浸泡将其洗去,该反应的基本类型属于______________。
15.小亮在学习酸碱盐的化学性质时做了如图实验,请你和他一起完成实验活动:
(1)实验A中点滴板上的氢氧化钾溶液能使石蕊溶液变 _________ 色;
(2)实验B中对比两支试管说明 ____ 会影响铝与硫酸铜的反应。写出会发生反应的化学方程式 ___ ;
(3)实验C的目的是确认CO2是否与NaOH发生反应,操作顺序应该是 ___ (填字母);
A 先滴加稀盐酸后滴加氢氧化钠溶液
B 先滴加氢氧化钠溶液后滴加稀盐酸
(4)在实验D的试管中,滴加少量的硫酸铜溶液,反应的化学方程式是 ________ 。
三、实验题
16.结合图示实验装置,回答下列问题。
(1)图中 b 仪器的名称:b _____ 。
(2)用氯酸钾固体制氧气需加二氧化锰做催化剂,该反应的化学方程式是 _____ ,若在氯酸钾中加少量的高锰酸钾,也能加快氯酸钾的分解,请说明理由 _____ 。
(3)实验室用硝酸铵和熟石灰加热条件下制取氨气的化学方程式 _____ , 如用E 装置收集NH3,则气体应从 _____ 端通入(填“c”或“d”)。
(4)下图是“空气中氧气体积分数测定”实验的改进装置。主要操作是:在实际容积为 150 mL 的集气瓶里,先装进 50 mL 的水,再按图连好仪器,按下热的玻璃棒,白磷立即被点燃。
① 白磷从燃烧到熄灭冷却的过程中, 瓶内水面的变化是 ______ ;若实验非常成功, 最终集气瓶中水的体积约为 _____ 。
②集气瓶里预先装进的 50 mL 水,在实验过程中起到哪些作用 _____ (填序号)
a 加快集气瓶冷却 b 液封导气管末端以防气体逸出 c 缓冲集气瓶内气压的骤然升高
四、简答题
17.实验小组用pH传感器探究盐酸和氢氧化钠的反应。测定结果如图所示:
(1)盐酸和氢氧化钠反应的化学方程式为_____。
(2)向烧瓶中缓慢注入稀盐酸,能说明盐酸与氢氧化钠发生化学反应的现象是_____。
(3)60s时,烧瓶内溶液中的溶质有_____。
18.从化学的视角认识生活中的有关问题。
(1)米和面中含有的主要营养素是_____。
(2)人体骨骼和牙齿中含有的钙元素属于_____(填“常量元素”或“微量元素”)。
(3)用可降解塑料代替传统塑料,有利于减轻“_____”。
(4)小苏打可以治疗胃酸过多,该反应的化学方程式为_____。
(5)王强家菜地里的蔬菜叶子发黄,根据所学化学知识,你建议他购买_____(填序号)。
①硝酸铵(NH4NO3) ②氯化钾(KCl) ③尿素[CO(NH2)2]④磷矿粉[Ca(PO4)2]
五、计算题
19.化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸(密度为1.1g/mL)来测定其溶质的质量分数。甲组同学的实验如图1所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,溶液pH的变化如图2所示.请回答
(1)a点溶液中大量存在的离子有__________
(2)b点溶液中的溶质有__________________
(3)计算氢氧化钠溶液中溶质的质量分数。(保留一位小数)
参考答案:
1.D 2.B 3.B 4.D 5.B 6.D 7.D 8.A 9.C 10.D 11.B 12.B
13.
14. CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4 碱 醋 复分解反应
15. 蓝 氧化铝薄膜 2Al+3CuSO4=Al2(SO4)3+3Cu B CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓
16. 长颈漏斗 高锰酸钾在加热的条件下分解产生二氧化锰,二氧化锰充当氯酸钾分解的催化剂 d 先下降后上升 70 abc
17. NaOH+HCl=NaCl+H2O 红色溶液变为无色,pH逐渐减小至小于7 NaCl、HCl
18. 糖类 常量元素 白色污染 NaHCO3+HCl═NaCl+H2O+CO2↑ ①③
19.(1)Na+ 、 Cl-- /钠离子、氯离子
(2)NaCl、HCl/氯化钠、氯化氢
(3)解:由图像可知,加入10mL盐酸时恰好完全反应,则加入盐酸的中氯化氢的质量为。
设氢氧化钠溶液中溶质的质量分数为x.
答:氢氧化钠溶液中溶质的质量分数为2.4%
一、单选题
1.变化观念是化学学科核心素养之一。下列变化中,属于化学变化的是
A.研碎胆矾 B.食盐溶解 C.对干冷玻璃片哈气 D.红磷燃烧
2.分类是化学学习的重要方法之一。下列各组物质按照单质、盐、混合物的顺序排列的是( )
A.生铁、熟石灰、冰水混合物 B.液氧、硫酸钡、粗盐
C.天然气、纯碱、石油 D.钙片、氯化镁、海水
3.下列各组实验方法能达到实验目的是
实验目的 A.检验NaOH溶液是否变质 B.探究氧气是燃烧发生的条件之一
操作
现象 产生红褐色沉淀 推注射器活塞后,水中的白磷开始燃烧
结论 NaOH溶液已变质 一般情况下,可燃物燃烧需要氧气
实验目的 C.比较Zn、Cu、Ag的金属活动性 D.验证质量守恒定律
操作
现象 Zn和Cu表面均有固体生成 两种溶液混合后,天平仍然平衡
结论 金属活动性:Zn>Cu>Ag 化学反应前后质量守恒
A.A B.B C.C D.D
4.下列依据实验目的所设计的实验操作中,正确的是
选项 实验目的 实验操作
A 分离 NaCl 和 Na2CO3 固体 加入适量氯化钙溶液、过滤
B 鉴别 NaOH 和 Na2CO3 溶液 滴加无色酚酞
C 检验 CaO 中的 CaCO3 加入少量水
D 除去 CO 中的少量 CO2 通入足量的 NaOH 溶液
A.A B.B C.C D.D
5.除去下列物质中的少量杂质(括号内为杂质)的方法错误的是
A.O2(H2O)﹣用生石灰 B.NaCl溶液(KNO3)﹣降温结晶
C.CaCO3粉末(Na2CO3)﹣加水过滤 D.KCl溶液(K2CO3)﹣加适量盐酸
6.下列说法中,正确的是
A.Fe、Fe2O3都能与稀盐酸反应,都属于置换反应
B.CaO、NaOH固体都能与水反应,都能作干燥剂
C.浓盐酸、浓硫酸都有挥发性,敞口放置浓度都会变小
D.NH4Cl、(NH4)2SO4都含有NH4+,都能与熟石灰反应生成NH3
7.下列有关叙述,对应的化学方程式书写,所属基本反应类型都正确的是( )
选项 叙述 化学方程式 基本反应类型
A 铝的自我保护 化合反应
B 工业上制CO2 分解反应
C 铁与盐酸混合 置换反应
D 硫在空气中燃烧 化合反应
A.A B.B C.C D.D
8.下列属于物理变化的是
A.干冰升华 B.铝箔发暗 C.烧碱变质 D.镁带变黑
9.下列图像能正确反映对应变化关系的是
A.向一定量的氢氧化钠溶液中滴加稀盐酸
B.向pH=12的氢氧化钠溶液中加水稀释
C.向一定量的稀盐酸中加入铁粉
D.浓硫酸敞口放置一段时间
10.下列图示的实验操作正确的是
A. 检验氧气是否收集满
B. 测定溶液pH
C. 加热液体药品
D.取用固体药品
11.某兴趣小组的同学利用下图探究化学反应前后物质的质量是否守恒,应选用的药品是
A.二氧化锰和过氧化氢溶液
B.铝片和硫酸铜溶液
C.碳酸钠粉末和稀盐酸
D.氯化钠固体和水
12.关于溶液pH的说法,正确的是
A.酸和碱混合后,溶液的pH一定等于7
B.氢氧化钠溶液加水后pH降低
C.用 pH试纸测定溶液的酸碱度时,先用水湿润
D.在pH=1的盐酸中加入等体积pH=5的盐酸,混合后溶液pH=6
二、填空题
13.按要求完成下列方程式的书写。
(1)有复合肥生成的中和反应(方程式表示)_____________
(2)某些金属氢化物(其中氢显-l价)与水反应可生成碱和氢气,如NaH+H2O =NaOH+H2↑。试用一个化学方程式表示CaH2与Na2CO3水溶液之间发生的化学反应(方程式表示)___________
(3)Cu不活泼,通常情况下不与稀硫酸反应,但向Cu和稀硫酸的混合物中滴入H2O2后,溶液很快变蓝色,试写出该反应的化学方程式 ___________________________
(4)仿照下列化学方程式:2H2S+SO2=3S↓+2H2O,试完成化学方程式的书写:NH3和NO2反应 ___________________________________________
14.“波尔多液”能杀死葡萄、柑橘表皮的寄生虫,它是用CuSO4溶液与石灰水混合而成的,其化学方程式为:__________________________;若喷洒“波尔多液”不久就采摘的柑橘、葡萄,表皮上常会残留一些水洗不掉的蓝色斑点,这些蓝色斑点属于_________(填“酸”、“碱”、“盐”、或“氧化物”),这时可在厨房用品中选用_________浸泡将其洗去,该反应的基本类型属于______________。
15.小亮在学习酸碱盐的化学性质时做了如图实验,请你和他一起完成实验活动:
(1)实验A中点滴板上的氢氧化钾溶液能使石蕊溶液变 _________ 色;
(2)实验B中对比两支试管说明 ____ 会影响铝与硫酸铜的反应。写出会发生反应的化学方程式 ___ ;
(3)实验C的目的是确认CO2是否与NaOH发生反应,操作顺序应该是 ___ (填字母);
A 先滴加稀盐酸后滴加氢氧化钠溶液
B 先滴加氢氧化钠溶液后滴加稀盐酸
(4)在实验D的试管中,滴加少量的硫酸铜溶液,反应的化学方程式是 ________ 。
三、实验题
16.结合图示实验装置,回答下列问题。
(1)图中 b 仪器的名称:b _____ 。
(2)用氯酸钾固体制氧气需加二氧化锰做催化剂,该反应的化学方程式是 _____ ,若在氯酸钾中加少量的高锰酸钾,也能加快氯酸钾的分解,请说明理由 _____ 。
(3)实验室用硝酸铵和熟石灰加热条件下制取氨气的化学方程式 _____ , 如用E 装置收集NH3,则气体应从 _____ 端通入(填“c”或“d”)。
(4)下图是“空气中氧气体积分数测定”实验的改进装置。主要操作是:在实际容积为 150 mL 的集气瓶里,先装进 50 mL 的水,再按图连好仪器,按下热的玻璃棒,白磷立即被点燃。
① 白磷从燃烧到熄灭冷却的过程中, 瓶内水面的变化是 ______ ;若实验非常成功, 最终集气瓶中水的体积约为 _____ 。
②集气瓶里预先装进的 50 mL 水,在实验过程中起到哪些作用 _____ (填序号)
a 加快集气瓶冷却 b 液封导气管末端以防气体逸出 c 缓冲集气瓶内气压的骤然升高
四、简答题
17.实验小组用pH传感器探究盐酸和氢氧化钠的反应。测定结果如图所示:
(1)盐酸和氢氧化钠反应的化学方程式为_____。
(2)向烧瓶中缓慢注入稀盐酸,能说明盐酸与氢氧化钠发生化学反应的现象是_____。
(3)60s时,烧瓶内溶液中的溶质有_____。
18.从化学的视角认识生活中的有关问题。
(1)米和面中含有的主要营养素是_____。
(2)人体骨骼和牙齿中含有的钙元素属于_____(填“常量元素”或“微量元素”)。
(3)用可降解塑料代替传统塑料,有利于减轻“_____”。
(4)小苏打可以治疗胃酸过多,该反应的化学方程式为_____。
(5)王强家菜地里的蔬菜叶子发黄,根据所学化学知识,你建议他购买_____(填序号)。
①硝酸铵(NH4NO3) ②氯化钾(KCl) ③尿素[CO(NH2)2]④磷矿粉[Ca(PO4)2]
五、计算题
19.化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸(密度为1.1g/mL)来测定其溶质的质量分数。甲组同学的实验如图1所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,溶液pH的变化如图2所示.请回答
(1)a点溶液中大量存在的离子有__________
(2)b点溶液中的溶质有__________________
(3)计算氢氧化钠溶液中溶质的质量分数。(保留一位小数)
参考答案:
1.D 2.B 3.B 4.D 5.B 6.D 7.D 8.A 9.C 10.D 11.B 12.B
13.
14. CuSO4+Ca(OH)2═Cu(OH)2↓+CaSO4 碱 醋 复分解反应
15. 蓝 氧化铝薄膜 2Al+3CuSO4=Al2(SO4)3+3Cu B CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓
16. 长颈漏斗 高锰酸钾在加热的条件下分解产生二氧化锰,二氧化锰充当氯酸钾分解的催化剂 d 先下降后上升 70 abc
17. NaOH+HCl=NaCl+H2O 红色溶液变为无色,pH逐渐减小至小于7 NaCl、HCl
18. 糖类 常量元素 白色污染 NaHCO3+HCl═NaCl+H2O+CO2↑ ①③
19.(1)Na+ 、 Cl-- /钠离子、氯离子
(2)NaCl、HCl/氯化钠、氯化氢
(3)解:由图像可知,加入10mL盐酸时恰好完全反应,则加入盐酸的中氯化氢的质量为。
设氢氧化钠溶液中溶质的质量分数为x.
答:氢氧化钠溶液中溶质的质量分数为2.4%
同课章节目录
