第九单元金属测试题(含答案)---2022-2023学年九年级化学鲁教版下册
文档属性
| 名称 | 第九单元金属测试题(含答案)---2022-2023学年九年级化学鲁教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 96.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-05 09:47:47 | ||
图片预览


文档简介
第九单元《金属》测试题
一、单选题
1.下列有关金属及合金的说法中正确的是
A.合金是由两种或两种以上金属熔合而成的具有金属特性的物质
B.在日常生活中,大量使用的常常不是纯金属,而是它们的合金
C.“真金不怕火炼”说明黄金的硬度非常大
D.生铁可以完全溶解在足量的稀盐酸中
2.相同质量的镁、锌、铁三种金属,分别与足量的稀硫酸反应,产生氢气
A.镁最多 B.锌最多 C.铁最多 D.一样多
3.氧气的化学性质活泼,下列物质与氧气反应的现象描述不正确的是
A.镁条在空气中燃烧:发出耀眼的白光,生成白色固体粉末
B.细铁丝在氧气中燃烧:火星四射,生成黑色固体
C.木炭在氧气中燃烧:发出耀眼的白光,放出大量的热,生成二氧化碳气体
D.在空气中加热铜粉:红色固体粉末逐渐变成黑色
4.在化学实验中,对实验现象的观察和描述非常重要。下列有关实验现象描述正确的是
A.镁条加入白醋中,产生气泡
B.红磷在空气中燃烧产生白色烟雾
C.硫在氧气中燃烧产生淡蓝色火焰
D.铜在氧气中加热,固体由黑色逐渐变成红色
5.下列防锈措施合理的是( )
A.经常用水冲洗自行车链条 B.在铁质栏杆上刷油漆
C.用“钢丝球”打磨铝锅表面 D.用过的菜刀及时用盐水清洗
6.下列做法合理的是
A.可以用铁桶盛放硫酸铜溶液 B.用煮沸的方法软化硬水
C.用钢丝球擦洗铝制炊具污垢 D.煤炉上放一壶水防止CO中毒
7.归纳总结是非常有效的促进知识内化的方式。下列总结中正确的是( )
A.油在锅内燃烧用锅盖盖灭和木材燃烧用水扑灭——灭火原理相同
B.水沸腾有气泡冒出与电解水有气泡冒出——变化的原理相同
C.自行车车架喷漆和链条涂油——防锈原理相同
D.洗洁精除油污和汽油除油污——去污原理相同
8.照明用台灯中的铜制插头是利用了金属铜的性质是
A.延展性 B.有金属光泽 C.导电性 D.可燃性
9.下列实验方案能够达到相应实验目的的是
选项 实验目的 实验方案
A 检验CH4中是否含有H2 将气体点燃
B 鉴别NaOH溶液和Ca(OH)2溶液 分别向溶液中通入CO2
C 除去NaCl中的Na2CO3 向其中加入足量稀硫酸
D 比较铁和铜的活动顺序 将其分别加入ZnSO4溶液
A.A B.B C.C D.D
10.在实验室中对下列四个实验都设计了两种方案,其中两种方案都合理的是
A B C D
实验要求 区分黄铜和黄金 区分不饱和KNO3溶液和饱和KNO3溶液 区分生铁和钢 区分食盐和硝酸铵
第一方案 加入稀盐酸 升温 用磁铁吸 加水看温度变化
第二方案 加入硫酸铜溶液 加入硝酸钾 加入足量稀盐酸,比较剩余固体多少 尝味道
A.A B.B C.C D.D
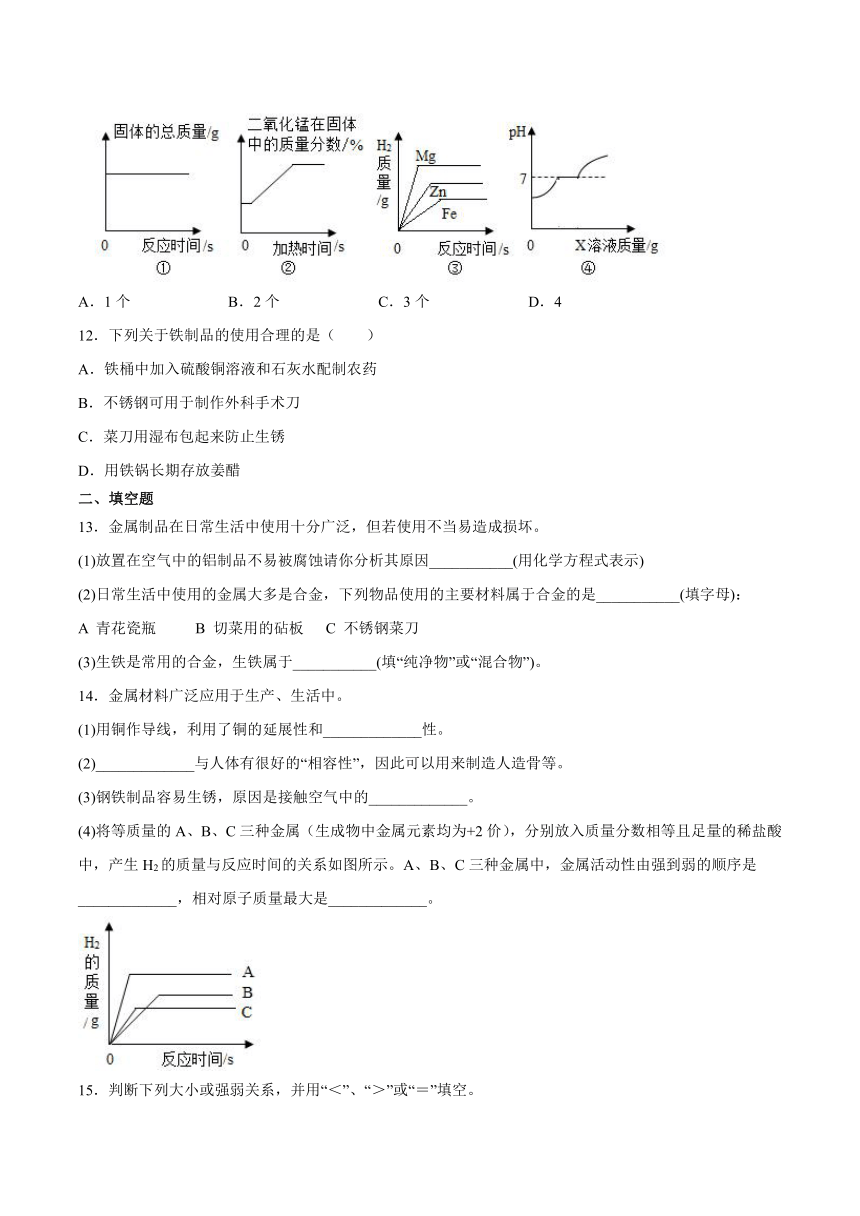
11.下列图像能正确反映对应变化关系的个数是( )
①一定质量的碳和氧化铜在密闭容器中充分反应
②一定质量的二氧化锰和氯酸钾的混合物充分加热反应
③等质量的金属镁、锌、铁分别放入足量的稀硫酸中充分反应
④一定质量的氯化钡和盐酸的混合溶液中逐滴加入X溶液,X可以是碳酸钠或氢氧化钠
A.1个 B.2个 C.3个 D.4
12.下列关于铁制品的使用合理的是( )
A.铁桶中加入硫酸铜溶液和石灰水配制农药
B.不锈钢可用于制作外科手术刀
C.菜刀用湿布包起来防止生锈
D.用铁锅长期存放姜醋
二、填空题
13.金属制品在日常生活中使用十分广泛,但若使用不当易造成损坏。
(1)放置在空气中的铝制品不易被腐蚀请你分析其原因___________(用化学方程式表示)
(2)日常生活中使用的金属大多是合金,下列物品使用的主要材料属于合金的是___________(填字母):
A 青花瓷瓶 B 切菜用的砧板 C 不锈钢菜刀
(3)生铁是常用的合金,生铁属于___________(填“纯净物”或“混合物”)。
14.金属材料广泛应用于生产、生活中。
(1)用铜作导线,利用了铜的延展性和_____________性。
(2)_____________与人体有很好的“相容性”,因此可以用来制造人造骨等。
(3)钢铁制品容易生锈,原因是接触空气中的_____________。
(4)将等质量的A、B、C三种金属(生成物中金属元素均为+2价),分别放入质量分数相等且足量的稀盐酸中,产生H2的质量与反应时间的关系如图所示。A、B、C三种金属中,金属活动性由强到弱的顺序是_____________,相对原子质量最大是_____________。
15.判断下列大小或强弱关系,并用“<”、“>”或“=”填空。
(1)金属活动性:铁_________铜; (2)受热稳定性:碳酸钠_________碳酸氢铵;
(3)相同条件下的密度:氢气_________空气;(4)硬度:纯铁_________不锈钢。
三、实验题
16.某实验学校初三兴趣小组利用如下装置(部分固定装置已略去)。制备氮化钙,并探究其化学式
(1)反应过程中末端导管必须插入试管A的水中,目的是 _____ 。
(2)制备氮化钙的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;③反应结束后, _____ ;④拆除装置,取出产物。
(3)数据记录如下:
空硬玻璃管质量m0/g 硬玻璃管与钙的质量m1/g 硬玻璃管与产物的质量m2/g
114.8 120.8 122.2
①计算得到化学式(实验式)CaxN2,其中x= _____ 。
②若通入的N2中混有少量O2,如上计算得到的x的值 _____ (填写“偏大”、“偏小”、“不变”),判断依据是 _____ 。
17.科学课上我们曾经观察过如图所示的实验。
(1)实验中,铜片上的白磷很快燃烧,其化学反应方程式为_____。
(2)该实验主要利用了铜片良好的_____性。燃着的白磷熄灭后,去掉铜片上的白色固体,可看到铜片表面变黑,该黑色物质是_____(填化学式)。
四、推断题
18.已知A~E为初中是常见的五种物质。其中A为赤铁矿的主要成分,B、C为组成元素相同的气体,F是紫红色固体单质,G的溶液为浅绿色,各物质之间的转化关系如图所示。请回答下列问题:
(1)反应①中体现B物质的_______性。
(2)反应①的化学方程式为_______;
(3)反应③的化学方程式为_______;
(4)写出物质C在生活的一种用途_______。
19.已知A~H为初中化学常见的八种物质。其中D的固体叫做“干冰”,C中只含两种元素,A与B不含相同元素,A是年产量最高的金属,H与F反应有刺激性气味的气体放出。各种物质间的反应和转化关系如图所示(“﹣”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。请分析后回答:
(1)A、G的化学式分别为______、______。
(2)F与H反应的化学方程式______。
(3)D→E反应的化学方程式______。
(4)A与C反应的基本反应类型为______,B的用途______。
五、计算题
20.小鸿设计如下实验,探究粗锌粒中锌的质量分数(粗锌所含的杂质不跟稀硫酸反应)。
计算:(写出计算过程)
(1)粗锌中锌的质量分数。(精确到0.1%)
(2)100g稀硫酸中硫酸的质量。
参考答案:
1.B 2.A 3.C 4.A 5.B 6.B 7.C 8.C 9.B 10.A 11.A 12.B
13. 4Al+3O2=2Al2O3 C 混合物
14.(1)导电
(2)钛合金
(3)氧气和水(或O2和H2O)
(4) A>C>B(或A、C、B) C
15. > > < <
16. 防止空气中的氧气通过末端导管进入实验装置与钙反应 停止加热,继续通氮气至装置冷却 3 偏小 因为钙的总量不变,含有氧化钙的氮化钙总质量增大,钙与氮(不纯)元素的质量比减小,其个数比也变小,所以x值会减小
17. 导热 CuO
18. 还原 3CO+ Fe2O32Fe +3CO2 Fe+CuSO4=FeSO4+Cu 灭火(合理即可)
19. Fe AgNO3
置换反应 做燃料
20.(1)解:设粗锌中锌的质量为x,100g稀硫酸中硫酸的质量为y
解得x=6.5g,y=9.8g
所以粗锌中锌的质量分数
答:粗锌中锌的质量分数为65%。
(2)答:100g稀硫酸中硫酸的质量为9.8g
一、单选题
1.下列有关金属及合金的说法中正确的是
A.合金是由两种或两种以上金属熔合而成的具有金属特性的物质
B.在日常生活中,大量使用的常常不是纯金属,而是它们的合金
C.“真金不怕火炼”说明黄金的硬度非常大
D.生铁可以完全溶解在足量的稀盐酸中
2.相同质量的镁、锌、铁三种金属,分别与足量的稀硫酸反应,产生氢气
A.镁最多 B.锌最多 C.铁最多 D.一样多
3.氧气的化学性质活泼,下列物质与氧气反应的现象描述不正确的是
A.镁条在空气中燃烧:发出耀眼的白光,生成白色固体粉末
B.细铁丝在氧气中燃烧:火星四射,生成黑色固体
C.木炭在氧气中燃烧:发出耀眼的白光,放出大量的热,生成二氧化碳气体
D.在空气中加热铜粉:红色固体粉末逐渐变成黑色
4.在化学实验中,对实验现象的观察和描述非常重要。下列有关实验现象描述正确的是
A.镁条加入白醋中,产生气泡
B.红磷在空气中燃烧产生白色烟雾
C.硫在氧气中燃烧产生淡蓝色火焰
D.铜在氧气中加热,固体由黑色逐渐变成红色
5.下列防锈措施合理的是( )
A.经常用水冲洗自行车链条 B.在铁质栏杆上刷油漆
C.用“钢丝球”打磨铝锅表面 D.用过的菜刀及时用盐水清洗
6.下列做法合理的是
A.可以用铁桶盛放硫酸铜溶液 B.用煮沸的方法软化硬水
C.用钢丝球擦洗铝制炊具污垢 D.煤炉上放一壶水防止CO中毒
7.归纳总结是非常有效的促进知识内化的方式。下列总结中正确的是( )
A.油在锅内燃烧用锅盖盖灭和木材燃烧用水扑灭——灭火原理相同
B.水沸腾有气泡冒出与电解水有气泡冒出——变化的原理相同
C.自行车车架喷漆和链条涂油——防锈原理相同
D.洗洁精除油污和汽油除油污——去污原理相同
8.照明用台灯中的铜制插头是利用了金属铜的性质是
A.延展性 B.有金属光泽 C.导电性 D.可燃性
9.下列实验方案能够达到相应实验目的的是
选项 实验目的 实验方案
A 检验CH4中是否含有H2 将气体点燃
B 鉴别NaOH溶液和Ca(OH)2溶液 分别向溶液中通入CO2
C 除去NaCl中的Na2CO3 向其中加入足量稀硫酸
D 比较铁和铜的活动顺序 将其分别加入ZnSO4溶液
A.A B.B C.C D.D
10.在实验室中对下列四个实验都设计了两种方案,其中两种方案都合理的是
A B C D
实验要求 区分黄铜和黄金 区分不饱和KNO3溶液和饱和KNO3溶液 区分生铁和钢 区分食盐和硝酸铵
第一方案 加入稀盐酸 升温 用磁铁吸 加水看温度变化
第二方案 加入硫酸铜溶液 加入硝酸钾 加入足量稀盐酸,比较剩余固体多少 尝味道
A.A B.B C.C D.D
11.下列图像能正确反映对应变化关系的个数是( )
①一定质量的碳和氧化铜在密闭容器中充分反应
②一定质量的二氧化锰和氯酸钾的混合物充分加热反应
③等质量的金属镁、锌、铁分别放入足量的稀硫酸中充分反应
④一定质量的氯化钡和盐酸的混合溶液中逐滴加入X溶液,X可以是碳酸钠或氢氧化钠
A.1个 B.2个 C.3个 D.4
12.下列关于铁制品的使用合理的是( )
A.铁桶中加入硫酸铜溶液和石灰水配制农药
B.不锈钢可用于制作外科手术刀
C.菜刀用湿布包起来防止生锈
D.用铁锅长期存放姜醋
二、填空题
13.金属制品在日常生活中使用十分广泛,但若使用不当易造成损坏。
(1)放置在空气中的铝制品不易被腐蚀请你分析其原因___________(用化学方程式表示)
(2)日常生活中使用的金属大多是合金,下列物品使用的主要材料属于合金的是___________(填字母):
A 青花瓷瓶 B 切菜用的砧板 C 不锈钢菜刀
(3)生铁是常用的合金,生铁属于___________(填“纯净物”或“混合物”)。
14.金属材料广泛应用于生产、生活中。
(1)用铜作导线,利用了铜的延展性和_____________性。
(2)_____________与人体有很好的“相容性”,因此可以用来制造人造骨等。
(3)钢铁制品容易生锈,原因是接触空气中的_____________。
(4)将等质量的A、B、C三种金属(生成物中金属元素均为+2价),分别放入质量分数相等且足量的稀盐酸中,产生H2的质量与反应时间的关系如图所示。A、B、C三种金属中,金属活动性由强到弱的顺序是_____________,相对原子质量最大是_____________。
15.判断下列大小或强弱关系,并用“<”、“>”或“=”填空。
(1)金属活动性:铁_________铜; (2)受热稳定性:碳酸钠_________碳酸氢铵;
(3)相同条件下的密度:氢气_________空气;(4)硬度:纯铁_________不锈钢。
三、实验题
16.某实验学校初三兴趣小组利用如下装置(部分固定装置已略去)。制备氮化钙,并探究其化学式
(1)反应过程中末端导管必须插入试管A的水中,目的是 _____ 。
(2)制备氮化钙的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;③反应结束后, _____ ;④拆除装置,取出产物。
(3)数据记录如下:
空硬玻璃管质量m0/g 硬玻璃管与钙的质量m1/g 硬玻璃管与产物的质量m2/g
114.8 120.8 122.2
①计算得到化学式(实验式)CaxN2,其中x= _____ 。
②若通入的N2中混有少量O2,如上计算得到的x的值 _____ (填写“偏大”、“偏小”、“不变”),判断依据是 _____ 。
17.科学课上我们曾经观察过如图所示的实验。
(1)实验中,铜片上的白磷很快燃烧,其化学反应方程式为_____。
(2)该实验主要利用了铜片良好的_____性。燃着的白磷熄灭后,去掉铜片上的白色固体,可看到铜片表面变黑,该黑色物质是_____(填化学式)。
四、推断题
18.已知A~E为初中是常见的五种物质。其中A为赤铁矿的主要成分,B、C为组成元素相同的气体,F是紫红色固体单质,G的溶液为浅绿色,各物质之间的转化关系如图所示。请回答下列问题:
(1)反应①中体现B物质的_______性。
(2)反应①的化学方程式为_______;
(3)反应③的化学方程式为_______;
(4)写出物质C在生活的一种用途_______。
19.已知A~H为初中化学常见的八种物质。其中D的固体叫做“干冰”,C中只含两种元素,A与B不含相同元素,A是年产量最高的金属,H与F反应有刺激性气味的气体放出。各种物质间的反应和转化关系如图所示(“﹣”表示相连的两种物质之间可以发生反应,“→”表示一种物质可以转化为另一种物质,反应条件、部分反应物和生成物已略去)。请分析后回答:
(1)A、G的化学式分别为______、______。
(2)F与H反应的化学方程式______。
(3)D→E反应的化学方程式______。
(4)A与C反应的基本反应类型为______,B的用途______。
五、计算题
20.小鸿设计如下实验,探究粗锌粒中锌的质量分数(粗锌所含的杂质不跟稀硫酸反应)。
计算:(写出计算过程)
(1)粗锌中锌的质量分数。(精确到0.1%)
(2)100g稀硫酸中硫酸的质量。
参考答案:
1.B 2.A 3.C 4.A 5.B 6.B 7.C 8.C 9.B 10.A 11.A 12.B
13. 4Al+3O2=2Al2O3 C 混合物
14.(1)导电
(2)钛合金
(3)氧气和水(或O2和H2O)
(4) A>C>B(或A、C、B) C
15. > > < <
16. 防止空气中的氧气通过末端导管进入实验装置与钙反应 停止加热,继续通氮气至装置冷却 3 偏小 因为钙的总量不变,含有氧化钙的氮化钙总质量增大,钙与氮(不纯)元素的质量比减小,其个数比也变小,所以x值会减小
17. 导热 CuO
18. 还原 3CO+ Fe2O32Fe +3CO2 Fe+CuSO4=FeSO4+Cu 灭火(合理即可)
19. Fe AgNO3
置换反应 做燃料
20.(1)解:设粗锌中锌的质量为x,100g稀硫酸中硫酸的质量为y
解得x=6.5g,y=9.8g
所以粗锌中锌的质量分数
答:粗锌中锌的质量分数为65%。
(2)答:100g稀硫酸中硫酸的质量为9.8g
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
