第七单元常见的酸和碱测试题(含答案)---2022-2023学年九年级化学鲁教版下册
文档属性
| 名称 | 第七单元常见的酸和碱测试题(含答案)---2022-2023学年九年级化学鲁教版下册 | 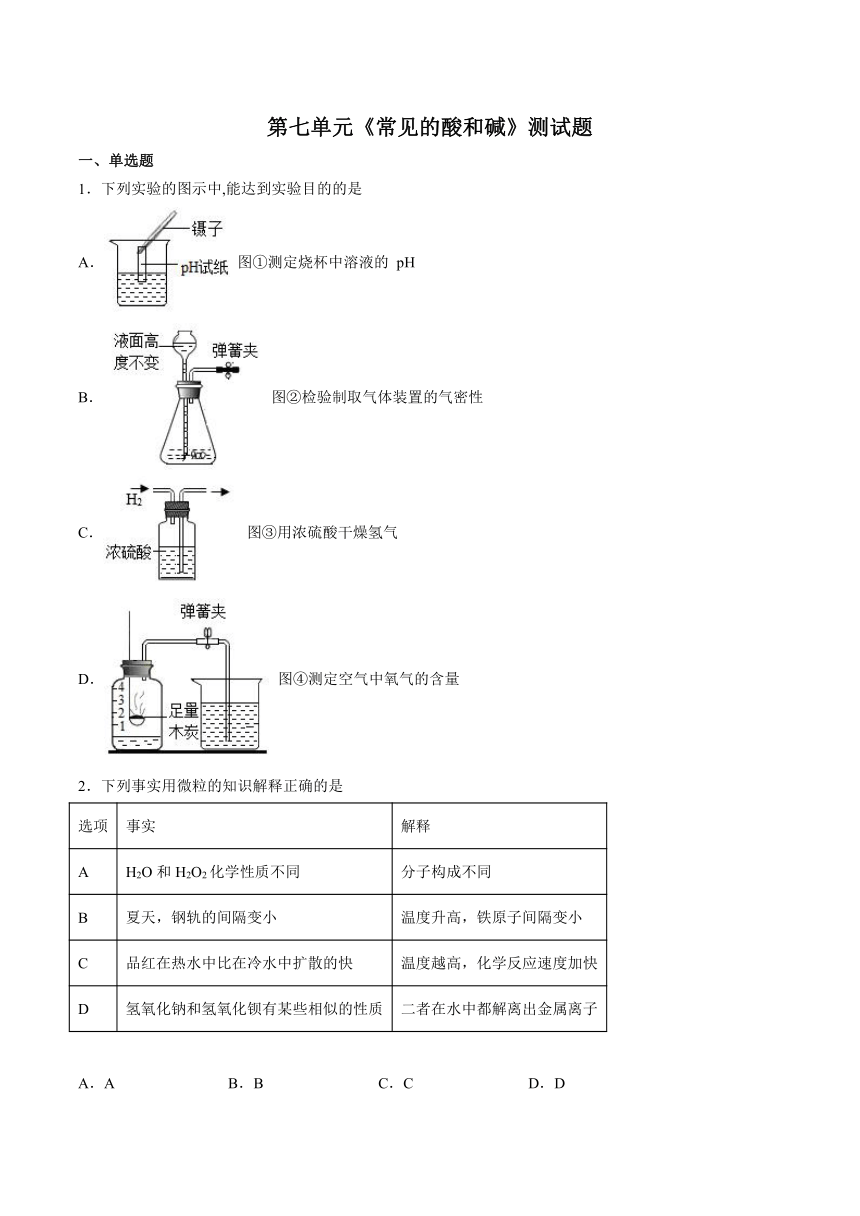 | |
| 格式 | docx | ||
| 文件大小 | 246.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-05 09:53:40 | ||
图片预览



文档简介
第七单元《常见的酸和碱》测试题
一、单选题
1.下列实验的图示中,能达到实验目的的是
A. 图①测定烧杯中溶液的 pH
B. 图②检验制取气体装置的气密性
C. 图③用浓硫酸干燥氢气
D. 图④测定空气中氧气的含量
2.下列事实用微粒的知识解释正确的是
选项 事实 解释
A H2O和H2O2化学性质不同 分子构成不同
B 夏天,钢轨的间隔变小 温度升高,铁原子间隔变小
C 品红在热水中比在冷水中扩散的快 温度越高,化学反应速度加快
D 氢氧化钠和氢氧化钡有某些相似的性质 二者在水中都解离出金属离子
A.A B.B C.C D.D
3.下列数据为常见水果的近似pH,其中呈碱性的是
A. 柿子pH = 8.5 B. 菠萝pH = 5.1 C. 苹果pH = 4.1 D. 杨梅pH=2.5
4.下图能正确表示加水稀释pH=11的溶液的是
A. B. C. D.
5.中和反应在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤 B.服用含A1(OH)3的药物治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液 D.用NaOH溶液洗涤石油产品中的残余硫酸
6.日常生活中的下列做法,一定会有化学变化的是( )
A.用活性炭除去冰箱异味 B.用食醋除水垢
C.用西瓜榨汁 D.用玻璃刀切割玻璃
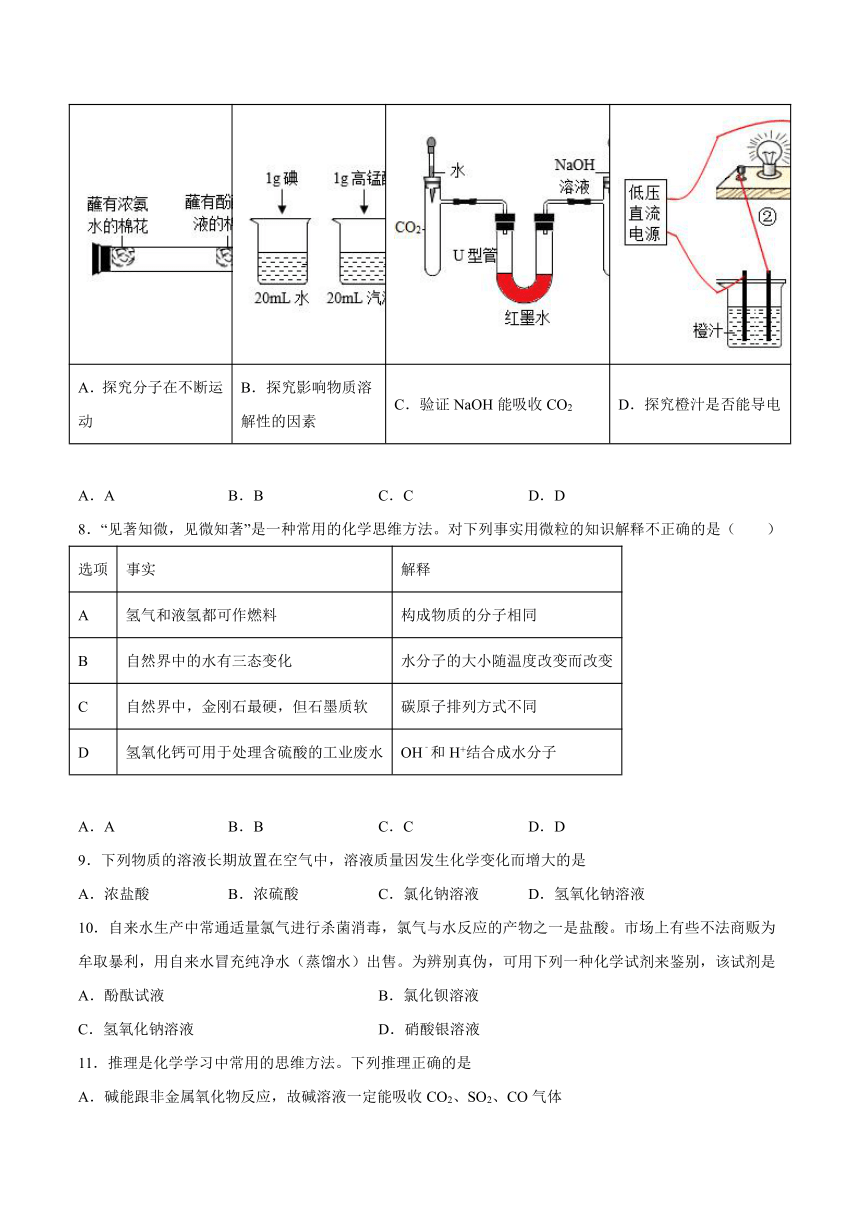
7.下列实验设计不能达到实验目的的是
A.探究分子在不断运动 B.探究影响物质溶解性的因素 C.验证NaOH能吸收CO2 D.探究橙汁是否能导电
A.A B.B C.C D.D
8.“见著知微,见微知著”是一种常用的化学思维方法。对下列事实用微粒的知识解释不正确的是( )
选项 事实 解释
A 氢气和液氢都可作燃料 构成物质的分子相同
B 自然界中的水有三态变化 水分子的大小随温度改变而改变
C 自然界中,金刚石最硬,但石墨质软 碳原子排列方式不同
D 氢氧化钙可用于处理含硫酸的工业废水 OH﹣和H+结合成水分子
A.A B.B C.C D.D
9.下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而增大的是
A.浓盐酸 B.浓硫酸 C.氯化钠溶液 D.氢氧化钠溶液
10.自来水生产中常通适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,用自来水冒充纯净水(蒸馏水)出售。为辨别真伪,可用下列一种化学试剂来鉴别,该试剂是
A.酚酞试液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
11.推理是化学学习中常用的思维方法。下列推理正确的是
A.碱能跟非金属氧化物反应,故碱溶液一定能吸收CO2、SO2、CO气体
B.酸和碱生成盐和水的反应叫中和反应,故生成盐和水的反应一定是中和反应
C.碱溶液能使无色酚酞溶液变红,故能使无色酚酞溶液变红的一定是碱溶液
D.燃烧需要同时满足三个条件,故破坏其中一个条件就可以灭火
12.同学们参加了佛山市中考实验技能考查,切身体会到规范操作的重要性。下列实验操作符合规范要求的是( )
A.测定溶液的pH,先用水润湿pH试纸,然后将试纸插入待测液中
B.配制稀硫酸时,将水沿量筒壁慢慢注入浓硫酸中,并不断搅拌
C.配制一定溶质质量分数的溶液实验中,多余的药品应放回原瓶
D.高锰酸钾制取氧气实验中,收集好气体后应先将导管移出水槽再停止加热
13.推理是化学学习中常用的思维方法,下列推理正确的是
A.酸性溶液的pH<7,则pH<7的溶液一定是酸溶液
B.酸雨呈酸性,呈酸性的雨水一定是酸雨
C.碳酸盐能与稀盐酸反应放出气体,则能与稀盐酸反应放出气体的物质一定是碳酸盐
D.碱性溶液能使酚酞溶液变红,能使酚酞溶液变红的溶液一定呈碱性
二、填空题
14.化学和我们的日常生活息息相关,请你用化学方程式解释下列问题:
(1)氢氧化钡溶液和稀硫酸恰好完全反应:______,此时液体的导电性比反应前__________(“增强”或“减弱”或“不变”)。
(2)用盐酸除去铁制品表面的铁锈: ______,该反应的基本类型是______。
(3)用含氢氧化铝成分的药品治疗胃酸过多:______。
(4)用生石灰做干燥剂: ______,反应的基本类型是 ______ 。
15.通过学习,我们初步认识了氧气、二氧化碳、水等物质。
(1)液态氧可用作火箭的助燃剂,这是利用氧气的_____性质(选填“物理”或“化学”)。
(2)盛放石灰水[Ca(OH)2]的试剂瓶放置时间久了会与空气中的______发生反应,在瓶内壁会形成一层白色物质(其主要成分是CaCO3)。写出生成这种白色物质的化学反应的符号表达式___________;该白色物质很难用水洗净,应加入______与之反应除去,写出该反应的符号表达式为______________。
(3)有两瓶无色气体,分别是氧气和二氧化碳,可用__________区别它们。
(4)生活离不开水,净化水的知识在日常生活中有着广泛的应用。用纱网可将茶叶与茶水分离,便于饮用,其应用的分离方法在化学上称为_________;自然界中的水多数不是纯水,小明同学为了检验自家的井水是否为软水,可用_______来检验;除去水中的色素、异味可用________吸附,生活中可用_______方法将硬水转化为软水(选填“过滤”、“沉降”、“煮沸”、“消毒”)。
16.清理实验室时,发现如下三个内壁都有白色固体的细口瓶,曾经装过标签标示的溶液。现要清洗这些细口瓶,请你一起完成。
(1)三个瓶中的白色固体一定是纯净物的是_____________;
(2)只用水不能清洗干净的细口瓶是______________(填字母序号),形成这种固体的化学反应的方程式为_____________;
(3)最后用稀盐酸和水将三个细口瓶洗净,洗后液体倒入一个干净的容器中,得到 澄清无色溶液,其中一定含有的溶质是_______。
三、实验题
17.如图为实验室制取气体的常见装置。请回答:(从A~F中选填)装置。
(1)仪器①的名称是 ______。
(2)实验室利用A装置制取氧气的化学方程式是 ______;收集较纯净的氧气可选择 ______(从A~F中选填)装置。
(3)实验室利用B装置制取二氧化碳的化学方程式是 ______;实验时长颈漏斗末端要伸入到液面以下,原因是 ______。
(4)相对于装置B,装置C的突出优点是 ______。
(5)用G装置干燥二氧化碳气体,瓶内盛装的试剂是 ______。
18.酸碱中和反应是初中阶段重要的一类反应,请你参与一起探究。
【实验1】从能量变化角度探究酸和碱的反应
某小组同学测量盐酸与氢氧化钠溶液反应过程中温度的变化,观察到溶液温度升高,因此,得出两者能反应的结论。有同学发现此结论不够严谨,在室温下设计了以下实验:
①10mL一定浓度的盐酸与10mL蒸馏水混合,测量溶液温度的变化。
②10mL一定浓度的氢氧化钠溶液与10mL蒸馏水混合,测量溶液温度的变化。
③10mL一定浓度的盐酸与10mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图1所示。
(1)由图1可知,盐酸、氢氧化钠溶液稀释时均___________(填“放热”或“吸热”),但它们稀释时温度的变化量远___________(填“大于”或“小于”)两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于___________(填离子符号)两种离子反应放出热量的缘故,由此说明氢氧化钠和盐酸发生了中和反应。
(3)在10mL溶质质量分数为10%NaOH溶液(密度为1.1g/mL)加入溶质质量分数为5%的盐酸(密度为1.0g/mL)的体积___________mL,就能使反应后溶液的pH等于7.(结果保留整数)
【实验2】从溶液电导率变化角度探究酸和碱的反应
小组同学根据图2进行相应实验操作,利用电导率传感器分别测定A试管和B试管反应过程中溶液的电导率变化,电导率的大小能反映离子浓度的大小。
(4)A试管中反应的化学方程式为___________;试管B中___________(填“有”或“无”)明显现象。
(5)表示A试管中溶液电导率变化的是___________(填“图3”或“图4”)。
(6)图4中电导率的变化___________(填“能”或“不能”)说明酸和碱发生了反应,a点所示溶液中含有的微粒有___________(填微粒符号)。
四、推断题
19.下图为A~G(初中常见物质)的转化关系:
根据以上信息回答下列问题:
(1)若A是一种最简单的有机物,则其化学式是 ________ 。
(2)若反应①为置换反应,则该反应的化学方程式为 _____________________________ 。
(3)写出反应②的化学方程式 ___________________________ 。
(4)反应③可应用于 __________________ (填一种用途),反应的现象是 ______________________ 。
(5)在图示转化反应中,属于复分解反应的是 ____________ (填序号)。
(6)若A为其他的可燃性气体,则A中一定含有的元素是 ____________ ,且A _______ (选填字母序号)
A只能是纯净物 B只能是混合物 C既可能是纯净物,也可能是混合物
20.常见物质A、B、C、D间的关系为:A+B→C+D.
(1)定性
①若A、C均为碱,D为碳酸钙,则B、C分别为_______(填化学式,下同)、_______。
②若A、B、C、D为四种不同类别的化合物,B和D不含氧元素,则该反应的化学方程式为_____(写一个)。
(2)定量
①若16gA和足量B在一定条件下充分反应,生成44gC和36gD,则参加反应的A和B的质量比为_____(填最简比)。
②若3.2g某纯净物A在氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,则A中一定含有的元素是____。
五、计算题
21.化学兴趣小组为了测定某氧化钙变质后的成分,取该氧化钙样品10g加入103.2g稀盐酸中,恰好完全反应后得到溶液的质量为111g。请回答下列问题:
(1)实验中完全反应生成二氧化碳的质量为___________g。
(2)求样品中碳酸钙的质量分数_________。(写出计算步骤)
(3)经测定得知反应后的溶液的溶质质量分数为10%,则10g氧化钙样品中钙元素的质量为________g。
参考答案:
1.B 2.A 3.A 4.D 5.C 6.B 7.B 8.B 9.D 10.D 11.D 12.D 13.D
14. 减弱 复分解反应
化合反应
15. 化学 二氧化碳(或CO2) Ca(OH)2+ CO2CaCO3+H2O 稀盐酸(或HCl) CaCO3 + HClCaCl2 + H2O + CO2 带火星的木条(或澄清石灰水等合理答案) 过滤 肥皂水 活性炭 煮沸
16. C B Ca(OH)2+CO2=CaCO3↓+H2O 氯化钠和氯化钙
17.(1)锥形瓶
(2) D
(3) 防止生成的气体从长颈漏斗下端逸出
(4)控制反应的发生或停止
(5)浓硫酸
18.(1) 放热 小于
(2)H+、OH-
(3)设:需要溶质质量分数为5%的盐酸的体积为x,
x=20mL
(4) Ba(OH)2+H2SO4=BaSO4↓+2H2O 无
(5)图3
(6) 能 Na+、Cl-、H2O
19. CH4 金属除锈 红棕色固体逐渐消失,溶液由无色变成黄色 ③④ 碳元素和氢元素 C
20. Na2CO3 NaOH 1:4 C、H、O
21. 2.2 50% 4
一、单选题
1.下列实验的图示中,能达到实验目的的是
A. 图①测定烧杯中溶液的 pH
B. 图②检验制取气体装置的气密性
C. 图③用浓硫酸干燥氢气
D. 图④测定空气中氧气的含量
2.下列事实用微粒的知识解释正确的是
选项 事实 解释
A H2O和H2O2化学性质不同 分子构成不同
B 夏天,钢轨的间隔变小 温度升高,铁原子间隔变小
C 品红在热水中比在冷水中扩散的快 温度越高,化学反应速度加快
D 氢氧化钠和氢氧化钡有某些相似的性质 二者在水中都解离出金属离子
A.A B.B C.C D.D
3.下列数据为常见水果的近似pH,其中呈碱性的是
A. 柿子pH = 8.5 B. 菠萝pH = 5.1 C. 苹果pH = 4.1 D. 杨梅pH=2.5
4.下图能正确表示加水稀释pH=11的溶液的是
A. B. C. D.
5.中和反应在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤 B.服用含A1(OH)3的药物治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液 D.用NaOH溶液洗涤石油产品中的残余硫酸
6.日常生活中的下列做法,一定会有化学变化的是( )
A.用活性炭除去冰箱异味 B.用食醋除水垢
C.用西瓜榨汁 D.用玻璃刀切割玻璃
7.下列实验设计不能达到实验目的的是
A.探究分子在不断运动 B.探究影响物质溶解性的因素 C.验证NaOH能吸收CO2 D.探究橙汁是否能导电
A.A B.B C.C D.D
8.“见著知微,见微知著”是一种常用的化学思维方法。对下列事实用微粒的知识解释不正确的是( )
选项 事实 解释
A 氢气和液氢都可作燃料 构成物质的分子相同
B 自然界中的水有三态变化 水分子的大小随温度改变而改变
C 自然界中,金刚石最硬,但石墨质软 碳原子排列方式不同
D 氢氧化钙可用于处理含硫酸的工业废水 OH﹣和H+结合成水分子
A.A B.B C.C D.D
9.下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而增大的是
A.浓盐酸 B.浓硫酸 C.氯化钠溶液 D.氢氧化钠溶液
10.自来水生产中常通适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,用自来水冒充纯净水(蒸馏水)出售。为辨别真伪,可用下列一种化学试剂来鉴别,该试剂是
A.酚酞试液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
11.推理是化学学习中常用的思维方法。下列推理正确的是
A.碱能跟非金属氧化物反应,故碱溶液一定能吸收CO2、SO2、CO气体
B.酸和碱生成盐和水的反应叫中和反应,故生成盐和水的反应一定是中和反应
C.碱溶液能使无色酚酞溶液变红,故能使无色酚酞溶液变红的一定是碱溶液
D.燃烧需要同时满足三个条件,故破坏其中一个条件就可以灭火
12.同学们参加了佛山市中考实验技能考查,切身体会到规范操作的重要性。下列实验操作符合规范要求的是( )
A.测定溶液的pH,先用水润湿pH试纸,然后将试纸插入待测液中
B.配制稀硫酸时,将水沿量筒壁慢慢注入浓硫酸中,并不断搅拌
C.配制一定溶质质量分数的溶液实验中,多余的药品应放回原瓶
D.高锰酸钾制取氧气实验中,收集好气体后应先将导管移出水槽再停止加热
13.推理是化学学习中常用的思维方法,下列推理正确的是
A.酸性溶液的pH<7,则pH<7的溶液一定是酸溶液
B.酸雨呈酸性,呈酸性的雨水一定是酸雨
C.碳酸盐能与稀盐酸反应放出气体,则能与稀盐酸反应放出气体的物质一定是碳酸盐
D.碱性溶液能使酚酞溶液变红,能使酚酞溶液变红的溶液一定呈碱性
二、填空题
14.化学和我们的日常生活息息相关,请你用化学方程式解释下列问题:
(1)氢氧化钡溶液和稀硫酸恰好完全反应:______,此时液体的导电性比反应前__________(“增强”或“减弱”或“不变”)。
(2)用盐酸除去铁制品表面的铁锈: ______,该反应的基本类型是______。
(3)用含氢氧化铝成分的药品治疗胃酸过多:______。
(4)用生石灰做干燥剂: ______,反应的基本类型是 ______ 。
15.通过学习,我们初步认识了氧气、二氧化碳、水等物质。
(1)液态氧可用作火箭的助燃剂,这是利用氧气的_____性质(选填“物理”或“化学”)。
(2)盛放石灰水[Ca(OH)2]的试剂瓶放置时间久了会与空气中的______发生反应,在瓶内壁会形成一层白色物质(其主要成分是CaCO3)。写出生成这种白色物质的化学反应的符号表达式___________;该白色物质很难用水洗净,应加入______与之反应除去,写出该反应的符号表达式为______________。
(3)有两瓶无色气体,分别是氧气和二氧化碳,可用__________区别它们。
(4)生活离不开水,净化水的知识在日常生活中有着广泛的应用。用纱网可将茶叶与茶水分离,便于饮用,其应用的分离方法在化学上称为_________;自然界中的水多数不是纯水,小明同学为了检验自家的井水是否为软水,可用_______来检验;除去水中的色素、异味可用________吸附,生活中可用_______方法将硬水转化为软水(选填“过滤”、“沉降”、“煮沸”、“消毒”)。
16.清理实验室时,发现如下三个内壁都有白色固体的细口瓶,曾经装过标签标示的溶液。现要清洗这些细口瓶,请你一起完成。
(1)三个瓶中的白色固体一定是纯净物的是_____________;
(2)只用水不能清洗干净的细口瓶是______________(填字母序号),形成这种固体的化学反应的方程式为_____________;
(3)最后用稀盐酸和水将三个细口瓶洗净,洗后液体倒入一个干净的容器中,得到 澄清无色溶液,其中一定含有的溶质是_______。
三、实验题
17.如图为实验室制取气体的常见装置。请回答:(从A~F中选填)装置。
(1)仪器①的名称是 ______。
(2)实验室利用A装置制取氧气的化学方程式是 ______;收集较纯净的氧气可选择 ______(从A~F中选填)装置。
(3)实验室利用B装置制取二氧化碳的化学方程式是 ______;实验时长颈漏斗末端要伸入到液面以下,原因是 ______。
(4)相对于装置B,装置C的突出优点是 ______。
(5)用G装置干燥二氧化碳气体,瓶内盛装的试剂是 ______。
18.酸碱中和反应是初中阶段重要的一类反应,请你参与一起探究。
【实验1】从能量变化角度探究酸和碱的反应
某小组同学测量盐酸与氢氧化钠溶液反应过程中温度的变化,观察到溶液温度升高,因此,得出两者能反应的结论。有同学发现此结论不够严谨,在室温下设计了以下实验:
①10mL一定浓度的盐酸与10mL蒸馏水混合,测量溶液温度的变化。
②10mL一定浓度的氢氧化钠溶液与10mL蒸馏水混合,测量溶液温度的变化。
③10mL一定浓度的盐酸与10mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图1所示。
(1)由图1可知,盐酸、氢氧化钠溶液稀释时均___________(填“放热”或“吸热”),但它们稀释时温度的变化量远___________(填“大于”或“小于”)两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于___________(填离子符号)两种离子反应放出热量的缘故,由此说明氢氧化钠和盐酸发生了中和反应。
(3)在10mL溶质质量分数为10%NaOH溶液(密度为1.1g/mL)加入溶质质量分数为5%的盐酸(密度为1.0g/mL)的体积___________mL,就能使反应后溶液的pH等于7.(结果保留整数)
【实验2】从溶液电导率变化角度探究酸和碱的反应
小组同学根据图2进行相应实验操作,利用电导率传感器分别测定A试管和B试管反应过程中溶液的电导率变化,电导率的大小能反映离子浓度的大小。
(4)A试管中反应的化学方程式为___________;试管B中___________(填“有”或“无”)明显现象。
(5)表示A试管中溶液电导率变化的是___________(填“图3”或“图4”)。
(6)图4中电导率的变化___________(填“能”或“不能”)说明酸和碱发生了反应,a点所示溶液中含有的微粒有___________(填微粒符号)。
四、推断题
19.下图为A~G(初中常见物质)的转化关系:
根据以上信息回答下列问题:
(1)若A是一种最简单的有机物,则其化学式是 ________ 。
(2)若反应①为置换反应,则该反应的化学方程式为 _____________________________ 。
(3)写出反应②的化学方程式 ___________________________ 。
(4)反应③可应用于 __________________ (填一种用途),反应的现象是 ______________________ 。
(5)在图示转化反应中,属于复分解反应的是 ____________ (填序号)。
(6)若A为其他的可燃性气体,则A中一定含有的元素是 ____________ ,且A _______ (选填字母序号)
A只能是纯净物 B只能是混合物 C既可能是纯净物,也可能是混合物
20.常见物质A、B、C、D间的关系为:A+B→C+D.
(1)定性
①若A、C均为碱,D为碳酸钙,则B、C分别为_______(填化学式,下同)、_______。
②若A、B、C、D为四种不同类别的化合物,B和D不含氧元素,则该反应的化学方程式为_____(写一个)。
(2)定量
①若16gA和足量B在一定条件下充分反应,生成44gC和36gD,则参加反应的A和B的质量比为_____(填最简比)。
②若3.2g某纯净物A在氧气中完全燃烧,生成4.4g二氧化碳和3.6g水,则A中一定含有的元素是____。
五、计算题
21.化学兴趣小组为了测定某氧化钙变质后的成分,取该氧化钙样品10g加入103.2g稀盐酸中,恰好完全反应后得到溶液的质量为111g。请回答下列问题:
(1)实验中完全反应生成二氧化碳的质量为___________g。
(2)求样品中碳酸钙的质量分数_________。(写出计算步骤)
(3)经测定得知反应后的溶液的溶质质量分数为10%,则10g氧化钙样品中钙元素的质量为________g。
参考答案:
1.B 2.A 3.A 4.D 5.C 6.B 7.B 8.B 9.D 10.D 11.D 12.D 13.D
14. 减弱 复分解反应
化合反应
15. 化学 二氧化碳(或CO2) Ca(OH)2+ CO2CaCO3+H2O 稀盐酸(或HCl) CaCO3 + HClCaCl2 + H2O + CO2 带火星的木条(或澄清石灰水等合理答案) 过滤 肥皂水 活性炭 煮沸
16. C B Ca(OH)2+CO2=CaCO3↓+H2O 氯化钠和氯化钙
17.(1)锥形瓶
(2) D
(3) 防止生成的气体从长颈漏斗下端逸出
(4)控制反应的发生或停止
(5)浓硫酸
18.(1) 放热 小于
(2)H+、OH-
(3)设:需要溶质质量分数为5%的盐酸的体积为x,
x=20mL
(4) Ba(OH)2+H2SO4=BaSO4↓+2H2O 无
(5)图3
(6) 能 Na+、Cl-、H2O
19. CH4 金属除锈 红棕色固体逐渐消失,溶液由无色变成黄色 ③④ 碳元素和氢元素 C
20. Na2CO3 NaOH 1:4 C、H、O
21. 2.2 50% 4
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
