专题5 药物合成的重要原料—卤代烃、胺、酰胺 单元测试卷 (含解析)2022-2023学年高二下学期化学苏教版(2019)选择性必修3
文档属性
| 名称 | 专题5 药物合成的重要原料—卤代烃、胺、酰胺 单元测试卷 (含解析)2022-2023学年高二下学期化学苏教版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 862.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-07 08:12:10 | ||
图片预览



文档简介
专题5《药物合成的重要原料—卤代烃、胺、酰胺》单元测试卷
一、单选题
1.糠醇可用于有机合成树脂、涂料等,四氢糠醇可做印染工业的润湿剂和分散剂,它们的转化关系如图,下列说法正确的是
A.四氢糠醇分子中存在2个手性碳原子
B.糠醇分子中所有原子不可能共平面
C.糠醇可以发生取代、氧化、消去等反应
D.糠醇可以使酸性高锰酸钾溶液褪色,而四氢糠醇不可以
2.下列关于常见有机物的说法不正确的是
A.乙烯可以与氢气发生加成反应,苯不能与氢气加成
B.乙酸和溴乙烷都能与氢氧化钠溶液反应
C.光照下2,2—二甲基丙烷与Br2反应其一溴取代物只有一种
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别
3.用图中实验装置完成对应的实验(已省略部分夹持装置),能达到实验目的的是
A.用①装置制取并收集少量乙炔
B.用②装置制取并检验乙烯
C.用③装置分离CCl4萃取碘水后已分层的有机层和水层
D.用④装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
4.下列关于有机化学史的说法,正确的是
A.贝采里乌斯提出了测定有机物定量分析方法
B.舍勒提出了基团理论
C.李比希提出了有机化学概念
D.维勒最早用人工方法将无机物转变为有机物
5.某物质R燃烧的化学方程式为:2R+5O24CO2+2H2O。则R的化学式是
A.CH B.C2H2 C.C2H4 D.C2H5O
6.辅酶具有预防动脉硬化的功效,其结构简式如右。下列有关辅酶的说法不正确的是
A.分子式为,存在3种官能团
B.分子中4个氧原子在同一平面
C.该物质与溶液反应,最多可消耗
D.该物质与足量反应,最多可消耗
7.美国《Science》杂志报道了“关于植物是怎样互相窃听从而发现附近是否有一个很饿的食草动物”,提出了关于植物能释放出化学“云”(挥发性有机物)的假设。下面就是一种化学“云”——茉莉酮酸酯的结构简式,有关该物质的说法正确的是
A.该有机物能使酸性高锰酸钾溶液褪色
B.1mol该有机物最多可以和3molH2发生加成反应
C.该有机物可以发生银镜反应
D.该物质在酸性条件下的水解比在碱性条件下的水解程度大
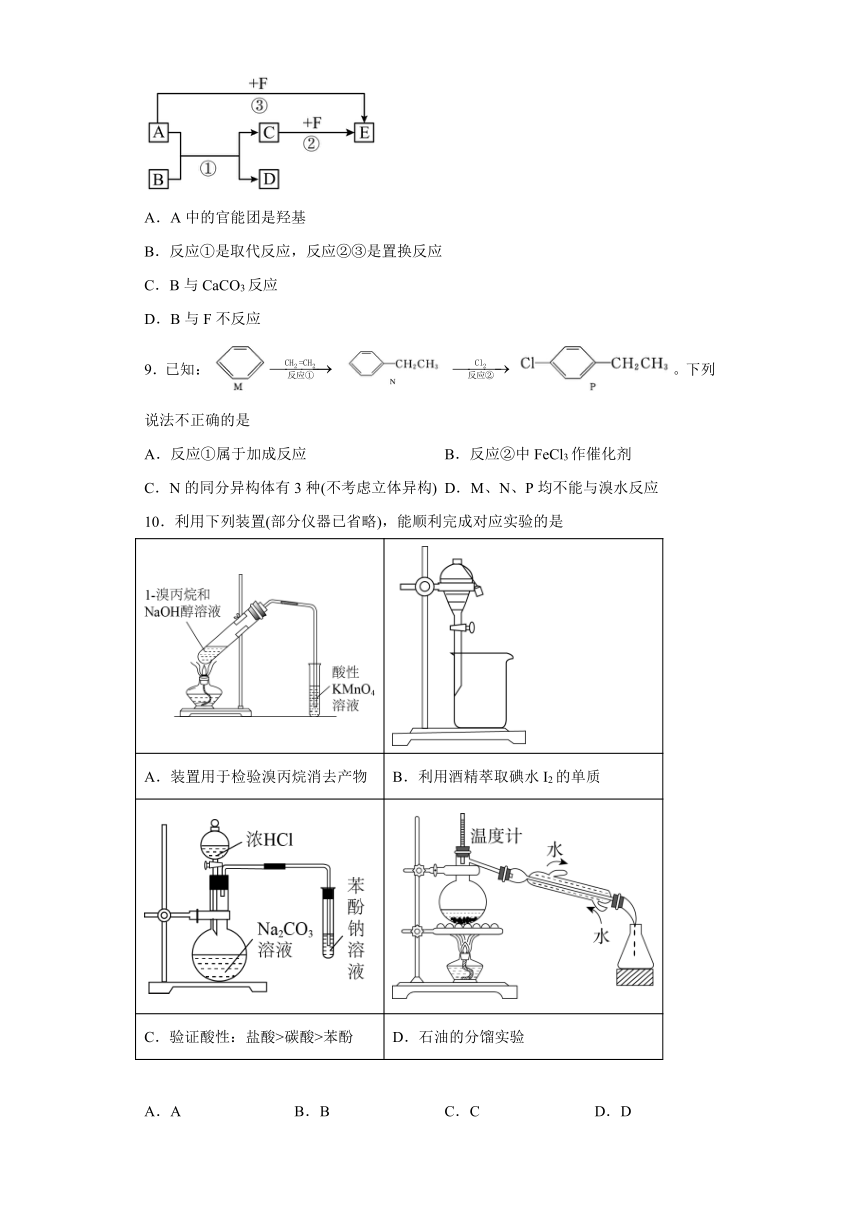
8.已知A、B、D是常见的有机物,相同条件下,A的蒸气对于氢气的相对密度为23,A可以被氧化为B,E是密度最小的气体,它们之间的转化关系如图所示(反应条件及部分产物未标出)。下列说法错误的是( )
A.A中的官能团是羟基
B.反应①是取代反应,反应②③是置换反应
C.B与CaCO3反应
D.B与F不反应
9.已知: 。下列说法不正确的是
A.反应①属于加成反应 B.反应②中FeCl3作催化剂
C.N的同分异构体有3种(不考虑立体异构) D.M、N、P均不能与溴水反应
10.利用下列装置(部分仪器已省略),能顺利完成对应实验的是
A.装置用于检验溴丙烷消去产物 B.利用酒精萃取碘水I2的单质
C.验证酸性:盐酸>碳酸>苯酚 D.石油的分馏实验
A.A B.B C.C D.D
11.欧前胡素()具有抗菌、平喘及抗过敏等作用。下列关于欧前胡素的说法错误的是
A.分子式为
B.能使酸性高锰酸钾溶液和溴水褪色,但反应类型不同
C.能够在碱性条件下发生水解反应
D.欧前胡素最多能与发生加成反应
12.某有机物分子结构为,下列有关它的说法正确的是
A.该有机物属于芳香烃
B.它的苯环上的一氯取代物有3种
C.一定条件下,它可通过加聚反应或缩聚反应形成高分子,也可自身形成环状酯
D.1 mol该有机物最多可与 2mol NaOH 反应
13.下列关于有机物的性质叙述错误的是
A.几种苯的同系物沸点由高到低的顺序为:邻二甲苯>间二甲苯>对二甲苯>乙苯>甲苯
B.顺—2—丁烯的沸点大于反—2—丁烯
C.某种有机物结构如图所示,该物质中羟基对分子极性影响较弱,所以该物质在水中溶解度不大
D.卤代烃的密度和沸点随烃基中碳原子数的增大而逐渐增大
14.有机化合物分子中基团间的相互影响会导致其化学性质改变。下列叙述能说明上述观点的是
A.苯酚易与NaOH溶液反应,而乙醇不能
B.溴乙烷能发生消去反应,而一氯甲烷不能
C.乙烯能发生加成反应,而聚乙烯不能
D.等物质的量的甘油和乙醇分别与足量Na反应,前者反应生成的H2多
15.已知E、F、G之间的转化关系如下图所示,下列说法正确的是
A.E为苯的同系物
B.F的一氯代物有1种
C.1molF最多与发生加成反应
D.G能发生加成反应和取代反应
二、填空题
16.有机化合物A~H的转换关系如所示:
(1)A是有支链的炔烃,其名称是___。
(2)F所属的类别是___。
(3)写出G的结构简式:___。
17.常见的塑料——聚乙烯
(1)聚乙烯的合成与分类
合成反应:nCH2=CH2 (聚乙烯)
_______
(2)聚乙烯的结构与软化温度、密度的关系:
①软化温度、密度大小与高分子链的_______有关;
②软化温度、密度大小与高分子链的_______有关。
_______、_______、_______
另外,线型结构的聚乙烯在一定条件下转变为_______结构的聚乙烯,可以增加强度。
18.Ⅰ.按要求填空。
从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
(1)甲中含氧官能团的名称为_______。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物):
甲X乙
反应②的化学方程式为_______。步骤③的反应试剂和反应条件是_______。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是_______(填序号)。
A.溴水 B.酸性高锰酸钾溶液 C.溴的CCl4溶液 D.银氨溶液
Ⅱ.按要求写化学方程式(注意标注反应条件)
(4)写出对苯二甲酸()和乙二醇在一定条件下发生缩聚反应的化学方程式:_______。
(5)写出有机物发生消去反应的化学方程式:_______。
三、实验题
19.某化学实验小组通过实验探究溴乙烷在不同溶剂中与NaOH反应的情况。
(1)若用如图所示装置进行实验,该实验的目的是_______,实验现象是_______,a试管的作用是_______。
(2)可以替代酸性高锰酸钾溶液的试剂是_______,此时如果去掉盛水的试管,对实验结果_______(填“有”或“无”)影响。
(3)在另一试管中取少量溴乙烷与NaOH溶液混合,充分反应后,向混合液中滴加AgNO3溶液,结果产生沉淀。化学实验小组的同学由此得出结论:溴乙烷与NaOH溶液发生取代反应,生成了溴化钠。该实验方案的错误之处是_______,原因是_______。
(4)用波谱的方法能方便地检验出溴乙烷发生取代反应的产物,使用波谱的名称是_______,波谱仪记录的结果是_______。
20.已知一溴环己烷()在不同溶剂中与发生不同类型的反应,且生成不同的有机产物。回答下列问题:
(1)一溴环己烷在水溶液中与反应,步骤如下:
Ⅰ.向试管中加入水溶液和5mL一溴环己烷,振荡;
Ⅱ.将试管如图固定后,水浴加热。
①图中试管口安装一长导管的作用是___________。
②当观察到___________现象时,表明一溴环己烷与溶液完全反应,生成有机产物的结构简式为___________。
③检验水解产物中的溴离子的方法是___________。
(2)将(1)中溶剂换成乙醇,并重复(1)中步骤。
①向反应后的混合液中先加盐酸酸化,再加入溴水,溶液很快褪色,该现象说明一溴环己烷在乙醇溶液中反应生成了___________(填名称);该发生的反应类型为___________。
②写出一溴环己烷在乙醇溶液中加热时发生反应的化学方程式:___________。
21.2-氯乙醇是一种重要的有机化工原料,溶于水,受热时易分解。通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇。制取反应装置如图所示。
原应原理为:
(g)+HCl(g)ClCH2CH2OH(l) △H<0
部分实验药品及物理量:
化合物名称 相对分子质量 熔点(℃) 沸点(℃)
环氧乙烷 44 -112.2 10.8
2-氯乙醇 80.5 -67.5 128.8
制取与测定实验步骤如下:
I.2-氯乙醇的制取
①将溶剂2-氯乙醇加入三颈烧瓶中,启动搅拌器;
②分别将氯化氢与环氧乙烷两种气体按6:5物质的量的配比通入反应器中,使其在溶剂中充分溶解反应;
③反应温度控制在30℃,持续反应100min;
④采用减压蒸馏、收集产品。
(1)实验装置A、B中均用到了浓硫酸,分别体现的浓硫酸的性质为___________,___________。
(2)步骤③控制反应温度在30℃,如果温度高于30℃可能的后果有___________。
(3)在步骤④中,采用减压蒸馏的原因是___________。
II.2-氯乙醇样品中Cl元素的测定
①取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;待反应完全后加稀硝酸至酸性;
②加入32.50mL 0.4000mol·L-1AgNO3溶液,使Cl-完全沉淀;
③向其中加入2.00mL硝基苯(密度:1.21g·mL-1),振荡,使沉淀表面被有机物覆盖;
④加入指示剂,用0.1000mol· L-1NH4SCN溶液滴定过量的Ag+至终点,消耗NH4SCN溶液 10.00mL;
⑤另取样品1.00mL加水稀释至10.00mL,用pH计测定,测得溶液pH为1.00。
已知:
a.Ksp(AgCl)=1.8×10-10、Ksp(AgSCN)=1.0×10-12
b.2-氯乙醇样品中还含有一定量的氯化氢和其他杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g·mL-1。
(1)ClCH2CH2OH与NaOH反应生成NaCl和另一种物质,该物质的分子式为___________。
(2)步骤③中加入硝基苯的目的是___________,若无此操作,则所测样品中Cl元素含量将___________。填(“偏大”、“偏小”或“不变”)
(3)步骤④中选用的指示剂可以是下列的___________。(选填序号)
A.淀粉溶液 B.酚酞溶液
C.NH4Fe(SO4)2溶液 D.NaCl溶液
(4)根据实验测定的数据计算,样品中2-氯乙醇的质量分数为___________。
试卷第2页,共9页
参考答案:
1.B
【来源】广东省佛山市顺德区罗定邦中学2021-2022学年高二下学期期中教学质量监测化学试题
【详解】A.手性碳是指连有四个不同原子团的碳原子,四氢糠醇分子中存在1个手性碳原子(如图用“*”标记),故A错误;
B.糠醇分子中含有饱和碳原子,饱和碳原子具有甲烷的结构特征,因此糠醇分子中所有原子不可能共平面,故B正确;
C.糠醇分子中羟基的邻位碳原子上没有氢原子,不能发生消去反应,故C错误;
D.糠醇中碳碳双键和羟基均可以使酸性高锰酸钾溶液褪色,四氢糠醇中羟基可以使酸性高锰酸钾溶液褪色,故D错误;
答案选B。
2.A
【来源】20102011学年广西武鸣高中高二上学期期末考试理综化学部分
【详解】A.因苯中具有特殊的不饱和键,乙烯中含碳碳双键,则都能与氢气发生加成反应,故A错误;
B.溴乙烷在碱性环境下发生取代反应,乙酸与NaOH发生中和反应,故B正确;
C.2,2—二甲基丙烷核磁共振氢谱只有一种峰,所以其一溴取代物只有一种,故C正确;
D.乙烯能被高锰酸钾氧化使其褪色,而甲烷不能,则乙烯和甲烷可用酸性高锰酸钾溶液鉴别,故D正确;
综上所述,本题正确选项A。
3.C
【来源】河南省周口市示范高中2020-2021学年高二下学期第一次考试化学试题
【详解】A.收集乙炔的试管不能密封,否则易发生爆炸,故A不符合题意;
B.制取乙烯需控制反应温度,②的制取乙烯装置缺少温度计,故B不符合题意;
C.CCl4萃取碘水后,四氯化碳的密度比水大,分层后在下层,现象合理,故C符合题意;
D.醇易挥发,醇及生成的乙烯均能使酸性高锰酸钾溶液褪色,现象不能说明乙烯生成,故D不符合题意;
本题答案C。
4.D
【来源】河南省南阳市六校2022-2023学年高二下学期第一次联考化学试题
【详解】A.贝采利乌斯在1806年最早提出“有机化学”这个名称,李比希最早提出了测定有机物元素组成的方法,A说法错误;
B.鲍里斯 塞泽尔基提出了基团理论,B说法错误;
C.贝采利乌斯最早提出有机化学的概念,而有机物的元素定量分析最早是由德国人李比希提出的,C说法错误;
D.德国化学家维勒用氰酸铵合成尿酸,最早用人工方法将无机物转变为有机物,D说法正确;
答案为D。
5.B
【来源】云南省昭通市镇雄县泼机中学2021-2022学年高一上学期第一次月考化学试题
【详解】根据化学方程式可知,生成物中共含4个C,4个H,10个O,根据原子守恒,2R中含4个C,4个H,不含O,则R的化学式为C2H2,故选B。
6.C
【来源】浙江省10校联盟2022-2023学年高三上学期10月月考化学试题
【详解】A.由结构简式碳原子个数为59,氧原子个数为4,不饱和度为15, 则分子式为C59H90O4,A正确;
B.这4个氧都处于连接碳碳双键的碳原子上或碳碳双键的碳原子上,而两个碳碳双键相连则必在同一平面,所以4个氧原子也在同一平面上,B正确;
C.醚水解之后得到的是醇,不与氢氧化钠溶液反应,C错误;
D. 该结构中一共12个碳碳双键,2个碳氧双键,则一共可与14mol氢气发生加成,故D正确;
故选C。
7.A
【来源】【百强校】2014-2015广西桂林十八中高二12月月考试题化学试卷(带解析)
【详解】A.该有机物结构中含有碳碳双键,能够被酸性高锰酸钾溶液氧化,导致酸性高锰酸钾溶液褪色,故A正确;
B.分子结构中含有羰基和碳碳双键,1mol该有机物最多可以和2molH2发生加成反应,故B错误;
C.分子结构中没有醛基,不能发生银镜反应,故C错误;
D.分子结构中含有酯基,在酸性条件下水解生成相应的酸和醇,在碱性条件下,中和了酸,促进了水解,水解程度增大,因此该物质在碱性条件下的水解程度大,故D错误;
故选A。
8.D
【来源】第30讲乙醇和乙酸基本营养物质(精练)-2021年高考化学一轮复习讲练测
【分析】A、B、D是三种常见的有机物,相同条件下,A的蒸气对于H2的相对密度为23,M(A)=23×2g/mol=46g/mol,能与F反应生成E,E是密度最小的气体,则E为氢气,结合A可以被氧化成B,可知A为乙醇,B为乙酸,二者发生酯化反应生成乙酸乙酯与水,则D为乙酸乙酯,乙醇、水均能与F发生反应生成氢气,则F为Na等,据此解答。
【详解】A. 物质A为乙醇,含有官能团为羟基,故A正确;
B. 反应①是乙酸与乙醇发生酯化反应,也属于取代反应,反应②是水和钠反应生成氢氧化钠与氢气,属于置换反应,反应③是乙醇和钠生成乙醇钠与氢气,属于置换反应,故B正确;
C. B为乙酸,乙酸酸性比碳酸强,能与碳酸钙反应生成醋酸钙与二氧化碳,故C正确;
D. 乙酸与Na反应生成乙酸钠与氢气,故D错误;
故选D。
9.C
【来源】考点44有机综合推断-备战2023年高考化学一轮复习考点帮(全国通用)
【详解】A.反应①为加成反应,A正确;
B.氯原子取代苯环上的H,应在催化剂存在条件下进行,可用FeCl3作催化剂,B正确;
C.N的同分异构体可为二甲苯或链状烃,二甲苯有3种结构,则对应的同分异构体多于3种,C错误;
D.M、N、P三种有机物均不含碳碳双键,与溴水不反应,D正确;
故答案为C。
10.D
【来源】广东省广州市广雅中学2020-2021学年高二下学3月阶段考试化学试题
【详解】A.挥发的乙醇也能被高锰酸钾氧化,干扰乙烯的检验,故A错误;
B.酒精与水互溶,不能用来萃取碘水中的I2单质,故B错误;
C.挥发的氯化氢也能使苯酚钠溶液变浑浊,不能验证酸性:醋酸>碳酸>苯酚,故C错误;
D.石油的分馏实验装置图中没有错误,故D正确;
故选D。
11.D
【来源】河南省顶尖计划2021届高三毕业班第三次考试理综化学试题
【详解】A.根据结构简式可以确定欧前胡素的分子式为C16H14O4,A项正确;
B.分子中含有碳碳双键,能使酸性高锰酸钾溶液和误水褪色,前者为氧化反应,后者为加成反应,故反应类型不同,B项正确;
C.含有酯基,在碱性条件下可以发生水解反应,C项正确;
D.分子中含有碳碳双键和苯环,可以与H2发生加成反应,但酯基中的C=O键不能与H2发生加成反应,故1 mol欧前胡素最多能与6 molH2发生加成反应,D项错误;
答案选D。
12.C
【来源】四川省南充高级中学2020-2021学年高二上学期期中考试化学试题
【分析】该有机物含有的官能团有碳碳双键、醇羟基和羧基。
【详解】A.该有机物中含有碳、氢、氧三种元素,不属于烃,属于烃的衍生物,A错误;
B.该有机物结构不对称,苯环上有4种氢,它的苯环上的一氯取代物有4种,B错误;
C.该有机物含有碳碳双键,可发生加聚反应;含有醇羟基、羧基,在一定条件下可发生缩聚反应,也可自身发生酯化反应形成环状酯,C正确;
D.该有机物中所含官能团中只有羧基能与氢氧化钠溶液反应,则1mol该有机物最多可与1molNaOH反应,D错误;
答案选C。
13.D
【来源】辽宁省辽南协作校2021-2022学年高二下学期期中联考化学试题
【详解】A.苯的同系物中,碳原子个数越大,相对分子质量越大,分子间作用力越大,沸点越高,则甲苯的沸点最低,分子式相同的苯的同系物中,分子间作用力的大小顺序为邻二甲苯>间二甲苯>对二甲苯>乙苯,所以沸点的大小顺序为邻二甲苯>间二甲苯>对二甲苯>乙苯,故A正确;
B.顺—2—丁烯和反—2—丁烯的分子式相同,顺—2—丁烯的分子间作用力大于反—2—丁烯,沸点高于反—2—丁烯,故B正确;
C.由结构简式可知,有机物分子的碳原子个较大,分子中只含有1个羟基,憎水基对有机物在水分子中的影响大于亲水基,所以有机物在水中溶解度不大,故C正确;
D.卤代烃的密度随烃基中碳原子数的增大而逐渐减小,故D错误;
故选D。
14.A
【来源】广东省广州市2020-2021学年高二下学期期末教学质量检测化学试题
【详解】A.苯酚因为羟基直接与苯环相连,苯环对羟基的影响使得羟基上的氢更活泼,能电离出氢离子,苯酚显弱酸性能与NaOH反应,乙醇不能,A符合题意;
B.一氯甲烷不能消去是因为只含有一个碳原子,不是基团间的相互影响,B不符合题意;
C.乙烯能加成是因为含有官能团碳碳双键,而聚乙烯中没有碳碳双键,不是基团间的影响,C不符合题意;
D.等物质的量的甘油和乙醇分别与足量Na反应,前者反应生成的氢气多是因为羟基的个数不同,不能体现基团间的影响,D不符合题意;
故选A。
15.D
【来源】重庆市2021-2022学年高三上学期第三次质量检测化学试题
【详解】A.苯的同系物是一个苯环与烷烃基结合形成的一系列物质,由此可知E不是苯的同系物,A项错误;
B.F的一氯代物有2种,如图所示的两个位置,B项错误;
C.1molF最多需要5molH2发生加成反应,C项错误;
D.G为卤代烃,能发生水解取代反应,同时含有苯环能发生加成,D项正确;
故选:D。
16. 3-甲基-1-丁炔(或异戊炔) 卤代烃 CH3CH(CH3)CHOHCH2OH
【来源】上海市浦东新区2017年高考化学二模试卷
【分析】A是有支链的炔烃,由分子式可知为CH3CH(CH3)C≡CH,与氢气发生加成反应生成的E可进一步与溴反应,则E应为烯烃,结构简式为CH3CH(CH3)CH=CH2,F为CH3CH(CH3)CHBrCH2Br,G为CH3CH(CH3)CHOHCH2OH,一定条件下与乙二酸发生酯化反应生成H,由H的分子式可知H为缩聚反应的产物,据此解答该题。
【详解】(1)A是有支链的炔烃,为CH3CH(CH3)C≡CH,名称为3-甲基-1-丁炔(或异戊炔);故答案为3-甲基-1-丁炔(或异戊炔);
(2)F为CH3CH(CH3)CHBrCH2Br,属于卤代烃;
故答案为卤代烃;
(3)由以上分析可知G为CH3CH(CH3)CHOHCH2OH;
故答案为CH3CH(CH3)CHOHCH2OH。
17. 高压法 较多 较低 低压法 较少 较高 长短 疏密 越大 接近 越大 网状
【来源】课前-5.2.1通用高分子材料-人教版2019选择性必修3
【解析】略
18.(1)羟基
(2) 2+O22+2H2O NaOH醇溶液,加热
(3)D
(4)n+nHOCH2CH2OH +(2n-1)H2O
(5)+NaBr+2H2O
【来源】江西省赣州教育发展联盟2021-2022学年高二下学期第8次联考化学试题
【分析】甲的结构简式为,在一定条件下转化为,则与HCl发生加成反应;由经两步反应转化为,为防止碳碳双键被氧化,应先氧化后消去,从而得出X为。
(1)
甲为,含氧官能团的名称为羟基。答案为:羟基;
(2)
反应②中,催化氧化生成,化学方程式为:2+O22+2H2O。步骤③为发生消去反应生成,反应试剂和反应条件为:NaOH醇溶液,加热。答案为:2+O22+2H2O;NaOH醇溶液,加热;
(3)
乙为,欲检验乙中的-CHO,需排除碳碳双键的干扰。
A.溴水既能与碳碳双键加成,又能氧化-CHO,A不符合题意;
B.酸性高锰酸钾溶液,既能氧化碳碳双键,又能氧化-CHO,B不符合题意;
C.溴的CCl4溶液,能与碳碳双键加成,但不与-CHO反应,C不符合题意;
D.银氨溶液,与碳碳双键不反应,只能氧化-CHO,从而生成银镜,D符合题意;
故选D。答案为:D;
(4)
对苯二甲酸()和乙二醇在一定条件下发生缩聚反应,生成等,化学方程式:n+nHOCH2CH2OH +(2n-1)H2O。答案为:n+nHOCH2CH2OH +(2n-1)H2O;
(5)
有机物在NaOH醇溶液中加热,能发生消去反应,生成等,化学方程式:+NaBr+2H2O。答案为:+NaBr+2H2O。
【点睛】推断有机物时,既可采用顺推法,又可采用逆推法。
19.(1) 检验加热条件下溴乙烷在NaOH醇溶液中发生消去反应的产物是否为乙烯 酸性高锰酸钾溶液褪色 吸收挥发出的少量乙醇
(2) 溴的四氯化碳溶液 无
(3) 滴加AgNO3溶液前没有用稀硝酸中和过量的氢氧化钠溶液 氢氧化钠溶液会和AgNO3溶液反应生成沉淀
(4) 核磁共振氢谱 有三组峰且峰面积之比为3∶2∶1
【来源】3.1卤代烃-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)
【分析】加热条件下,溴乙烷在NaOH水溶液中反应生成乙醇,在NaOH醇溶液中反应生成乙烯,乙烯会和酸性高锰酸钾反应使溶液褪色;
(1)
该实验将气体通入水中后又通入酸性高锰酸钾溶液中,目的是检验加热条件下溴乙烷在NaOH醇溶液中发生消去反应的产物是否为乙烯;实验现象是酸性高锰酸钾溶液褪色,说明通入气体中含有乙烯;乙醇和水互溶且也能使高锰酸钾溶液褪色,a试管用于吸收挥发出的少量乙醇,防止乙醇与高锰酸钾酸性溶液反应而干扰实验。
(2)
乙烯会和溴单质反应,使溴的四氯化碳溶液褪色,故可以用溴的四氯化碳溶液替代酸性高锰酸钾溶液,乙醇和溴的四氯化碳溶液不反应,因此去掉盛水的试管,对实验结果无影响。
(3)
该实验方案的错误之处是滴加AgNO3溶液前没有用稀硝酸中和过量的氢氧化钠溶液,原因是氢氧化钠溶液会和AgNO3溶液反应生成沉淀,干扰溴离子的检验。
(4)
溴乙烷发生取代反应生成的有机产物为乙醇,乙醇中有3中不同位置的氢原子,原子数目分别为3、2、1,故可以利用核磁共振氢谱法进行检验,波谱仪记录的结果中将会有三组峰且峰面积之比为3∶2∶1。
20. 冷凝回流 溶液分层消失 取少量溶液,加入足量硝酸酸化,再加入硝酸银溶液,若有淡黄色沉淀生成,则说明水解后的溶液含有溴离子 环己烯 消去反应
【来源】青海省西宁市大通回族土族自治县2020-2021学年高二下学期期末联考化学试题
【详解】(1)①图中试管口安装一长导管的作用是冷凝回流;故答案为:冷凝回流。
②一溴环己烷不溶于水,会与水溶液分层,当观察到溶液分层消失现象时,表明一溴环己烷与溶液完全反应,生成有机物环己醇,其结构简式为;故答案为:溶液分层消失;。
③水解后产物中有溴离子和氢氧根,因此检验水解产物中的溴离子的方法是取少量溶液,加入足量硝酸酸化,再加入硝酸银溶液,若有淡黄色沉淀生成,则说明水解后的溶液含有溴离子;故答案为:取少量溶液,加入足量硝酸酸化,再加入硝酸银溶液,若有淡黄色沉淀生成,则说明水解后的溶液含有溴离子。
(2)①能使溴水褪色,说明生成了烯烃,而一溴环己烷在乙醇溶液中反应生成了环己烯;该发生的反应类型为消去反应;故答案为:环己烯;消去反应。
②一溴环己烷在乙醇溶液中加热时反应生成环己烯,其反应的化学方程式:;故答案为:。
21. 难挥发性 吸水性 2-氯乙烷产率低(其他合理答案也可) 减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解 C2H6O2 防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀 偏小 C 80.5%
【来源】山西省运城市新绛县山西省新绛中学校2021届高三上学期阶段性检测理综化学试题
【分析】浓硫酸与NaCl固体在加热条件下反应,生成NaHSO4或Na2SO4和HCl,用浓硫酸干燥后得到纯净的氯化氢气体;氯化氢与环氧乙烷在三颈烧瓶内发生反应,生成2-氯乙醇;由于反应为放热的可逆反应,温度高不利于平衡的正向移动,所以用温水浴加热时,需控制水浴的温度,以提高反应物的转化率。
【详解】(1)装置A中,浓硫酸作为反应物,利用难挥发性酸制易挥发性酸的原理,制取氯化氢气体;B中用浓硫酸除去氯化氢中混有的水蒸气,所以分别体现的浓硫酸的性质为难挥发性,吸水性。答案为:难挥发性;吸水性;
(2)对于反应(g)+HCl(g)ClCH2CH2OH(l) △H<0,步骤③控制反应温度在30℃,以加快反应速率,但如果温度高于30℃,则平衡会发生逆向移动,所以可能的后果有2-氯乙烷产率低(其他合理答案也可)。答案为:2-氯乙烷产率低(其他合理答案也可);
(3)题中信息显示:“2-氯乙醇受热时易分解”,所以在步骤④中,采用减压蒸馏的原因是减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解。答案为:减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解;
II.(1)ClCH2CH2OH与NaOH反应发生水解反应,生成NaCl和乙二醇(HOCH2CH2OH),乙二醇的分子式为C2H6O2。答案为:C2H6O2;
(2)由“Ksp(AgCl)=1.8×10-10、Ksp(AgSCN)=1.0×10-12”可以看出,AgCl的溶度积比AgSCN大,所以AgCl能转化为AgSCN,为阻止此转化反应的发生,从而减少实验误差,步骤③中加入硝基苯(使沉淀表面被有机物覆盖)的目的是防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀,若无此操作,则有一部分AgCl能转化为AgSCN,消耗NH4SCN的量增多,所测样品中Cl元素含量将偏小;答案为:防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀;偏小;
(3)步骤④中,为准确测定NH4SCN与过量的Ag+刚好完全反应,需选择与SCN-反应敏感的Fe3+,所以选用的指示剂可以是NH4Fe(SO4)2溶液,故选C;答案为:C;
(4)样品中含有HCl的物质的量为n(HCl)=0.1mol/L×0.01L=0.001mol,n(AgNO3)=0.4mol/L×0.0325L=0.013mol,n(NH4SCN)= 0.1mol/L×0.01L=0.001mol,则样品中氯原子的物质的量为0.013mol-0.001mol-0.001mol=0.011mol,所以样品中2-氯乙醇的质量分数为=80.5%。答案为:80.5%。
【点睛】样品中溶有氯化氢,它也能与AgNO3发生反应生成AgCl沉淀,从而消耗gNO3溶液,解题时需引起注意
一、单选题
1.糠醇可用于有机合成树脂、涂料等,四氢糠醇可做印染工业的润湿剂和分散剂,它们的转化关系如图,下列说法正确的是
A.四氢糠醇分子中存在2个手性碳原子
B.糠醇分子中所有原子不可能共平面
C.糠醇可以发生取代、氧化、消去等反应
D.糠醇可以使酸性高锰酸钾溶液褪色,而四氢糠醇不可以
2.下列关于常见有机物的说法不正确的是
A.乙烯可以与氢气发生加成反应,苯不能与氢气加成
B.乙酸和溴乙烷都能与氢氧化钠溶液反应
C.光照下2,2—二甲基丙烷与Br2反应其一溴取代物只有一种
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别
3.用图中实验装置完成对应的实验(已省略部分夹持装置),能达到实验目的的是
A.用①装置制取并收集少量乙炔
B.用②装置制取并检验乙烯
C.用③装置分离CCl4萃取碘水后已分层的有机层和水层
D.用④装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
4.下列关于有机化学史的说法,正确的是
A.贝采里乌斯提出了测定有机物定量分析方法
B.舍勒提出了基团理论
C.李比希提出了有机化学概念
D.维勒最早用人工方法将无机物转变为有机物
5.某物质R燃烧的化学方程式为:2R+5O24CO2+2H2O。则R的化学式是
A.CH B.C2H2 C.C2H4 D.C2H5O
6.辅酶具有预防动脉硬化的功效,其结构简式如右。下列有关辅酶的说法不正确的是
A.分子式为,存在3种官能团
B.分子中4个氧原子在同一平面
C.该物质与溶液反应,最多可消耗
D.该物质与足量反应,最多可消耗
7.美国《Science》杂志报道了“关于植物是怎样互相窃听从而发现附近是否有一个很饿的食草动物”,提出了关于植物能释放出化学“云”(挥发性有机物)的假设。下面就是一种化学“云”——茉莉酮酸酯的结构简式,有关该物质的说法正确的是
A.该有机物能使酸性高锰酸钾溶液褪色
B.1mol该有机物最多可以和3molH2发生加成反应
C.该有机物可以发生银镜反应
D.该物质在酸性条件下的水解比在碱性条件下的水解程度大
8.已知A、B、D是常见的有机物,相同条件下,A的蒸气对于氢气的相对密度为23,A可以被氧化为B,E是密度最小的气体,它们之间的转化关系如图所示(反应条件及部分产物未标出)。下列说法错误的是( )
A.A中的官能团是羟基
B.反应①是取代反应,反应②③是置换反应
C.B与CaCO3反应
D.B与F不反应
9.已知: 。下列说法不正确的是
A.反应①属于加成反应 B.反应②中FeCl3作催化剂
C.N的同分异构体有3种(不考虑立体异构) D.M、N、P均不能与溴水反应
10.利用下列装置(部分仪器已省略),能顺利完成对应实验的是
A.装置用于检验溴丙烷消去产物 B.利用酒精萃取碘水I2的单质
C.验证酸性:盐酸>碳酸>苯酚 D.石油的分馏实验
A.A B.B C.C D.D
11.欧前胡素()具有抗菌、平喘及抗过敏等作用。下列关于欧前胡素的说法错误的是
A.分子式为
B.能使酸性高锰酸钾溶液和溴水褪色,但反应类型不同
C.能够在碱性条件下发生水解反应
D.欧前胡素最多能与发生加成反应
12.某有机物分子结构为,下列有关它的说法正确的是
A.该有机物属于芳香烃
B.它的苯环上的一氯取代物有3种
C.一定条件下,它可通过加聚反应或缩聚反应形成高分子,也可自身形成环状酯
D.1 mol该有机物最多可与 2mol NaOH 反应
13.下列关于有机物的性质叙述错误的是
A.几种苯的同系物沸点由高到低的顺序为:邻二甲苯>间二甲苯>对二甲苯>乙苯>甲苯
B.顺—2—丁烯的沸点大于反—2—丁烯
C.某种有机物结构如图所示,该物质中羟基对分子极性影响较弱,所以该物质在水中溶解度不大
D.卤代烃的密度和沸点随烃基中碳原子数的增大而逐渐增大
14.有机化合物分子中基团间的相互影响会导致其化学性质改变。下列叙述能说明上述观点的是
A.苯酚易与NaOH溶液反应,而乙醇不能
B.溴乙烷能发生消去反应,而一氯甲烷不能
C.乙烯能发生加成反应,而聚乙烯不能
D.等物质的量的甘油和乙醇分别与足量Na反应,前者反应生成的H2多
15.已知E、F、G之间的转化关系如下图所示,下列说法正确的是
A.E为苯的同系物
B.F的一氯代物有1种
C.1molF最多与发生加成反应
D.G能发生加成反应和取代反应
二、填空题
16.有机化合物A~H的转换关系如所示:
(1)A是有支链的炔烃,其名称是___。
(2)F所属的类别是___。
(3)写出G的结构简式:___。
17.常见的塑料——聚乙烯
(1)聚乙烯的合成与分类
合成反应:nCH2=CH2 (聚乙烯)
_______
(2)聚乙烯的结构与软化温度、密度的关系:
①软化温度、密度大小与高分子链的_______有关;
②软化温度、密度大小与高分子链的_______有关。
_______、_______、_______
另外,线型结构的聚乙烯在一定条件下转变为_______结构的聚乙烯,可以增加强度。
18.Ⅰ.按要求填空。
从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
(1)甲中含氧官能团的名称为_______。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物):
甲X乙
反应②的化学方程式为_______。步骤③的反应试剂和反应条件是_______。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是_______(填序号)。
A.溴水 B.酸性高锰酸钾溶液 C.溴的CCl4溶液 D.银氨溶液
Ⅱ.按要求写化学方程式(注意标注反应条件)
(4)写出对苯二甲酸()和乙二醇在一定条件下发生缩聚反应的化学方程式:_______。
(5)写出有机物发生消去反应的化学方程式:_______。
三、实验题
19.某化学实验小组通过实验探究溴乙烷在不同溶剂中与NaOH反应的情况。
(1)若用如图所示装置进行实验,该实验的目的是_______,实验现象是_______,a试管的作用是_______。
(2)可以替代酸性高锰酸钾溶液的试剂是_______,此时如果去掉盛水的试管,对实验结果_______(填“有”或“无”)影响。
(3)在另一试管中取少量溴乙烷与NaOH溶液混合,充分反应后,向混合液中滴加AgNO3溶液,结果产生沉淀。化学实验小组的同学由此得出结论:溴乙烷与NaOH溶液发生取代反应,生成了溴化钠。该实验方案的错误之处是_______,原因是_______。
(4)用波谱的方法能方便地检验出溴乙烷发生取代反应的产物,使用波谱的名称是_______,波谱仪记录的结果是_______。
20.已知一溴环己烷()在不同溶剂中与发生不同类型的反应,且生成不同的有机产物。回答下列问题:
(1)一溴环己烷在水溶液中与反应,步骤如下:
Ⅰ.向试管中加入水溶液和5mL一溴环己烷,振荡;
Ⅱ.将试管如图固定后,水浴加热。
①图中试管口安装一长导管的作用是___________。
②当观察到___________现象时,表明一溴环己烷与溶液完全反应,生成有机产物的结构简式为___________。
③检验水解产物中的溴离子的方法是___________。
(2)将(1)中溶剂换成乙醇,并重复(1)中步骤。
①向反应后的混合液中先加盐酸酸化,再加入溴水,溶液很快褪色,该现象说明一溴环己烷在乙醇溶液中反应生成了___________(填名称);该发生的反应类型为___________。
②写出一溴环己烷在乙醇溶液中加热时发生反应的化学方程式:___________。
21.2-氯乙醇是一种重要的有机化工原料,溶于水,受热时易分解。通常是以适量的2-氯乙醇为溶剂,用氯化氢与环氧乙烷反应制得新的2-氯乙醇。制取反应装置如图所示。
原应原理为:
(g)+HCl(g)ClCH2CH2OH(l) △H<0
部分实验药品及物理量:
化合物名称 相对分子质量 熔点(℃) 沸点(℃)
环氧乙烷 44 -112.2 10.8
2-氯乙醇 80.5 -67.5 128.8
制取与测定实验步骤如下:
I.2-氯乙醇的制取
①将溶剂2-氯乙醇加入三颈烧瓶中,启动搅拌器;
②分别将氯化氢与环氧乙烷两种气体按6:5物质的量的配比通入反应器中,使其在溶剂中充分溶解反应;
③反应温度控制在30℃,持续反应100min;
④采用减压蒸馏、收集产品。
(1)实验装置A、B中均用到了浓硫酸,分别体现的浓硫酸的性质为___________,___________。
(2)步骤③控制反应温度在30℃,如果温度高于30℃可能的后果有___________。
(3)在步骤④中,采用减压蒸馏的原因是___________。
II.2-氯乙醇样品中Cl元素的测定
①取样品1.00mL于锥形瓶中,加入NaOH溶液,加热;待反应完全后加稀硝酸至酸性;
②加入32.50mL 0.4000mol·L-1AgNO3溶液,使Cl-完全沉淀;
③向其中加入2.00mL硝基苯(密度:1.21g·mL-1),振荡,使沉淀表面被有机物覆盖;
④加入指示剂,用0.1000mol· L-1NH4SCN溶液滴定过量的Ag+至终点,消耗NH4SCN溶液 10.00mL;
⑤另取样品1.00mL加水稀释至10.00mL,用pH计测定,测得溶液pH为1.00。
已知:
a.Ksp(AgCl)=1.8×10-10、Ksp(AgSCN)=1.0×10-12
b.2-氯乙醇样品中还含有一定量的氯化氢和其他杂质(杂质不与NaOH和AgNO3溶液反应),密度约为1.10g·mL-1。
(1)ClCH2CH2OH与NaOH反应生成NaCl和另一种物质,该物质的分子式为___________。
(2)步骤③中加入硝基苯的目的是___________,若无此操作,则所测样品中Cl元素含量将___________。填(“偏大”、“偏小”或“不变”)
(3)步骤④中选用的指示剂可以是下列的___________。(选填序号)
A.淀粉溶液 B.酚酞溶液
C.NH4Fe(SO4)2溶液 D.NaCl溶液
(4)根据实验测定的数据计算,样品中2-氯乙醇的质量分数为___________。
试卷第2页,共9页
参考答案:
1.B
【来源】广东省佛山市顺德区罗定邦中学2021-2022学年高二下学期期中教学质量监测化学试题
【详解】A.手性碳是指连有四个不同原子团的碳原子,四氢糠醇分子中存在1个手性碳原子(如图用“*”标记),故A错误;
B.糠醇分子中含有饱和碳原子,饱和碳原子具有甲烷的结构特征,因此糠醇分子中所有原子不可能共平面,故B正确;
C.糠醇分子中羟基的邻位碳原子上没有氢原子,不能发生消去反应,故C错误;
D.糠醇中碳碳双键和羟基均可以使酸性高锰酸钾溶液褪色,四氢糠醇中羟基可以使酸性高锰酸钾溶液褪色,故D错误;
答案选B。
2.A
【来源】20102011学年广西武鸣高中高二上学期期末考试理综化学部分
【详解】A.因苯中具有特殊的不饱和键,乙烯中含碳碳双键,则都能与氢气发生加成反应,故A错误;
B.溴乙烷在碱性环境下发生取代反应,乙酸与NaOH发生中和反应,故B正确;
C.2,2—二甲基丙烷核磁共振氢谱只有一种峰,所以其一溴取代物只有一种,故C正确;
D.乙烯能被高锰酸钾氧化使其褪色,而甲烷不能,则乙烯和甲烷可用酸性高锰酸钾溶液鉴别,故D正确;
综上所述,本题正确选项A。
3.C
【来源】河南省周口市示范高中2020-2021学年高二下学期第一次考试化学试题
【详解】A.收集乙炔的试管不能密封,否则易发生爆炸,故A不符合题意;
B.制取乙烯需控制反应温度,②的制取乙烯装置缺少温度计,故B不符合题意;
C.CCl4萃取碘水后,四氯化碳的密度比水大,分层后在下层,现象合理,故C符合题意;
D.醇易挥发,醇及生成的乙烯均能使酸性高锰酸钾溶液褪色,现象不能说明乙烯生成,故D不符合题意;
本题答案C。
4.D
【来源】河南省南阳市六校2022-2023学年高二下学期第一次联考化学试题
【详解】A.贝采利乌斯在1806年最早提出“有机化学”这个名称,李比希最早提出了测定有机物元素组成的方法,A说法错误;
B.鲍里斯 塞泽尔基提出了基团理论,B说法错误;
C.贝采利乌斯最早提出有机化学的概念,而有机物的元素定量分析最早是由德国人李比希提出的,C说法错误;
D.德国化学家维勒用氰酸铵合成尿酸,最早用人工方法将无机物转变为有机物,D说法正确;
答案为D。
5.B
【来源】云南省昭通市镇雄县泼机中学2021-2022学年高一上学期第一次月考化学试题
【详解】根据化学方程式可知,生成物中共含4个C,4个H,10个O,根据原子守恒,2R中含4个C,4个H,不含O,则R的化学式为C2H2,故选B。
6.C
【来源】浙江省10校联盟2022-2023学年高三上学期10月月考化学试题
【详解】A.由结构简式碳原子个数为59,氧原子个数为4,不饱和度为15, 则分子式为C59H90O4,A正确;
B.这4个氧都处于连接碳碳双键的碳原子上或碳碳双键的碳原子上,而两个碳碳双键相连则必在同一平面,所以4个氧原子也在同一平面上,B正确;
C.醚水解之后得到的是醇,不与氢氧化钠溶液反应,C错误;
D. 该结构中一共12个碳碳双键,2个碳氧双键,则一共可与14mol氢气发生加成,故D正确;
故选C。
7.A
【来源】【百强校】2014-2015广西桂林十八中高二12月月考试题化学试卷(带解析)
【详解】A.该有机物结构中含有碳碳双键,能够被酸性高锰酸钾溶液氧化,导致酸性高锰酸钾溶液褪色,故A正确;
B.分子结构中含有羰基和碳碳双键,1mol该有机物最多可以和2molH2发生加成反应,故B错误;
C.分子结构中没有醛基,不能发生银镜反应,故C错误;
D.分子结构中含有酯基,在酸性条件下水解生成相应的酸和醇,在碱性条件下,中和了酸,促进了水解,水解程度增大,因此该物质在碱性条件下的水解程度大,故D错误;
故选A。
8.D
【来源】第30讲乙醇和乙酸基本营养物质(精练)-2021年高考化学一轮复习讲练测
【分析】A、B、D是三种常见的有机物,相同条件下,A的蒸气对于H2的相对密度为23,M(A)=23×2g/mol=46g/mol,能与F反应生成E,E是密度最小的气体,则E为氢气,结合A可以被氧化成B,可知A为乙醇,B为乙酸,二者发生酯化反应生成乙酸乙酯与水,则D为乙酸乙酯,乙醇、水均能与F发生反应生成氢气,则F为Na等,据此解答。
【详解】A. 物质A为乙醇,含有官能团为羟基,故A正确;
B. 反应①是乙酸与乙醇发生酯化反应,也属于取代反应,反应②是水和钠反应生成氢氧化钠与氢气,属于置换反应,反应③是乙醇和钠生成乙醇钠与氢气,属于置换反应,故B正确;
C. B为乙酸,乙酸酸性比碳酸强,能与碳酸钙反应生成醋酸钙与二氧化碳,故C正确;
D. 乙酸与Na反应生成乙酸钠与氢气,故D错误;
故选D。
9.C
【来源】考点44有机综合推断-备战2023年高考化学一轮复习考点帮(全国通用)
【详解】A.反应①为加成反应,A正确;
B.氯原子取代苯环上的H,应在催化剂存在条件下进行,可用FeCl3作催化剂,B正确;
C.N的同分异构体可为二甲苯或链状烃,二甲苯有3种结构,则对应的同分异构体多于3种,C错误;
D.M、N、P三种有机物均不含碳碳双键,与溴水不反应,D正确;
故答案为C。
10.D
【来源】广东省广州市广雅中学2020-2021学年高二下学3月阶段考试化学试题
【详解】A.挥发的乙醇也能被高锰酸钾氧化,干扰乙烯的检验,故A错误;
B.酒精与水互溶,不能用来萃取碘水中的I2单质,故B错误;
C.挥发的氯化氢也能使苯酚钠溶液变浑浊,不能验证酸性:醋酸>碳酸>苯酚,故C错误;
D.石油的分馏实验装置图中没有错误,故D正确;
故选D。
11.D
【来源】河南省顶尖计划2021届高三毕业班第三次考试理综化学试题
【详解】A.根据结构简式可以确定欧前胡素的分子式为C16H14O4,A项正确;
B.分子中含有碳碳双键,能使酸性高锰酸钾溶液和误水褪色,前者为氧化反应,后者为加成反应,故反应类型不同,B项正确;
C.含有酯基,在碱性条件下可以发生水解反应,C项正确;
D.分子中含有碳碳双键和苯环,可以与H2发生加成反应,但酯基中的C=O键不能与H2发生加成反应,故1 mol欧前胡素最多能与6 molH2发生加成反应,D项错误;
答案选D。
12.C
【来源】四川省南充高级中学2020-2021学年高二上学期期中考试化学试题
【分析】该有机物含有的官能团有碳碳双键、醇羟基和羧基。
【详解】A.该有机物中含有碳、氢、氧三种元素,不属于烃,属于烃的衍生物,A错误;
B.该有机物结构不对称,苯环上有4种氢,它的苯环上的一氯取代物有4种,B错误;
C.该有机物含有碳碳双键,可发生加聚反应;含有醇羟基、羧基,在一定条件下可发生缩聚反应,也可自身发生酯化反应形成环状酯,C正确;
D.该有机物中所含官能团中只有羧基能与氢氧化钠溶液反应,则1mol该有机物最多可与1molNaOH反应,D错误;
答案选C。
13.D
【来源】辽宁省辽南协作校2021-2022学年高二下学期期中联考化学试题
【详解】A.苯的同系物中,碳原子个数越大,相对分子质量越大,分子间作用力越大,沸点越高,则甲苯的沸点最低,分子式相同的苯的同系物中,分子间作用力的大小顺序为邻二甲苯>间二甲苯>对二甲苯>乙苯,所以沸点的大小顺序为邻二甲苯>间二甲苯>对二甲苯>乙苯,故A正确;
B.顺—2—丁烯和反—2—丁烯的分子式相同,顺—2—丁烯的分子间作用力大于反—2—丁烯,沸点高于反—2—丁烯,故B正确;
C.由结构简式可知,有机物分子的碳原子个较大,分子中只含有1个羟基,憎水基对有机物在水分子中的影响大于亲水基,所以有机物在水中溶解度不大,故C正确;
D.卤代烃的密度随烃基中碳原子数的增大而逐渐减小,故D错误;
故选D。
14.A
【来源】广东省广州市2020-2021学年高二下学期期末教学质量检测化学试题
【详解】A.苯酚因为羟基直接与苯环相连,苯环对羟基的影响使得羟基上的氢更活泼,能电离出氢离子,苯酚显弱酸性能与NaOH反应,乙醇不能,A符合题意;
B.一氯甲烷不能消去是因为只含有一个碳原子,不是基团间的相互影响,B不符合题意;
C.乙烯能加成是因为含有官能团碳碳双键,而聚乙烯中没有碳碳双键,不是基团间的影响,C不符合题意;
D.等物质的量的甘油和乙醇分别与足量Na反应,前者反应生成的氢气多是因为羟基的个数不同,不能体现基团间的影响,D不符合题意;
故选A。
15.D
【来源】重庆市2021-2022学年高三上学期第三次质量检测化学试题
【详解】A.苯的同系物是一个苯环与烷烃基结合形成的一系列物质,由此可知E不是苯的同系物,A项错误;
B.F的一氯代物有2种,如图所示的两个位置,B项错误;
C.1molF最多需要5molH2发生加成反应,C项错误;
D.G为卤代烃,能发生水解取代反应,同时含有苯环能发生加成,D项正确;
故选:D。
16. 3-甲基-1-丁炔(或异戊炔) 卤代烃 CH3CH(CH3)CHOHCH2OH
【来源】上海市浦东新区2017年高考化学二模试卷
【分析】A是有支链的炔烃,由分子式可知为CH3CH(CH3)C≡CH,与氢气发生加成反应生成的E可进一步与溴反应,则E应为烯烃,结构简式为CH3CH(CH3)CH=CH2,F为CH3CH(CH3)CHBrCH2Br,G为CH3CH(CH3)CHOHCH2OH,一定条件下与乙二酸发生酯化反应生成H,由H的分子式可知H为缩聚反应的产物,据此解答该题。
【详解】(1)A是有支链的炔烃,为CH3CH(CH3)C≡CH,名称为3-甲基-1-丁炔(或异戊炔);故答案为3-甲基-1-丁炔(或异戊炔);
(2)F为CH3CH(CH3)CHBrCH2Br,属于卤代烃;
故答案为卤代烃;
(3)由以上分析可知G为CH3CH(CH3)CHOHCH2OH;
故答案为CH3CH(CH3)CHOHCH2OH。
17. 高压法 较多 较低 低压法 较少 较高 长短 疏密 越大 接近 越大 网状
【来源】课前-5.2.1通用高分子材料-人教版2019选择性必修3
【解析】略
18.(1)羟基
(2) 2+O22+2H2O NaOH醇溶液,加热
(3)D
(4)n+nHOCH2CH2OH +(2n-1)H2O
(5)+NaBr+2H2O
【来源】江西省赣州教育发展联盟2021-2022学年高二下学期第8次联考化学试题
【分析】甲的结构简式为,在一定条件下转化为,则与HCl发生加成反应;由经两步反应转化为,为防止碳碳双键被氧化,应先氧化后消去,从而得出X为。
(1)
甲为,含氧官能团的名称为羟基。答案为:羟基;
(2)
反应②中,催化氧化生成,化学方程式为:2+O22+2H2O。步骤③为发生消去反应生成,反应试剂和反应条件为:NaOH醇溶液,加热。答案为:2+O22+2H2O;NaOH醇溶液,加热;
(3)
乙为,欲检验乙中的-CHO,需排除碳碳双键的干扰。
A.溴水既能与碳碳双键加成,又能氧化-CHO,A不符合题意;
B.酸性高锰酸钾溶液,既能氧化碳碳双键,又能氧化-CHO,B不符合题意;
C.溴的CCl4溶液,能与碳碳双键加成,但不与-CHO反应,C不符合题意;
D.银氨溶液,与碳碳双键不反应,只能氧化-CHO,从而生成银镜,D符合题意;
故选D。答案为:D;
(4)
对苯二甲酸()和乙二醇在一定条件下发生缩聚反应,生成等,化学方程式:n+nHOCH2CH2OH +(2n-1)H2O。答案为:n+nHOCH2CH2OH +(2n-1)H2O;
(5)
有机物在NaOH醇溶液中加热,能发生消去反应,生成等,化学方程式:+NaBr+2H2O。答案为:+NaBr+2H2O。
【点睛】推断有机物时,既可采用顺推法,又可采用逆推法。
19.(1) 检验加热条件下溴乙烷在NaOH醇溶液中发生消去反应的产物是否为乙烯 酸性高锰酸钾溶液褪色 吸收挥发出的少量乙醇
(2) 溴的四氯化碳溶液 无
(3) 滴加AgNO3溶液前没有用稀硝酸中和过量的氢氧化钠溶液 氢氧化钠溶液会和AgNO3溶液反应生成沉淀
(4) 核磁共振氢谱 有三组峰且峰面积之比为3∶2∶1
【来源】3.1卤代烃-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修3)
【分析】加热条件下,溴乙烷在NaOH水溶液中反应生成乙醇,在NaOH醇溶液中反应生成乙烯,乙烯会和酸性高锰酸钾反应使溶液褪色;
(1)
该实验将气体通入水中后又通入酸性高锰酸钾溶液中,目的是检验加热条件下溴乙烷在NaOH醇溶液中发生消去反应的产物是否为乙烯;实验现象是酸性高锰酸钾溶液褪色,说明通入气体中含有乙烯;乙醇和水互溶且也能使高锰酸钾溶液褪色,a试管用于吸收挥发出的少量乙醇,防止乙醇与高锰酸钾酸性溶液反应而干扰实验。
(2)
乙烯会和溴单质反应,使溴的四氯化碳溶液褪色,故可以用溴的四氯化碳溶液替代酸性高锰酸钾溶液,乙醇和溴的四氯化碳溶液不反应,因此去掉盛水的试管,对实验结果无影响。
(3)
该实验方案的错误之处是滴加AgNO3溶液前没有用稀硝酸中和过量的氢氧化钠溶液,原因是氢氧化钠溶液会和AgNO3溶液反应生成沉淀,干扰溴离子的检验。
(4)
溴乙烷发生取代反应生成的有机产物为乙醇,乙醇中有3中不同位置的氢原子,原子数目分别为3、2、1,故可以利用核磁共振氢谱法进行检验,波谱仪记录的结果中将会有三组峰且峰面积之比为3∶2∶1。
20. 冷凝回流 溶液分层消失 取少量溶液,加入足量硝酸酸化,再加入硝酸银溶液,若有淡黄色沉淀生成,则说明水解后的溶液含有溴离子 环己烯 消去反应
【来源】青海省西宁市大通回族土族自治县2020-2021学年高二下学期期末联考化学试题
【详解】(1)①图中试管口安装一长导管的作用是冷凝回流;故答案为:冷凝回流。
②一溴环己烷不溶于水,会与水溶液分层,当观察到溶液分层消失现象时,表明一溴环己烷与溶液完全反应,生成有机物环己醇,其结构简式为;故答案为:溶液分层消失;。
③水解后产物中有溴离子和氢氧根,因此检验水解产物中的溴离子的方法是取少量溶液,加入足量硝酸酸化,再加入硝酸银溶液,若有淡黄色沉淀生成,则说明水解后的溶液含有溴离子;故答案为:取少量溶液,加入足量硝酸酸化,再加入硝酸银溶液,若有淡黄色沉淀生成,则说明水解后的溶液含有溴离子。
(2)①能使溴水褪色,说明生成了烯烃,而一溴环己烷在乙醇溶液中反应生成了环己烯;该发生的反应类型为消去反应;故答案为:环己烯;消去反应。
②一溴环己烷在乙醇溶液中加热时反应生成环己烯,其反应的化学方程式:;故答案为:。
21. 难挥发性 吸水性 2-氯乙烷产率低(其他合理答案也可) 减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解 C2H6O2 防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀 偏小 C 80.5%
【来源】山西省运城市新绛县山西省新绛中学校2021届高三上学期阶段性检测理综化学试题
【分析】浓硫酸与NaCl固体在加热条件下反应,生成NaHSO4或Na2SO4和HCl,用浓硫酸干燥后得到纯净的氯化氢气体;氯化氢与环氧乙烷在三颈烧瓶内发生反应,生成2-氯乙醇;由于反应为放热的可逆反应,温度高不利于平衡的正向移动,所以用温水浴加热时,需控制水浴的温度,以提高反应物的转化率。
【详解】(1)装置A中,浓硫酸作为反应物,利用难挥发性酸制易挥发性酸的原理,制取氯化氢气体;B中用浓硫酸除去氯化氢中混有的水蒸气,所以分别体现的浓硫酸的性质为难挥发性,吸水性。答案为:难挥发性;吸水性;
(2)对于反应(g)+HCl(g)ClCH2CH2OH(l) △H<0,步骤③控制反应温度在30℃,以加快反应速率,但如果温度高于30℃,则平衡会发生逆向移动,所以可能的后果有2-氯乙烷产率低(其他合理答案也可)。答案为:2-氯乙烷产率低(其他合理答案也可);
(3)题中信息显示:“2-氯乙醇受热时易分解”,所以在步骤④中,采用减压蒸馏的原因是减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解。答案为:减小压强,使液体沸点降低,防止2-氯乙醇因温度过高而分解;
II.(1)ClCH2CH2OH与NaOH反应发生水解反应,生成NaCl和乙二醇(HOCH2CH2OH),乙二醇的分子式为C2H6O2。答案为:C2H6O2;
(2)由“Ksp(AgCl)=1.8×10-10、Ksp(AgSCN)=1.0×10-12”可以看出,AgCl的溶度积比AgSCN大,所以AgCl能转化为AgSCN,为阻止此转化反应的发生,从而减少实验误差,步骤③中加入硝基苯(使沉淀表面被有机物覆盖)的目的是防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀,若无此操作,则有一部分AgCl能转化为AgSCN,消耗NH4SCN的量增多,所测样品中Cl元素含量将偏小;答案为:防止在滴加NH4SCN时,AgCl沉淀部分转化为AgSCN沉淀;偏小;
(3)步骤④中,为准确测定NH4SCN与过量的Ag+刚好完全反应,需选择与SCN-反应敏感的Fe3+,所以选用的指示剂可以是NH4Fe(SO4)2溶液,故选C;答案为:C;
(4)样品中含有HCl的物质的量为n(HCl)=0.1mol/L×0.01L=0.001mol,n(AgNO3)=0.4mol/L×0.0325L=0.013mol,n(NH4SCN)= 0.1mol/L×0.01L=0.001mol,则样品中氯原子的物质的量为0.013mol-0.001mol-0.001mol=0.011mol,所以样品中2-氯乙醇的质量分数为=80.5%。答案为:80.5%。
【点睛】样品中溶有氯化氢,它也能与AgNO3发生反应生成AgCl沉淀,从而消耗gNO3溶液,解题时需引起注意
