专题4 分子空间结构与物质性质 单元测试卷(含解析) 2022-2023学年高二下学期化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4 分子空间结构与物质性质 单元测试卷(含解析) 2022-2023学年高二下学期化学苏教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 606.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-08 09:34:50 | ||
图片预览



文档简介
专题4《分子空间结构与物质性质》单元测试卷
一、单选题
1.下列各组物质互为同素异形体的是
A.O2和O3 B.C和CO2
C.H2O和H2O2 D.N2O4和NO2
2.以下核外电子的表示方法中,正确的是
A.N: B.:
C.: D.:
3.含锂材料在社会生产与生活中应用广泛,如和用作核反应堆最佳热载体,和用作高温堆减速剂.下列说法正确的是
A.和互为同素异形体 B.和的化学性质不同
C.和核外电子排布方式相同 D.通过化学变化可以实现与间的相互转化
4.下列说法正确的是
A.固体NaCl不存在阴阳离子,不导电
B.Na2O、Fe2O3、 Al2O3 均属于碱性氧化物
C.硫酸钡溶液几乎不导电,但硫酸钡属于电解质
D.金刚石和石墨是同素异形体,化学性质不同,物理性质相同
5.下列说法正确的是( )
A.C3H7Cl的同分异构体有3种
B.的名称为戊烷
C.CH3OH和CH3—O—CH3分子组成相差一个CH2,所以互为同系物
D.由于原子个数和原子排列方式的不同形成的不同单质互称为同素异形体
6.2022年是令人难忘的一年,下列有关说法不正确的是
A.神舟号宇宙飞船返回舱表面使用的高温结构陶瓷属于新型无机非金属材料
B.新冠疫情仍然是对人类的重大挑战,常用体积分数为95%的医用酒精杀菌消毒
C.北京冬奥会吉祥物“冰墩墩”的材质是由二氯硅烷(SiH2Cl2)经水解等一系列的反应得到的硅胶,二氯硅烷水解可生成强酸
D.世界杯是令人瞩目的体育比赛,化学中也有“足球”——足球烯(C60),它与石墨互为同素异形体
7.据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如图所示:
下列说法不正确的是
A.图中代表H2O2
B.步骤i、ii的总反应方程式是
C.由图可知,步骤iv生成的H2O,其中的H原子全部来自H2O2
D.根据以上原理,推测步骤vi生成HCOOH和H2O
8.下列微粒中,互为同位素的是
A.D2O和H2O B.X和X C.Y和Y D.O2和O3
9.反应8NH3+3Cl2=6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子: B.核内有33个中子的Fe表示为Fe
C.Cl2分子的结构式:Cl-Cl D.Cl-的结构示意图:
10.在原子中,下列关系中一定正确的是
A.中子数=核外电子数 B.质子数+中子数=质量数
C.质子数+核外电子数=质量数 D.质子数=中子数
11.下列物质互为同素异形体的是
A.H2O和H2O2 B.H2和Cl2 C.金刚石和石灰石 D.O2和O3
12.钠元素广泛存在于自然界中,中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。下列有关物质的说法错误的是
A.金刚石、石墨和C60是碳元素的同素异形体
B.Na2O与Na2O2两种固体颜色不同
C.治疗胃酸过多可以用NaHCO3,糕点制作也可以用NaHCO3
D.金属钠放置空气中,最终会变成Na2O2
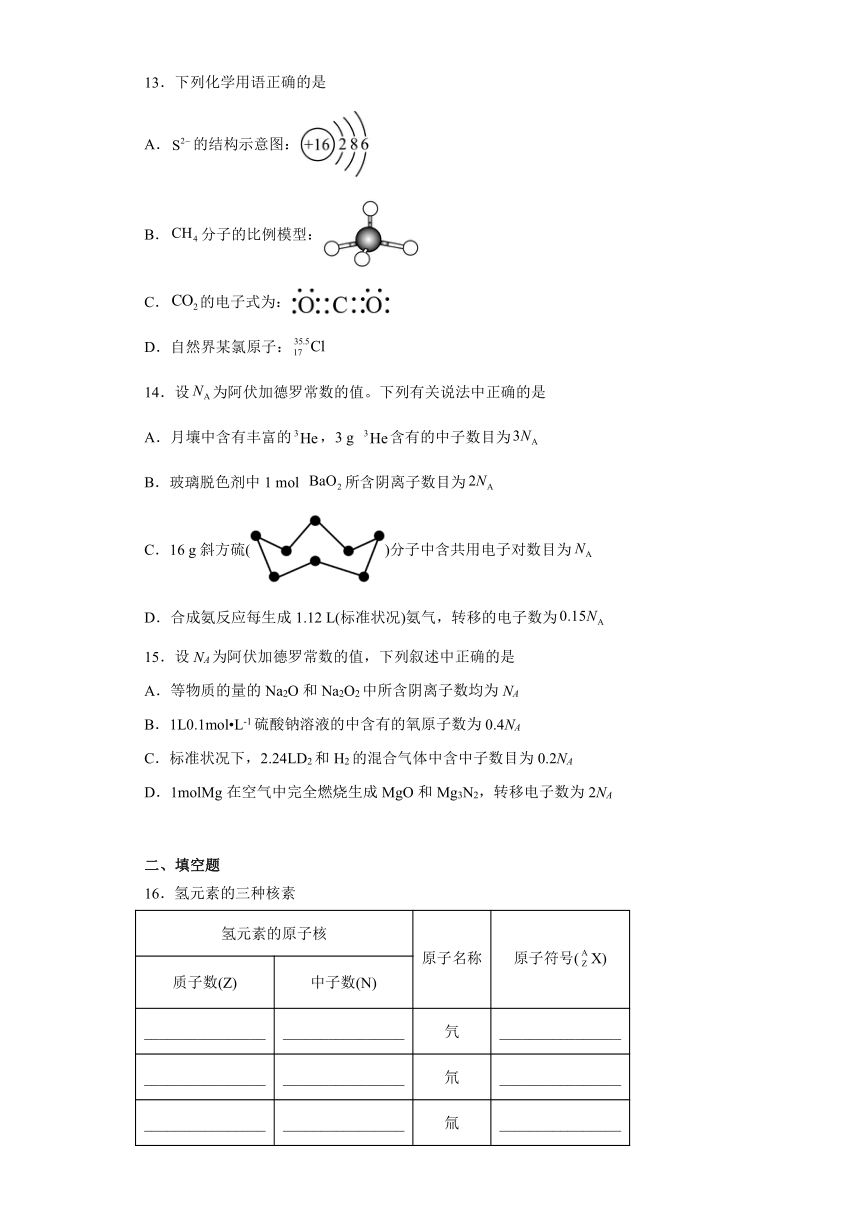
13.下列化学用语正确的是
A.的结构示意图:
B.分子的比例模型:
C.的电子式为:
D.自然界某氯原子:
14.设为阿伏加德罗常数的值。下列有关说法中正确的是
A.月壤中含有丰富的,3 g 含有的中子数目为
B.玻璃脱色剂中1 mol 所含阴离子数目为
C.16 g斜方硫()分子中含共用电子对数目为
D.合成氨反应每生成1.12 L(标准状况)氨气,转移的电子数为
15.设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.等物质的量的Na2O和Na2O2中所含阴离子数均为NA
B.1L0.1mol L-1硫酸钠溶液的中含有的氧原子数为0.4NA
C.标准状况下,2.24LD2和H2的混合气体中含中子数目为0.2NA
D.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数为2NA
二、填空题
16.氢元素的三种核素
氢元素的原子核 原子名称 原子符号(X)
质子数(Z) 中子数(N)
________________ ________________ 氕 ________________
________________ ________________ 氘 ________________
________________ ________________ 氚 ________________
17.在、、、、、中
(1)互为同位素的是_______和_______。
(2)质量数相等,但不能互称同位素的是_______和_______。
(3)中子数相等,但质子数不相等的是_______和_______。
18.已知某粒子的结构示意图为。(x为质子数,y为最外层电子式)。试回答:
(1)当x-y=10时,该微粒为_______(选填“原子”“正离子”或“负离子”),当y=6时,写出该原子的电子式_______。
(2)当y=8时,正离子或负离子可能为_______(填离子符号,各写一例)。若它们形成化合物时离子数之比为1:2,则该种化合物的电子式为_______。
三、实验题
19.(本题共14分)按要求完成下列各题14分
(1)下列各组物质 ① O2和O3②12C和14C
互为同位素的是______ 互为同素异形体的是_____,互为同分异构体的是_____________
(2)如下图所示,把试管放入盛有25℃的饱和石灰水溶液的烧杯中,试管中开始放入几小片镁片,再用滴管滴入5 mL盐酸于试管中。回答下列问题:
①实验中观察到的现象是_____________________。
②产生上述现象的原因是___________________。
③写出有关反应的离子方程式__________________。
④由实验推知,所得MgCl2溶液和H2的总能量___________(填“大于”“小于”“等于”)原来镁片和盐酸的总能量。
20.归纳与演绎是重要的科学方法,也是常用的化学学习方法,请用该方法解决下列问题。
(1)我们已经学过实验室制取、、三种气体的反应原理与收集方法。请你归纳出选择实验室制取气体反应的发生装置主要考虑的因素:_______(填序号)。
①反应物的状态 ②生成气体的溶解性 ③反应条件 ④原料为纯净物 ⑤气体的密度
(2)探究课上,小明同学为了探究氨气的某些性质,做了如图实验(从左向右依次是他所做实验及现象)。
通过实验,小明同学可得出氨气的三点性质,分别是
①_______;
②_______;
③_______。
(3)在获得氨气的主要性质后,小明决定自己来制取氨气,他先查阅了有关资料,知道可通过多种反应得到他准备分别用以下两种化学反应来制备氨气,请结合所学知识帮助他完成氨气的实验制备方案。
①
②
若选择反应①作为实验室制取的反应原理,需要用图中装置的_______作为发生装置,若用D装置来收集氨气,气体由_______端进入。若选择反应②作为实验室制取的反应原理,需要用图中装置的_______作为发生装置。
试卷第2页,共6页
参考答案:
1.A
【来源】专题八原子结构与元素周期表(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
【分析】同素异形体指同种元素组成的不同单质,据此分析解答。
【详解】A.O2和O3是氧元素的两种不同单质,互为同素异形体,A符合题意;
B.CO2是化合物,B不符合题意;
C.H2O和H2O2均为化合物,C不符合题意;
D.N2O4和NO2均为化合物,D不符合题意;
答案选A。
2.B
【来源】专题1~2综合检测(基础卷)
【详解】A.电子优先单独占据1个轨道,且自旋方向相同,N原子p轨道有3个电子,分占3个轨道,其轨道表示式为,故A错误;
B.核外共10个电子,其轨道表示式为,故B正确;
C.Fe原子核外共有26个电子,电子排布式为,故C错误;
D.Cu原子核外有29个电子,位于元素周期表第四周期第ⅠB族,其价电子排布为3d104s1,所以基态原子的电子排布式为,故D错误;
故答案选B。
3.C
【来源】云南省大理州祥云县2020-2021学年高一上学期期末统测化学试题
【详解】A.同种元素形成的不同单质互为同素异形体,和是化合物,不互为同素异形体,故A错误;
B.同种元素的不同原子间互为同位素,而互为同位素的原子的最外层电子数相同,所以化学性质也相同,故和的化学性质相同,故B错误;
C.和的核内均有3个质子,核外均有3个电子,故两者的核外电子排布方式相同,故C正确;
D.化学反应中的最小微粒是原子,故化学变化不可以实现与间的相互转化,两者的转化也不是化学变化,故D错误;
本题答案C。
4.C
【来源】吉林公主岭范家屯一中2020-2021学年高一上学期期中考试化学试题
【详解】A.固体NaCl含有钠离子、氯离子,由于离子不能自由移动,因此固体NaCl不导电,故A不符合题意;
B.Na2O、Fe2O3均属于碱性氧化物,Al2O3属于两性氧化物,故B不符合题意;
C.硫酸钡溶液几乎不导电,主要是因为硫酸钡难溶于水,在熔融状态下能导电,因此硫酸钡属于电解质,故C符合题意;
D.金刚石和石墨是同素异形体,化学性质基本相同,物理性质不同,比如硬度不同,故D不符合题意;
答案为C。
5.D
【来源】人教版2019必修第二册第七章第一~二节综合拔高练
【详解】A.C3H8中含2种H,则C3H7Cl的同分异构体有2种,A错误;
B.的名称为异戊烷或2-甲基丁烷,B错误;
C.CH3OH和CH3—O—CH3分别为醇、醚,为不同类的物质,一定不互为同系物,C错误;
D.由于原子个数和原子排列方式的不同形成的不同单质,为同种元素的不同单质,互称为同素异形体,D正确;
故选:D。
6.B
【来源】江西省上饶市2022-2023学年高二上学期期末教学质量测试化学试题
【详解】A.高温结构陶瓷属于新型无机非金属材料,A正确;
B.常用体积分数为75%的医用酒精杀菌消毒,B错误;
C.二氯硅烷(SiH2Cl2)含有硅元素,经水解等一系列的反应得到的硅胶,二氯硅烷水解可生成盐酸,盐酸属于强酸,C正确;
D.同素异形体是同种元素组成的单质;足球烯(C60)与石墨互为同素异形体,故D正确;
故选B。
7.C
【来源】第14周晚练题-备战2022年高考化学周测与晚练(新高考专用)
【详解】A.根据题意,H2O2与CH4转化为含氧有机物, 为H2O2的比例模型,A正确,不选;
B.根据图示步骤i、ii,得到产物水和CH3OH,方程式为,B正确,不选;
C.根据图示,步骤iv生成的H2O,其中的H来自于步骤ii生成的CH3OH和H2O2,C错误,符合题意;
D.模仿步骤ii,H2O2分解成2个-OH,1个结合H原子生成H2O,1个与v生成的-CHO结合得到HCOOH,因此步骤vi生成HCOOH和H2O,D正确,不选;
故选C。
8.C
【来源】云南省镇沅县第一中学2021-2022学年高二下学期开学考试化学试题
【分析】同位素指具有相同质子数和不同质量数的核素之间的关系。
【详解】A.D2O和H2O是两种分子,不是核素,不属于同位素关系,A不符合题意;
B.X和X两种的质子数不相同,不属于同位素关系,B不符合题意;
C.Y和Y两者具有相同质子数和不同质量数,互为同位素,C符合题意;
D.O2和O3是两种分子,不是核素,不属于同位素关系,D不符合题意;
故选C。
9.C
【来源】山东省淄博市桓台第二中学2021-2022学年高三9月月考化学试题
【详解】A.中子数为9的氮原子:,A错误;
B.核内有33个中子的Fe表示为Fe,B错误;
C.Cl2分子中氯原子与氯原子之间有一对共用电子对,其结构式:Cl-Cl,C正确;
D.Cl-是在氯原子基础上得1电子形成8电子稳定结构,D错误;
故选C。
10.B
【来源】湖北省十堰市2020-2021学年高一上学期期末考试化学试题
【详解】A.在原子中,中子数不一定等于核外电子数,A错误;
B.在原子中,质子数+中子数=质量数,B正确;
C.由于核外电子数不一定等于中子数,所以质子数+核外电子数不一定等于质量数,C错误;
D.质子数不一定等于中子数,D错误;
答案选B。
11.D
【来源】【浙江新东方】绍兴qw89
【解析】由同种元素形成的不同单质互为同素异形体,互为同素异形体的物质需要满足两个条件,即同种元素、不同单质,由此分析。
【详解】A.H2O和H2O2都是化合物,不是单质,不属于同素异形体,故A不符合题意;
B.H2和Cl2是单质,但不是同种元素组成的单质,故B不符合题意;
C.金刚石是碳的单质,石灰石的主要成分是碳酸钙,不是单质,金刚石和石灰石不属于同素异形体,故C不符合题意;
D.O2和O3都是氧元素形成的不同单质,互为同素异形体,故D符合题意;
答案选D。
12.D
【来源】辽宁省渤海大学附属高级中学2021-2022学年高一上学期期末质量检测化学试题
【详解】A.金刚石、石墨和C60是碳元素形成的不同单质,互称为同素异形体,A正确;
B.Na2O是白色固体,Na2O2是淡黄色固体,因此两种固体颜色不同,B正确;
C.NaHCO3能够与胃酸(HCl)发生反应,降低胃酸的浓度,其本身对人无刺激性,因此可以用于治疗胃酸过多;NaHCO3不稳定,受热会发生分解反应产生CO2气体,能够使面团松软,因此也可用于制糕点,C正确;
D.金属钠放置空气中,会被空气中的氧气氧化变成Na2O,Na2O与水反应产生NaOH,NaOH吸收CO2气体变为Na2CO3,因此金属钠放置空气中,最终会变成Na2CO3,D错误;
故合理选项是D。
13.C
【来源】山西省吕梁市2021届高三上学期期中化学试题
【详解】A. 的核电荷数为16,核外电子数为18,该结构示意图中核外电子数为16,此为S原子的结构示意图,故A错误;
B. 此为分子的球棍模型,不是比例模型,故B错误;
C. 为共价化合物,C与每个O原子形成两对共用电子对,其电子式为:,故C正确;
D. 35.5是自然界中氯元素的相对分子质量,不是某氯原子的质量数,故D错误;
故选C。
14.D
【来源】河南省商开大联考2021-2022学年高二下学期期末测试化学试题
【详解】A.3 g 的物质的量为1 mol,一个中含有1个中子,故1 mol 含有中子的数目为,A项错误;
B.BaO2中的阴离子为,1 mol 中所含阴离子数目为,B项错误;
C.一个()分子中含共用电子对数为8,16 g 的物质的量为,含有的共用电子对的数目为,C项错误;
D.标准状况下,1.12 L氨气的物质的量为0.05 mol,合成氨反应中氮元素的化合价从0价降低到-3价,生成1molNH3转移电子的物质的量为3mol,则生成0.05molNH3转移电子的数目为,D项正确;
故选D。
15.D
【来源】【浙江新东方】在线化学64高一下
【详解】A.没有指明Na2O和Na2O2的物质的量,无法计算含有阴离子数目,故A错误;
B.硫酸钠溶液中除了硫酸钠含有氧原子外,水中也含有氧原子,无法计算总共含有的氧原子数,故B错误;
C.1个D2中含有2个中子,H2中没有中子。标准状况下,2.24LD2和H2的混合气体共0.1mol,若0.1mol都是D2,则含有中子数目为0.2NA,若0.1mol都是H2,则含有中子数为0,所以1molD2和H2的混合气体中含中子数目小于0.2 NA,故C错误;
D.1molMg在空气中完全燃烧生成MgO和Mg3N2,镁元素由0价升高到+2价生成Mg2+,1molMg失2mol电子,数目为2NA,故D正确。
答案选D。
【点睛】本题考查的是阿伏加德罗常数。解题时特别注意D选项,无论镁燃烧最终生成什么物质,均转化为Mg2+,1molMg均失2mol电子。
16. 1; 0; ; 1; 1; H或D; 1; 2; H或T。
【来源】物质结构元素周期表——整体认识
【详解】氢元素的三种核素的名称分别为:氕、氘、氚,氕的质子数为1,中子数为0,原子符号为:,氘的质子数为1,中子数为1,原子符号为:H或D,氚的质子数为1,中子数为2,原子符号为:H或T,故答案为:1;0;;1;1;H或D;1;2;H或T。
17.
【来源】【石家庄新东方】21年21中高一下期中试卷
【分析】同位素是具有相同的质子数和不同的中子数的同种元素的不同原子,结合质量数=质子数+中子数来分析判断。
【详解】(1)、是同一种元素的不同种原子,互为同位素,故答案为:;;
(2)和的质量数相等均是14,质子数不同,中子数也不同,不是同位素,故答案为:;;
(3)和的中子数相等,均为12,但质子数不相等,分别为11、12,质子数不相等,不是同一种元素,故答案为:;。
18.(1) 原子
(2) Cl-(或S2-等)、Ca2+(或K+等) (或)
【来源】上海市上海大学附属嘉定高级中学2021-2022学年高一下学期期中考试化学试题
【解析】(1)
当x-y=10时,x= 10+y,核内质子数等于核外电子数,该微粒为原子;当y=6时,x为16,则该微粒为S原子,S原子最外层有6个电子,其电子式为,故答案为:原子; ;
(2)
当y=8时,该离子核外电子数为18,若为正离子,可能为Ca2+、K+等,若为负离子,可能为Cl-、S2-等,若它们形成化合物时离子数之比为1:2,则可能为K2S、CaCl2,K2S为离子化合物,由2个K+和1个S2-构成,其电子式为 ,CaCl2也是离子化合物,由2个Cl-和1个Ca2+构成,其电子式为,故答案为:Cl-(或S2-等)、Ca2+(或K+);(或)。
19. ② ① ③ 烧杯中出现白色浑浊 镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 Mg+2H+=Mg2++H2↑ 小于
【来源】2010—2011学年河北省南宫中学高一下学期期中考试化学试卷
【分析】(1) 同一元素的不同核素之间互为同位素;由同种元素组成的不同单质互称同素异形体;同分异构体是分子式相同结构式不同的化合物;据以上概念进行判断;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;
②金属与酸的反应为放热反应,氢氧化钙溶解度随着温度升高而减小;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子;
④当反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。
【详解】(1)① O2和O3,是由氧元素组成的不同单质,互称同素异形体;
②12C和14C,是碳元素的不同核素,互为同位素;
其分子式都是C5H12,但结构不同,为同分异构体;
所以互为同位素的是②;互为同素异形体的是①;互为同分异构体的是③;
综上所述,本题正确选项:②;①;③;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;镁和稀盐酸反应生成氯化镁和氢气,所以试管中镁片逐渐溶解,生成氢气,所以试管中产生无色气泡,金属和酸的反应是放热反应,氢氧化钙溶解度随着温度升高而减小,升高温度,氢氧化钙饱和溶液变为过饱和溶液,所以烧杯底部析出少量白色固体;
因此,本题正确答案是:烧杯中出现白色浑浊;
②镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
因此,本题正确答案是:镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子,镁与盐酸反应的离子方程式为Mg+2H+=Mg2++H2↑;
因此,本题正确答案是: Mg+2H+=Mg2++H2↑;
④根据能量守恒定律可知,镁片的能量加上稀盐酸的总能量等于氯化镁溶液的能量、氢气的能量和释放出来的热量之和,所以氯化镁溶液与氢气的总能量小于镁片和盐酸的总能量;
因此,本题正确答案是:小于。
20.(1)①③
(2) 相同条件下,氨气的密度比空气小 氨气极易溶于水 氨气能跟水发生化学反应,反应后的溶液显碱性
(3) A e B或C
【来源】专题1揭示物质结构的奥秘本专题复习提升
【解析】(1)
实验室制取气体反应的发生装置的选择主要考虑反应物的状态是固体还是液体以及反应条件,如加热等;
(2)
根据实验可知,气体是由上到下充满试管的,充满氨气的试管能形成喷泉且形成的溶液使酚酞显红色,从而得出氨气的三点性质:相同条件下,氨气的密度比空气小、氨气极易溶于水、氨气能跟水发生化学反应,反应后的溶液显碱性;
(3)
反应①需要用固固加热型发生装置,则选取A作为发生装置;氨气的密度比空气小,则用D装置收集时,气体由e端进入;若选择反应②作为实验室制取的反应原理,则应选择固液不加热型发生装置,即B或C
一、单选题
1.下列各组物质互为同素异形体的是
A.O2和O3 B.C和CO2
C.H2O和H2O2 D.N2O4和NO2
2.以下核外电子的表示方法中,正确的是
A.N: B.:
C.: D.:
3.含锂材料在社会生产与生活中应用广泛,如和用作核反应堆最佳热载体,和用作高温堆减速剂.下列说法正确的是
A.和互为同素异形体 B.和的化学性质不同
C.和核外电子排布方式相同 D.通过化学变化可以实现与间的相互转化
4.下列说法正确的是
A.固体NaCl不存在阴阳离子,不导电
B.Na2O、Fe2O3、 Al2O3 均属于碱性氧化物
C.硫酸钡溶液几乎不导电,但硫酸钡属于电解质
D.金刚石和石墨是同素异形体,化学性质不同,物理性质相同
5.下列说法正确的是( )
A.C3H7Cl的同分异构体有3种
B.的名称为戊烷
C.CH3OH和CH3—O—CH3分子组成相差一个CH2,所以互为同系物
D.由于原子个数和原子排列方式的不同形成的不同单质互称为同素异形体
6.2022年是令人难忘的一年,下列有关说法不正确的是
A.神舟号宇宙飞船返回舱表面使用的高温结构陶瓷属于新型无机非金属材料
B.新冠疫情仍然是对人类的重大挑战,常用体积分数为95%的医用酒精杀菌消毒
C.北京冬奥会吉祥物“冰墩墩”的材质是由二氯硅烷(SiH2Cl2)经水解等一系列的反应得到的硅胶,二氯硅烷水解可生成强酸
D.世界杯是令人瞩目的体育比赛,化学中也有“足球”——足球烯(C60),它与石墨互为同素异形体
7.据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如图所示:
下列说法不正确的是
A.图中代表H2O2
B.步骤i、ii的总反应方程式是
C.由图可知,步骤iv生成的H2O,其中的H原子全部来自H2O2
D.根据以上原理,推测步骤vi生成HCOOH和H2O
8.下列微粒中,互为同位素的是
A.D2O和H2O B.X和X C.Y和Y D.O2和O3
9.反应8NH3+3Cl2=6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子: B.核内有33个中子的Fe表示为Fe
C.Cl2分子的结构式:Cl-Cl D.Cl-的结构示意图:
10.在原子中,下列关系中一定正确的是
A.中子数=核外电子数 B.质子数+中子数=质量数
C.质子数+核外电子数=质量数 D.质子数=中子数
11.下列物质互为同素异形体的是
A.H2O和H2O2 B.H2和Cl2 C.金刚石和石灰石 D.O2和O3
12.钠元素广泛存在于自然界中,中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。下列有关物质的说法错误的是
A.金刚石、石墨和C60是碳元素的同素异形体
B.Na2O与Na2O2两种固体颜色不同
C.治疗胃酸过多可以用NaHCO3,糕点制作也可以用NaHCO3
D.金属钠放置空气中,最终会变成Na2O2
13.下列化学用语正确的是
A.的结构示意图:
B.分子的比例模型:
C.的电子式为:
D.自然界某氯原子:
14.设为阿伏加德罗常数的值。下列有关说法中正确的是
A.月壤中含有丰富的,3 g 含有的中子数目为
B.玻璃脱色剂中1 mol 所含阴离子数目为
C.16 g斜方硫()分子中含共用电子对数目为
D.合成氨反应每生成1.12 L(标准状况)氨气,转移的电子数为
15.设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.等物质的量的Na2O和Na2O2中所含阴离子数均为NA
B.1L0.1mol L-1硫酸钠溶液的中含有的氧原子数为0.4NA
C.标准状况下,2.24LD2和H2的混合气体中含中子数目为0.2NA
D.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数为2NA
二、填空题
16.氢元素的三种核素
氢元素的原子核 原子名称 原子符号(X)
质子数(Z) 中子数(N)
________________ ________________ 氕 ________________
________________ ________________ 氘 ________________
________________ ________________ 氚 ________________
17.在、、、、、中
(1)互为同位素的是_______和_______。
(2)质量数相等,但不能互称同位素的是_______和_______。
(3)中子数相等,但质子数不相等的是_______和_______。
18.已知某粒子的结构示意图为。(x为质子数,y为最外层电子式)。试回答:
(1)当x-y=10时,该微粒为_______(选填“原子”“正离子”或“负离子”),当y=6时,写出该原子的电子式_______。
(2)当y=8时,正离子或负离子可能为_______(填离子符号,各写一例)。若它们形成化合物时离子数之比为1:2,则该种化合物的电子式为_______。
三、实验题
19.(本题共14分)按要求完成下列各题14分
(1)下列各组物质 ① O2和O3②12C和14C
互为同位素的是______ 互为同素异形体的是_____,互为同分异构体的是_____________
(2)如下图所示,把试管放入盛有25℃的饱和石灰水溶液的烧杯中,试管中开始放入几小片镁片,再用滴管滴入5 mL盐酸于试管中。回答下列问题:
①实验中观察到的现象是_____________________。
②产生上述现象的原因是___________________。
③写出有关反应的离子方程式__________________。
④由实验推知,所得MgCl2溶液和H2的总能量___________(填“大于”“小于”“等于”)原来镁片和盐酸的总能量。
20.归纳与演绎是重要的科学方法,也是常用的化学学习方法,请用该方法解决下列问题。
(1)我们已经学过实验室制取、、三种气体的反应原理与收集方法。请你归纳出选择实验室制取气体反应的发生装置主要考虑的因素:_______(填序号)。
①反应物的状态 ②生成气体的溶解性 ③反应条件 ④原料为纯净物 ⑤气体的密度
(2)探究课上,小明同学为了探究氨气的某些性质,做了如图实验(从左向右依次是他所做实验及现象)。
通过实验,小明同学可得出氨气的三点性质,分别是
①_______;
②_______;
③_______。
(3)在获得氨气的主要性质后,小明决定自己来制取氨气,他先查阅了有关资料,知道可通过多种反应得到他准备分别用以下两种化学反应来制备氨气,请结合所学知识帮助他完成氨气的实验制备方案。
①
②
若选择反应①作为实验室制取的反应原理,需要用图中装置的_______作为发生装置,若用D装置来收集氨气,气体由_______端进入。若选择反应②作为实验室制取的反应原理,需要用图中装置的_______作为发生装置。
试卷第2页,共6页
参考答案:
1.A
【来源】专题八原子结构与元素周期表(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
【分析】同素异形体指同种元素组成的不同单质,据此分析解答。
【详解】A.O2和O3是氧元素的两种不同单质,互为同素异形体,A符合题意;
B.CO2是化合物,B不符合题意;
C.H2O和H2O2均为化合物,C不符合题意;
D.N2O4和NO2均为化合物,D不符合题意;
答案选A。
2.B
【来源】专题1~2综合检测(基础卷)
【详解】A.电子优先单独占据1个轨道,且自旋方向相同,N原子p轨道有3个电子,分占3个轨道,其轨道表示式为,故A错误;
B.核外共10个电子,其轨道表示式为,故B正确;
C.Fe原子核外共有26个电子,电子排布式为,故C错误;
D.Cu原子核外有29个电子,位于元素周期表第四周期第ⅠB族,其价电子排布为3d104s1,所以基态原子的电子排布式为,故D错误;
故答案选B。
3.C
【来源】云南省大理州祥云县2020-2021学年高一上学期期末统测化学试题
【详解】A.同种元素形成的不同单质互为同素异形体,和是化合物,不互为同素异形体,故A错误;
B.同种元素的不同原子间互为同位素,而互为同位素的原子的最外层电子数相同,所以化学性质也相同,故和的化学性质相同,故B错误;
C.和的核内均有3个质子,核外均有3个电子,故两者的核外电子排布方式相同,故C正确;
D.化学反应中的最小微粒是原子,故化学变化不可以实现与间的相互转化,两者的转化也不是化学变化,故D错误;
本题答案C。
4.C
【来源】吉林公主岭范家屯一中2020-2021学年高一上学期期中考试化学试题
【详解】A.固体NaCl含有钠离子、氯离子,由于离子不能自由移动,因此固体NaCl不导电,故A不符合题意;
B.Na2O、Fe2O3均属于碱性氧化物,Al2O3属于两性氧化物,故B不符合题意;
C.硫酸钡溶液几乎不导电,主要是因为硫酸钡难溶于水,在熔融状态下能导电,因此硫酸钡属于电解质,故C符合题意;
D.金刚石和石墨是同素异形体,化学性质基本相同,物理性质不同,比如硬度不同,故D不符合题意;
答案为C。
5.D
【来源】人教版2019必修第二册第七章第一~二节综合拔高练
【详解】A.C3H8中含2种H,则C3H7Cl的同分异构体有2种,A错误;
B.的名称为异戊烷或2-甲基丁烷,B错误;
C.CH3OH和CH3—O—CH3分别为醇、醚,为不同类的物质,一定不互为同系物,C错误;
D.由于原子个数和原子排列方式的不同形成的不同单质,为同种元素的不同单质,互称为同素异形体,D正确;
故选:D。
6.B
【来源】江西省上饶市2022-2023学年高二上学期期末教学质量测试化学试题
【详解】A.高温结构陶瓷属于新型无机非金属材料,A正确;
B.常用体积分数为75%的医用酒精杀菌消毒,B错误;
C.二氯硅烷(SiH2Cl2)含有硅元素,经水解等一系列的反应得到的硅胶,二氯硅烷水解可生成盐酸,盐酸属于强酸,C正确;
D.同素异形体是同种元素组成的单质;足球烯(C60)与石墨互为同素异形体,故D正确;
故选B。
7.C
【来源】第14周晚练题-备战2022年高考化学周测与晚练(新高考专用)
【详解】A.根据题意,H2O2与CH4转化为含氧有机物, 为H2O2的比例模型,A正确,不选;
B.根据图示步骤i、ii,得到产物水和CH3OH,方程式为,B正确,不选;
C.根据图示,步骤iv生成的H2O,其中的H来自于步骤ii生成的CH3OH和H2O2,C错误,符合题意;
D.模仿步骤ii,H2O2分解成2个-OH,1个结合H原子生成H2O,1个与v生成的-CHO结合得到HCOOH,因此步骤vi生成HCOOH和H2O,D正确,不选;
故选C。
8.C
【来源】云南省镇沅县第一中学2021-2022学年高二下学期开学考试化学试题
【分析】同位素指具有相同质子数和不同质量数的核素之间的关系。
【详解】A.D2O和H2O是两种分子,不是核素,不属于同位素关系,A不符合题意;
B.X和X两种的质子数不相同,不属于同位素关系,B不符合题意;
C.Y和Y两者具有相同质子数和不同质量数,互为同位素,C符合题意;
D.O2和O3是两种分子,不是核素,不属于同位素关系,D不符合题意;
故选C。
9.C
【来源】山东省淄博市桓台第二中学2021-2022学年高三9月月考化学试题
【详解】A.中子数为9的氮原子:,A错误;
B.核内有33个中子的Fe表示为Fe,B错误;
C.Cl2分子中氯原子与氯原子之间有一对共用电子对,其结构式:Cl-Cl,C正确;
D.Cl-是在氯原子基础上得1电子形成8电子稳定结构,D错误;
故选C。
10.B
【来源】湖北省十堰市2020-2021学年高一上学期期末考试化学试题
【详解】A.在原子中,中子数不一定等于核外电子数,A错误;
B.在原子中,质子数+中子数=质量数,B正确;
C.由于核外电子数不一定等于中子数,所以质子数+核外电子数不一定等于质量数,C错误;
D.质子数不一定等于中子数,D错误;
答案选B。
11.D
【来源】【浙江新东方】绍兴qw89
【解析】由同种元素形成的不同单质互为同素异形体,互为同素异形体的物质需要满足两个条件,即同种元素、不同单质,由此分析。
【详解】A.H2O和H2O2都是化合物,不是单质,不属于同素异形体,故A不符合题意;
B.H2和Cl2是单质,但不是同种元素组成的单质,故B不符合题意;
C.金刚石是碳的单质,石灰石的主要成分是碳酸钙,不是单质,金刚石和石灰石不属于同素异形体,故C不符合题意;
D.O2和O3都是氧元素形成的不同单质,互为同素异形体,故D符合题意;
答案选D。
12.D
【来源】辽宁省渤海大学附属高级中学2021-2022学年高一上学期期末质量检测化学试题
【详解】A.金刚石、石墨和C60是碳元素形成的不同单质,互称为同素异形体,A正确;
B.Na2O是白色固体,Na2O2是淡黄色固体,因此两种固体颜色不同,B正确;
C.NaHCO3能够与胃酸(HCl)发生反应,降低胃酸的浓度,其本身对人无刺激性,因此可以用于治疗胃酸过多;NaHCO3不稳定,受热会发生分解反应产生CO2气体,能够使面团松软,因此也可用于制糕点,C正确;
D.金属钠放置空气中,会被空气中的氧气氧化变成Na2O,Na2O与水反应产生NaOH,NaOH吸收CO2气体变为Na2CO3,因此金属钠放置空气中,最终会变成Na2CO3,D错误;
故合理选项是D。
13.C
【来源】山西省吕梁市2021届高三上学期期中化学试题
【详解】A. 的核电荷数为16,核外电子数为18,该结构示意图中核外电子数为16,此为S原子的结构示意图,故A错误;
B. 此为分子的球棍模型,不是比例模型,故B错误;
C. 为共价化合物,C与每个O原子形成两对共用电子对,其电子式为:,故C正确;
D. 35.5是自然界中氯元素的相对分子质量,不是某氯原子的质量数,故D错误;
故选C。
14.D
【来源】河南省商开大联考2021-2022学年高二下学期期末测试化学试题
【详解】A.3 g 的物质的量为1 mol,一个中含有1个中子,故1 mol 含有中子的数目为,A项错误;
B.BaO2中的阴离子为,1 mol 中所含阴离子数目为,B项错误;
C.一个()分子中含共用电子对数为8,16 g 的物质的量为,含有的共用电子对的数目为,C项错误;
D.标准状况下,1.12 L氨气的物质的量为0.05 mol,合成氨反应中氮元素的化合价从0价降低到-3价,生成1molNH3转移电子的物质的量为3mol,则生成0.05molNH3转移电子的数目为,D项正确;
故选D。
15.D
【来源】【浙江新东方】在线化学64高一下
【详解】A.没有指明Na2O和Na2O2的物质的量,无法计算含有阴离子数目,故A错误;
B.硫酸钠溶液中除了硫酸钠含有氧原子外,水中也含有氧原子,无法计算总共含有的氧原子数,故B错误;
C.1个D2中含有2个中子,H2中没有中子。标准状况下,2.24LD2和H2的混合气体共0.1mol,若0.1mol都是D2,则含有中子数目为0.2NA,若0.1mol都是H2,则含有中子数为0,所以1molD2和H2的混合气体中含中子数目小于0.2 NA,故C错误;
D.1molMg在空气中完全燃烧生成MgO和Mg3N2,镁元素由0价升高到+2价生成Mg2+,1molMg失2mol电子,数目为2NA,故D正确。
答案选D。
【点睛】本题考查的是阿伏加德罗常数。解题时特别注意D选项,无论镁燃烧最终生成什么物质,均转化为Mg2+,1molMg均失2mol电子。
16. 1; 0; ; 1; 1; H或D; 1; 2; H或T。
【来源】物质结构元素周期表——整体认识
【详解】氢元素的三种核素的名称分别为:氕、氘、氚,氕的质子数为1,中子数为0,原子符号为:,氘的质子数为1,中子数为1,原子符号为:H或D,氚的质子数为1,中子数为2,原子符号为:H或T,故答案为:1;0;;1;1;H或D;1;2;H或T。
17.
【来源】【石家庄新东方】21年21中高一下期中试卷
【分析】同位素是具有相同的质子数和不同的中子数的同种元素的不同原子,结合质量数=质子数+中子数来分析判断。
【详解】(1)、是同一种元素的不同种原子,互为同位素,故答案为:;;
(2)和的质量数相等均是14,质子数不同,中子数也不同,不是同位素,故答案为:;;
(3)和的中子数相等,均为12,但质子数不相等,分别为11、12,质子数不相等,不是同一种元素,故答案为:;。
18.(1) 原子
(2) Cl-(或S2-等)、Ca2+(或K+等) (或)
【来源】上海市上海大学附属嘉定高级中学2021-2022学年高一下学期期中考试化学试题
【解析】(1)
当x-y=10时,x= 10+y,核内质子数等于核外电子数,该微粒为原子;当y=6时,x为16,则该微粒为S原子,S原子最外层有6个电子,其电子式为,故答案为:原子; ;
(2)
当y=8时,该离子核外电子数为18,若为正离子,可能为Ca2+、K+等,若为负离子,可能为Cl-、S2-等,若它们形成化合物时离子数之比为1:2,则可能为K2S、CaCl2,K2S为离子化合物,由2个K+和1个S2-构成,其电子式为 ,CaCl2也是离子化合物,由2个Cl-和1个Ca2+构成,其电子式为,故答案为:Cl-(或S2-等)、Ca2+(或K+);(或)。
19. ② ① ③ 烧杯中出现白色浑浊 镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 Mg+2H+=Mg2++H2↑ 小于
【来源】2010—2011学年河北省南宫中学高一下学期期中考试化学试卷
【分析】(1) 同一元素的不同核素之间互为同位素;由同种元素组成的不同单质互称同素异形体;同分异构体是分子式相同结构式不同的化合物;据以上概念进行判断;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;
②金属与酸的反应为放热反应,氢氧化钙溶解度随着温度升高而减小;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子;
④当反应物的总能量高于生成物的总能量,则反应是放热反应,反之是吸热反应。
【详解】(1)① O2和O3,是由氧元素组成的不同单质,互称同素异形体;
②12C和14C,是碳元素的不同核素,互为同位素;
其分子式都是C5H12,但结构不同,为同分异构体;
所以互为同位素的是②;互为同素异形体的是①;互为同分异构体的是③;
综上所述,本题正确选项:②;①;③;
(2)①Mg位于氢之前,能和稀盐酸反应生成氢气,该反应是放热反应,放出的热量使烧杯中溶液温度升高,氢氧化钙溶解度随着温度升高而减小;镁和稀盐酸反应生成氯化镁和氢气,所以试管中镁片逐渐溶解,生成氢气,所以试管中产生无色气泡,金属和酸的反应是放热反应,氢氧化钙溶解度随着温度升高而减小,升高温度,氢氧化钙饱和溶液变为过饱和溶液,所以烧杯底部析出少量白色固体;
因此,本题正确答案是:烧杯中出现白色浑浊;
②镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
因此,本题正确答案是:镁与盐酸反应为放热反应, Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
③单质、气体、沉淀等写化学式,可溶性强电解质写离子,镁与盐酸反应的离子方程式为Mg+2H+=Mg2++H2↑;
因此,本题正确答案是: Mg+2H+=Mg2++H2↑;
④根据能量守恒定律可知,镁片的能量加上稀盐酸的总能量等于氯化镁溶液的能量、氢气的能量和释放出来的热量之和,所以氯化镁溶液与氢气的总能量小于镁片和盐酸的总能量;
因此,本题正确答案是:小于。
20.(1)①③
(2) 相同条件下,氨气的密度比空气小 氨气极易溶于水 氨气能跟水发生化学反应,反应后的溶液显碱性
(3) A e B或C
【来源】专题1揭示物质结构的奥秘本专题复习提升
【解析】(1)
实验室制取气体反应的发生装置的选择主要考虑反应物的状态是固体还是液体以及反应条件,如加热等;
(2)
根据实验可知,气体是由上到下充满试管的,充满氨气的试管能形成喷泉且形成的溶液使酚酞显红色,从而得出氨气的三点性质:相同条件下,氨气的密度比空气小、氨气极易溶于水、氨气能跟水发生化学反应,反应后的溶液显碱性;
(3)
反应①需要用固固加热型发生装置,则选取A作为发生装置;氨气的密度比空气小,则用D装置收集时,气体由e端进入;若选择反应②作为实验室制取的反应原理,则应选择固液不加热型发生装置,即B或C
