2023年人教版高中化学必修二教学课件 第五章 阶段重点突破练(二)(共36张PPT)
文档属性
| 名称 | 2023年人教版高中化学必修二教学课件 第五章 阶段重点突破练(二)(共36张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-07 08:25:04 | ||
图片预览










文档简介
(共36张PPT)
阶段重点突破练(二)
第五章
2023年人教版高中化学必修二教学课件★★
一、氮及其氧化物重要性质及相关计算
1.下列关于氮及其化合物的说法正确的是
A.N2化学性质稳定,可用作保护气
B.NO、NO2均为大气污染气体,在大气中可稳定存在
C.NO、NO2均易溶于水
D.NO、NO2均能与水发生反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
一氧化氮会与氧气反应,因此不能在空气中稳定存在,B项错误;
一氧化氮不溶于水,C项错误;
一氧化氮不与水发生反应,D项错误。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
2.(2021·浙江1月选考,10)关于反应8NH3+6NO2===7N2+12H2O,下列说法正确的是
A.NH3中H元素被氧化
B.NO2在反应过程中失去电子
C.还原剂与氧化剂的物质的量之比为3∶4
D.氧化产物与还原产物的质量之比为4∶3
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
NH3中H元素化合价不发生变化,A错误;
NO2中N元素得到电子化合价由+4价降低到N2中的0价,B错误;
该反应中NH3是还原剂,NO2是氧化剂,还原剂与氧化剂的物质的量之比为4∶3,C错误;
化学方程式中生成7个N2,有8个N来源于NH3中N的升价,有6个N来源于NO2中N的降价,氧化产物与还原产物的质量之比为4∶3,D正确。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
3.将a mL NO、b mL NO2和c mL O2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a∶b∶c不可能是
A.1∶1∶1 B.2∶1∶1
C.3∶7∶4 D.1∶5∶2
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
根据发生的反应:4NO+3O2+2H2O===4HNO3,4NO2+O2+2H2O===4HNO3,若气体能完全溶于水,即NO、NO2、O2三种气体恰好完全反应,全部生成了硝酸,a mol NO,b mol NO2和c mol O2在反应中a mol NO失去3a mol电子,b mol NO2失去b mol电子,c mol O2得到4c mol电子生成HNO3,根据反应中电子得失守恒,应该有3a+b=4c成立,只有B项比例不能使关系式成立。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
二、氨及铵盐
4.如图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨和氯化氢,烧杯内盛装滴有石蕊溶液的蒸馏水。下列说法错误的是
A.在实验室中,可用浓氨水和生石灰制备氨,用浓盐酸和浓
硫酸制备氯化氢
B.在实验室中制备干燥的氨和氯化氢时,可选用相同的干燥剂
C.实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D.喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
用浓氨水和生石灰制备氨,是因为CaO与水反应放热,
使浓氨水中的氨气逸出,用浓盐酸和浓硫酸制备氯化
氢,利用浓硫酸的吸水性,A正确;
在实验室中制备干燥的氨和氯化氢时,可选用相同的
干燥剂,如无水硫酸钠等中性干燥剂,B正确;
实验中同时打开止水夹a、c、d,a导管中少量氨和氯化氢相互作用,使两烧瓶内压强减小,氨溶于水显碱性,氯化氢溶于水显酸性,即可分别形成蓝色和红色喷泉,C正确;
氯化铵受热分解,蒸干得不到氯化铵固体,D错误。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
1
2
3
4
5
6
7
9
10
11
12
13
14
√
8
1
2
3
4
5
6
7
9
10
11
12
13
14
8
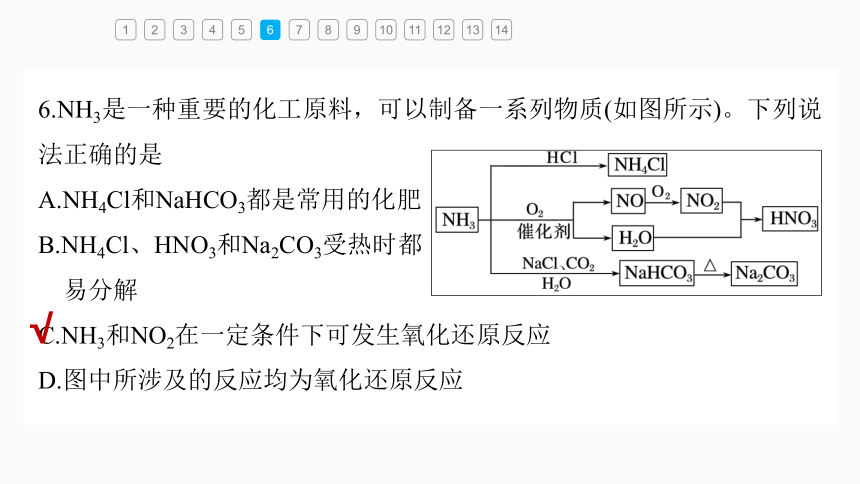
6.NH3是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法正确的是
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都
易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的反应均为氧化还原反应
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
NH4Cl是氮肥,NaHCO3不是化肥,
A项错误;
NH4Cl、HNO3受热易分解,而
Na2CO3受热不易分解,B项错误;
NO2与NH3可以发生反应6NO2+8NH3 7N2+12H2O,该反应是
氧化还原反应,C项正确;
碳酸氢钠受热分解生成碳酸钠、CO2和H2O,该反应是非氧化还原反应,D项错误。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
7.(2022·无锡高一期中)某课外活动小组在实验室用如图所示的装置进行实验,验证氨的某些性质并收集少量纯净的N2。实验进行一段时间后,观察到加热的硬质玻璃管内黑色氧化铜粉末变为红色,盛无水CuSO4的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的N2。下列说法不正确的是
A.盛放无水硫酸铜的装置是干燥管
B.这个反应说明氨气具有还原性
C.洗气瓶中浓硫酸的作用只有吸收多余氨气和干燥氮气
D.在最后出气管口可以用塑料袋或球胆收集氮气
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
浓氨水滴入盛有CaO的烧瓶中,CaO
与H2O反应生成Ca(OH)2,该反应放
热,使浓氨水中的氨气逸出,逸出
的NH3经碱石灰干燥后与CuO反应,黑色CuO粉末变为红色,说明生成Cu,盛无水CuSO4的干燥管内出现蓝色说明有H2O生成,反应的化学方程式为3CuO+2NH3 3Cu+3H2O+N2。由装置图可知,盛放无水硫酸铜的装置是球形干燥管,A项正确;
NH3中的N元素由-3价被氧化为0价,说明NH3具有还原性,B项正确;
1
2
3
4
5
6
7
9
10
11
12
13
14
8
1
2
3
4
5
6
7
9
10
11
12
13
14
洗气瓶中浓硫酸除了吸收多余氨
气和干燥氮气之外,还可以防止
空气中的水蒸气进入装置而对产
物的检验造成干扰,C项错误;
最后出来的气体为N2,可以用塑料袋或球胆收集,D项正确。
8
三、硝酸的性质和计算
8.下列有关实验操作、现象和解释或结论都正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
选项 实验操作 现象 解释或结论
① 将过量的Fe粉加入稀HNO3中,充分反应后,滴入KSCN溶液 溶液呈红色 稀HNO3将Fe氧化为Fe3+
② 浓HNO3久置或光照 变黄色 HNO3不稳定易分解
③ 铝箔插入稀HNO3中 无现象 铝箔表面被HNO3氧化,形成致密的氧化膜
④ 用玻璃棒蘸取浓HNO3点到蓝色石蕊试纸上 试纸先变红色后褪色 浓HNO3具有酸性和强氧化性
A.①② B.③④ C.②③④ D.②④
√
将过量的铁粉加入稀HNO3中,生成Fe2+,加入KSCN溶液时,颜色不变,故①错;
浓HNO3久置变黄是因为HNO3分解产生的NO2溶于浓HNO3所致,故②正确;
铝箔遇浓HNO3钝化,遇稀HNO3会溶解,故③错;
浓HNO3具有酸性和强氧化性,可使蓝色石蕊试纸先变红色后褪色,故④正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9.如图所示,向一定量的铁粉中加入一定体积12 mol·L-1硝酸并加热,待反应结束后,下列微粒在体系中一定存在的是
① ②Fe3+ ③H+ ④NO ⑤NO2
A.① B.①⑤
C.②④⑤ D.①②③⑤
当铁与浓硝酸反应时,还原产物为NO2;当铁过量时,氧化产物是Fe2+;当铁少量时,氧化产物是Fe3+;因产物中有硝酸盐,故溶液中一定有 。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
√
10.0.3 mol Cu2S与HNO3溶液恰好完全反应,生成Cu(NO3)2、H2SO4、NO和H2O,则未被还原的HNO3的物质的量是
A.1.0 mol B.1.2 mol
C.0.3 mol D.2.2 mol
√
未被还原的HNO3中的氮原子的物质的量=反应后Cu(NO3)2中氮原子的物质的量。由Cu2S~2Cu(NO3)2得,n[Cu(NO3)2]=0.6 mol,所以未被还原的HNO3的物质的量是1.2 mol。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
11.某实验过程如图所示,③试管中的现象是
A.无明显现象,因稀H2SO4不与铜反应
B.铜片溶解,产生无色气体,该气体遇到空气
不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.铜片溶解,产生无色气体,该气体在试管口变为红棕色
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
12.向含有1 mol HNO3和1 mol H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是
A.a表示Fe3+的关系曲线
B.n1=0.75
C.P点时,n(Fe2+)=0.562 5 mol
D.向P点溶液中加入铜粉,最多可溶解14.4 g
1
2
3
4
5
6
7
9
10
11
12
13
14
8
√
该反应可以看作两步:①Fe+4H++ ===
Fe3++NO↑+2H2O,硝酸根离子过量,氢
离子不足;②2Fe3++Fe===3Fe2+。a表示Fe3+
的关系曲线,A正确;
溶液中共有3 mol H+参加反应,消耗铁为0.75 mol,B正确;
P点n(Fe2+)=n(Fe3+),二者均为0.45 mol,C错误;
剩余0.45 mol Fe3+,消耗0.225 mol铜,质量为14.4 g,D正确。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
四、氮及其化合物的综合实验
13.氮是我们熟悉的典型非金属元素,研究氮及其化合物的性质对于生产、生活、科研具有重要意义,请回答以下问题:
1
2
3
4
5
6
7
9
10
11
12
13
14
8
Ⅰ.(1)图1为制取氨的装置和选用的试剂,其中合理的是___(填字母)。
A.①② B.②③ C.②④ D.①③
C
NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl,气体进入干燥管的机会不多,故①错误;
向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水中的氨逸出,故②正确;
1
2
3
4
5
6
7
9
10
11
12
13
14
8
固体加热制气体时,试管口应略向下倾斜,使产生的水能够流出,以免损坏试管,故③错误;
浓氨水易挥发,用浓氨水加热制取NH3的方法是正确的,氨是碱性气体,可用碱石灰干燥,故④正确。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
(2)实验室制备氨的化学方程式是_______
__________________________________。
实验室用加热氯化铵和氢氧化钙的方法制取氨,二者反应生成氯化钙、氨和水,反应的化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
2NH4Cl
+Ca(OH)2 CaCl2+2H2O+2NH3↑
Ⅱ.图2为铵盐的受热分解装置:
(1)被加热的铂丝处发生反应的化学方程式为
___________________________。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
(2)B中出现的现象为___________________。
一氧化氮和氧气是无色气体,一氧化氮和氧气反应生成红棕色的二氧化氮,反应的化学方程式为2NO+O2===2NO2,所以看到的现象是无色气体变成红棕色。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
无色气体变成红棕色
(3)如图3:将图2烧杯C中反应得到酸的足量浓溶液与Cu反应,实验完毕后,试管中收集到气体的主要成分为____(写化学式)。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
NO
14.(2022·广东实验中学高一期中)实验室
模拟工业制备硫氰化钾的实验装置如图
所示(部分夹持装置已略去):
已知:CS2是密度比水大且不溶于水的液
体,NH3不溶于CS2。
在一定条件下发生反应:CS2+3NH3 NH4SCN+NH4HS,生成物中NH4HS的热稳定性较NH4SCN差。请回答下列问题:
(1)装置A的作用是________。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
制备NH3
由分析可知装置A应该是固体和液体不加热制备氨的装置,固体应该是碱石灰,恒压滴液漏斗中的试剂是浓氨水。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
(2)三颈烧瓶内盛放有CS2、H2O和催化
剂,进气导管口必须插入下层CS2液体
中,目的是_______________________
_________。该反应比较缓慢,实验中
可通过观察C中现象来控制A中NH3的生成速率,则X的化学式为____。
氨极易溶于水、不溶于二硫化碳,可通过观察装置C中氨逸出的气泡来控制A中NH3的生成速率,则X为CS2。催化剂进气导管口必须插入下层CS2液体中,目的是使反应物充分接触,防止发生倒吸。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
使反应物充分接触,防止
发生倒吸
CS2
(3)反应一段时间后,关闭K1,保持三
颈烧瓶内液体温度105 ℃一段时间,其
目的是_______________________;然
后打开K2,继续保持液体温度105 ℃,
缓缓滴入适量的KOH溶液,制得较纯净的KSCN溶液,该反应的化学方
程式为_______________________________________。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
让NH4HS完全分解而除去
NH4HS的热稳定性较NH4SCN差,则
反应一段时间后,关闭K1,保持三颈
烧瓶内液体温度为105 ℃一段时间,
其目的是让NH4HS完全分解而除去;
然后打开K2,继续保持液体温度105 ℃,缓缓滴入适量的KOH溶液,制得较纯净的KSCN溶液,反应的化学方程式为NH4SCN+KOH
KSCN+NH3↑+H2O。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
(4)装置E吸收尾气,防止污染环境,其
中吸收NH3生成无色无味气体的离子方
程式为____________________________
____________。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
N2↑+7H2O
阶段重点突破练(二)
第五章
2023年人教版高中化学必修二教学课件★★
一、氮及其氧化物重要性质及相关计算
1.下列关于氮及其化合物的说法正确的是
A.N2化学性质稳定,可用作保护气
B.NO、NO2均为大气污染气体,在大气中可稳定存在
C.NO、NO2均易溶于水
D.NO、NO2均能与水发生反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
一氧化氮会与氧气反应,因此不能在空气中稳定存在,B项错误;
一氧化氮不溶于水,C项错误;
一氧化氮不与水发生反应,D项错误。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
2.(2021·浙江1月选考,10)关于反应8NH3+6NO2===7N2+12H2O,下列说法正确的是
A.NH3中H元素被氧化
B.NO2在反应过程中失去电子
C.还原剂与氧化剂的物质的量之比为3∶4
D.氧化产物与还原产物的质量之比为4∶3
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
NH3中H元素化合价不发生变化,A错误;
NO2中N元素得到电子化合价由+4价降低到N2中的0价,B错误;
该反应中NH3是还原剂,NO2是氧化剂,还原剂与氧化剂的物质的量之比为4∶3,C错误;
化学方程式中生成7个N2,有8个N来源于NH3中N的升价,有6个N来源于NO2中N的降价,氧化产物与还原产物的质量之比为4∶3,D正确。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
3.将a mL NO、b mL NO2和c mL O2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a∶b∶c不可能是
A.1∶1∶1 B.2∶1∶1
C.3∶7∶4 D.1∶5∶2
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
根据发生的反应:4NO+3O2+2H2O===4HNO3,4NO2+O2+2H2O===4HNO3,若气体能完全溶于水,即NO、NO2、O2三种气体恰好完全反应,全部生成了硝酸,a mol NO,b mol NO2和c mol O2在反应中a mol NO失去3a mol电子,b mol NO2失去b mol电子,c mol O2得到4c mol电子生成HNO3,根据反应中电子得失守恒,应该有3a+b=4c成立,只有B项比例不能使关系式成立。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
二、氨及铵盐
4.如图所示为“双色双喷泉”实验装置,图中烧瓶内分别充满氨和氯化氢,烧杯内盛装滴有石蕊溶液的蒸馏水。下列说法错误的是
A.在实验室中,可用浓氨水和生石灰制备氨,用浓盐酸和浓
硫酸制备氯化氢
B.在实验室中制备干燥的氨和氯化氢时,可选用相同的干燥剂
C.实验中同时打开止水夹a、c、d,即可分别形成蓝色和红色喷泉
D.喷泉结束后,将烧瓶内溶液混合后呈紫色,蒸干可得氯化铵固体
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
用浓氨水和生石灰制备氨,是因为CaO与水反应放热,
使浓氨水中的氨气逸出,用浓盐酸和浓硫酸制备氯化
氢,利用浓硫酸的吸水性,A正确;
在实验室中制备干燥的氨和氯化氢时,可选用相同的
干燥剂,如无水硫酸钠等中性干燥剂,B正确;
实验中同时打开止水夹a、c、d,a导管中少量氨和氯化氢相互作用,使两烧瓶内压强减小,氨溶于水显碱性,氯化氢溶于水显酸性,即可分别形成蓝色和红色喷泉,C正确;
氯化铵受热分解,蒸干得不到氯化铵固体,D错误。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
1
2
3
4
5
6
7
9
10
11
12
13
14
√
8
1
2
3
4
5
6
7
9
10
11
12
13
14
8
6.NH3是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法正确的是
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都
易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的反应均为氧化还原反应
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
NH4Cl是氮肥,NaHCO3不是化肥,
A项错误;
NH4Cl、HNO3受热易分解,而
Na2CO3受热不易分解,B项错误;
NO2与NH3可以发生反应6NO2+8NH3 7N2+12H2O,该反应是
氧化还原反应,C项正确;
碳酸氢钠受热分解生成碳酸钠、CO2和H2O,该反应是非氧化还原反应,D项错误。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
7.(2022·无锡高一期中)某课外活动小组在实验室用如图所示的装置进行实验,验证氨的某些性质并收集少量纯净的N2。实验进行一段时间后,观察到加热的硬质玻璃管内黑色氧化铜粉末变为红色,盛无水CuSO4的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的N2。下列说法不正确的是
A.盛放无水硫酸铜的装置是干燥管
B.这个反应说明氨气具有还原性
C.洗气瓶中浓硫酸的作用只有吸收多余氨气和干燥氮气
D.在最后出气管口可以用塑料袋或球胆收集氮气
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
浓氨水滴入盛有CaO的烧瓶中,CaO
与H2O反应生成Ca(OH)2,该反应放
热,使浓氨水中的氨气逸出,逸出
的NH3经碱石灰干燥后与CuO反应,黑色CuO粉末变为红色,说明生成Cu,盛无水CuSO4的干燥管内出现蓝色说明有H2O生成,反应的化学方程式为3CuO+2NH3 3Cu+3H2O+N2。由装置图可知,盛放无水硫酸铜的装置是球形干燥管,A项正确;
NH3中的N元素由-3价被氧化为0价,说明NH3具有还原性,B项正确;
1
2
3
4
5
6
7
9
10
11
12
13
14
8
1
2
3
4
5
6
7
9
10
11
12
13
14
洗气瓶中浓硫酸除了吸收多余氨
气和干燥氮气之外,还可以防止
空气中的水蒸气进入装置而对产
物的检验造成干扰,C项错误;
最后出来的气体为N2,可以用塑料袋或球胆收集,D项正确。
8
三、硝酸的性质和计算
8.下列有关实验操作、现象和解释或结论都正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
选项 实验操作 现象 解释或结论
① 将过量的Fe粉加入稀HNO3中,充分反应后,滴入KSCN溶液 溶液呈红色 稀HNO3将Fe氧化为Fe3+
② 浓HNO3久置或光照 变黄色 HNO3不稳定易分解
③ 铝箔插入稀HNO3中 无现象 铝箔表面被HNO3氧化,形成致密的氧化膜
④ 用玻璃棒蘸取浓HNO3点到蓝色石蕊试纸上 试纸先变红色后褪色 浓HNO3具有酸性和强氧化性
A.①② B.③④ C.②③④ D.②④
√
将过量的铁粉加入稀HNO3中,生成Fe2+,加入KSCN溶液时,颜色不变,故①错;
浓HNO3久置变黄是因为HNO3分解产生的NO2溶于浓HNO3所致,故②正确;
铝箔遇浓HNO3钝化,遇稀HNO3会溶解,故③错;
浓HNO3具有酸性和强氧化性,可使蓝色石蕊试纸先变红色后褪色,故④正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
9.如图所示,向一定量的铁粉中加入一定体积12 mol·L-1硝酸并加热,待反应结束后,下列微粒在体系中一定存在的是
① ②Fe3+ ③H+ ④NO ⑤NO2
A.① B.①⑤
C.②④⑤ D.①②③⑤
当铁与浓硝酸反应时,还原产物为NO2;当铁过量时,氧化产物是Fe2+;当铁少量时,氧化产物是Fe3+;因产物中有硝酸盐,故溶液中一定有 。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
√
10.0.3 mol Cu2S与HNO3溶液恰好完全反应,生成Cu(NO3)2、H2SO4、NO和H2O,则未被还原的HNO3的物质的量是
A.1.0 mol B.1.2 mol
C.0.3 mol D.2.2 mol
√
未被还原的HNO3中的氮原子的物质的量=反应后Cu(NO3)2中氮原子的物质的量。由Cu2S~2Cu(NO3)2得,n[Cu(NO3)2]=0.6 mol,所以未被还原的HNO3的物质的量是1.2 mol。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
11.某实验过程如图所示,③试管中的现象是
A.无明显现象,因稀H2SO4不与铜反应
B.铜片溶解,产生无色气体,该气体遇到空气
不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.铜片溶解,产生无色气体,该气体在试管口变为红棕色
√
1
2
3
4
5
6
7
9
10
11
12
13
14
8
12.向含有1 mol HNO3和1 mol H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是
A.a表示Fe3+的关系曲线
B.n1=0.75
C.P点时,n(Fe2+)=0.562 5 mol
D.向P点溶液中加入铜粉,最多可溶解14.4 g
1
2
3
4
5
6
7
9
10
11
12
13
14
8
√
该反应可以看作两步:①Fe+4H++ ===
Fe3++NO↑+2H2O,硝酸根离子过量,氢
离子不足;②2Fe3++Fe===3Fe2+。a表示Fe3+
的关系曲线,A正确;
溶液中共有3 mol H+参加反应,消耗铁为0.75 mol,B正确;
P点n(Fe2+)=n(Fe3+),二者均为0.45 mol,C错误;
剩余0.45 mol Fe3+,消耗0.225 mol铜,质量为14.4 g,D正确。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
四、氮及其化合物的综合实验
13.氮是我们熟悉的典型非金属元素,研究氮及其化合物的性质对于生产、生活、科研具有重要意义,请回答以下问题:
1
2
3
4
5
6
7
9
10
11
12
13
14
8
Ⅰ.(1)图1为制取氨的装置和选用的试剂,其中合理的是___(填字母)。
A.①② B.②③ C.②④ D.①③
C
NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl,气体进入干燥管的机会不多,故①错误;
向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水中的氨逸出,故②正确;
1
2
3
4
5
6
7
9
10
11
12
13
14
8
固体加热制气体时,试管口应略向下倾斜,使产生的水能够流出,以免损坏试管,故③错误;
浓氨水易挥发,用浓氨水加热制取NH3的方法是正确的,氨是碱性气体,可用碱石灰干燥,故④正确。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
(2)实验室制备氨的化学方程式是_______
__________________________________。
实验室用加热氯化铵和氢氧化钙的方法制取氨,二者反应生成氯化钙、氨和水,反应的化学方程式为2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
2NH4Cl
+Ca(OH)2 CaCl2+2H2O+2NH3↑
Ⅱ.图2为铵盐的受热分解装置:
(1)被加热的铂丝处发生反应的化学方程式为
___________________________。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
(2)B中出现的现象为___________________。
一氧化氮和氧气是无色气体,一氧化氮和氧气反应生成红棕色的二氧化氮,反应的化学方程式为2NO+O2===2NO2,所以看到的现象是无色气体变成红棕色。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
无色气体变成红棕色
(3)如图3:将图2烧杯C中反应得到酸的足量浓溶液与Cu反应,实验完毕后,试管中收集到气体的主要成分为____(写化学式)。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
NO
14.(2022·广东实验中学高一期中)实验室
模拟工业制备硫氰化钾的实验装置如图
所示(部分夹持装置已略去):
已知:CS2是密度比水大且不溶于水的液
体,NH3不溶于CS2。
在一定条件下发生反应:CS2+3NH3 NH4SCN+NH4HS,生成物中NH4HS的热稳定性较NH4SCN差。请回答下列问题:
(1)装置A的作用是________。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
制备NH3
由分析可知装置A应该是固体和液体不加热制备氨的装置,固体应该是碱石灰,恒压滴液漏斗中的试剂是浓氨水。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
(2)三颈烧瓶内盛放有CS2、H2O和催化
剂,进气导管口必须插入下层CS2液体
中,目的是_______________________
_________。该反应比较缓慢,实验中
可通过观察C中现象来控制A中NH3的生成速率,则X的化学式为____。
氨极易溶于水、不溶于二硫化碳,可通过观察装置C中氨逸出的气泡来控制A中NH3的生成速率,则X为CS2。催化剂进气导管口必须插入下层CS2液体中,目的是使反应物充分接触,防止发生倒吸。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
使反应物充分接触,防止
发生倒吸
CS2
(3)反应一段时间后,关闭K1,保持三
颈烧瓶内液体温度105 ℃一段时间,其
目的是_______________________;然
后打开K2,继续保持液体温度105 ℃,
缓缓滴入适量的KOH溶液,制得较纯净的KSCN溶液,该反应的化学方
程式为_______________________________________。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
让NH4HS完全分解而除去
NH4HS的热稳定性较NH4SCN差,则
反应一段时间后,关闭K1,保持三颈
烧瓶内液体温度为105 ℃一段时间,
其目的是让NH4HS完全分解而除去;
然后打开K2,继续保持液体温度105 ℃,缓缓滴入适量的KOH溶液,制得较纯净的KSCN溶液,反应的化学方程式为NH4SCN+KOH
KSCN+NH3↑+H2O。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
(4)装置E吸收尾气,防止污染环境,其
中吸收NH3生成无色无味气体的离子方
程式为____________________________
____________。
1
2
3
4
5
6
7
9
10
11
12
13
14
8
N2↑+7H2O
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
