2023年人教版高中化学必修二教学课件(共49张PPT)第五章 阶段重点突破练(一)
文档属性
| 名称 | 2023年人教版高中化学必修二教学课件(共49张PPT)第五章 阶段重点突破练(一) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-07 08:25:35 | ||
图片预览





文档简介
(共49张PPT)
第五章
阶段重点突破练(一)
2023年人教版高中化学必修二教学课件★★
一、二氧化硫的性质及应用
1.二氧化硫表现还原性的反应是
A.SO2+Na2CO3===Na2SO3+CO2
B.SO2+2H2S===2H2O+3S
C.SO2+2NaOH===Na2SO3+H2O
D.SO2+2H2O+Cl2===H2SO4+2HCl
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
SO2+Na2CO3===Na2SO3+CO2证明了酸性:H2SO3>H2CO3,S的化合价未发生变化,A不符合题意;
在SO2+2H2S===2H2O+3S中,SO2中的S由+4价变为0价,化合价降低,得电子,SO2表现氧化性,B不符合题意;
在SO2+2NaOH===Na2SO3+H2O中SO2表现酸性氧化物的通性,S的化合价未发生变化,C不符合题意;
在SO2+2H2O+Cl2===H2SO4+2HCl中,S由+4价变为+6价,化合价升高,失电子,SO2表现出还原性,D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
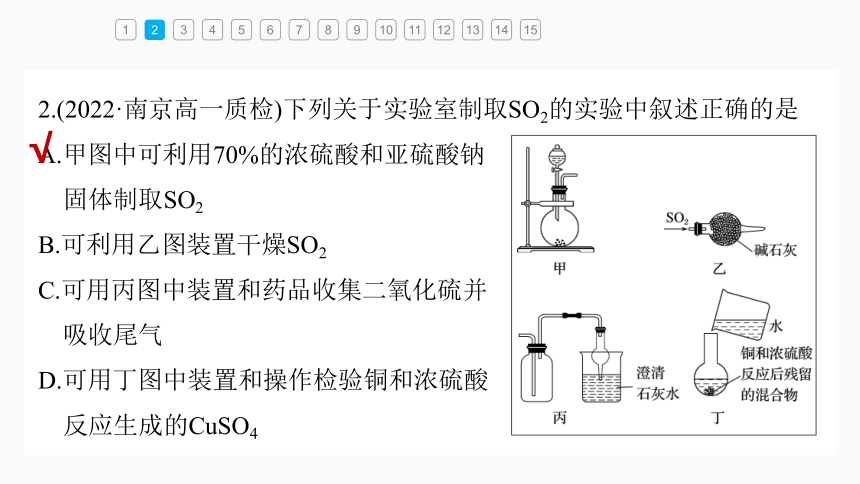
2.(2022·南京高一质检)下列关于实验室制取SO2的实验中叙述正确的是
A.甲图中可利用70%的浓硫酸和亚硫酸钠
固体制取SO2
B.可利用乙图装置干燥SO2
C.可用丙图中装置和药品收集二氧化硫并
吸收尾气
D.可用丁图中装置和操作检验铜和浓硫酸
反应生成的CuSO4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
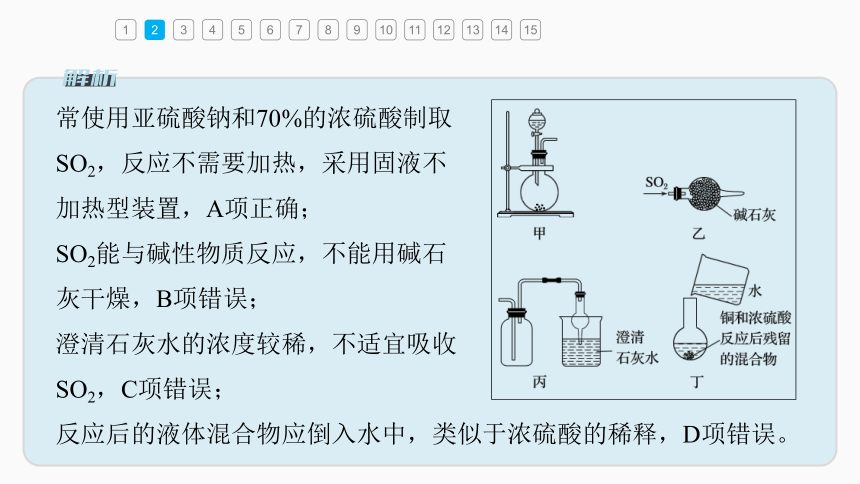
常使用亚硫酸钠和70%的浓硫酸制取
SO2,反应不需要加热,采用固液不
加热型装置,A项正确;
SO2能与碱性物质反应,不能用碱石
灰干燥,B项错误;
澄清石灰水的浓度较稀,不适宜吸收
SO2,C项错误;
反应后的液体混合物应倒入水中,类似于浓硫酸的稀释,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
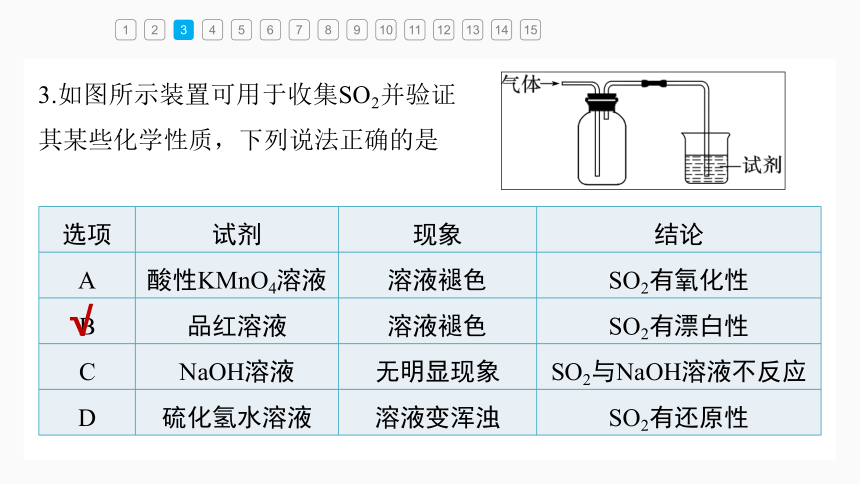
3.如图所示装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 试剂 现象 结论
A 酸性KMnO4溶液 溶液褪色 SO2有氧化性
B 品红溶液 溶液褪色 SO2有漂白性
C NaOH溶液 无明显现象 SO2与NaOH溶液不反应
D 硫化氢水溶液 溶液变浑浊 SO2有还原性
√
A项,酸性KMnO4溶液能与SO2发生氧化
还原反应,SO2被氧化成 ,SO2作还
原剂,错误;
C项,SO2为酸性氧化物,能与NaOH溶液反应,无明显现象,错误;
D项,SO2能与H2S反应生成S和H2O,体现出SO2的氧化性,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
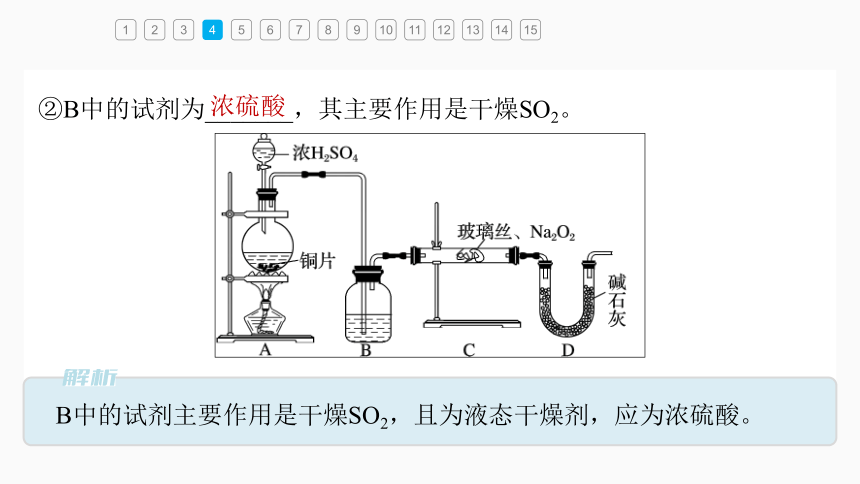
4.(2022·北京市第二十七中学高一期中)实验小组研究SO2与Na2O2的反应。
(1)实验前分析物质的化学性质,提出假设:
假设1:SO2和CO2都是酸性氧化物。类比CO2与Na2O2的反应可知,SO2与Na2O2反应生成Na2SO3和O2;
假设2:SO2具有_____性,SO2与Na2O2反应生成Na2SO4。
SO2与Na2O2反应生成Na2SO4,二氧化硫被氧化成硫酸根离子,体现二氧化硫的还原性。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
还原
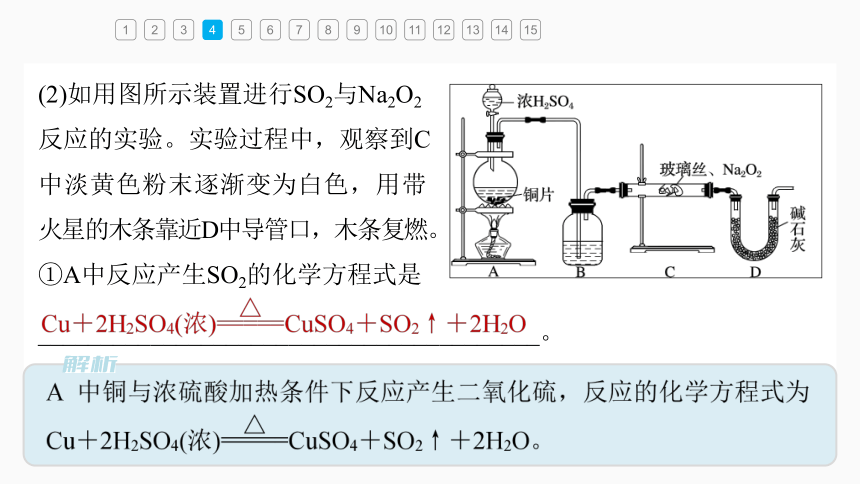
(2)如用图所示装置进行SO2与Na2O2
反应的实验。实验过程中,观察到C
中淡黄色粉末逐渐变为白色,用带
火星的木条靠近D中导管口,木条复燃。
①A中反应产生SO2的化学方程式是
________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
②B中的试剂为_______,其主要作用是干燥SO2。
B中的试剂主要作用是干燥SO2,且为液态干燥剂,应为浓硫酸。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
浓硫酸
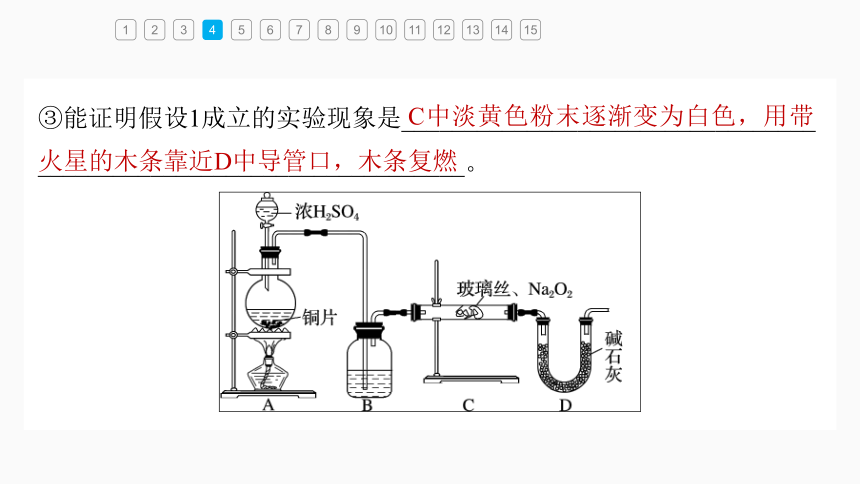
③能证明假设1成立的实验现象是_________________________________
__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导管口,木条复燃
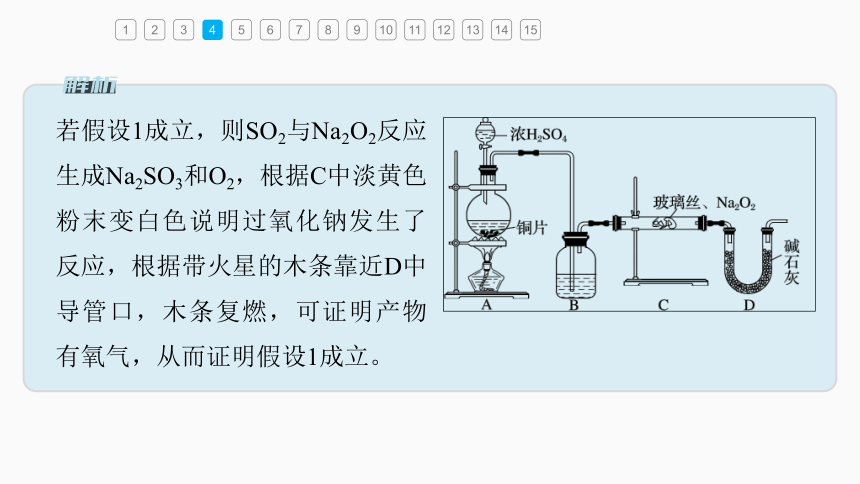
若假设1成立,则SO2与Na2O2反应生成Na2SO3和O2,根据C中淡黄色粉末变白色说明过氧化钠发生了反应,根据带火星的木条靠近D中导管口,木条复燃,可证明产物有氧气,从而证明假设1成立。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)进一步实验证明C中反应后的固体中既有Na2SO3又有Na2SO4。从氧化还原反应的角度分析,+4价硫元素能被氧化为+6价。在上述实验条件下,+4价硫元素未完全转化为+6价,可见化学反应实际进行的情况与反应的______________(只写一条)有关。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
温度(或者条件)
在上述实验条件下,+4价硫元素未完全转化为+6价,说明反应不能充分进行,这个反应是在常温条件下进行,温度对物质的性质有一定影响,导致反应不能充分进行。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
二、硫酸的性质及应用
5.下列关于浓硫酸和稀硫酸的叙述中,正确的是
A.常温时都能与铁发生反应,放出气体
B.加热时都能与铜发生反应
C.硫元素的化合价都是+6
D.都能作为气体的干燥剂
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
常温下浓硫酸能使铁钝化,加热时浓硫酸能与铜发生反应,浓硫酸具有吸水性,常作气体的干燥剂。常温下稀硫酸能与铁反应放出氢气,常温或加热时,稀硫酸都不能与铜反应,稀硫酸不具有吸水性,不能作干燥剂。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.某化学兴趣小组探究铜丝与足量浓硫酸的反应,装置(已略去夹持装置,其中铜丝可抽动)如图,下列有关说法不正确的是
A.①中生成的气体可使品红溶液褪色
B.②中可观察到溶液棕黄色变浅,且有白色
沉淀生成
C.为进行尾气处理,③中装有NaOH溶液
D.反应后,通过向①中加水,观察溶液颜色可判断反应有硫酸铜生成
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①中铜与浓硫酸在加热条件下发生反应,生
成的气体为二氧化硫,具有漂白性,可使品
红溶液褪色,A正确;
②中二氧化硫与铁离子发生氧化还原反应生
成硫酸根离子,其与钡离子反应生成硫酸钡,可观察到溶液棕黄色变浅,且有白色沉淀生成,B正确;
二氧化硫有毒,需进行尾气处理,③中装有NaOH溶液,C正确;
反应液密度大于水的密度,则反应后将①中剩余物质注入水中,观察溶液颜色可判断反应有硫酸铜生成,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.浓硫酸分别与三种钠盐反应,现象如图所示。下列分析正确的是
A.对比①和②可以说明还原性:Br->Cl-
B.②中发生的反应为氧化还原反应
C.②中试管口出现白雾是HCl遇水蒸
气所致,说明酸性:H2SO4>HCl
D.③中浓H2SO4被还原成SO2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
反应①中生成的红棕色气体是溴蒸
气,反应②产生的白雾是HCl,说明
浓硫酸能将溴离子氧化成溴单质,而
不能将氯离子氧化成氯气,A项正确;
②中发生的反应为复分解反应,该反应利用的是高沸点酸制低沸点酸的原理,浓硫酸难挥发,HCl易挥发,不能比较二者的酸性,B、C项错误;
反应③生成的是SO2气体,但该反应是非氧化还原反应,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.某同学在研究Fe与H2SO4的反应时,进行了如下实验。
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为____________
___________。
Fe和稀硫酸反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+===Fe2++H2↑。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Fe+2H+===
Fe2++H2↑
(2)实验Ⅱ中,铁丝表面迅速变黑,反应很快停止,其原因是_____________________________________________。
浓硫酸具有强氧化性,生成致密的氧化膜覆盖在Fe的表面,发生钝化。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铁丝表面生成致密的氧化膜,阻止反应进一步进行
(3)实验Ⅲ中,加热后产生大量气体,A试管中溶液的红色褪去,C处始终未检测到可燃性气体。B试管中发生反应的离子方程式是________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
实验Ⅲ中,铁与浓硫酸共热发生反应生成二氧化硫,实验中未检测到可燃性气体,说明反应中没有氢气生成,二氧化硫具有漂白性,能使品红溶液的红色褪去,二氧化硫是酸性氧化物,与足量氢氧化钠溶液反应生成亚硫酸钠和水,反应的离子方程式为SO2+2OH-=== +H2O。
(4)对比实验Ⅰ、Ⅱ和Ⅲ,得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同。浓硫酸的氧化性源于+6价的硫元素,稀硫酸的氧化性源于______________。
②造成生成物多样性的主要因素有___________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
+1价的氢元素
反应物的浓度、温度
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl)。某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤,取滤液;③蒸发滤液;④冷却结晶。
(1)在①②③④的操作中需要用到玻璃棒的是________(填序号)。
在溶解步骤需用玻璃棒搅拌加速溶解,过滤时需用玻璃棒引流,蒸发时需用玻璃棒不断搅拌,使受热均匀,防止暴沸,故需要用到玻璃棒的操作是①②③。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①②③
(2)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
实验步骤 实验现象 实验结论
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清石灰水加入烧杯中 _______________________,澄清石灰水变浑浊 证明含有
试管中有大量的气泡产生
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Ⅱ.取第二份溶液,分别滴加________和___________ 证明含有
Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去 和 ,再滴加AgNO3溶液和稀硝酸 有白色沉淀生成 证明含有Cl-
Ⅳ.取第四份溶液进行焰色试验 透过蓝色钴玻璃观察火焰呈紫色 证明含有K+
稀盐酸
氯化钡溶液
有白色沉淀生成
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)步骤Ⅲ所得的结论,你认为是否正确:___(填“是”或“否”);为什么?_______________________________________________。
由于步骤Ⅲ所加试剂BaCl2本身引入了Cl-,故所得的结论不正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
否
步骤Ⅲ所加试剂BaCl2本身引入了Cl-,干扰实验结果
(4)写出步骤Ⅱ有关反应的化学方程式:____________________________
_____________________________________。
步骤Ⅱ是先加入足量的稀盐酸,再加入BaCl2溶液,故发生的有关反应的化学方程式:K2CO3+2HCl===2KCl+H2O+CO2↑,K2SO4+BaCl2===BaSO4↓+2KCl。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
K2CO3+2HCl===2KCl+H2O+CO2↑,K2SO4+BaCl2===BaSO4↓+2KCl
四、含硫物质的性质及其相互转化
12.如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是
A.溶液B中发生的反应为2SO2+O2
2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>
D.此工艺的优点之一是物质能循环利用
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
溶液C中含有Fe2(SO4)3,可用KSCN溶液检验Fe3+,B项错误;
Fe2(SO4)3可循环利用,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.(2022·甘肃张掖市第二中学高一期中)如图是硫元素的常见化合价与部分含硫物质类别的对应关系图,下列说法正确的是
A.X、Z都可以被W的浓溶液氧化
B.常温下,Y难溶于水,微溶于酒精,
易溶于CS2
C.Z具有漂白性,所以可以使酸性高
锰酸钾溶液褪色
D.W的浓溶液使胆矾变白,说明W的
浓溶液具有脱水性
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
X是H2S,Z是SO2,W是H2SO4。浓硫
酸具有强氧化性,H2S、SO2具有还原
性,在一定条件下浓H2SO4可以氧化
H2S,但不能与SO2发生反应,A错误;
Y是S单质,在常温下,S难溶于水,微
溶于酒精,易溶于CS2,B正确;
Z是SO2,SO2具有漂白性,可以使品红溶液褪色,但SO2使酸性高锰酸钾溶液褪色是由于其还原性,与漂白性无关,C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
浓硫酸能够使胆矾变白,这体现了浓硫酸的吸水性而不是脱水性,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.(2022·湖南岳阳高一月考)硫代硫酸钠晶体(Na2S2O3·5H2O)不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分Na2S,含少量Na2SO4 )及纯碱等为原料制备Na2S2O3·5H2O的流程如图如下:
下列说法正确的是
A.Na2S2O3作脱氯剂时主要利用其氧化性
B.“净化”时加入的试剂X可选用BaCl2
溶液
C.“反应”过程中体系pH大小对产品产率无影响
D.提纯Na2S2O3·5H2O时,应先用水洗,再用乙醇洗涤
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
纸浆漂白时留下的含氯物质具有强
氧化性,硫代硫酸钠作脱氯剂时,
主要利用其还原性,A项错误;
“净化”时加入的试剂X是为了除
去硫酸根离子,加入BaCl2溶液会引入新杂质氯离子不易除去,结合流程可知可选用Ba(OH)2溶液,B项错误;
若pH过小,Na2S2O3不稳定,会发生歧化反应,使产率降低,C项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
从溶液中获得的Na2S2O3·5H2O晶体中含有杂质,应先用水洗除去吸附的杂质离子,由于硫代硫酸钠晶体不溶于乙醇,再用乙醇洗涤除去水,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
15.某小组同学设计实验实现几种价态硫元素的转化。
Ⅰ:从以下试剂中选择合适的试剂实现S(+6价)→S(+4价)的转化。
试剂清单:①浓H2SO4;②稀H2SO4;③酸性KMnO4溶液;④Na2SO3溶液;⑤Cu;⑥品红溶液
(1)写出实现转化的化学方程式:__________________________________
______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
要实现S(+6价)→S(+4价)的转化,即反应过程中+6价的硫元素被还原为+4价的硫元素,也就是说含+6价硫的物质作氧化剂,含+4价硫的物质作还原产物,需要加入还原剂完成上述转化过程;根据试剂清单,结合物质性质分析,能符合转化过程的为①浓H2SO4与⑤Cu反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+
2H2SO4(浓) CuSO4+SO2↑+2H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)设计实验,证明实现了该转化(写出操作和现象):________________
_____________________。
要证明实现了该转化只需要证明产生二氧化硫,结合二氧化硫的漂白性,可将反应后产生的气体通入品红溶液中,若溶液褪色,即为实现上述转化。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
将产生的气体通入
品红溶液中,溶液褪色
Ⅱ:实现硫元素在0价、+2价、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
二氧化硫转变为亚硫酸钠过程中硫元素化合价没有发生变化,完成该转化过程,结合二氧化硫是酸性氧化物,其与氢氧化钠溶液反应生成亚硫酸钠。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)ⅰ中加入的物质是__________,该转化利用的是SO2的___________性质。
NaOH溶液 酸性氧化物
(4)写出ⅲ反应的离子方程式:______________________________。
根据题干信息,+2价硫在酸性条件下不稳定,易发生自身氧化还原反应,即发生歧化反应,+2价的硫化合价既升高又降低,结合步骤ⅱ的反应亚硫酸钠和X反应生成硫代硫酸钠分析可得X中硫的化合价应低于+2价,则X为硫单质,发生的反应为2H++ ===S↓+SO2↑+H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
第五章
阶段重点突破练(一)
2023年人教版高中化学必修二教学课件★★
一、二氧化硫的性质及应用
1.二氧化硫表现还原性的反应是
A.SO2+Na2CO3===Na2SO3+CO2
B.SO2+2H2S===2H2O+3S
C.SO2+2NaOH===Na2SO3+H2O
D.SO2+2H2O+Cl2===H2SO4+2HCl
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
SO2+Na2CO3===Na2SO3+CO2证明了酸性:H2SO3>H2CO3,S的化合价未发生变化,A不符合题意;
在SO2+2H2S===2H2O+3S中,SO2中的S由+4价变为0价,化合价降低,得电子,SO2表现氧化性,B不符合题意;
在SO2+2NaOH===Na2SO3+H2O中SO2表现酸性氧化物的通性,S的化合价未发生变化,C不符合题意;
在SO2+2H2O+Cl2===H2SO4+2HCl中,S由+4价变为+6价,化合价升高,失电子,SO2表现出还原性,D符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2.(2022·南京高一质检)下列关于实验室制取SO2的实验中叙述正确的是
A.甲图中可利用70%的浓硫酸和亚硫酸钠
固体制取SO2
B.可利用乙图装置干燥SO2
C.可用丙图中装置和药品收集二氧化硫并
吸收尾气
D.可用丁图中装置和操作检验铜和浓硫酸
反应生成的CuSO4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
常使用亚硫酸钠和70%的浓硫酸制取
SO2,反应不需要加热,采用固液不
加热型装置,A项正确;
SO2能与碱性物质反应,不能用碱石
灰干燥,B项错误;
澄清石灰水的浓度较稀,不适宜吸收
SO2,C项错误;
反应后的液体混合物应倒入水中,类似于浓硫酸的稀释,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
3.如图所示装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 试剂 现象 结论
A 酸性KMnO4溶液 溶液褪色 SO2有氧化性
B 品红溶液 溶液褪色 SO2有漂白性
C NaOH溶液 无明显现象 SO2与NaOH溶液不反应
D 硫化氢水溶液 溶液变浑浊 SO2有还原性
√
A项,酸性KMnO4溶液能与SO2发生氧化
还原反应,SO2被氧化成 ,SO2作还
原剂,错误;
C项,SO2为酸性氧化物,能与NaOH溶液反应,无明显现象,错误;
D项,SO2能与H2S反应生成S和H2O,体现出SO2的氧化性,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
4.(2022·北京市第二十七中学高一期中)实验小组研究SO2与Na2O2的反应。
(1)实验前分析物质的化学性质,提出假设:
假设1:SO2和CO2都是酸性氧化物。类比CO2与Na2O2的反应可知,SO2与Na2O2反应生成Na2SO3和O2;
假设2:SO2具有_____性,SO2与Na2O2反应生成Na2SO4。
SO2与Na2O2反应生成Na2SO4,二氧化硫被氧化成硫酸根离子,体现二氧化硫的还原性。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
还原
(2)如用图所示装置进行SO2与Na2O2
反应的实验。实验过程中,观察到C
中淡黄色粉末逐渐变为白色,用带
火星的木条靠近D中导管口,木条复燃。
①A中反应产生SO2的化学方程式是
________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
②B中的试剂为_______,其主要作用是干燥SO2。
B中的试剂主要作用是干燥SO2,且为液态干燥剂,应为浓硫酸。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
浓硫酸
③能证明假设1成立的实验现象是_________________________________
__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导管口,木条复燃
若假设1成立,则SO2与Na2O2反应生成Na2SO3和O2,根据C中淡黄色粉末变白色说明过氧化钠发生了反应,根据带火星的木条靠近D中导管口,木条复燃,可证明产物有氧气,从而证明假设1成立。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)进一步实验证明C中反应后的固体中既有Na2SO3又有Na2SO4。从氧化还原反应的角度分析,+4价硫元素能被氧化为+6价。在上述实验条件下,+4价硫元素未完全转化为+6价,可见化学反应实际进行的情况与反应的______________(只写一条)有关。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
温度(或者条件)
在上述实验条件下,+4价硫元素未完全转化为+6价,说明反应不能充分进行,这个反应是在常温条件下进行,温度对物质的性质有一定影响,导致反应不能充分进行。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
二、硫酸的性质及应用
5.下列关于浓硫酸和稀硫酸的叙述中,正确的是
A.常温时都能与铁发生反应,放出气体
B.加热时都能与铜发生反应
C.硫元素的化合价都是+6
D.都能作为气体的干燥剂
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
常温下浓硫酸能使铁钝化,加热时浓硫酸能与铜发生反应,浓硫酸具有吸水性,常作气体的干燥剂。常温下稀硫酸能与铁反应放出氢气,常温或加热时,稀硫酸都不能与铜反应,稀硫酸不具有吸水性,不能作干燥剂。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.某化学兴趣小组探究铜丝与足量浓硫酸的反应,装置(已略去夹持装置,其中铜丝可抽动)如图,下列有关说法不正确的是
A.①中生成的气体可使品红溶液褪色
B.②中可观察到溶液棕黄色变浅,且有白色
沉淀生成
C.为进行尾气处理,③中装有NaOH溶液
D.反应后,通过向①中加水,观察溶液颜色可判断反应有硫酸铜生成
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①中铜与浓硫酸在加热条件下发生反应,生
成的气体为二氧化硫,具有漂白性,可使品
红溶液褪色,A正确;
②中二氧化硫与铁离子发生氧化还原反应生
成硫酸根离子,其与钡离子反应生成硫酸钡,可观察到溶液棕黄色变浅,且有白色沉淀生成,B正确;
二氧化硫有毒,需进行尾气处理,③中装有NaOH溶液,C正确;
反应液密度大于水的密度,则反应后将①中剩余物质注入水中,观察溶液颜色可判断反应有硫酸铜生成,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.浓硫酸分别与三种钠盐反应,现象如图所示。下列分析正确的是
A.对比①和②可以说明还原性:Br->Cl-
B.②中发生的反应为氧化还原反应
C.②中试管口出现白雾是HCl遇水蒸
气所致,说明酸性:H2SO4>HCl
D.③中浓H2SO4被还原成SO2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
反应①中生成的红棕色气体是溴蒸
气,反应②产生的白雾是HCl,说明
浓硫酸能将溴离子氧化成溴单质,而
不能将氯离子氧化成氯气,A项正确;
②中发生的反应为复分解反应,该反应利用的是高沸点酸制低沸点酸的原理,浓硫酸难挥发,HCl易挥发,不能比较二者的酸性,B、C项错误;
反应③生成的是SO2气体,但该反应是非氧化还原反应,D项错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.某同学在研究Fe与H2SO4的反应时,进行了如下实验。
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为____________
___________。
Fe和稀硫酸反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+===Fe2++H2↑。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Fe+2H+===
Fe2++H2↑
(2)实验Ⅱ中,铁丝表面迅速变黑,反应很快停止,其原因是_____________________________________________。
浓硫酸具有强氧化性,生成致密的氧化膜覆盖在Fe的表面,发生钝化。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铁丝表面生成致密的氧化膜,阻止反应进一步进行
(3)实验Ⅲ中,加热后产生大量气体,A试管中溶液的红色褪去,C处始终未检测到可燃性气体。B试管中发生反应的离子方程式是________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
实验Ⅲ中,铁与浓硫酸共热发生反应生成二氧化硫,实验中未检测到可燃性气体,说明反应中没有氢气生成,二氧化硫具有漂白性,能使品红溶液的红色褪去,二氧化硫是酸性氧化物,与足量氢氧化钠溶液反应生成亚硫酸钠和水,反应的离子方程式为SO2+2OH-=== +H2O。
(4)对比实验Ⅰ、Ⅱ和Ⅲ,得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同。浓硫酸的氧化性源于+6价的硫元素,稀硫酸的氧化性源于______________。
②造成生成物多样性的主要因素有___________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
+1价的氢元素
反应物的浓度、温度
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl)。某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤,取滤液;③蒸发滤液;④冷却结晶。
(1)在①②③④的操作中需要用到玻璃棒的是________(填序号)。
在溶解步骤需用玻璃棒搅拌加速溶解,过滤时需用玻璃棒引流,蒸发时需用玻璃棒不断搅拌,使受热均匀,防止暴沸,故需要用到玻璃棒的操作是①②③。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①②③
(2)为检验草木灰中的离子,取少量晶体溶于水,并把溶液分成四份,完成以下实验报告:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
实验步骤 实验现象 实验结论
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清石灰水加入烧杯中 _______________________,澄清石灰水变浑浊 证明含有
试管中有大量的气泡产生
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Ⅱ.取第二份溶液,分别滴加________和___________ 证明含有
Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去 和 ,再滴加AgNO3溶液和稀硝酸 有白色沉淀生成 证明含有Cl-
Ⅳ.取第四份溶液进行焰色试验 透过蓝色钴玻璃观察火焰呈紫色 证明含有K+
稀盐酸
氯化钡溶液
有白色沉淀生成
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)步骤Ⅲ所得的结论,你认为是否正确:___(填“是”或“否”);为什么?_______________________________________________。
由于步骤Ⅲ所加试剂BaCl2本身引入了Cl-,故所得的结论不正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
否
步骤Ⅲ所加试剂BaCl2本身引入了Cl-,干扰实验结果
(4)写出步骤Ⅱ有关反应的化学方程式:____________________________
_____________________________________。
步骤Ⅱ是先加入足量的稀盐酸,再加入BaCl2溶液,故发生的有关反应的化学方程式:K2CO3+2HCl===2KCl+H2O+CO2↑,K2SO4+BaCl2===BaSO4↓+2KCl。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
K2CO3+2HCl===2KCl+H2O+CO2↑,K2SO4+BaCl2===BaSO4↓+2KCl
四、含硫物质的性质及其相互转化
12.如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是
A.溶液B中发生的反应为2SO2+O2
2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>
D.此工艺的优点之一是物质能循环利用
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
溶液C中含有Fe2(SO4)3,可用KSCN溶液检验Fe3+,B项错误;
Fe2(SO4)3可循环利用,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.(2022·甘肃张掖市第二中学高一期中)如图是硫元素的常见化合价与部分含硫物质类别的对应关系图,下列说法正确的是
A.X、Z都可以被W的浓溶液氧化
B.常温下,Y难溶于水,微溶于酒精,
易溶于CS2
C.Z具有漂白性,所以可以使酸性高
锰酸钾溶液褪色
D.W的浓溶液使胆矾变白,说明W的
浓溶液具有脱水性
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
X是H2S,Z是SO2,W是H2SO4。浓硫
酸具有强氧化性,H2S、SO2具有还原
性,在一定条件下浓H2SO4可以氧化
H2S,但不能与SO2发生反应,A错误;
Y是S单质,在常温下,S难溶于水,微
溶于酒精,易溶于CS2,B正确;
Z是SO2,SO2具有漂白性,可以使品红溶液褪色,但SO2使酸性高锰酸钾溶液褪色是由于其还原性,与漂白性无关,C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
浓硫酸能够使胆矾变白,这体现了浓硫酸的吸水性而不是脱水性,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.(2022·湖南岳阳高一月考)硫代硫酸钠晶体(Na2S2O3·5H2O)不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分Na2S,含少量Na2SO4 )及纯碱等为原料制备Na2S2O3·5H2O的流程如图如下:
下列说法正确的是
A.Na2S2O3作脱氯剂时主要利用其氧化性
B.“净化”时加入的试剂X可选用BaCl2
溶液
C.“反应”过程中体系pH大小对产品产率无影响
D.提纯Na2S2O3·5H2O时,应先用水洗,再用乙醇洗涤
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
纸浆漂白时留下的含氯物质具有强
氧化性,硫代硫酸钠作脱氯剂时,
主要利用其还原性,A项错误;
“净化”时加入的试剂X是为了除
去硫酸根离子,加入BaCl2溶液会引入新杂质氯离子不易除去,结合流程可知可选用Ba(OH)2溶液,B项错误;
若pH过小,Na2S2O3不稳定,会发生歧化反应,使产率降低,C项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
从溶液中获得的Na2S2O3·5H2O晶体中含有杂质,应先用水洗除去吸附的杂质离子,由于硫代硫酸钠晶体不溶于乙醇,再用乙醇洗涤除去水,D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
15.某小组同学设计实验实现几种价态硫元素的转化。
Ⅰ:从以下试剂中选择合适的试剂实现S(+6价)→S(+4价)的转化。
试剂清单:①浓H2SO4;②稀H2SO4;③酸性KMnO4溶液;④Na2SO3溶液;⑤Cu;⑥品红溶液
(1)写出实现转化的化学方程式:__________________________________
______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
要实现S(+6价)→S(+4价)的转化,即反应过程中+6价的硫元素被还原为+4价的硫元素,也就是说含+6价硫的物质作氧化剂,含+4价硫的物质作还原产物,需要加入还原剂完成上述转化过程;根据试剂清单,结合物质性质分析,能符合转化过程的为①浓H2SO4与⑤Cu反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+
2H2SO4(浓) CuSO4+SO2↑+2H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)设计实验,证明实现了该转化(写出操作和现象):________________
_____________________。
要证明实现了该转化只需要证明产生二氧化硫,结合二氧化硫的漂白性,可将反应后产生的气体通入品红溶液中,若溶液褪色,即为实现上述转化。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
将产生的气体通入
品红溶液中,溶液褪色
Ⅱ:实现硫元素在0价、+2价、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
二氧化硫转变为亚硫酸钠过程中硫元素化合价没有发生变化,完成该转化过程,结合二氧化硫是酸性氧化物,其与氢氧化钠溶液反应生成亚硫酸钠。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)ⅰ中加入的物质是__________,该转化利用的是SO2的___________性质。
NaOH溶液 酸性氧化物
(4)写出ⅲ反应的离子方程式:______________________________。
根据题干信息,+2价硫在酸性条件下不稳定,易发生自身氧化还原反应,即发生歧化反应,+2价的硫化合价既升高又降低,结合步骤ⅱ的反应亚硫酸钠和X反应生成硫代硫酸钠分析可得X中硫的化合价应低于+2价,则X为硫单质,发生的反应为2H++ ===S↓+SO2↑+H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
