2023年安徽省中考化学二轮复习专题六 计算题(共39张PPT)
文档属性
| 名称 | 2023年安徽省中考化学二轮复习专题六 计算题(共39张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-10 16:22:57 | ||
图片预览









文档简介
(共39张PPT)
【安徽中考2023复习】专题六 计算题
命题导向
01
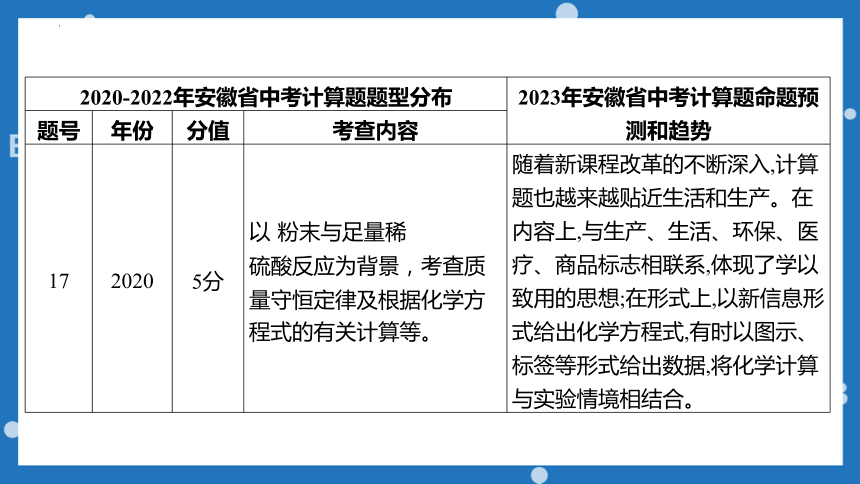
2020-2022年安徽省中考计算题题型分布 2023年安徽省中考计算题命题预测和趋势
题号 年份 分值 考查内容
17 2020 5分 以
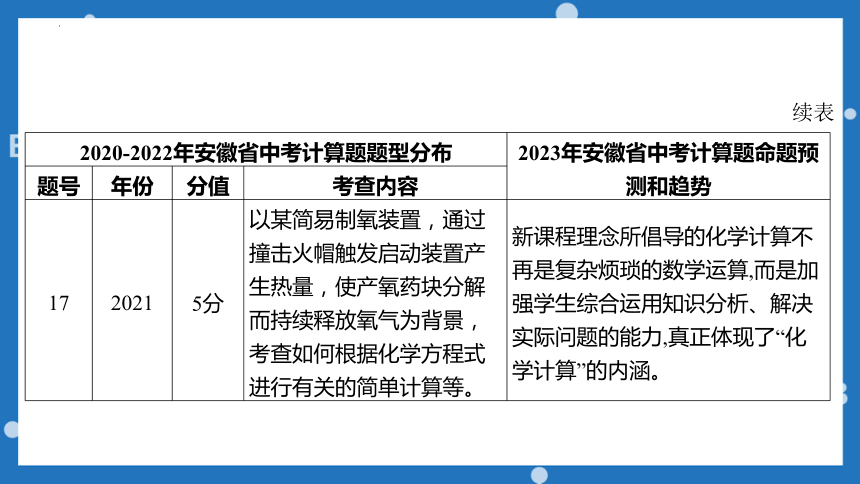
2020-2022年安徽省中考计算题题型分布 2023年安徽省中考计算题命题预测和趋势
题号 年份 分值 考查内容
17 2021 5分 以某简易制氧装置,通过撞击火帽触发启动装置产生热量,使产氧药块分解而持续释放氧气为背景,考查如何根据化学方程式进行有关的简单计算等。 新课程理念所倡导的化学计算不再是复杂烦琐的数学运算,而是加强学生综合运用知识分析、解决实际问题的能力,真正体现了“化学计算”的内涵。
续表
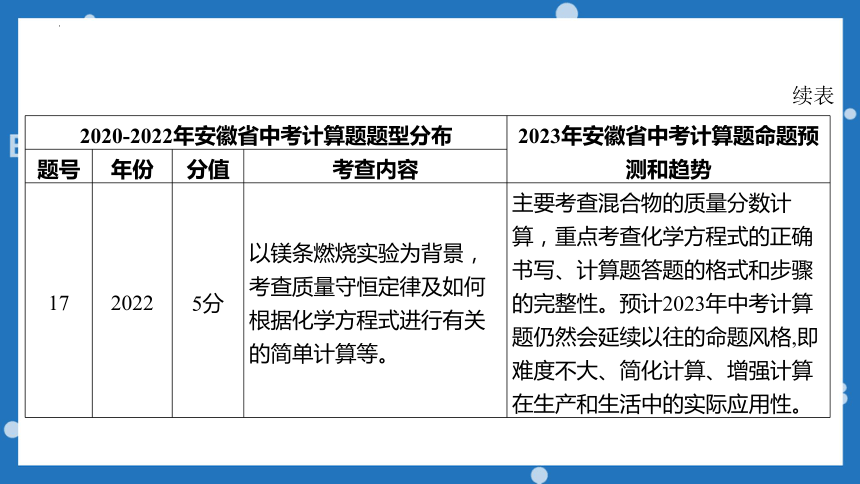
2020-2022年安徽省中考计算题题型分布 2023年安徽省中考计算题命题预测和趋势
题号 年份 分值 考查内容
17 2022 5分 以镁条燃烧实验为背景,考查质量守恒定律及如何根据化学方程式进行有关的简单计算等。 主要考查混合物的质量分数计算,重点考查化学方程式的正确书写、计算题答题的格式和步骤的完整性。预计2023年中考计算题仍然会延续以往的命题风格,即难度不大、简化计算、增强计算在生产和生活中的实际应用性。
续表
题型解读
02
计算题是安徽省中考化学必考试题,通常出现在试卷最后,分值一般为5分,主要考查化学式的计算和化学方程式的计算。化学式的计算包括相对分子质量、元素质量比、元素质量分数的计算等;化学方程式的计算主要出现在试卷最后一题。新课程理念所倡导的化学计算不再是复杂烦琐的数学运算,而是加强了对学生解决实际问题能力的考查,真正体现了化学计算的内涵。
解题要点:
(1)认真审题是正确解题的关键。特别要注意一些关键词,如“含杂质”等。
(2)书写过程要规范,不能只关心答案,更要关注解题步骤的完整性。
(3)平时加强化学方程式的书写。
典例实训
03
常考知识点:
1.化学式的计算
(1)相对分子质量:各元素的相对原子质量×原子的个数之和;
(2)化学式中各元素的质量比:各元素的相对原子质量×原子的个数之比;
(3)化学式中各元素的质量分数:(该元素的相对原子质量×原子个数)
物的相对分子质量
2.根据化学方程式的计算
(1)准确书写化学方程式;
(2)准确计算相对分子质量;
(3)代入量均指纯净物的质量(单位要代入计算过程)。
主要关注点:
1.解题步骤:设,写,标,列,算,答。
2.计算要准确。(相对分子质量×化学计量数)
3.注意数据的正确处理。(如保留几位小数)
一、已知唯一的一种纯净物的质量
【例1】(2022·张家界)二氧化氯
亚氯酸钠固体的质量是多少?
解:设理论上需要亚氯酸钠固体的质量为
答:理论上需要亚氯酸钠固体的质量是
[解析] 在利用反应的化学方程式进行计算时,首先要正确书写化学方程式。正确书写
化学方程式要遵循两个原则:以客观事实为基础,遵守质量守恒定律。此外,还要注
意“设、写、标、列、算、答”要完整,已知物质与未知物质的质量关系及比例式要正
确写出,计算过程中要带单位进行,设未知物质量时不需要单位等。如果题目中只告
诉了一种纯净物的质量,那么就把这种纯净物的质量作为已知量。在本题中,这个唯
一的纯净物的质量就是
针对训练
1.(2022·益阳)我国科学家成功合成新型催化剂,将
这不仅可以缓解碳排放引起的温室效应,还将成为理想的能源补充形式。
(1)若
(2)根据上述信息,请计算生成
设消耗
2.(2022·常德)充分燃烧
计算结果精确至0.1)
设产生二氧化碳的质量为
3.(2022·吉林)“碳达峰”是指二氧化碳的排放达到峰值,不再增长,达到峰值后再慢慢减下去。
(1)为了在2030年前实现我国“碳达峰”的目标,应提倡使用______________________
____等清洁能源。
太阳能、风能(合理即可)
(2)若减少
设最多可减少向空气中排放二氧化碳的质量是
解得
二、已知一种纯净物的质量和一种(或多种)混合物的质量
【例2】(2022·邵阳)取一定量
一定溶质质量分数的盐酸逐滴加入到样品中,边加边搅拌,测得生成气体的质量与所
加盐酸的质量关系如图所示。请分析并计算:
(1)恰好完全反应时产生气体的质量是______
解:由图像可知,恰好完全反应时产生气体的质量是
(2)
[解析] 碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,
溶液中含有的溶质是
(3)计算所加盐酸的溶质质量分数。(写出计算过程,结果精确到0.01
设恰好完全反应时所加盐酸溶液溶质质量为
盐酸的溶质质量分数为
答:所加盐酸的溶质质量分数为3.65
[解析] 如果题目中告诉了一种纯净物的质量和一种(或多种)混合物的质量,那么就
把这种纯净物的质量作为已知量。在本题中,“一种纯净物的质量”是气体的质量
(即二氧化碳的质量),“一种混合物的质量”是
二氧化碳的质量)作为已知量直接代入化学方程式计算。
针对训练
1.(2022·娄底)在氢气还原氧化铜实验后的固体中含有
如图所示。
已知:
(1)固体样品中
0.8
(2)固体样品与稀硫酸恰好完全反应时所得溶液的溶质质量分数为多少?(写出计算过程)
设反应生成硫酸铜的质量为
解得
量分数为16
2.(2022·陕西)学习小组同学为测定某品牌钙片中含碳酸钙的质量分数,向盛有
钙片的烧杯中加入过量稀盐酸,充分反应后,测得烧杯内混合物的总质量比反应前稀
盐酸与钙片的总质量减少了
该品牌钙片中含碳酸钙的质量分数。
根据质量守恒定律,反应后减少的质量为生成二氧化碳的质量,即二氧化碳质量为
可得
3.(2022·广安)我国科学家侯德榜发明了联合制碱法,为世界科学发展做出了重要贡
献。该制碱法以食盐为原料制备纯碱,产品中会混有少量氯化钠。某学习小组为了探
测产品中纯碱的质量分数,将
钙溶液恰好完全反应
涤、干燥,称得沉淀质量为
(1)过滤后的滤液质量为_____
50.5
(2)求纯碱样品中纯碱的质量分数。(写出计算过程)
设样品中纯碱的质量为
解得
品中纯碱的质量分数为95.4
三、已知一种混合物(或溶液)的质量和它的纯度(或溶质质量分数)
【例3】(2022·西宁)根据
铁。现用
必要的计算过程。
(1)该铁矿石中含四氧化三铁质量是多少?
解:铁矿石中含四氧化三铁质量是
答:铁矿石中含四氧化三铁质量是
(2)理论上可炼出含铁
设理论上可炼出含铁
答:理论上可炼出含铁
[解析] 如果题目中告诉了一种混合物(或溶液)的质量和它的纯度(或溶质质量分数),
那么就把它们的乘积作为已知量。本题中告诉了一种混合物(某铁矿石)的质量
及它的纯度46.4
针对训练
1.(2022·德阳)盐酸是一种重要的化工原料,但在使用前一般需测定其中
数。现取
质量分数为20
酸中
设盐酸溶液中
解得
的质量分数为18.25
2.(2022·湘西州)常温下,向盛有
为
(1)恰好完全反应时,所加稀盐酸的质量为____
(2)该
消耗的稀盐酸的质量为
设参加反应的氢氧化钾的质量为
解得
3.(2021·岳阳)向
开始后产生氧气的总质量随时间的变化关系如图所示,请回答:
(1)从反应开始到
0.8
(2)试计算:
设
四、已知反应前各物质的总质量和反应后剩余物质的总质量
【例4】(2022·枣庄)碳酸氢钠是发酵粉的主要成分,常用作糕点、馒头的发泡剂。为
测定某碳酸氢钠样品中
再变化),称得固体质量为
(1)计算样品中
解:根据质量守恒定律,混合物减少的质量即为生成二氧化碳和水的质量之和,生成二
氧化碳和水的质量之和为
设样品中
样品中
答:样品中
(2)若上述测定过程中未加热至恒重,则测得
“偏小”“偏大”或“无影响”)。
偏小
[解析] 若上述测定过程中未加热至恒重,测定的剩余固体的质量偏大,则测得
答:偏小。
[解析] 如果题目中告诉了反应前各物质的总质量和反应后剩余物质的总质量,就利用
反应前后的质量差求出一种纯净物的质量,再把这种纯净物的质量作为已知量。在本
题中,告诉了反应前各物质的总质量是
根据质量守恒定律可知,反应生成的二氧化碳和水的质量为:
然后把
成二氧化碳和水的质量之和,由反应的化学方程式列式计算出参加反应的碳酸氢钠的
质量即可。
针对训练
1.(2017·安徽)实验室加热氯酸钾
反应后剩余固体质量为
(1)生成氧气的质量;
根据质量守恒定律可得,生成的氧气的质量为
(2)原混合物中氯酸钾的质量。
设原混合物中氯酸钾的质量为
2.(2022·赤峰)根据图示实验过程和所提供的数据进行计算:
(1)生成氢气的质量为____
0.2
(2)
设合金中锌的质量为
合金中铜的质量分数为
3.(2022·岳阳)为测定
条件下加入足量木炭粉使其完全反应,固体总质量随时间的变化如图所示。
(1)完全反应后,产生二氧化碳的总质量是______;
(2)试计算氧化铜样品中氧化铜的质量分数(写出计算过程)。
设氧化铜样品中氧化铜的质量为
得
中氧化铜的质量分数为
【安徽中考2023复习】专题六 计算题
命题导向
01
2020-2022年安徽省中考计算题题型分布 2023年安徽省中考计算题命题预测和趋势
题号 年份 分值 考查内容
17 2020 5分 以
2020-2022年安徽省中考计算题题型分布 2023年安徽省中考计算题命题预测和趋势
题号 年份 分值 考查内容
17 2021 5分 以某简易制氧装置,通过撞击火帽触发启动装置产生热量,使产氧药块分解而持续释放氧气为背景,考查如何根据化学方程式进行有关的简单计算等。 新课程理念所倡导的化学计算不再是复杂烦琐的数学运算,而是加强学生综合运用知识分析、解决实际问题的能力,真正体现了“化学计算”的内涵。
续表
2020-2022年安徽省中考计算题题型分布 2023年安徽省中考计算题命题预测和趋势
题号 年份 分值 考查内容
17 2022 5分 以镁条燃烧实验为背景,考查质量守恒定律及如何根据化学方程式进行有关的简单计算等。 主要考查混合物的质量分数计算,重点考查化学方程式的正确书写、计算题答题的格式和步骤的完整性。预计2023年中考计算题仍然会延续以往的命题风格,即难度不大、简化计算、增强计算在生产和生活中的实际应用性。
续表
题型解读
02
计算题是安徽省中考化学必考试题,通常出现在试卷最后,分值一般为5分,主要考查化学式的计算和化学方程式的计算。化学式的计算包括相对分子质量、元素质量比、元素质量分数的计算等;化学方程式的计算主要出现在试卷最后一题。新课程理念所倡导的化学计算不再是复杂烦琐的数学运算,而是加强了对学生解决实际问题能力的考查,真正体现了化学计算的内涵。
解题要点:
(1)认真审题是正确解题的关键。特别要注意一些关键词,如“含杂质”等。
(2)书写过程要规范,不能只关心答案,更要关注解题步骤的完整性。
(3)平时加强化学方程式的书写。
典例实训
03
常考知识点:
1.化学式的计算
(1)相对分子质量:各元素的相对原子质量×原子的个数之和;
(2)化学式中各元素的质量比:各元素的相对原子质量×原子的个数之比;
(3)化学式中各元素的质量分数:(该元素的相对原子质量×原子个数)
物的相对分子质量
2.根据化学方程式的计算
(1)准确书写化学方程式;
(2)准确计算相对分子质量;
(3)代入量均指纯净物的质量(单位要代入计算过程)。
主要关注点:
1.解题步骤:设,写,标,列,算,答。
2.计算要准确。(相对分子质量×化学计量数)
3.注意数据的正确处理。(如保留几位小数)
一、已知唯一的一种纯净物的质量
【例1】(2022·张家界)二氧化氯
亚氯酸钠固体的质量是多少?
解:设理论上需要亚氯酸钠固体的质量为
答:理论上需要亚氯酸钠固体的质量是
[解析] 在利用反应的化学方程式进行计算时,首先要正确书写化学方程式。正确书写
化学方程式要遵循两个原则:以客观事实为基础,遵守质量守恒定律。此外,还要注
意“设、写、标、列、算、答”要完整,已知物质与未知物质的质量关系及比例式要正
确写出,计算过程中要带单位进行,设未知物质量时不需要单位等。如果题目中只告
诉了一种纯净物的质量,那么就把这种纯净物的质量作为已知量。在本题中,这个唯
一的纯净物的质量就是
针对训练
1.(2022·益阳)我国科学家成功合成新型催化剂,将
这不仅可以缓解碳排放引起的温室效应,还将成为理想的能源补充形式。
(1)若
(2)根据上述信息,请计算生成
设消耗
2.(2022·常德)充分燃烧
计算结果精确至0.1)
设产生二氧化碳的质量为
3.(2022·吉林)“碳达峰”是指二氧化碳的排放达到峰值,不再增长,达到峰值后再慢慢减下去。
(1)为了在2030年前实现我国“碳达峰”的目标,应提倡使用______________________
____等清洁能源。
太阳能、风能(合理即可)
(2)若减少
设最多可减少向空气中排放二氧化碳的质量是
解得
二、已知一种纯净物的质量和一种(或多种)混合物的质量
【例2】(2022·邵阳)取一定量
一定溶质质量分数的盐酸逐滴加入到样品中,边加边搅拌,测得生成气体的质量与所
加盐酸的质量关系如图所示。请分析并计算:
(1)恰好完全反应时产生气体的质量是______
解:由图像可知,恰好完全反应时产生气体的质量是
(2)
[解析] 碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,
溶液中含有的溶质是
(3)计算所加盐酸的溶质质量分数。(写出计算过程,结果精确到0.01
设恰好完全反应时所加盐酸溶液溶质质量为
盐酸的溶质质量分数为
答:所加盐酸的溶质质量分数为3.65
[解析] 如果题目中告诉了一种纯净物的质量和一种(或多种)混合物的质量,那么就
把这种纯净物的质量作为已知量。在本题中,“一种纯净物的质量”是气体的质量
(即二氧化碳的质量),“一种混合物的质量”是
二氧化碳的质量)作为已知量直接代入化学方程式计算。
针对训练
1.(2022·娄底)在氢气还原氧化铜实验后的固体中含有
如图所示。
已知:
(1)固体样品中
0.8
(2)固体样品与稀硫酸恰好完全反应时所得溶液的溶质质量分数为多少?(写出计算过程)
设反应生成硫酸铜的质量为
解得
量分数为16
2.(2022·陕西)学习小组同学为测定某品牌钙片中含碳酸钙的质量分数,向盛有
钙片的烧杯中加入过量稀盐酸,充分反应后,测得烧杯内混合物的总质量比反应前稀
盐酸与钙片的总质量减少了
该品牌钙片中含碳酸钙的质量分数。
根据质量守恒定律,反应后减少的质量为生成二氧化碳的质量,即二氧化碳质量为
可得
3.(2022·广安)我国科学家侯德榜发明了联合制碱法,为世界科学发展做出了重要贡
献。该制碱法以食盐为原料制备纯碱,产品中会混有少量氯化钠。某学习小组为了探
测产品中纯碱的质量分数,将
钙溶液恰好完全反应
涤、干燥,称得沉淀质量为
(1)过滤后的滤液质量为_____
50.5
(2)求纯碱样品中纯碱的质量分数。(写出计算过程)
设样品中纯碱的质量为
解得
品中纯碱的质量分数为95.4
三、已知一种混合物(或溶液)的质量和它的纯度(或溶质质量分数)
【例3】(2022·西宁)根据
铁。现用
必要的计算过程。
(1)该铁矿石中含四氧化三铁质量是多少?
解:铁矿石中含四氧化三铁质量是
答:铁矿石中含四氧化三铁质量是
(2)理论上可炼出含铁
设理论上可炼出含铁
答:理论上可炼出含铁
[解析] 如果题目中告诉了一种混合物(或溶液)的质量和它的纯度(或溶质质量分数),
那么就把它们的乘积作为已知量。本题中告诉了一种混合物(某铁矿石)的质量
及它的纯度46.4
针对训练
1.(2022·德阳)盐酸是一种重要的化工原料,但在使用前一般需测定其中
数。现取
质量分数为20
酸中
设盐酸溶液中
解得
的质量分数为18.25
2.(2022·湘西州)常温下,向盛有
为
(1)恰好完全反应时,所加稀盐酸的质量为____
(2)该
消耗的稀盐酸的质量为
设参加反应的氢氧化钾的质量为
解得
3.(2021·岳阳)向
开始后产生氧气的总质量随时间的变化关系如图所示,请回答:
(1)从反应开始到
0.8
(2)试计算:
设
四、已知反应前各物质的总质量和反应后剩余物质的总质量
【例4】(2022·枣庄)碳酸氢钠是发酵粉的主要成分,常用作糕点、馒头的发泡剂。为
测定某碳酸氢钠样品中
再变化),称得固体质量为
(1)计算样品中
解:根据质量守恒定律,混合物减少的质量即为生成二氧化碳和水的质量之和,生成二
氧化碳和水的质量之和为
设样品中
样品中
答:样品中
(2)若上述测定过程中未加热至恒重,则测得
“偏小”“偏大”或“无影响”)。
偏小
[解析] 若上述测定过程中未加热至恒重,测定的剩余固体的质量偏大,则测得
答:偏小。
[解析] 如果题目中告诉了反应前各物质的总质量和反应后剩余物质的总质量,就利用
反应前后的质量差求出一种纯净物的质量,再把这种纯净物的质量作为已知量。在本
题中,告诉了反应前各物质的总质量是
根据质量守恒定律可知,反应生成的二氧化碳和水的质量为:
然后把
成二氧化碳和水的质量之和,由反应的化学方程式列式计算出参加反应的碳酸氢钠的
质量即可。
针对训练
1.(2017·安徽)实验室加热氯酸钾
反应后剩余固体质量为
(1)生成氧气的质量;
根据质量守恒定律可得,生成的氧气的质量为
(2)原混合物中氯酸钾的质量。
设原混合物中氯酸钾的质量为
2.(2022·赤峰)根据图示实验过程和所提供的数据进行计算:
(1)生成氢气的质量为____
0.2
(2)
设合金中锌的质量为
合金中铜的质量分数为
3.(2022·岳阳)为测定
条件下加入足量木炭粉使其完全反应,固体总质量随时间的变化如图所示。
(1)完全反应后,产生二氧化碳的总质量是______;
(2)试计算氧化铜样品中氧化铜的质量分数(写出计算过程)。
设氧化铜样品中氧化铜的质量为
得
中氧化铜的质量分数为
同课章节目录
