【备考2023】浙教版科学中考“临门一脚”专题训练(九):化学工艺流程图分析含答案】
文档属性
| 名称 | 【备考2023】浙教版科学中考“临门一脚”专题训练(九):化学工艺流程图分析含答案】 |

|
|
| 格式 | doc | ||
| 文件大小 | 262.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-08 00:00:00 | ||
图片预览

文档简介
1.氧化锌(ZnO)是一种重要而且使用广泛的物理防晒剂,还有抗菌和抗炎的作用,是目前防晒剂评价中最安全有效的成分,其生产工艺如下。
(1)气体B在点燃前必须进行的操作是________。
(2)步骤Ⅱ需要进行一种操作将ZnC2O4和溶液C分离,该操作的名称是 ,在实验室进行该操作时,用到的玻璃仪器是烧杯、玻璃棒和 。
(3)已知ZnC2O4是一种沉淀,请写出步骤Ⅱ发生反应的化学方程式_____________。
(4)请写出溶液C的一种用途________________________________。
(5)气体D中是两种氧化物,一种是二氧化碳,另一种是 。(写化学式)
2.工业上利用某废渣[含FeSO4、Fe2(SO4)3及少量CaO和MgO]制备高档颜料铁红(主要成分Fe2O3)和回收(NH4)2SO4。具体生产流程如下:
【背景信息】a.氧化还原反应中,会有元素化合价发生变化。
b.3Fe2(SO4)3+12NH3·H2O=== (NH4)2Fe6(SO4)4(OH)12↓+5(NH4)2SO4
铵黄铁矾晶体
(1)步骤③中操作Y的名称是________。
(2)加入物质X溶解废渣,X应选用______(填序号)。
A. 盐酸 B. 硫酸 C. 氨水 D. 氢氧化钠
步骤①酸浸时,生成盐的化学方程式为______________________(任写一个)。
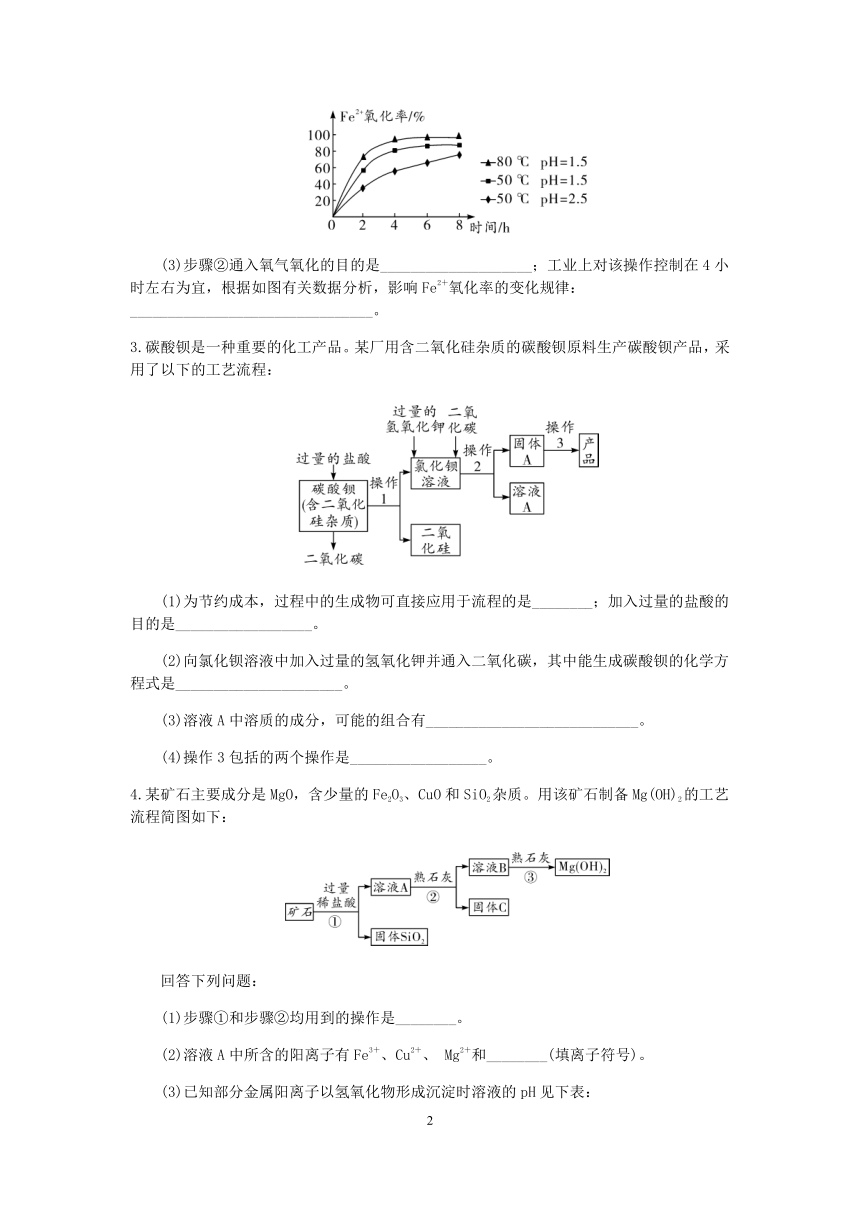
(3)步骤②通入氧气氧化的目的是____________________;工业上对该操作控制在4小时左右为宜,根据如图有关数据分析,影响Fe2+氧化率的变化规律:________________________________。
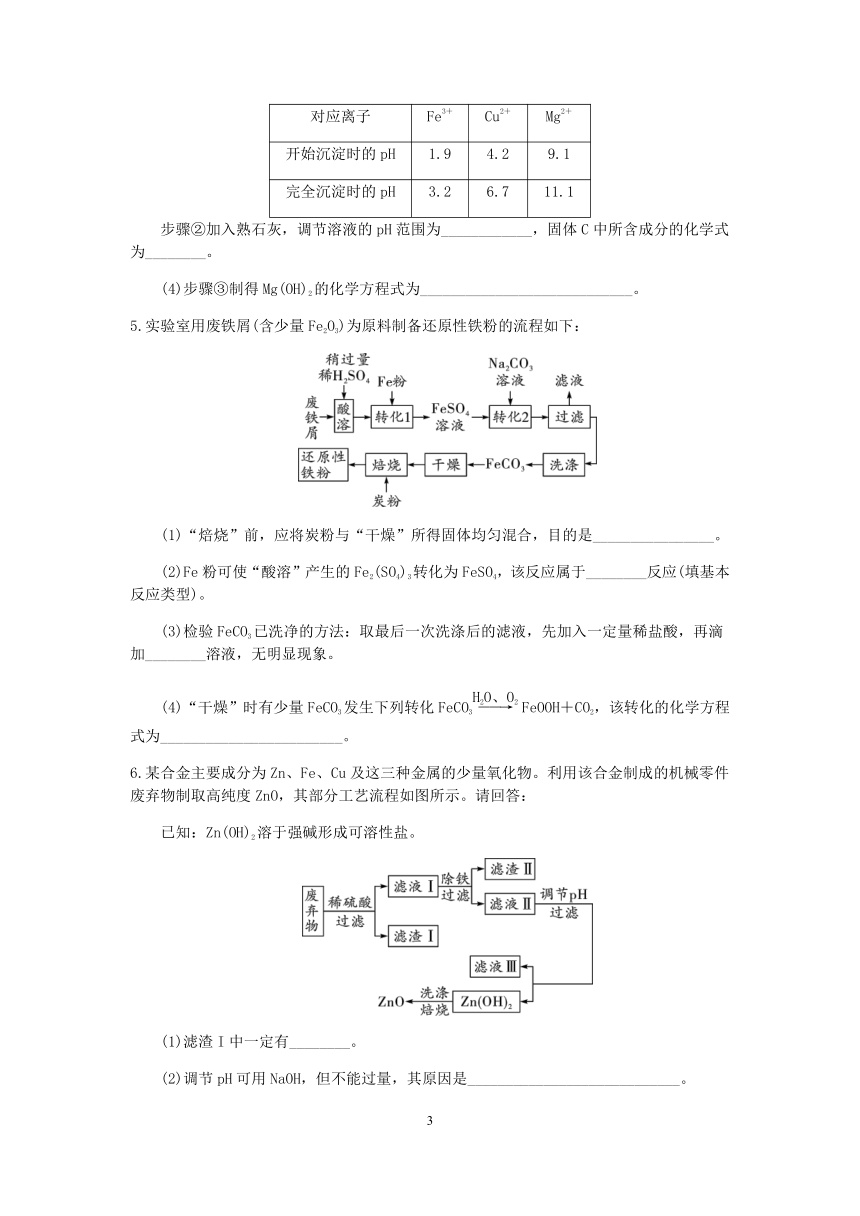
3.碳酸钡是一种重要的化工产品。某厂用含二氧化硅杂质的碳酸钡原料生产碳酸钡产品,采用了以下的工艺流程:
(1)为节约成本,过程中的生成物可直接应用于流程的是________;加入过量的盐酸的目的是__________________。
(2)向氯化钡溶液中加入过量的氢氧化钾并通入二氧化碳,其中能生成碳酸钡的化学方程式是______________________。
(3)溶液A中溶质的成分,可能的组合有____________________________。
(4)操作3包括的两个操作是__________________。
4.某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如下:
回答下列问题:
(1)步骤①和步骤②均用到的操作是________。
(2)溶液A中所含的阳离子有Fe3+、Cu2+、 Mg2+和________(填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 Fe3+ Cu2+ Mg2+
开始沉淀时的pH 1.9 4.2 9.1
完全沉淀时的pH 3.2 6.7 11.1
步骤②加入熟石灰,调节溶液的pH范围为____________,固体C中所含成分的化学式为________。
(4)步骤③制得Mg(OH)2的化学方程式为____________________________。
5.实验室用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
(1)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是________________。
(2)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应属于________反应(填基本反应类型)。
(3)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加________溶液,无明显现象。
(4)“干燥”时有少量FeCO3发生下列转化FeCO3 FeOOH+CO2,该转化的化学方程式为________________________。
6.某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣I中一定有________。
(2)调节pH可用NaOH,但不能过量,其原因是____________________________。
(3)焙烧Zn(OH)2发生分解反应的化学方程式为____________________________。
7. 木炭粉还原氧化铜实验后的混合粉末中含有铜和氧化铜,实验室从该混合粉末中回收铜的方案如下:
(1)固体B中所含的物质是________(填化学式)。
(2)溶液A中加入过量铁粉的目的是______________________。
(3)途径Ⅱ中用稀硫酸溶解黑色固体的化学方程式为____________________________________。
(4)途径Ⅱ与途径Ⅰ相比,途径Ⅱ的优点是____________________________________________。
8.某氯化钾样品中含有杂质氯化钙和氯
化镁,设计提纯的流程图如下:
(1)蒸发操作的目的是除去____________________(填物质的化学式)。
(2)写出加入Y溶液时发生反应的化学方程式_____________________。
(3)加入过量盐酸的目的是__________________________________。
(4)设计实验证明滤液中存在KOH。(写出操作步骤、现象和结论)
9.有一包白色固体,可能含氯化钠、碳酸钠、硫酸钠、氢氧化钠、氢氧化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验:
(1)向固体样品中加入过量稀硝酸,产生的气体是________。
(2)生成白色滤渣甲反应的化学方程式为______________________________。
(3)原固体中一定不含有的物质是________。
(4)请设计实验进一步探究滤液A中含有氯化钠。(提示:硫酸银微溶于水)
10.碱式碳酸镁是一种新型阻燃剂,其工业制备流程如下:
(1)常温下向溶液中加入少量的NH4HCO3固体,固体不能溶解,则该溶液为NH4HCO3的 (填“饱和”或“不饱和”)溶液。
(2)操作1的名称是 ;“一系列操作”中包括蒸发,实验室中蒸发溶液时用玻璃棒搅拌的作用是 。
(3)副产品氯化铵与氢氧化钠反应,生成了一种可直接进入上述流程循环利用的物质是 。
11.高锰酸钾是常用的氧化剂。如图是实验室模拟工业上制备高锰酸钾晶体的操作流程:
(1)完成操作③所需要的玻璃仪器是 (填一种即可);实验中通过操作②析出高锰酸钾晶体,说明高锰酸钾的溶解度随温度升高而 。
(2)操作流程中可循环利用的物质是 。
(3)氢氧化钾、二氧化锰和氧气在高温条件下煅烧,生成锰酸钾和水,该反应的化学方程式为 。
参考答案
1.(1)检验气体纯度 (2)过滤 漏斗 (3)ZnCl2+(NH4)2C2O4=== ZnC2O4↓+2NH4Cl (4)用作化肥(合理即可) (5)CO
2. (1)过滤 (2)B CaO+H2SO4 === CaSO4+H2O(或 MgO+H2SO4 === MgSO4+H2O) (3)将FeSO4氧化成Fe2(SO4)3(合理即可) Fe2+的氧化率随温度升高而增大,随pH降低而增大(合理即可)
3. (1)二氧化碳(或CO2) 使碳酸钡充分反应 (2)BaCl2+K2CO3=== 2KCl+BaCO3↓ (3)KOH、KCl或KOH、KCl、BaCl2或KOH、KCl、K2CO3 (4)洗涤、干燥
4.(1)过滤 (2)H+ (3)6.7~9.1 Fe(OH)3和Cu(OH)2 (4)MgCl2+Ca(OH)2 === Mg(OH)2↓+CaCl2
5. (1)使反应更充分 (2)化合 (3)氯化钡(或BaCl2) (4)4FeCO3+2H2O+O2=== 4FeOOH+4CO2
6. (1)Cu (2)过量的NaOH会使生成的Zn(OH)2沉淀溶解 (3)Zn(OH)2 ZnO+H2O↑
7. (1)Fe、Cu (2)将硫酸铜溶液中的铜全部置换出来 (3)H2SO4+CuO=== CuSO4+H2O (4)回收所得铜的质量大
8. (1)H2O、HCl (2)K2CO3+CaCl2=== CaCO3↓+2KCl (3)除去过量的氢氧化钾和碳酸钾 (4)取少量滤液于试管中,加入足量的氯化钙(或氯化钡)溶液,产生白色沉淀,静置,取上层清液向其中加入几滴酚酞溶液,若溶液变红,则滤液中有氢氧化钾。
9. (1)CO2 (2)MgSO4+Ba(NO3)2 === BaSO4↓+Mg(NO3)2 (3)Na2SO4 (4)取少量滤液A于试管中加入过量的硝酸钡溶液,静置,再取上层清液于另一支试管中,向其中滴加硝酸银溶液,若产生白色沉淀,则证明滤液A中含有氯化钠。
10. (1)饱和 (2)过滤 防止因局部温度过高,造成液滴飞溅(合理即可) (3)氨气(或NH3)
11. (1)烧杯(或玻璃棒或漏斗) 增大 (2)二氧化锰(或MnO2) (3)4KOH+2MnO2+O2 2K2MnO4+2H2O
化学工艺流程图分析
(1)气体B在点燃前必须进行的操作是________。
(2)步骤Ⅱ需要进行一种操作将ZnC2O4和溶液C分离,该操作的名称是 ,在实验室进行该操作时,用到的玻璃仪器是烧杯、玻璃棒和 。
(3)已知ZnC2O4是一种沉淀,请写出步骤Ⅱ发生反应的化学方程式_____________。
(4)请写出溶液C的一种用途________________________________。
(5)气体D中是两种氧化物,一种是二氧化碳,另一种是 。(写化学式)
2.工业上利用某废渣[含FeSO4、Fe2(SO4)3及少量CaO和MgO]制备高档颜料铁红(主要成分Fe2O3)和回收(NH4)2SO4。具体生产流程如下:
【背景信息】a.氧化还原反应中,会有元素化合价发生变化。
b.3Fe2(SO4)3+12NH3·H2O=== (NH4)2Fe6(SO4)4(OH)12↓+5(NH4)2SO4
铵黄铁矾晶体
(1)步骤③中操作Y的名称是________。
(2)加入物质X溶解废渣,X应选用______(填序号)。
A. 盐酸 B. 硫酸 C. 氨水 D. 氢氧化钠
步骤①酸浸时,生成盐的化学方程式为______________________(任写一个)。
(3)步骤②通入氧气氧化的目的是____________________;工业上对该操作控制在4小时左右为宜,根据如图有关数据分析,影响Fe2+氧化率的变化规律:________________________________。
3.碳酸钡是一种重要的化工产品。某厂用含二氧化硅杂质的碳酸钡原料生产碳酸钡产品,采用了以下的工艺流程:
(1)为节约成本,过程中的生成物可直接应用于流程的是________;加入过量的盐酸的目的是__________________。
(2)向氯化钡溶液中加入过量的氢氧化钾并通入二氧化碳,其中能生成碳酸钡的化学方程式是______________________。
(3)溶液A中溶质的成分,可能的组合有____________________________。
(4)操作3包括的两个操作是__________________。
4.某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。用该矿石制备Mg(OH)2的工艺流程简图如下:
回答下列问题:
(1)步骤①和步骤②均用到的操作是________。
(2)溶液A中所含的阳离子有Fe3+、Cu2+、 Mg2+和________(填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 Fe3+ Cu2+ Mg2+
开始沉淀时的pH 1.9 4.2 9.1
完全沉淀时的pH 3.2 6.7 11.1
步骤②加入熟石灰,调节溶液的pH范围为____________,固体C中所含成分的化学式为________。
(4)步骤③制得Mg(OH)2的化学方程式为____________________________。
5.实验室用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
(1)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是________________。
(2)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应属于________反应(填基本反应类型)。
(3)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加________溶液,无明显现象。
(4)“干燥”时有少量FeCO3发生下列转化FeCO3 FeOOH+CO2,该转化的化学方程式为________________________。
6.某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
(1)滤渣I中一定有________。
(2)调节pH可用NaOH,但不能过量,其原因是____________________________。
(3)焙烧Zn(OH)2发生分解反应的化学方程式为____________________________。
7. 木炭粉还原氧化铜实验后的混合粉末中含有铜和氧化铜,实验室从该混合粉末中回收铜的方案如下:
(1)固体B中所含的物质是________(填化学式)。
(2)溶液A中加入过量铁粉的目的是______________________。
(3)途径Ⅱ中用稀硫酸溶解黑色固体的化学方程式为____________________________________。
(4)途径Ⅱ与途径Ⅰ相比,途径Ⅱ的优点是____________________________________________。
8.某氯化钾样品中含有杂质氯化钙和氯
化镁,设计提纯的流程图如下:
(1)蒸发操作的目的是除去____________________(填物质的化学式)。
(2)写出加入Y溶液时发生反应的化学方程式_____________________。
(3)加入过量盐酸的目的是__________________________________。
(4)设计实验证明滤液中存在KOH。(写出操作步骤、现象和结论)
9.有一包白色固体,可能含氯化钠、碳酸钠、硫酸钠、氢氧化钠、氢氧化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验:
(1)向固体样品中加入过量稀硝酸,产生的气体是________。
(2)生成白色滤渣甲反应的化学方程式为______________________________。
(3)原固体中一定不含有的物质是________。
(4)请设计实验进一步探究滤液A中含有氯化钠。(提示:硫酸银微溶于水)
10.碱式碳酸镁是一种新型阻燃剂,其工业制备流程如下:
(1)常温下向溶液中加入少量的NH4HCO3固体,固体不能溶解,则该溶液为NH4HCO3的 (填“饱和”或“不饱和”)溶液。
(2)操作1的名称是 ;“一系列操作”中包括蒸发,实验室中蒸发溶液时用玻璃棒搅拌的作用是 。
(3)副产品氯化铵与氢氧化钠反应,生成了一种可直接进入上述流程循环利用的物质是 。
11.高锰酸钾是常用的氧化剂。如图是实验室模拟工业上制备高锰酸钾晶体的操作流程:
(1)完成操作③所需要的玻璃仪器是 (填一种即可);实验中通过操作②析出高锰酸钾晶体,说明高锰酸钾的溶解度随温度升高而 。
(2)操作流程中可循环利用的物质是 。
(3)氢氧化钾、二氧化锰和氧气在高温条件下煅烧,生成锰酸钾和水,该反应的化学方程式为 。
参考答案
1.(1)检验气体纯度 (2)过滤 漏斗 (3)ZnCl2+(NH4)2C2O4=== ZnC2O4↓+2NH4Cl (4)用作化肥(合理即可) (5)CO
2. (1)过滤 (2)B CaO+H2SO4 === CaSO4+H2O(或 MgO+H2SO4 === MgSO4+H2O) (3)将FeSO4氧化成Fe2(SO4)3(合理即可) Fe2+的氧化率随温度升高而增大,随pH降低而增大(合理即可)
3. (1)二氧化碳(或CO2) 使碳酸钡充分反应 (2)BaCl2+K2CO3=== 2KCl+BaCO3↓ (3)KOH、KCl或KOH、KCl、BaCl2或KOH、KCl、K2CO3 (4)洗涤、干燥
4.(1)过滤 (2)H+ (3)6.7~9.1 Fe(OH)3和Cu(OH)2 (4)MgCl2+Ca(OH)2 === Mg(OH)2↓+CaCl2
5. (1)使反应更充分 (2)化合 (3)氯化钡(或BaCl2) (4)4FeCO3+2H2O+O2=== 4FeOOH+4CO2
6. (1)Cu (2)过量的NaOH会使生成的Zn(OH)2沉淀溶解 (3)Zn(OH)2 ZnO+H2O↑
7. (1)Fe、Cu (2)将硫酸铜溶液中的铜全部置换出来 (3)H2SO4+CuO=== CuSO4+H2O (4)回收所得铜的质量大
8. (1)H2O、HCl (2)K2CO3+CaCl2=== CaCO3↓+2KCl (3)除去过量的氢氧化钾和碳酸钾 (4)取少量滤液于试管中,加入足量的氯化钙(或氯化钡)溶液,产生白色沉淀,静置,取上层清液向其中加入几滴酚酞溶液,若溶液变红,则滤液中有氢氧化钾。
9. (1)CO2 (2)MgSO4+Ba(NO3)2 === BaSO4↓+Mg(NO3)2 (3)Na2SO4 (4)取少量滤液A于试管中加入过量的硝酸钡溶液,静置,再取上层清液于另一支试管中,向其中滴加硝酸银溶液,若产生白色沉淀,则证明滤液A中含有氯化钠。
10. (1)饱和 (2)过滤 防止因局部温度过高,造成液滴飞溅(合理即可) (3)氨气(或NH3)
11. (1)烧杯(或玻璃棒或漏斗) 增大 (2)二氧化锰(或MnO2) (3)4KOH+2MnO2+O2 2K2MnO4+2H2O
化学工艺流程图分析
同课章节目录
