9.3溶解度同步练习(含答案)--2022-2023学年九年级化学京改版(2013)下册
文档属性
| 名称 | 9.3溶解度同步练习(含答案)--2022-2023学年九年级化学京改版(2013)下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 174.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-07 00:00:00 | ||
图片预览




文档简介
9.3溶解度
同步练习
一、单选题
1.如图,是甲、乙两物质的溶解度曲线,下列叙述中正确的是
A.t1℃时,甲、乙各 100g 溶液中均含有 30g 溶质
B.把 100g 溶质质量分数为30%的甲溶液从 t2℃降温到t1℃,其溶质质量分数仍为30%
C.t2℃时,甲的溶液中溶质和溶剂的质量比质量一定不大于 1:2
D.t2℃时,将甲、乙两物质溶液恒温蒸发等质量的水,甲析出在固体一定大于乙
2.甲、乙、丙三种固体的溶解度曲线如图所示。则下列说法中,正确的是
A.甲的溶解度最大,丙的溶解度最小
B.t1℃时,甲、乙饱和溶液中溶质与溶剂的质量比为3:7
C.甲、丙混合溶液,可通过降温结晶的方式提纯丙
D.将t1℃时甲、乙、丙饱和溶液分别升温到t2℃,所得溶液的溶质质量分数大小关系为甲=乙>丙
3.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是
A.t1℃时,向50g水中加入20g乙物质,得到的溶液的质量是70g
B.t2℃时甲饱和溶液中溶质质量是t1℃甲饱和溶液中溶质质量的2倍
C.将t2℃时的甲、乙饱和溶液分别降温至t1℃,此时两种溶液中溶质质量分数相等
D.固体乙中混有少量甲,提纯乙的方法是降温结晶
4.A、B、C三种物质的溶解度曲线如图所示。下列分析正确的是( )
A.将C物质的饱和溶液变为不饱和溶液,可采用升温的方法
B.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等
C.将t2℃时A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>A>C
D.t2℃时,把50gB放入100g水中能得到B物质的饱和溶液,其中溶质和溶剂的质量比为1:2
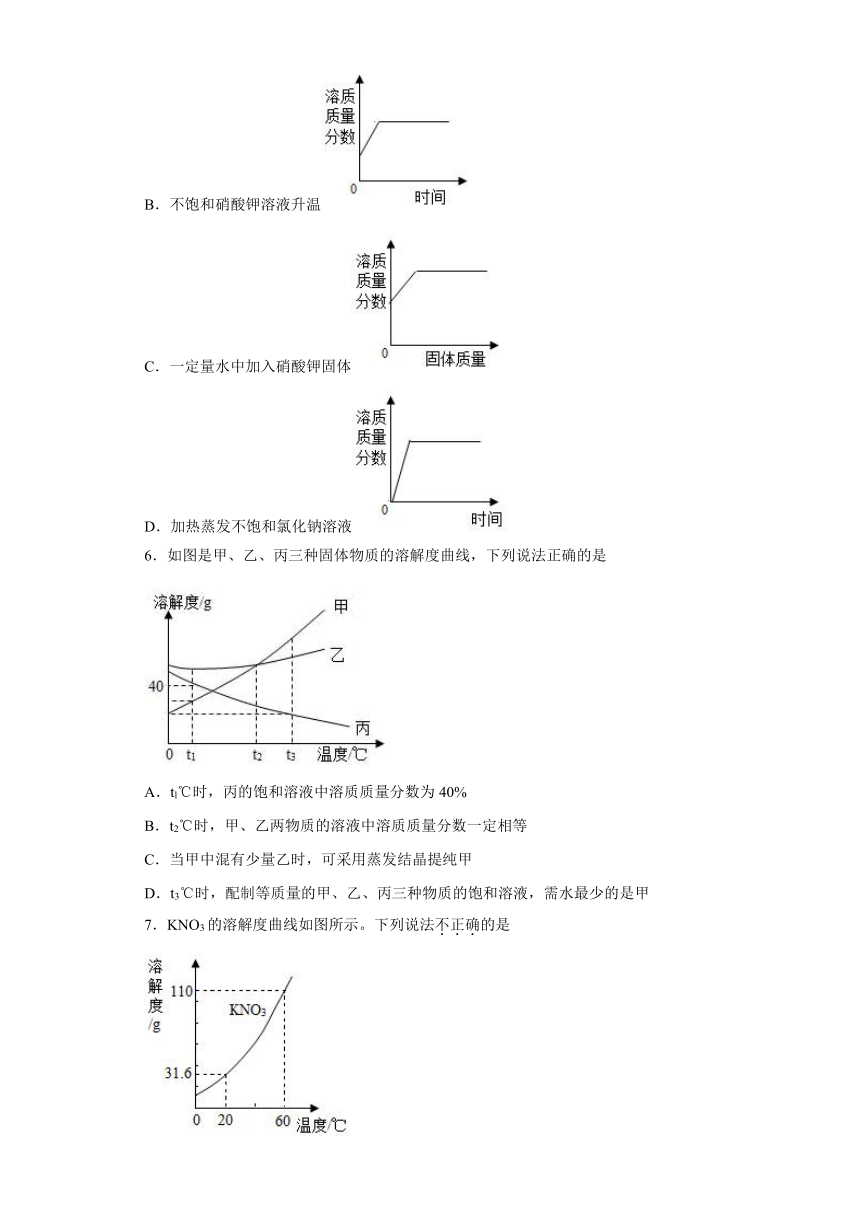
5.下图中能正确反映题中所描述的变化事实的是
A.接近饱和的氯化钠溶液中加入氯化钠固体
B.不饱和硝酸钾溶液升温
C.一定量水中加入硝酸钾固体
D.加热蒸发不饱和氯化钠溶液
6.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是
A.tl℃时,丙的饱和溶液中溶质质量分数为40%
B.t2℃时,甲、乙两物质的溶液中溶质质量分数一定相等
C.当甲中混有少量乙时,可采用蒸发结晶提纯甲
D.t3℃时,配制等质量的甲、乙、丙三种物质的饱和溶液,需水最少的是甲
7.KNO3的溶解度曲线如图所示。下列说法不正确的是
A.0~60 ℃,KNO3的溶解度随温度升高而增大
B.20 ℃时,KNO3饱和溶液中溶质质量分数为31.6%
C.60 ℃时,100 g 水中最多溶解110 g KNO3
D.将20 ℃的KNO3饱和溶液升温至60℃,溶液中溶质质量不变
8.化学与生活、生产密切相关。下列化学知识的应用或解释不正确的是
A.海水“晒盐”的过程利用的是蒸发结晶
B.氧气能用于钢铁冶炼和金属焊接,利用了氧气的可燃性
C.钙片最好嚼服,这样可以增大钙片与胃液的接触面积,使反应更充分
D.打开汽水瓶盖,会喷出大量泡沫,是因为压强减小,二氧化碳的溶解度减小逸出所致
9.化学与生活生产密切相关。下列说法错误的是
A.喝汽水打嗝是因为升温使气体溶解度升高
B.工业上利用分离液态空气得到氧气
C.洗洁精可以乳化油污
D.农业上可利用营养液对植物进行无土栽培
10.如图为物质M(不含结晶水)的溶解度曲线。下列有关说法正确的是
A.t1℃时,100gM的饱和溶液中含有20gM
B.t2℃时,a表示M的饱和溶液,b表示M的不饱和溶液,且两种溶液的质量相等
C.b→a:保持温度不变,向b点表示的溶液中加入M至恰好饱和
D.将a、b两点的溶液分别降温到t1℃,都有晶体析出
11.下图为某固体饱和溶液的浓度随温度变化的曲线。该固体从溶液中析出时不带结晶水。M、N两点分别表示该固体形成的两份溶液在不同温度时的浓度。当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,其中判断不正确的是( )
A.都升温10℃后,M、N点均向右平移
B.都降温10℃后,M点沿曲线向左下移,N点向左平移
C.加水稀释(假设温度都不变)时,M、N点均不动
D.蒸发溶剂(假设温度都不变)时,先是M点不动,N点向上移至曲线;继续蒸发溶剂,M、N点都不动
12. 在20℃时,往100克饱和食盐溶液中,加入5克食盐,保持不变的是
A.溶质质量 B.溶剂质量 C.溶液质量 D.以上皆是
13.向一瓶饱和的氯化铵溶液中,逐渐加入氯化铵晶体,下列图像符合溶液中溶质质量变化规律的是
A. B.
C. D.
14.20℃时氯化钠的溶解度为36g,下列说法正确的是
A.100g水中溶解36g氯化钠一定饱和
B.20℃时100gNaCl的饱和溶液中含有36g氯化钠
C.20℃时136gNaCl的饱和溶液中含有36g氯化钠
D.20℃时NaCl的饱和溶液中NaCl质量分数为36%
15.下列有关溶液的叙述正确的是
A.溶液是由溶质和溶剂组成的化合物
B.一定温度时,将30%的KNO3溶液倒出一半,剩余溶液的溶质质量分数也减少一半
C.用NaCl固体配制一定质量分数的NaCl溶液,需使用的仪器只有:天平、药匙、玻璃棒
D.Ca(OH) 2的溶解度随温度升高而减小
二、填空题
16.研究“水”可从多角度展开
(1)水的用途
①碘和锌在常温下反应速率很慢,若滴入几滴水则反应剧烈,水在此处的作用是_______ 作用。
②小魔术“纸杯烧水”——纸杯中装满冷水,在纸杯底下点一根蜡烛,发现纸杯并没有燃烧,在这个实验中水的作用是___________。
(2)水的净化
自来水厂处理水的过程如图所示。
①投药消毒所用的Ca(ClO)2中Cl元素的化合价是_____________。
②生活中可以用__________区分硬水和软水。
(3)水与溶液
根据图,回答下列问题
①t2℃时,30g甲投入50g水中,形成___________g溶液。
②将甲、乙、丙三种物质的饱和溶液从t2℃降温至t1℃时,所得溶液溶质质量分数大小是_______
A、甲>乙>丙 B、乙>甲>丙 C、乙>甲=丙 D、无法比较
(4)水的性质:将黄豆大小的金属钠放入滴有酚酞溶液的水中,发现溶液变红,化学方程式为:,X的化学式为________。
17.下列是A、B、C三种固体物质的溶解度曲线如图所示,请回答:
(1)20℃时,A、B、C三种物质的溶解度大小关系是 _____ ;
(2)50℃时,向50g水中加入50g A固体,所得溶液中溶质的质量为 _____ g。
(3)下列说法不正确的是 _____ 。
① 将50℃时A、B、C的饱和溶液降温到20℃,溶质质量分数从大到小的顺序是B>A=C
② 将50℃的C的不饱和溶液变为饱和溶液,溶液质量、溶剂质量、溶质质量分数不一定发生变化
③ A中含有少量的B可采用海水晒盐的原理提纯A
④ 50℃时,将等质量的A、B、C三种物质分别加水完全溶解配制成饱和溶液,A所需要的水最少
⑤ 分别将40℃时三种物质的饱和溶液降温到20℃,A溶液中析出的晶体最多,C溶液中无晶体析出
18.图1为NaCl和KNO3的溶解度曲线。
(1)20℃时,KNO3的溶解度是_______。
(2)50℃时,将50gKNO3固体加入到50g水中得到的是KNO3的_______(填“饱和”或“不饱和”)溶液,此时溶液的溶质质量分数是_______(保留到0.1%)
(3)除去NaCl溶液中混有少量的KNO3,提纯NaCl的方法是_______。
(4)20℃时,某同学进行了图2实验,得到相应溶液①~④,说法正确的是______。
A①②中溶液的溶质质量分数相等
B③④中溶液的溶质质量分数相等
C将③④降温至20℃,均有晶体析出且m(KNO3)>m(NaCl)
D将③④降温至20℃,溶质的质量③>④
19.甲、乙、丙三种物质的溶解度曲线如图所示。
(1)20℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是___________________
(2)50℃时,35克乙物质的饱和溶液中,含乙物质________________克。
(3)若要配制溶质质量分数相等的甲和乙的饱和溶液,温度应控制在____________℃。
(4)若分别将100克甲、乙、丙三种物质的饱和溶液从50℃降温至10℃,所得溶液的质量由多到少的顺序是_________。
(5)甲中混有少量的杂质乙,若想得到较为纯净的甲,可以采用的方法是_________。小明用提纯后的甲固体和水配制一定质量、一定溶质质量分数的甲溶液,其操作步骤是:_____、称量和量取、_______、装瓶贴标签。经检测,小明所配溶液中甲溶质质量分数偏小,其原因不可能是_______(填序号)。
Ⅰ.甲固体仍然不纯 Ⅱ.溶解前,烧杯中有少量水
Ⅲ.量取水时,俯视读数 Ⅳ.装瓶时,有少量溶液洒出
20.A、B、C三种固体物质在水中的溶解度曲线如图所示,请回答:
①_______℃时,A、B两种物质溶解度相等;
②若B溶液中混有少量的A,最好采用______的方法提纯B;
③现有接近饱和的物质A的溶液,使其变成饱和溶液的方法有:
I._________;II.恒温蒸发溶剂;Ⅲ.________;
④t3℃时将20g A物质放入50g水中,充分搅拌,所得溶液中溶质的质量分数是_______;
⑤将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t1℃时, 所得溶液的质量由大到小的顺序是_______;
⑥如图所示,向盛有生石灰的试管中加入适量水,反应的化学方程式是__________。实验时,烧杯中有固体析出,判断该饱和溶液中析出的晶体是__________(填A或B或C)。
三、实验题
21.为了研究物质的溶解现象,进行如下探究活动。
(1)探究 I:探究氢氧化钠固体溶于水后液体的温度变化。图1中的操作存在一处错误,应该改正为______。
(2)探究II如下表:
实验序号 ① ② ③
现象 固体溶解,形成紫红色溶液 固体溶解,形成紫色溶液 固体几乎不溶解
对探究 II中实验现象进行分析,需要做的对比是______,分析得出的结论之一是______。
(3)探究III过程如图2所示。
所得溶液一定属于饱和溶液的是______。通过该探究得出的结论是______(答一点即可)。
(4)在上述探究的基础上,同学们想通过探究,比较食盐和氯化铵在水中的溶解度大小,探究方案应该是______。
参考答案:
1.C2.D3.C4.C5.A6.D7.B8.B9.A10.C11.C12.D13.B14.C15.D
16.催化作用 吸收热量,使温度达不到可燃物着火点 +1 肥皂水 75 B NaOH
17.B>A=C(或B>C=A) 25 ①③⑤
18.31.6g/100g水 饱和 46.1% 蒸发结晶 AC
19.乙>甲>丙 10 40 丙>乙>甲 降温结晶 计算 溶解 ⅠⅡ
20.t2 蒸发结晶 加入A物质 降温 20%(或1/5) C﹥B﹥A CaO+H2O→Ca(OH)2 C
21.应该用玻璃棒搅拌 将②③对比(或①③对比,答出一组即可) 其他条件相同时,高锰酸钾在水中的溶解能力比在汽油中强(或碘在汽油中的溶解能力比高锰酸钾在汽油中溶解能力强等其它合理答案均可) BDE 硝酸钾的溶解能力随温度升高而增大 20℃时,各取100g水于两只烧杯中,分别逐渐加入氯化铵/食盐,至不再溶解,称量两溶液的质量,溶液质量越大,该物质的溶解度越大(其它合理答案均可)
同步练习
一、单选题
1.如图,是甲、乙两物质的溶解度曲线,下列叙述中正确的是
A.t1℃时,甲、乙各 100g 溶液中均含有 30g 溶质
B.把 100g 溶质质量分数为30%的甲溶液从 t2℃降温到t1℃,其溶质质量分数仍为30%
C.t2℃时,甲的溶液中溶质和溶剂的质量比质量一定不大于 1:2
D.t2℃时,将甲、乙两物质溶液恒温蒸发等质量的水,甲析出在固体一定大于乙
2.甲、乙、丙三种固体的溶解度曲线如图所示。则下列说法中,正确的是
A.甲的溶解度最大,丙的溶解度最小
B.t1℃时,甲、乙饱和溶液中溶质与溶剂的质量比为3:7
C.甲、丙混合溶液,可通过降温结晶的方式提纯丙
D.将t1℃时甲、乙、丙饱和溶液分别升温到t2℃,所得溶液的溶质质量分数大小关系为甲=乙>丙
3.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是
A.t1℃时,向50g水中加入20g乙物质,得到的溶液的质量是70g
B.t2℃时甲饱和溶液中溶质质量是t1℃甲饱和溶液中溶质质量的2倍
C.将t2℃时的甲、乙饱和溶液分别降温至t1℃,此时两种溶液中溶质质量分数相等
D.固体乙中混有少量甲,提纯乙的方法是降温结晶
4.A、B、C三种物质的溶解度曲线如图所示。下列分析正确的是( )
A.将C物质的饱和溶液变为不饱和溶液,可采用升温的方法
B.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等
C.将t2℃时A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>A>C
D.t2℃时,把50gB放入100g水中能得到B物质的饱和溶液,其中溶质和溶剂的质量比为1:2
5.下图中能正确反映题中所描述的变化事实的是
A.接近饱和的氯化钠溶液中加入氯化钠固体
B.不饱和硝酸钾溶液升温
C.一定量水中加入硝酸钾固体
D.加热蒸发不饱和氯化钠溶液
6.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是
A.tl℃时,丙的饱和溶液中溶质质量分数为40%
B.t2℃时,甲、乙两物质的溶液中溶质质量分数一定相等
C.当甲中混有少量乙时,可采用蒸发结晶提纯甲
D.t3℃时,配制等质量的甲、乙、丙三种物质的饱和溶液,需水最少的是甲
7.KNO3的溶解度曲线如图所示。下列说法不正确的是
A.0~60 ℃,KNO3的溶解度随温度升高而增大
B.20 ℃时,KNO3饱和溶液中溶质质量分数为31.6%
C.60 ℃时,100 g 水中最多溶解110 g KNO3
D.将20 ℃的KNO3饱和溶液升温至60℃,溶液中溶质质量不变
8.化学与生活、生产密切相关。下列化学知识的应用或解释不正确的是
A.海水“晒盐”的过程利用的是蒸发结晶
B.氧气能用于钢铁冶炼和金属焊接,利用了氧气的可燃性
C.钙片最好嚼服,这样可以增大钙片与胃液的接触面积,使反应更充分
D.打开汽水瓶盖,会喷出大量泡沫,是因为压强减小,二氧化碳的溶解度减小逸出所致
9.化学与生活生产密切相关。下列说法错误的是
A.喝汽水打嗝是因为升温使气体溶解度升高
B.工业上利用分离液态空气得到氧气
C.洗洁精可以乳化油污
D.农业上可利用营养液对植物进行无土栽培
10.如图为物质M(不含结晶水)的溶解度曲线。下列有关说法正确的是
A.t1℃时,100gM的饱和溶液中含有20gM
B.t2℃时,a表示M的饱和溶液,b表示M的不饱和溶液,且两种溶液的质量相等
C.b→a:保持温度不变,向b点表示的溶液中加入M至恰好饱和
D.将a、b两点的溶液分别降温到t1℃,都有晶体析出
11.下图为某固体饱和溶液的浓度随温度变化的曲线。该固体从溶液中析出时不带结晶水。M、N两点分别表示该固体形成的两份溶液在不同温度时的浓度。当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,其中判断不正确的是( )
A.都升温10℃后,M、N点均向右平移
B.都降温10℃后,M点沿曲线向左下移,N点向左平移
C.加水稀释(假设温度都不变)时,M、N点均不动
D.蒸发溶剂(假设温度都不变)时,先是M点不动,N点向上移至曲线;继续蒸发溶剂,M、N点都不动
12. 在20℃时,往100克饱和食盐溶液中,加入5克食盐,保持不变的是
A.溶质质量 B.溶剂质量 C.溶液质量 D.以上皆是
13.向一瓶饱和的氯化铵溶液中,逐渐加入氯化铵晶体,下列图像符合溶液中溶质质量变化规律的是
A. B.
C. D.
14.20℃时氯化钠的溶解度为36g,下列说法正确的是
A.100g水中溶解36g氯化钠一定饱和
B.20℃时100gNaCl的饱和溶液中含有36g氯化钠
C.20℃时136gNaCl的饱和溶液中含有36g氯化钠
D.20℃时NaCl的饱和溶液中NaCl质量分数为36%
15.下列有关溶液的叙述正确的是
A.溶液是由溶质和溶剂组成的化合物
B.一定温度时,将30%的KNO3溶液倒出一半,剩余溶液的溶质质量分数也减少一半
C.用NaCl固体配制一定质量分数的NaCl溶液,需使用的仪器只有:天平、药匙、玻璃棒
D.Ca(OH) 2的溶解度随温度升高而减小
二、填空题
16.研究“水”可从多角度展开
(1)水的用途
①碘和锌在常温下反应速率很慢,若滴入几滴水则反应剧烈,水在此处的作用是_______ 作用。
②小魔术“纸杯烧水”——纸杯中装满冷水,在纸杯底下点一根蜡烛,发现纸杯并没有燃烧,在这个实验中水的作用是___________。
(2)水的净化
自来水厂处理水的过程如图所示。
①投药消毒所用的Ca(ClO)2中Cl元素的化合价是_____________。
②生活中可以用__________区分硬水和软水。
(3)水与溶液
根据图,回答下列问题
①t2℃时,30g甲投入50g水中,形成___________g溶液。
②将甲、乙、丙三种物质的饱和溶液从t2℃降温至t1℃时,所得溶液溶质质量分数大小是_______
A、甲>乙>丙 B、乙>甲>丙 C、乙>甲=丙 D、无法比较
(4)水的性质:将黄豆大小的金属钠放入滴有酚酞溶液的水中,发现溶液变红,化学方程式为:,X的化学式为________。
17.下列是A、B、C三种固体物质的溶解度曲线如图所示,请回答:
(1)20℃时,A、B、C三种物质的溶解度大小关系是 _____ ;
(2)50℃时,向50g水中加入50g A固体,所得溶液中溶质的质量为 _____ g。
(3)下列说法不正确的是 _____ 。
① 将50℃时A、B、C的饱和溶液降温到20℃,溶质质量分数从大到小的顺序是B>A=C
② 将50℃的C的不饱和溶液变为饱和溶液,溶液质量、溶剂质量、溶质质量分数不一定发生变化
③ A中含有少量的B可采用海水晒盐的原理提纯A
④ 50℃时,将等质量的A、B、C三种物质分别加水完全溶解配制成饱和溶液,A所需要的水最少
⑤ 分别将40℃时三种物质的饱和溶液降温到20℃,A溶液中析出的晶体最多,C溶液中无晶体析出
18.图1为NaCl和KNO3的溶解度曲线。
(1)20℃时,KNO3的溶解度是_______。
(2)50℃时,将50gKNO3固体加入到50g水中得到的是KNO3的_______(填“饱和”或“不饱和”)溶液,此时溶液的溶质质量分数是_______(保留到0.1%)
(3)除去NaCl溶液中混有少量的KNO3,提纯NaCl的方法是_______。
(4)20℃时,某同学进行了图2实验,得到相应溶液①~④,说法正确的是______。
A①②中溶液的溶质质量分数相等
B③④中溶液的溶质质量分数相等
C将③④降温至20℃,均有晶体析出且m(KNO3)>m(NaCl)
D将③④降温至20℃,溶质的质量③>④
19.甲、乙、丙三种物质的溶解度曲线如图所示。
(1)20℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是___________________
(2)50℃时,35克乙物质的饱和溶液中,含乙物质________________克。
(3)若要配制溶质质量分数相等的甲和乙的饱和溶液,温度应控制在____________℃。
(4)若分别将100克甲、乙、丙三种物质的饱和溶液从50℃降温至10℃,所得溶液的质量由多到少的顺序是_________。
(5)甲中混有少量的杂质乙,若想得到较为纯净的甲,可以采用的方法是_________。小明用提纯后的甲固体和水配制一定质量、一定溶质质量分数的甲溶液,其操作步骤是:_____、称量和量取、_______、装瓶贴标签。经检测,小明所配溶液中甲溶质质量分数偏小,其原因不可能是_______(填序号)。
Ⅰ.甲固体仍然不纯 Ⅱ.溶解前,烧杯中有少量水
Ⅲ.量取水时,俯视读数 Ⅳ.装瓶时,有少量溶液洒出
20.A、B、C三种固体物质在水中的溶解度曲线如图所示,请回答:
①_______℃时,A、B两种物质溶解度相等;
②若B溶液中混有少量的A,最好采用______的方法提纯B;
③现有接近饱和的物质A的溶液,使其变成饱和溶液的方法有:
I._________;II.恒温蒸发溶剂;Ⅲ.________;
④t3℃时将20g A物质放入50g水中,充分搅拌,所得溶液中溶质的质量分数是_______;
⑤将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t1℃时, 所得溶液的质量由大到小的顺序是_______;
⑥如图所示,向盛有生石灰的试管中加入适量水,反应的化学方程式是__________。实验时,烧杯中有固体析出,判断该饱和溶液中析出的晶体是__________(填A或B或C)。
三、实验题
21.为了研究物质的溶解现象,进行如下探究活动。
(1)探究 I:探究氢氧化钠固体溶于水后液体的温度变化。图1中的操作存在一处错误,应该改正为______。
(2)探究II如下表:
实验序号 ① ② ③
现象 固体溶解,形成紫红色溶液 固体溶解,形成紫色溶液 固体几乎不溶解
对探究 II中实验现象进行分析,需要做的对比是______,分析得出的结论之一是______。
(3)探究III过程如图2所示。
所得溶液一定属于饱和溶液的是______。通过该探究得出的结论是______(答一点即可)。
(4)在上述探究的基础上,同学们想通过探究,比较食盐和氯化铵在水中的溶解度大小,探究方案应该是______。
参考答案:
1.C2.D3.C4.C5.A6.D7.B8.B9.A10.C11.C12.D13.B14.C15.D
16.催化作用 吸收热量,使温度达不到可燃物着火点 +1 肥皂水 75 B NaOH
17.B>A=C(或B>C=A) 25 ①③⑤
18.31.6g/100g水 饱和 46.1% 蒸发结晶 AC
19.乙>甲>丙 10 40 丙>乙>甲 降温结晶 计算 溶解 ⅠⅡ
20.t2 蒸发结晶 加入A物质 降温 20%(或1/5) C﹥B﹥A CaO+H2O→Ca(OH)2 C
21.应该用玻璃棒搅拌 将②③对比(或①③对比,答出一组即可) 其他条件相同时,高锰酸钾在水中的溶解能力比在汽油中强(或碘在汽油中的溶解能力比高锰酸钾在汽油中溶解能力强等其它合理答案均可) BDE 硝酸钾的溶解能力随温度升高而增大 20℃时,各取100g水于两只烧杯中,分别逐渐加入氯化铵/食盐,至不再溶解,称量两溶液的质量,溶液质量越大,该物质的溶解度越大(其它合理答案均可)
