浙教版2022-2023学年第二学期八年级科学“期末冲刺”专题训练(六):有关化学方程式的计算(2)(含答案)
文档属性
| 名称 | 浙教版2022-2023学年第二学期八年级科学“期末冲刺”专题训练(六):有关化学方程式的计算(2)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 305.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-09 15:35:23 | ||
图片预览



文档简介
1.称取12.5克石灰石(主要成分是 CaCO3,杂质不参加反应)放入烧杯中,向其中加入50克稀盐酸,两者恰好完全反应。反应结束后称量烧杯中剩余物员的总崩量为58.1克(不包括烧杯的质量,且气体的溶解忽略不计)。 计算石灰石中CaCO3的质量分数和反应后所得溶液中的溶质质量。
2.实验室常用过氧化氢溶液与二氧化锰混合制取氧气。现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体。请完成下列问题:
(1)过氧化氢(H202)中氢元素与氧元素的质量比为_______________。
(2)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为____________g。
(3)计算原过氧化氢溶液中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)
3.一定质量的细铁丝(假设不含任何杂质)在氧气中完全燃烧后生成四氧化三铁。固体的质量随时间的变化关系如图所示,试计算:
(1)参加反应的氧气的质量是____________(用m1、m2表示)。
(2)上述反应生成的四氧化三铁中铁元素的质量与多少克氧化铁中铁元素的质量相等?
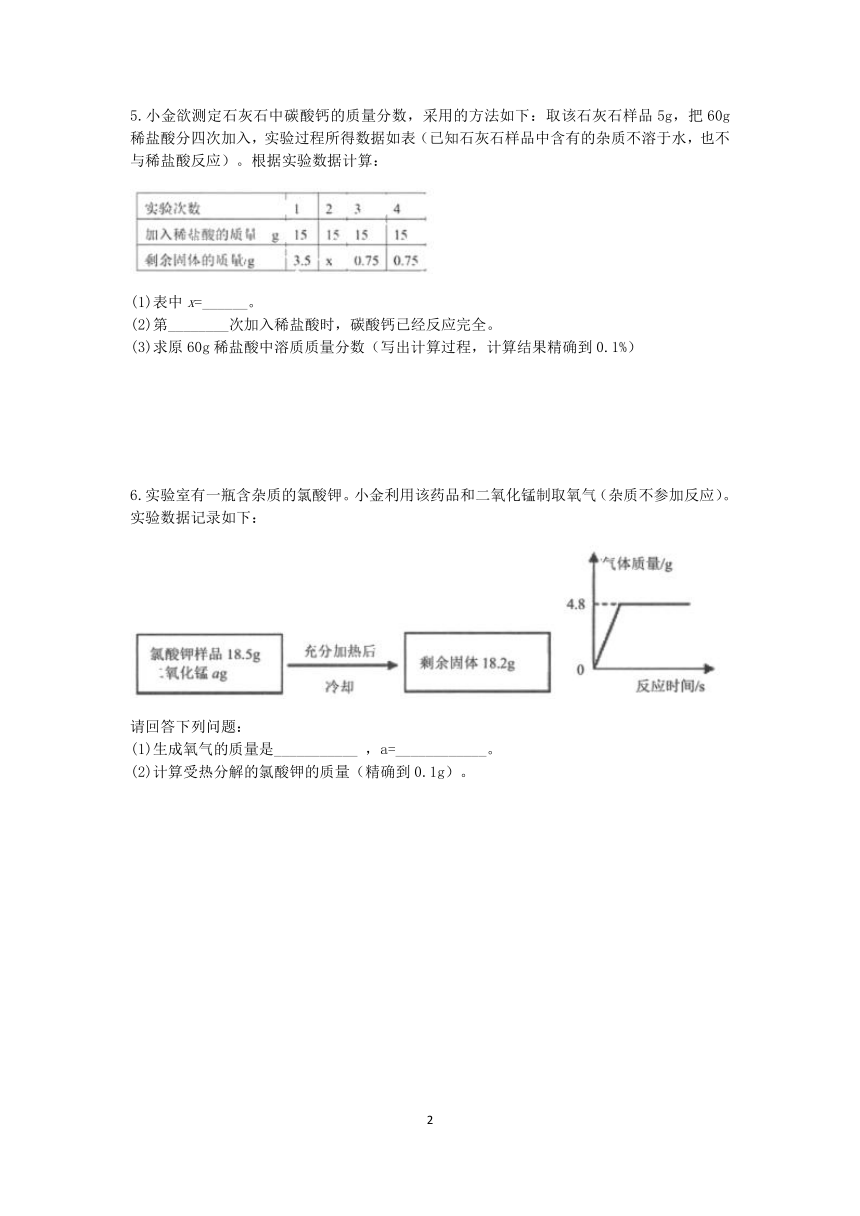
5.小金欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品5g,把60g稀盐酸分四次加入,实验过程所得数据如表(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应)。根据实验数据计算:
(1)表中x=______。
(2)第________次加入稀盐酸时,碳酸钙已经反应完全。
(3)求原60g稀盐酸中溶质质量分数(写出计算过程,计算结果精确到0.1%)
6.实验室有一瓶含杂质的氯酸钾。小金利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如下:
请回答下列问题:
(1)生成氧气的质量是___________ ,a=____________。
(2)计算受热分解的氯酸钾的质量(精确到0.1g)。
7.小乐在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量变化如图所示,回答问题:
(1)制取氧气的质量是________g。
(2)原混合物中氯酿钾的质量分数。(写出计算过程,计算结果精确到0.1%)
8.无水硫酸铜易溶于水,硫酸铜溶液可催化过氧化氢分解制得氧气。某次小金实验测得的相关数据如下图:
9.为确定某大理石样品的纯度,小应进行如下实验:称取该大理石(主要成分是CaCO3,杂质不参
加反应)加入烧杯中,向其中逐渐加入稀盐酸至完全反应。反应结束后,称量烧杯的总质量(溶解的气体忽略不计),有关数据记录如下表。
(1)实验中判断碳酸钙已经完全反应的方法是____________________________。
(2)请计算该大理石样品的纯度。(计算结果精确到0.1%))
(3)实验中不建议用稀硫酸代替稀盐酸,原因是__________________________。
10.某同学采用如图装置,用一些植物的器官来代替Mn02作催化剂,分解H202制取氧气,记录数据如下表。
请依据上述信息分析:
(1)要使胡萝卜能够更快地促进过氧化氢的分解,可采用的方法是________________。
(2)当量筒内的水达到80毫升时,打开广口瓶的橡皮塞,立即将带火星的木条伸入瓶内,却发现木条不能复燃。请你解释木条不能复燃的原因是______________________________。
(3)计算:34克15%的H202溶液中的溶质完全分解,能制得氧气多少克?
11.在新一轮的动力电池投资热潮中,固态锂电池正在成为下一代电池技术中的全球“新宠”。锂电池是一种以金属锂或锂合金为负极材料的电池。锂是已知元素中金属活动性最强的,它能与水反应,生成LiOH和世界上已知密度最小的气体。
(1)写出金属锂与水反应的化学方程式__________________________;
(2)计算1.4克金属锂能与多少克水反应?
12.为了测定实验室中高锰酸钾样品的纯度(假设杂质不参加反应),称取4.0g该样品中试管中加热。高锰酸钾完全分解,用排水法得到0.2升冷却到室温的氧气(常温下氧气的密度约为1.6克/升)。请回答下列问题:
(1)高锰酸钾完全分解得到氧气的质量约为__________;
(2)该样品中高锰酸钾的质量分数是多少?
13.小乐利用图示实验装置测定某大理石样品的纯度(所含杂质不与盐酸反应,且不溶于水)。她取了该大理石样品12.5g,并加入足量稀盐酸进行实验。实验数据记录如下表:
(1)反应共生成CO2的质量为_______g。
(2)计算该大理石样品中CaCO3的质量分数。(写出计算过程)
14.在2.0g的大理石中加入足量的盐酸(假设杂质不与酸反应),用数字检测仪分别测得产生的二氧化碳体积随时间的变化曲线如图所示。甲曲线表示粉末状大理石与10%的盐酸反应过程,乙曲线表示块状大理石与10%的盐酸反应过程。已知:①该条件下,二氧化碳密度为1.98g/L。②一般来说,其他条件相同,增大反应物浓度,化学反应速率加快。
(1)根据图中信息,反应速率快的是_________(选填“甲”或“乙”)。
(2)求大理石中碳酸钙的百分含量。(写出计算过程,结果保留1位小数)
(3)请你在图中画出:用块状大理石与6%的盐酸反应的大致曲线。
15.完成下列研究性学习的有关内容:探究氯酸钾和二氧化锰混合物中氯酸钾的质量分数。
【研究方案】先称取一定质量的氯酸钾和二氧化锰混合物、放入大试管中加热至质量不再变化为止。根据质量守恒定律,固体物质减轻的质量即为产生氧气的质量,从而求出氯酸钾的质量。
【解决问题】实验测得固体混合物质量随加热时间变化的相关数据如右图所示。请你计算:
(1)反应中产生氧气的质量
(2)原混合物中氯酸钾的质量分数
【继续研究】为了分离回收二氧化锰和氯化钾,他们在反应后的固体混合物中加入80克水使其中的氯化钾完全溶解,然后通过过滤使二氧化锰与液体分离。请你计算他们得到的溶液中氯化钾的质量分数。(过滤中水的损失不计)
参考答案
1.
2.(1)1:16(2)2.5
(3)设100g过氧化氢溶液中含有过氧化氢的质量为x。
2H2O2=2H2O+O2↑
68 32
x 1.6g
68:32 =x:1.6g x=3.4g
过氧化氢溶液的溶质的质量分数= 3.4g/100g×100% = 3.4%
3. (1)(m2-m1)g
4. (2)设:上述反应生成的四氧化三铁与X克氧化铁的含铁量相等 化合物中某元素的质量=该化合物的质量×该化合物中该元素的质量分数m2×3×56/3×56+4×16×100%=X×2×562×56+3×16×100%计算得:X=30m229(克)
5.(1)2.00。(2)3。(3)设第一次参加反应的HCl的质量为X
100/73=1.50/x,x=1.095g
稀盐酸中溶质质量分数为:1.095g/15g×100%=7.3%
答:原60g稀盐酸中溶质质量分数为7.3%。
6.(1)4.8g,4.5g
(2)由于是充分反应,所以是氯酸钾完全分解,设原固体混合物中氯酸钾的质量为x。
2KClO3=Δ==2KCl+3O2↑
245 96
x 4.8g
245/96=x/4.8g x≈12.3g
答:(2)受热分解的氯酸钾的质量12.3g。
7.解:(1)1.92
(2)设原混合物中KClO3的质量为x
2KClO3=2KCl+3O2↑
245 96
x 1.92g
245/96=x/1.92g x=4.90g
原混合物中KClO3的质量分数是:4.90g、6.00g×100%≈81.7%
答:原混合物中KClO3的质量分数是81.7%。
8.(1)设溶液中过氧化氢的质量为x
2H2O2===2H2O+O2↑
68 32
x 1.6g
68/32=x/1.6g x=3.4g
(2)反应后的溶液为CuSO4溶液,溶液质量为:48g+3.6g-1.6g=50g
CuSO4%=3.6g/50g×100%=7.2%
9.(1)继续滴入稀盐酸,观察到不再产生气泡(2)CO2:3.3
解:设8.5克大理石样品中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3克
100x=443.3克x=7.5克
大理石样品的纯度=7.5克/8.5克×100%=88.2%
答:该大理石样品的纯度为 88.2%。
(3)稀硫酸与碳酸钙反应会生成微溶的硫酸钙,覆盖在碳酸钙表面,阻止反应进一步发生。
10.(1)将胡萝卜切成更小的颗粒(或“将胡萝卜磨成浆”等均可);
(2)此时广口瓶内的气体主要为空气
(3)解:设产生氧气的质量为m
2H2O2= 2H2O + O2↑
68 32
34克×15% m
68/34克×15%=32/m m=2.4g
11.(1)2Li+2H2O=2LiOH+H2↑(2)3.6
12.(1)0.32(2)79%
13.(1)4.4(2)解:设CaCO3的质量为x。
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 4.4g
100/44=x/4.4g x=100×4.4g/44=10g
大理石样品中CaCO3的质量分数=10g/12.5g×100%=80%
答:大理石样品中CaCO3的质量分数为80%。
14.(1)甲 (2)设2.0g大理石中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 400×10﹣3L×1.98g/L
100/44=x/400×10 3L×1.98g/L x=1.8g
则大理石中碳酸钙的百分含量为1.8g/2.0g×100%=90%
答:大理石中碳酸钙的百分含量为90%。
(3)依据题意可知,一般来说,其他条件相同,增大反应物浓度,化学反应速率加快,则:
15.(1)4.8克 (2)76.6% 8.5%
有关化学方程式的计算(2)
2.实验室常用过氧化氢溶液与二氧化锰混合制取氧气。现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体。请完成下列问题:
(1)过氧化氢(H202)中氢元素与氧元素的质量比为_______________。
(2)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为____________g。
(3)计算原过氧化氢溶液中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)
3.一定质量的细铁丝(假设不含任何杂质)在氧气中完全燃烧后生成四氧化三铁。固体的质量随时间的变化关系如图所示,试计算:
(1)参加反应的氧气的质量是____________(用m1、m2表示)。
(2)上述反应生成的四氧化三铁中铁元素的质量与多少克氧化铁中铁元素的质量相等?
5.小金欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品5g,把60g稀盐酸分四次加入,实验过程所得数据如表(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应)。根据实验数据计算:
(1)表中x=______。
(2)第________次加入稀盐酸时,碳酸钙已经反应完全。
(3)求原60g稀盐酸中溶质质量分数(写出计算过程,计算结果精确到0.1%)
6.实验室有一瓶含杂质的氯酸钾。小金利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如下:
请回答下列问题:
(1)生成氧气的质量是___________ ,a=____________。
(2)计算受热分解的氯酸钾的质量(精确到0.1g)。
7.小乐在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量变化如图所示,回答问题:
(1)制取氧气的质量是________g。
(2)原混合物中氯酿钾的质量分数。(写出计算过程,计算结果精确到0.1%)
8.无水硫酸铜易溶于水,硫酸铜溶液可催化过氧化氢分解制得氧气。某次小金实验测得的相关数据如下图:
9.为确定某大理石样品的纯度,小应进行如下实验:称取该大理石(主要成分是CaCO3,杂质不参
加反应)加入烧杯中,向其中逐渐加入稀盐酸至完全反应。反应结束后,称量烧杯的总质量(溶解的气体忽略不计),有关数据记录如下表。
(1)实验中判断碳酸钙已经完全反应的方法是____________________________。
(2)请计算该大理石样品的纯度。(计算结果精确到0.1%))
(3)实验中不建议用稀硫酸代替稀盐酸,原因是__________________________。
10.某同学采用如图装置,用一些植物的器官来代替Mn02作催化剂,分解H202制取氧气,记录数据如下表。
请依据上述信息分析:
(1)要使胡萝卜能够更快地促进过氧化氢的分解,可采用的方法是________________。
(2)当量筒内的水达到80毫升时,打开广口瓶的橡皮塞,立即将带火星的木条伸入瓶内,却发现木条不能复燃。请你解释木条不能复燃的原因是______________________________。
(3)计算:34克15%的H202溶液中的溶质完全分解,能制得氧气多少克?
11.在新一轮的动力电池投资热潮中,固态锂电池正在成为下一代电池技术中的全球“新宠”。锂电池是一种以金属锂或锂合金为负极材料的电池。锂是已知元素中金属活动性最强的,它能与水反应,生成LiOH和世界上已知密度最小的气体。
(1)写出金属锂与水反应的化学方程式__________________________;
(2)计算1.4克金属锂能与多少克水反应?
12.为了测定实验室中高锰酸钾样品的纯度(假设杂质不参加反应),称取4.0g该样品中试管中加热。高锰酸钾完全分解,用排水法得到0.2升冷却到室温的氧气(常温下氧气的密度约为1.6克/升)。请回答下列问题:
(1)高锰酸钾完全分解得到氧气的质量约为__________;
(2)该样品中高锰酸钾的质量分数是多少?
13.小乐利用图示实验装置测定某大理石样品的纯度(所含杂质不与盐酸反应,且不溶于水)。她取了该大理石样品12.5g,并加入足量稀盐酸进行实验。实验数据记录如下表:
(1)反应共生成CO2的质量为_______g。
(2)计算该大理石样品中CaCO3的质量分数。(写出计算过程)
14.在2.0g的大理石中加入足量的盐酸(假设杂质不与酸反应),用数字检测仪分别测得产生的二氧化碳体积随时间的变化曲线如图所示。甲曲线表示粉末状大理石与10%的盐酸反应过程,乙曲线表示块状大理石与10%的盐酸反应过程。已知:①该条件下,二氧化碳密度为1.98g/L。②一般来说,其他条件相同,增大反应物浓度,化学反应速率加快。
(1)根据图中信息,反应速率快的是_________(选填“甲”或“乙”)。
(2)求大理石中碳酸钙的百分含量。(写出计算过程,结果保留1位小数)
(3)请你在图中画出:用块状大理石与6%的盐酸反应的大致曲线。
15.完成下列研究性学习的有关内容:探究氯酸钾和二氧化锰混合物中氯酸钾的质量分数。
【研究方案】先称取一定质量的氯酸钾和二氧化锰混合物、放入大试管中加热至质量不再变化为止。根据质量守恒定律,固体物质减轻的质量即为产生氧气的质量,从而求出氯酸钾的质量。
【解决问题】实验测得固体混合物质量随加热时间变化的相关数据如右图所示。请你计算:
(1)反应中产生氧气的质量
(2)原混合物中氯酸钾的质量分数
【继续研究】为了分离回收二氧化锰和氯化钾,他们在反应后的固体混合物中加入80克水使其中的氯化钾完全溶解,然后通过过滤使二氧化锰与液体分离。请你计算他们得到的溶液中氯化钾的质量分数。(过滤中水的损失不计)
参考答案
1.
2.(1)1:16(2)2.5
(3)设100g过氧化氢溶液中含有过氧化氢的质量为x。
2H2O2=2H2O+O2↑
68 32
x 1.6g
68:32 =x:1.6g x=3.4g
过氧化氢溶液的溶质的质量分数= 3.4g/100g×100% = 3.4%
3. (1)(m2-m1)g
4. (2)设:上述反应生成的四氧化三铁与X克氧化铁的含铁量相等 化合物中某元素的质量=该化合物的质量×该化合物中该元素的质量分数m2×3×56/3×56+4×16×100%=X×2×562×56+3×16×100%计算得:X=30m229(克)
5.(1)2.00。(2)3。(3)设第一次参加反应的HCl的质量为X
100/73=1.50/x,x=1.095g
稀盐酸中溶质质量分数为:1.095g/15g×100%=7.3%
答:原60g稀盐酸中溶质质量分数为7.3%。
6.(1)4.8g,4.5g
(2)由于是充分反应,所以是氯酸钾完全分解,设原固体混合物中氯酸钾的质量为x。
2KClO3=Δ==2KCl+3O2↑
245 96
x 4.8g
245/96=x/4.8g x≈12.3g
答:(2)受热分解的氯酸钾的质量12.3g。
7.解:(1)1.92
(2)设原混合物中KClO3的质量为x
2KClO3=2KCl+3O2↑
245 96
x 1.92g
245/96=x/1.92g x=4.90g
原混合物中KClO3的质量分数是:4.90g、6.00g×100%≈81.7%
答:原混合物中KClO3的质量分数是81.7%。
8.(1)设溶液中过氧化氢的质量为x
2H2O2===2H2O+O2↑
68 32
x 1.6g
68/32=x/1.6g x=3.4g
(2)反应后的溶液为CuSO4溶液,溶液质量为:48g+3.6g-1.6g=50g
CuSO4%=3.6g/50g×100%=7.2%
9.(1)继续滴入稀盐酸,观察到不再产生气泡(2)CO2:3.3
解:设8.5克大理石样品中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3克
100x=443.3克x=7.5克
大理石样品的纯度=7.5克/8.5克×100%=88.2%
答:该大理石样品的纯度为 88.2%。
(3)稀硫酸与碳酸钙反应会生成微溶的硫酸钙,覆盖在碳酸钙表面,阻止反应进一步发生。
10.(1)将胡萝卜切成更小的颗粒(或“将胡萝卜磨成浆”等均可);
(2)此时广口瓶内的气体主要为空气
(3)解:设产生氧气的质量为m
2H2O2= 2H2O + O2↑
68 32
34克×15% m
68/34克×15%=32/m m=2.4g
11.(1)2Li+2H2O=2LiOH+H2↑(2)3.6
12.(1)0.32(2)79%
13.(1)4.4(2)解:设CaCO3的质量为x。
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 4.4g
100/44=x/4.4g x=100×4.4g/44=10g
大理石样品中CaCO3的质量分数=10g/12.5g×100%=80%
答:大理石样品中CaCO3的质量分数为80%。
14.(1)甲 (2)设2.0g大理石中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 400×10﹣3L×1.98g/L
100/44=x/400×10 3L×1.98g/L x=1.8g
则大理石中碳酸钙的百分含量为1.8g/2.0g×100%=90%
答:大理石中碳酸钙的百分含量为90%。
(3)依据题意可知,一般来说,其他条件相同,增大反应物浓度,化学反应速率加快,则:
15.(1)4.8克 (2)76.6% 8.5%
有关化学方程式的计算(2)
同课章节目录
