浙教版2022-2023学年第二学期八年级科学“期末冲刺”专题训练(五):有关化学方程式的计算(1)(含答案)
文档属性
| 名称 | 浙教版2022-2023学年第二学期八年级科学“期末冲刺”专题训练(五):有关化学方程式的计算(1)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 433.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-09 16:00:34 | ||
图片预览


文档简介
1.为测出鸡蛋壳(主要成分是碳酸钙)中钙元素的质量分数,小乐称取已洗净、晾干、研成粉末的鸡蛋壳10克置于烧杯中,将烧杯放在电子天平上,往烧杯中加入稀盐酸100克(足量),每0.5分钟记录一次电子天平的示数,据此计算出产生气体的质量,具体数据如表:
(1)若产生的气体全部是鸡蛋壳中的碳酸钙与稀盐酸反应生成的CO2,根据实验结果计算出该鸡蛋壳中碳酸钙的质量分数(假定鸡蛋壳中其它成分不含钙元素,写出具体计算过程)。
(2)下列哪些情况会导致实验中钙元素质量分数测量结果偏大 _______(选填字母)。
A. 盐酸溶质质量分数过大 B.鸡蛋壳未晾干 C.鸡蛋壳未充分研碎
2.取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:
(1)生成氧气的质量是________克;
(2)参加反应的氯酸钾的质量是多少克?(写出具体计算步骤)
(3)氯化钾溶液的质量是多少克?(写出具体计算步骤)
3.实验室有一瓶含杂质的氯酸钾。取氯酸钾样品16.45g和一定质量二氧化锰混和加热(杂质不参加反应,不含氧元素),充分反应后测得剩余固体质量为16g,生成氧气4.8g。
(1)二氧化锰为该反应的催化剂,反应前后二氧化锰的__________和__________均没有发生改变;
(2)求样品中氯酸钾的质量:
(3)求剩余固体中氧元素的质量。
4.超市卖的纯碱产品中往往会含有少量的氯化钠,化学兴趣小组的同学要通过实验来测定某品牌的纯碱样品中Na2CO3的质量分数。他们取了6g纯碱样品放入烧杯中,再将80g一定溶质质量分数的稀盐酸分4次加入该烧杯中,充分反应后测得实验数据如下表(不考虑CO2溶解于水)。(计算结果精确到0.1%)
(1)表格中m的值为__________。
(2)样品中Na2CO3的质量分数是多少?
(3)第四次实验后所得溶液中NaCl的质量分数是多少?
5.长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和其它杂质(其它杂质与盐酸反应不产生气体)。为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生气体的质量情况如图所示。
(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是 g。
(2)水垢中碳酸钙的质量分数是多少?(列式计算)
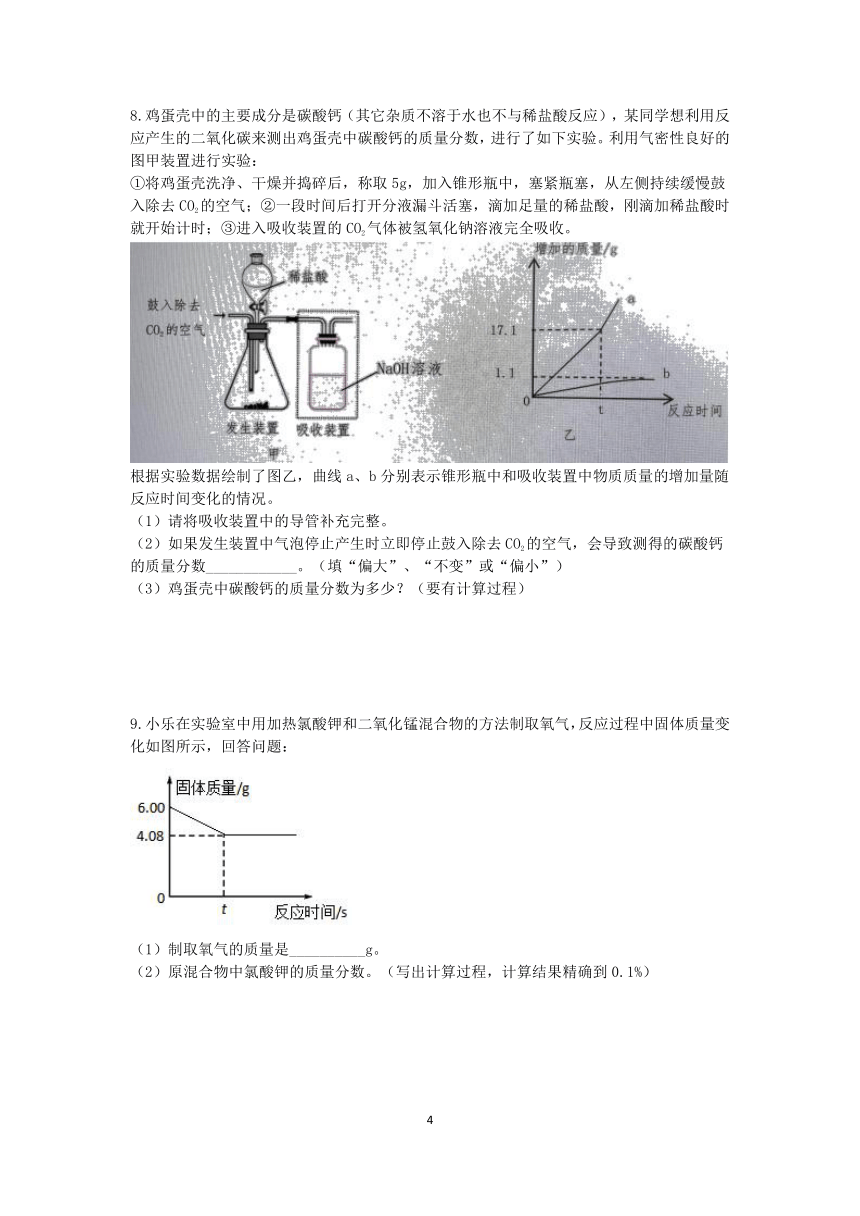
6.小乐利用图示实验装置测定某大理石样品的纯度(所含杂质不与盐酸反应,且不溶于水)。她取了该大理石样品12.5g,并加入足量稀盐酸进行实验。实验数据记录如下表:
(1)反应共生成CO2的质量为_______g。
(2)计算该大理石样品中CaCO3的质量分数。(写出计算过程)
7.为测定某钙片中碳酸钙的质量分数(钙片中其他成分不参与反应),小乐取10g钙片研磨后,进行了如图所示的实验(忽略水分蒸发)。回答下列问题:
(1)研磨钙片的目的是_____________。该实验中,装置的气密性对测定结果__________(选填“有”或“无”)影响。
(2)计算该钙片中碳酸钙的质量分数。(写出计算过程)
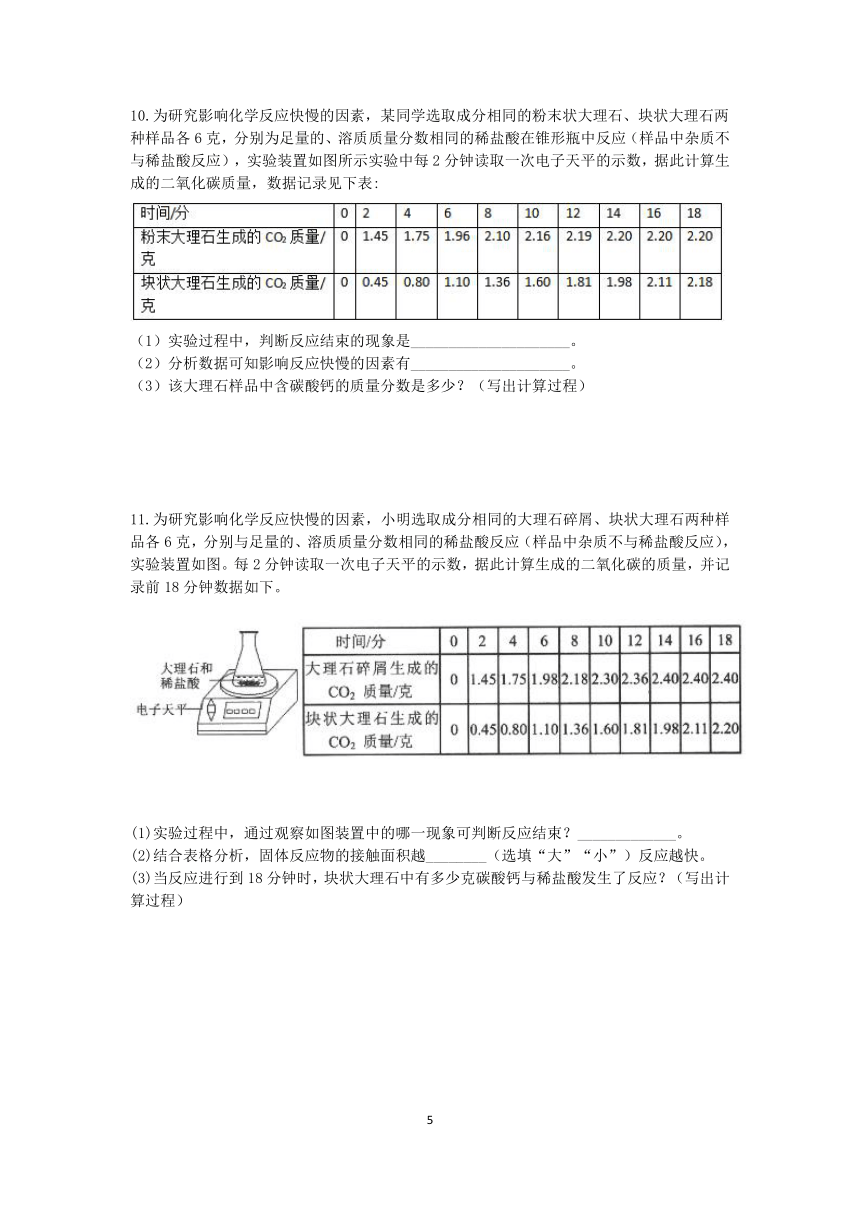
8.鸡蛋壳中的主要成分是碳酸钙(其它杂质不溶于水也不与稀盐酸反应),某同学想利用反应产生的二氧化碳来测出鸡蛋壳中碳酸钙的质量分数,进行了如下实验。利用气密性良好的图甲装置进行实验:
①将鸡蛋壳洗净、干燥并捣碎后,称取5g,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入除去CO2的空气;②一段时间后打开分液漏斗活塞,滴加足量的稀盐酸,刚滴加稀盐酸时就开始计时;③进入吸收装置的CO2气体被氢氧化钠溶液完全吸收。
根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶中和吸收装置中物质质量的增加量随反应时间变化的情况。
(1)请将吸收装置中的导管补充完整。
(2)如果发生装置中气泡停止产生时立即停止鼓入除去CO2的空气,会导致测得的碳酸钙的质量分数____________。(填“偏大”、“不变”或“偏小”)
(3)鸡蛋壳中碳酸钙的质量分数为多少?(要有计算过程)
9.小乐在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量变化如图所示,回答问题:
(1)制取氧气的质量是__________g。
(2)原混合物中氯酸钾的质量分数。(写出计算过程,计算结果精确到0.1%)
10.为研究影响化学反应快慢的因素,某同学选取成分相同的粉末状大理石、块状大理石两种样品各6克,分别为足量的、溶质质量分数相同的稀盐酸在锥形瓶中反应(样品中杂质不与稀盐酸反应),实验装置如图所示实验中每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳质量,数据记录见下表:
(1)实验过程中,判断反应结束的现象是_____________________。
(2)分析数据可知影响反应快慢的因素有_____________________。
(3)该大理石样品中含碳酸钙的质量分数是多少?(写出计算过程)
11.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下。
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束?_____________。
(2)结合表格分析,固体反应物的接触面积越________(选填“大”“小”)反应越快。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
12.某补钙剂的主要成分是碳酸钙。为测定补钙剂中钙的含量,取15克补钙剂样品,加入足量的稀盐酸后,质量变化如图。假设产生的二氧化碳全部逸出,且不考虑水分和酸液的蒸发,补钙剂中其余杂质不参与反应。请回答。
(1)可利用_________定律求出反应后生成C02的质量。
(2)该样品中碳酸钙的质量。(请列式计算)
(3)若装置的气密性不好,则补钙剂中钙元素含量的测定结果将_________(填“偏大”、“偏小”“没有影响”)。
13.在燃烧匙中放入足量的白磷,用如图所示装置来测量空气中氧气含量。集气瓶容积为600mL,集气瓶内水的体积为100mL,实验开始前量筒中的水体积为200mL,实验结束后量筒中水的体积为100mL。
(1)根据实验结果,测得集气瓶内原有氧气体积是_______mL,其质量为_______克。(已知氧气密度为1.4g/L)。
(2)若有0.124克的白磷充分燃烧,至少需要氧气多少克?
(3)上述实验中,若燃烧匙中放入0.124克的白磷是否足够?说明理由。
14.小明同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
试求:(1)m的值为__________g。(2)石灰石样品的纯度。
15.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下。
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束?________________。
(2)结合表格分析,影响化学反应快慢的因素是________________。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
参考答案
1.(1)设:10克鸡蛋壳中含有CaCO3的质量是x。根据:100/x=44/3.96g
可得:x=9gCaCO3%=9g/10g=0.9=90%(2)A。
2.(1)4.8 (2)设氯酸钾的质量为x,生成氯化钾的质量为y,
2KClO3=2KCl+3O2↑
245 149 96
x y 4.8
245/x=96/4.8 149/y=96/4.8解得:x=12.25g,y=7.45g
(3)解:氯化钾溶液的质量:7.45g/10%=74.5g
3.(1)化学性质;质量(2)12.25g(3)1.6g
4.(1)44.4 (2)88.3% (3)7.8%
5.
6.(1)4.4
(2)解:设CaCO3的质量为x。
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 4.4g
100/44=x/4.4g x=100×4.4g/44=10g
大理石样品中CaCO3的质量分数=10g/12.5g×100%=80%
答:大理石样品中CaCO3的质量分数为80%。
7.(1)增大接触面积,使反应更充分。无。
(2)二氧化碳质量为340g-336.7g=3.3g设碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 3.3g
x=7.5g碳酸钙的质量分数为=7.5g/10g×100%=75%
8.(1)图略(2)偏大
(3)解:设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 1.1g
100/44=x/1.1g x=2.5g CaCO3%=2.5g/5g×100%=50%
9.解:(1)1.92
(2)设原混合物中KClO3的质量为x
2KClO3===2KCl+3O2↑
245 96
x 1.92g
245/96=x/1.92g x=4.90g
原混合物中KClO3的质量分数是:4.90g/6.00g×100%≈81.7%
答:原混合物中KClO3的质量分数是81.7%。
10.(1)电子天平质量不变(或不再产生气泡)(2)反应物的接触面积(3)83%
11.(1)锥形瓶内不再产生气泡。(2)大。
(3)设发生反应的CaCO3的质量是x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.20克
100/x=44/2.20g x=5g
答:块状大理石中有5g碳酸钙与稀盐酸发生了反应。
12.(1)质量守恒
(2)解:CO2的质量:270克-265.6克=4.4克
设补钙剂中CaCO3的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
100:44=x:4.4g x=10g
(3)没有影响
13.(1)100;0.14
(2)解:0.124克的白磷充分燃烧,至少需要氧气质量为x
4P + 5O2 =点燃====2P2O5
124 160
0.124g X
124/160=0.124g/X X=0.16 克
(3)足够。因为0.124 克的白磷充分燃烧,至少需要氧气0.16 克,而瓶内氧气只有0.14 克,所以0.124克的白磷充分燃烧能将瓶内氧气消耗完。
14.3.3克;83.3%
15.(1)容器内不再产生气泡(或电子天平示数不再改变)
(2)反应物之间的接触面积
(3)解:设块状大理石中有x克碳酸钙与稀盐酸发生了反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
100:44=x: 2.2 克
x=5 克
有关化学方程式的计算(1)
(1)若产生的气体全部是鸡蛋壳中的碳酸钙与稀盐酸反应生成的CO2,根据实验结果计算出该鸡蛋壳中碳酸钙的质量分数(假定鸡蛋壳中其它成分不含钙元素,写出具体计算过程)。
(2)下列哪些情况会导致实验中钙元素质量分数测量结果偏大 _______(选填字母)。
A. 盐酸溶质质量分数过大 B.鸡蛋壳未晾干 C.鸡蛋壳未充分研碎
2.取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:
(1)生成氧气的质量是________克;
(2)参加反应的氯酸钾的质量是多少克?(写出具体计算步骤)
(3)氯化钾溶液的质量是多少克?(写出具体计算步骤)
3.实验室有一瓶含杂质的氯酸钾。取氯酸钾样品16.45g和一定质量二氧化锰混和加热(杂质不参加反应,不含氧元素),充分反应后测得剩余固体质量为16g,生成氧气4.8g。
(1)二氧化锰为该反应的催化剂,反应前后二氧化锰的__________和__________均没有发生改变;
(2)求样品中氯酸钾的质量:
(3)求剩余固体中氧元素的质量。
4.超市卖的纯碱产品中往往会含有少量的氯化钠,化学兴趣小组的同学要通过实验来测定某品牌的纯碱样品中Na2CO3的质量分数。他们取了6g纯碱样品放入烧杯中,再将80g一定溶质质量分数的稀盐酸分4次加入该烧杯中,充分反应后测得实验数据如下表(不考虑CO2溶解于水)。(计算结果精确到0.1%)
(1)表格中m的值为__________。
(2)样品中Na2CO3的质量分数是多少?
(3)第四次实验后所得溶液中NaCl的质量分数是多少?
5.长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和其它杂质(其它杂质与盐酸反应不产生气体)。为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生气体的质量情况如图所示。
(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是 g。
(2)水垢中碳酸钙的质量分数是多少?(列式计算)
6.小乐利用图示实验装置测定某大理石样品的纯度(所含杂质不与盐酸反应,且不溶于水)。她取了该大理石样品12.5g,并加入足量稀盐酸进行实验。实验数据记录如下表:
(1)反应共生成CO2的质量为_______g。
(2)计算该大理石样品中CaCO3的质量分数。(写出计算过程)
7.为测定某钙片中碳酸钙的质量分数(钙片中其他成分不参与反应),小乐取10g钙片研磨后,进行了如图所示的实验(忽略水分蒸发)。回答下列问题:
(1)研磨钙片的目的是_____________。该实验中,装置的气密性对测定结果__________(选填“有”或“无”)影响。
(2)计算该钙片中碳酸钙的质量分数。(写出计算过程)
8.鸡蛋壳中的主要成分是碳酸钙(其它杂质不溶于水也不与稀盐酸反应),某同学想利用反应产生的二氧化碳来测出鸡蛋壳中碳酸钙的质量分数,进行了如下实验。利用气密性良好的图甲装置进行实验:
①将鸡蛋壳洗净、干燥并捣碎后,称取5g,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入除去CO2的空气;②一段时间后打开分液漏斗活塞,滴加足量的稀盐酸,刚滴加稀盐酸时就开始计时;③进入吸收装置的CO2气体被氢氧化钠溶液完全吸收。
根据实验数据绘制了图乙,曲线a、b分别表示锥形瓶中和吸收装置中物质质量的增加量随反应时间变化的情况。
(1)请将吸收装置中的导管补充完整。
(2)如果发生装置中气泡停止产生时立即停止鼓入除去CO2的空气,会导致测得的碳酸钙的质量分数____________。(填“偏大”、“不变”或“偏小”)
(3)鸡蛋壳中碳酸钙的质量分数为多少?(要有计算过程)
9.小乐在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量变化如图所示,回答问题:
(1)制取氧气的质量是__________g。
(2)原混合物中氯酸钾的质量分数。(写出计算过程,计算结果精确到0.1%)
10.为研究影响化学反应快慢的因素,某同学选取成分相同的粉末状大理石、块状大理石两种样品各6克,分别为足量的、溶质质量分数相同的稀盐酸在锥形瓶中反应(样品中杂质不与稀盐酸反应),实验装置如图所示实验中每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳质量,数据记录见下表:
(1)实验过程中,判断反应结束的现象是_____________________。
(2)分析数据可知影响反应快慢的因素有_____________________。
(3)该大理石样品中含碳酸钙的质量分数是多少?(写出计算过程)
11.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下。
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束?_____________。
(2)结合表格分析,固体反应物的接触面积越________(选填“大”“小”)反应越快。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
12.某补钙剂的主要成分是碳酸钙。为测定补钙剂中钙的含量,取15克补钙剂样品,加入足量的稀盐酸后,质量变化如图。假设产生的二氧化碳全部逸出,且不考虑水分和酸液的蒸发,补钙剂中其余杂质不参与反应。请回答。
(1)可利用_________定律求出反应后生成C02的质量。
(2)该样品中碳酸钙的质量。(请列式计算)
(3)若装置的气密性不好,则补钙剂中钙元素含量的测定结果将_________(填“偏大”、“偏小”“没有影响”)。
13.在燃烧匙中放入足量的白磷,用如图所示装置来测量空气中氧气含量。集气瓶容积为600mL,集气瓶内水的体积为100mL,实验开始前量筒中的水体积为200mL,实验结束后量筒中水的体积为100mL。
(1)根据实验结果,测得集气瓶内原有氧气体积是_______mL,其质量为_______克。(已知氧气密度为1.4g/L)。
(2)若有0.124克的白磷充分燃烧,至少需要氧气多少克?
(3)上述实验中,若燃烧匙中放入0.124克的白磷是否足够?说明理由。
14.小明同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
试求:(1)m的值为__________g。(2)石灰石样品的纯度。
15.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下。
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束?________________。
(2)结合表格分析,影响化学反应快慢的因素是________________。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
参考答案
1.(1)设:10克鸡蛋壳中含有CaCO3的质量是x。根据:100/x=44/3.96g
可得:x=9gCaCO3%=9g/10g=0.9=90%(2)A。
2.(1)4.8 (2)设氯酸钾的质量为x,生成氯化钾的质量为y,
2KClO3=2KCl+3O2↑
245 149 96
x y 4.8
245/x=96/4.8 149/y=96/4.8解得:x=12.25g,y=7.45g
(3)解:氯化钾溶液的质量:7.45g/10%=74.5g
3.(1)化学性质;质量(2)12.25g(3)1.6g
4.(1)44.4 (2)88.3% (3)7.8%
5.
6.(1)4.4
(2)解:设CaCO3的质量为x。
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 4.4g
100/44=x/4.4g x=100×4.4g/44=10g
大理石样品中CaCO3的质量分数=10g/12.5g×100%=80%
答:大理石样品中CaCO3的质量分数为80%。
7.(1)增大接触面积,使反应更充分。无。
(2)二氧化碳质量为340g-336.7g=3.3g设碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 3.3g
x=7.5g碳酸钙的质量分数为=7.5g/10g×100%=75%
8.(1)图略(2)偏大
(3)解:设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 1.1g
100/44=x/1.1g x=2.5g CaCO3%=2.5g/5g×100%=50%
9.解:(1)1.92
(2)设原混合物中KClO3的质量为x
2KClO3===2KCl+3O2↑
245 96
x 1.92g
245/96=x/1.92g x=4.90g
原混合物中KClO3的质量分数是:4.90g/6.00g×100%≈81.7%
答:原混合物中KClO3的质量分数是81.7%。
10.(1)电子天平质量不变(或不再产生气泡)(2)反应物的接触面积(3)83%
11.(1)锥形瓶内不再产生气泡。(2)大。
(3)设发生反应的CaCO3的质量是x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.20克
100/x=44/2.20g x=5g
答:块状大理石中有5g碳酸钙与稀盐酸发生了反应。
12.(1)质量守恒
(2)解:CO2的质量:270克-265.6克=4.4克
设补钙剂中CaCO3的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
100:44=x:4.4g x=10g
(3)没有影响
13.(1)100;0.14
(2)解:0.124克的白磷充分燃烧,至少需要氧气质量为x
4P + 5O2 =点燃====2P2O5
124 160
0.124g X
124/160=0.124g/X X=0.16 克
(3)足够。因为0.124 克的白磷充分燃烧,至少需要氧气0.16 克,而瓶内氧气只有0.14 克,所以0.124克的白磷充分燃烧能将瓶内氧气消耗完。
14.3.3克;83.3%
15.(1)容器内不再产生气泡(或电子天平示数不再改变)
(2)反应物之间的接触面积
(3)解:设块状大理石中有x克碳酸钙与稀盐酸发生了反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
100:44=x: 2.2 克
x=5 克
有关化学方程式的计算(1)
同课章节目录
