北京5年(2018-2022)真题1年模拟化学分类汇编:专题18 探究题(含解析)
文档属性
| 名称 | 北京5年(2018-2022)真题1年模拟化学分类汇编:专题18 探究题(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 835.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-09 07:05:57 | ||
图片预览

文档简介
5年(2018-2022)中考1年模拟化学分项汇编
专题18 探究题
【5年中考真题】
1. (2022北京中考)絮凝剂常用于水的净化,实验小组探究用絮凝剂净水时影响净化效果的因素。
【查阅资料】絮凝剂溶于水后能够吸附水中悬浮物并发生沉降,从而达到净水目的。硫酸铁是一种常见的絮凝剂。
【进行实验】
Ⅰ.配制水样和絮凝剂溶液
配制水样:向10L水中加入25g高岭土,搅拌、静置,取上层液作为水样。
配制絮凝剂溶液:用100mL水和5g硫酸铁进行配制。
Ⅱ.探究影响水样净化效果的因素
取水样,向其中加入絮凝剂溶液,搅拌,测定静置不同时间水样的浊度,并计算浊度去除率(浊度去除率越高代表净化效果越好)。实验记录如下:
实验序号 水样的体积/mL 加入絮凝剂溶液的体积/mL 静置时间/min 浊度去除率/%
① 200 0 20 12.48
② 200 0.2 20 76.54
③ 200 0.3 20 84.60
④ 200 0.4 5 64.45
⑤ 200 0.4 10 70.85
⑥ 200 0.4 15 81.04
⑦ 200 0.4 20 86.02
⑧ 200 0.5 20 88.15
⑨ 200 0.6 20 86.49
【解释与结论】
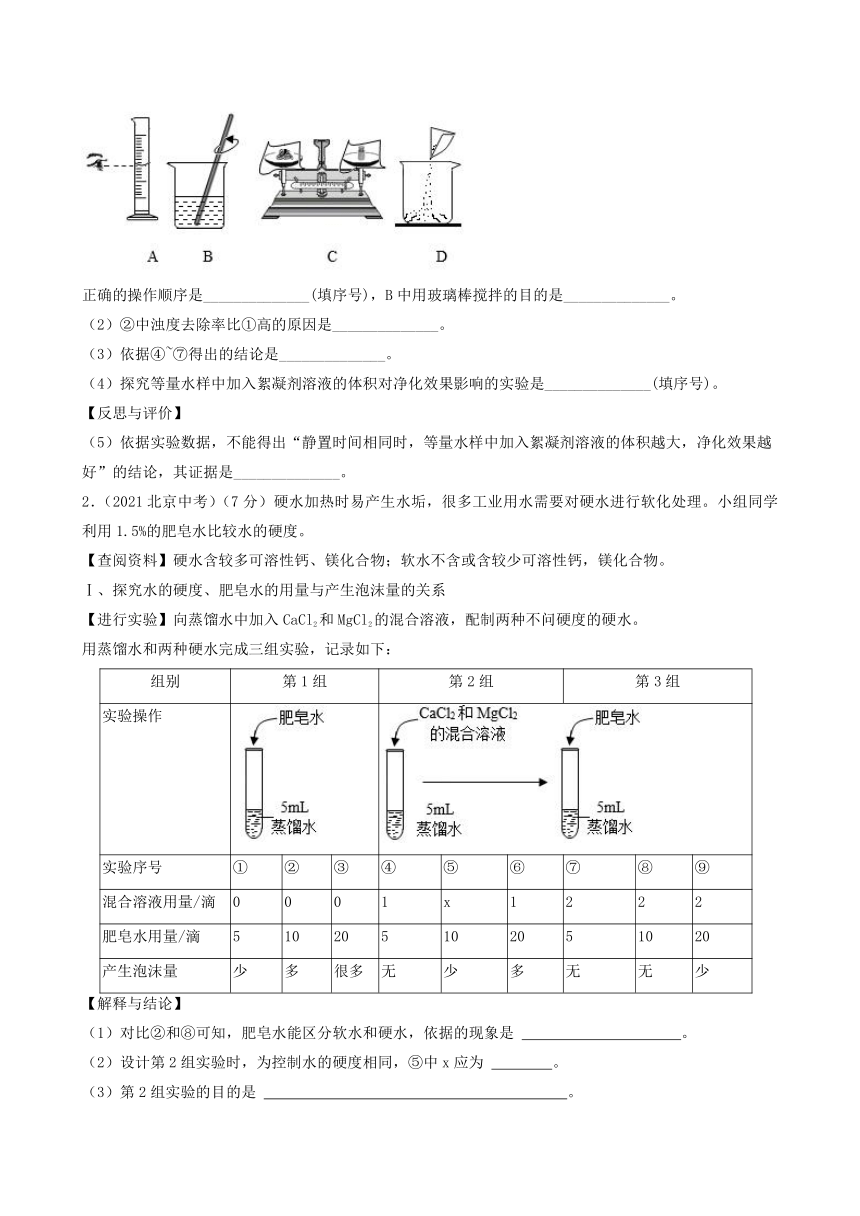
(1)配制絮凝剂溶液的操作如下图所示。
正确的操作顺序是______________(填序号),B中用玻璃棒搅拌的目的是______________。
(2)②中浊度去除率比①高的原因是______________。
(3)依据④~⑦得出的结论是______________。
(4)探究等量水样中加入絮凝剂溶液的体积对净化效果影响的实验是______________(填序号)。
【反思与评价】
(5)依据实验数据,不能得出“静置时间相同时,等量水样中加入絮凝剂溶液的体积越大,净化效果越好”的结论,其证据是______________。
2.(2021北京中考)(7分)硬水加热时易产生水垢,很多工业用水需要对硬水进行软化处理。小组同学利用1.5%的肥皂水比较水的硬度。
【查阅资料】硬水含较多可溶性钙、镁化合物;软水不含或含较少可溶性钙,镁化合物。
Ⅰ、探究水的硬度、肥皂水的用量与产生泡沫量的关系
【进行实验】向蒸馏水中加入CaCl2和MgCl2的混合溶液,配制两种不问硬度的硬水。
用蒸馏水和两种硬水完成三组实验,记录如下:
组别 第1组 第2组 第3组
实验操作
实验序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
混合溶液用量/滴 0 0 0 1 x 1 2 2 2
肥皂水用量/滴 5 10 20 5 10 20 5 10 20
产生泡沫量 少 多 很多 无 少 多 无 无 少
【解释与结论】
(1)对比②和⑧可知,肥皂水能区分软水和硬水,依据的现象是 。
(2)设计第2组实验时,为控制水的硬度相同,⑤中x应为 。
(3)第2组实验的目的是 。
(4)由上述三组实验得到的结论是 。
Ⅱ、比较不同水样的硬度
【进行实验】用四种水样完成实验,记录观察到泡沫产生时所需肥皂水的用量。
实验操作 水样 肥皂水用量/滴
市售纯净水 2
煮沸后的自来水 6
自来水 9
湖水 14
【解释与结论】
(5)硬度最大的水样是 。
(6)由上述实验可知,能将自来水硬度降低的方法有 。
(7)继续实验,发现山泉水的硬度大于自来水的硬度,其实验方案为 。
3.(2020北京中考)丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
I.探究丙酸钙的性质
进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
序号 ① ②
装置
现象 试管内壁有水雾 注入酸后,有气泡产生,石灰水变浑浊
【解释与结论】
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为________。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是_______。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
组别 第1组 第2组
序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
配方 面粉/ g 50 50 50 50 50 50 50 50
酵母/ g 0.75 0.75 0.75 0.75 0.75 0.75 0.75 0.75
蔗糖/ g 0 0 0 0 5 5 x 5
丙酸钙/g 0 0.06 0.10 0.15 0 0.06 0.10 0.15
开始发霉时间 第3天 第4天 第5天 第6天 第3天 第4天 第5天 第6天
【解释与结论】
(3)设计第1组实验的目的是____。
(4)第2组,⑦中x为_______。
(5)对比第1组、第2组实验可得到的结论是______。
【反思与评价】
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:_____。
4.(2019北京中考)下图“黑面包”实验中,蔗糖(C12H22O11)变黑,体积膨胀,变成疏松的炭,放出有刺激性气味的气体。
【提出问题】改变糖的种类、浓硫酸的体积、水的滴数和温度是否会影响实验效果呢
【进行实验】分别取5g糖粉进行实验,根据前2min的现象对实验效果进行评分,
记录如下:
表1实验记录
实验 糖 浓硫酸体积/mL 水的滴数 温度/℃ 效果得分
1 蔗糖 4 5 22 65
2 蔗糖 5 10 30 81
3 蔗糖 6 15 50 93
4 冰糖 4 10 50 91
5 冰糖 5 15 22 88
6 冰糖 a 5 30 75
7 葡萄糖 4 15 30 0
8 葡萄糖 5 5 50 0
9 葡萄糖 6 10 22 0
【处理数据】分析表1,计算效果得分均值,结果如下:
表2效果得分均值
因素 糖 浓硫酸体积/mL 水滴数 温度/℃
蔗糖 冰糖 葡萄糖 4 5 6 5 10 15 22 30 50
均值 79.7 84.7 0 52.0 56.3 56.0 46.7 57.3 60.3 51.0 52.0 61.3
依据均值推断最佳实验方案,均值越高,效果越好。
【解释与结论】
(1)蔗糖变成黑色的炭,发生了_____________(填“物理”或“化学”)变化。
(2)推测放出的气体含SO2,从元素守恒角度说明理由:________________________________。
(3)实验6中,a为_____________mL。
(4)根据表2推断,“黑面包”实验最好选择5g冰糖、5mL浓硫酸、_____滴水和50℃
【反思与评价】
(5)表2中,22℃对应的均值为51.0,计算该值所依据的3个数据分别是_____________________。
(6)综合分析,使实验3的效果得分高于实验4的因素有________________________________。
5.(2018北京中考)为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+ H2SO4 = CuSO4 + H2O + Cu
【进行实验】
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 1-1 1-2
装置
反应后物质的颜色、状态 黑色粉末中混有少量红色固体 红色固体有金属光泽,混有极少量,黑色物质
实验2:取一定量的混合物,用1—2装置进行实验。
序号 木炭粉与氧化铜质量比 反应后物质的颜色、状态
2-1 1:9 红色固体有金属光泽 混有少量黑色物质
2-2 1:10 混有很少量黑色物质
2-3 1:11 混有极少量黑色物质
2-4 1:12 无黑色物质
2-5 1:13 混有较多黑色物质
【解释与结论】
(1)配平化学方程式: ___ C+ ___ CuO高温___ Cu+ ___ CO2↑。
(2)实验1—2中,证明产生CO2的现象是 _______________________ 。
(3)实验1的目的是 __________ 。
(4)实验2的结论是 _____________ 。
【反思与评价】
(5)实验2没有进行质量比为1:14的实验,理由是 ________________ 。
(6)为检验2—4的红色固体中是否含Cu2O,所需试剂是 __________ 。
【1年模拟题】
1. (2022北京大兴二模)实验小组同学对铁生锈的条件和影响因素进行探究。
【进行实验】
实验1:如下图所示进行实验,一段时间后观察到C中铁钉生锈,A、B中铁钉无明显变化。
实验2:为进一步探究影响铁生锈速率的因素,小组同学设计如图所示实验,利用传感器监测过程中氧气浓度的变化来判断铁生锈的情况。
实验记录如下:
序号 其他试剂 初始时氧气浓度/% 200s时氧气浓度/%
水/滴 食盐质量/g 稀醋酸/滴
① 0 0 0 20.8 20.8
② 10 0 0 20.8 15.2
③ 10 0 5 20.8 12.7
④ 10 1.0 0 20.8 8.0
【解释与结论】
(1)铁生锈属于______(填“物理变化”或“化学变化”)。
(2)由实验1能得出“与H2O接触是铁生锈条件之一”的结论,依据的实验现象是______。
(3)实验2,①中200s时氧气浓度没有发生变化的原因是______。
(4)由实验2得出“食盐能加速铁生锈”结论,依据的实验是______(填序号)。
(5)实验2,设计②③的目的是______。
【反思与评价】
(6)小明欲进一步探究NaOH稀溶液对铁生锈速率是否有影响,他又补充设计了如下实验:
其他试剂 初始时氧气浓度/% 200s时氧气浓度/%
水/滴 食盐质量/g 稀醋酸/滴 NaOH稀溶液/滴
5 20.8
该实验中水、食盐、稀醋酸的量分别是______。
2. (2022北京朝阳一模)化学小组对市售“茶垢清洁剂”进行如下探究。
【查阅资料】
①使用方法:将“茶垢清洁剂”粉末倒入容器中,加入50℃~70℃的水,浸泡10分钟,清水冲洗即可。
②过碳酸钠是常用的洗涤助剂。它是白色固体,溶于水时分解生成碳酸钠和过氧化氢。
实验1:验证“茶垢清洁剂”的主要成分是过碳酸钠
【进行实验】在分液漏斗a中加入新配制的“茶垢清洁剂”的饱和溶液。
实验装置 实验步骤 实验现象 实验结论
Ⅰ.打开分液漏斗a的活塞,加入适量溶液后,关闭活塞,然后_______。 产生大量气泡,带火星的木条复燃 “茶垢清洁剂”的主要成分是过碳酸钠
Ⅱ.待Ⅰ中反应停止后,打开分液漏斗b的活塞,加入适量溶液后,关闭活塞,将生成的气体通入澄清石灰水。 产生大量气泡,澄清石灰水变浑浊
【解释与结论】
(1)步骤I,关闭活塞后进行的实验操作是_______,产生大量气泡的化学方程式为_______。
(2)步骤Ⅱ,分液漏斗b中的液体是_______,依据步骤Ⅱ的现象得出的结论是_______。
实验2:探究影响过碳酸钠去茶渍效果的因素
【进行实验】25℃时,取洗碗基料15g于洗碗机中,分别加人不同质量的过碳酸钠,按照不同洗涤模式对具有相同茶渍的茶杯进行洗涤,洗涤后根据去茶渍效果打分,分数越高效果越好,记录如下:
组别 第1组(常规洗涤模式) 第2组(快洗模式)
实验序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
过碳酸钠用量/g 0 1 2 3 0 1 2 3
水的硬度/mg·kg 250 250 250 250 250 250 250 250
pH 11 11 11 11 11 11 11 11
去茶渍效果打分 2 5 7 9 2 4 6 8
【解释与结论】
(3)对比②和⑥可知,常规洗涤模式比快洗模式去茶渍效果好,依据是_______。
(4)第1组实验的目的是_______。
(5)生活中碳酸钠也是常用洗涤剂。继续实验,发现碳酸钠比过碳酸钠去茶渍效果差,其实验方案是:在25℃、水的硬度为250mg·kg-1、pH为11的条件下,取洗碗基料15g于洗碗机中,加入2g碳酸钠,_______。
3. (2022北京丰台一模)食品脱氧剂主要成分有铁粉、活性炭、氯化钠,发生脱氧反应消耗食品包装袋内的氧气延长食品保质期。实验小组探究脱氧反应发生条件和影响脱氧反应速率的因素。
实验一 探究脱氧反应发生条件
按图1所示装置进行实验,利用氧气传感器测定密闭容器中氧气含量变化,如图2所示。
(1)结合图2分析,集气瓶②中铁粉发生脱氧反应的依据是______。
(2)实验一得出的结论是发生脱氧反应需要铁粉与氧气和______同时接触。
实验二 探究氯化钠、活性炭用量对脱氧反应速率的影响
室温下,利用5g铁粉和10滴水,改变活性炭和氯化钠的用量(见下表),用氧气传感器测定密闭容器中氧气含量变化,实验结果如图3、图4所示。
实验编号 铁粉/g 活性炭/g 氯化钠/g
1 5 0 1
2 5 0.75 0
3 5 0.75 1
4 5 1.5 1
5 5 a 2
(3)实验5中,a=______。
(4)实验1、3、4的目的是______。
(5)结合图4,对比实验2、3、5可以得到的结论是______。
实验三 探究硅藻土的用量对脱氧反应速率的影响
脱氧剂中还经常添加硅藻土,主要作用是吸附水分, 同时疏松配料,使铁粉更易于与氧气接触。室温下,在一定量的脱氧剂中加入不同质量的硅藻土,测定密闭容器中氧气耗尽所需时间,如图5所示。
(6)由图5可知,硅藻土用量和氧气耗尽所需时间的关系是______。
(7)结合以上实验分析,脱氧剂的反应速率还可能受哪些因素影响______(写出一条即可)。
4. (2022北京东城一模)实验小组探究金属与酸的置换反应。
【进行实验】
(1)实验1:向分别盛有Fe片、Cu片的试管中加入稀盐酸。
①Fe与稀盐酸发生反应,化学方程式为______。
②Cu与稀盐酸不反应,原因是______。
(2)实验2:探究Fe与硫酸的反应(Fe片大小相同且已除去表面氧化膜;硫酸溶液体积相等)
序号 药品 现章
① Fe片+硫酸溶液(V浓硫酸:V水=1:2) 快速产生气泡
② Fe片+硫酸溶液(V浓硫酸:V水=1:200) 缓慢产生气泡
③ Fe片+硫酸溶液(V浓硫酸:V水=1:200000) 无气泡产生
①对比实验①和②,可得到的结论是______。
②实验③中没有气泡产生的原因是______。
(3)实验3:探究Cu与浓盐酸的反应
用如下装置进行实验(硫酸溶液与浓盐酸中H+的浓度接近)。
装置 序号 药品 现象
④ 浓盐酸 24小时后仍无明显变化
⑤ Cu粉+硫酸溶液 24小时后得无明显变化
⑥ Cu粉+浓盐酸 24小时后气球变鼓
【解释与结论】
① ④是对照实验,目的是排除______的干扰。
② 点燃⑥中气球内的气体,发出爆鸣声,则⑥中气球变鼓是因为生成了______;经检测,⑥反应后的溶液中主要成分是H3CuCl4。
【反思与评价】
③综合以上实验,请写出你对金属与酸的置换反应的新认识______。
5. (2022北京房山二模)食用油是厨房中常见的食材,小组同学针对食用油的变质问题进行了探究。
【查阅资料】
①食用油不易溶于水,能溶于酒精和醋酸中。白酒和白醋的主要成分分别为酒精和醋酸。
②食用油变质后产生的过氧化物可使碘化钾淀粉试纸由白色变为蓝色。
Ⅰ.检验食用油是否变质
【进行实验】
ⅰ.空白对照组
实验操作 试剂 现象
52°白酒 碘化钾淀粉试纸不变色
白酷 碘化钾淀粉试纸不变色
ⅱ.对比实验组
实验操作
实验序号 1-1 1-2 1-3 1-4 1-5 1-6
溶剂 52°白酒 52°白酒 52°白酒 白醋 白醋 白醋
油样 新油 过期油 煎炸过的老油 新油 过期油 煎炸过的老油
现象 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸变为蓝色 碘化钾淀粉试纸轻微变蓝
【解释与结论】
(1)食用油中常含有 C18H34O2、C18H32O2、C16H32O2等,这些物质的相同点是_______ (写出一点即可)。
(2)依据空白对照组可知,用 52°白酒和白醋作溶剂 _____(填“会”或“不会”)影响实验结果。
(3)由对比实验组可知,适宜的溶剂为 _______。
(4)经上述实验检验,已经发生变质的是_____(填序号)。
A. 新油 B. 过期油 C. 煎炸过的老油
Ⅱ.去除食用油中过氧化物的方法
【进行实验】
实验方法 2-1隔绝氧气自降解法 2-2还原降解法
实验操作 在隔绝氧气条件下,取四份相同体积、不同温度的食用油,分别恒温放置,每隔一段时间测定油样的过氧化值。 30℃时,取若干份相同体积的食用油,添加不同质量的还原剂(半胱氨酸),测定油样的过氧化值。
实验结果
【解释与结论】
(5)设计实验 2-1 的目的是_______。
(6)由实验 2-2 得到的结论是______。
【反思与评价】
(7)根据上述实验,请从食用油的加工、储存或使用等方面,提出一条合理建议:______。
6. (2022北京丰台二模)“固体酒精”是乙醇、硬脂酸、NaOH 混合而成的一种燃料,同学们对制备“固体酒精”的最佳反应条件进行了探究。
【查阅资料】制备“固体酒精”的工艺流程如下:
实验 1 探究加料方式对制备“固体酒精”的影响
一定温度下,乙醇、硬脂酸、NaOH 用量相同时,用不同的加料方式进行实验,实验现象记录如下:
实验序号 ① ② ③
加料方式 硬脂酸和NaOH同时加入乙醇 先将硬脂酸溶于乙醇,再加入NaOH 将硬脂酸和NaOH分别充分溶于2份乙醇后,再混合
完全溶解所需时间 60min 45min 30min
实验 2 探究制备“固体酒精”的最佳温度
在不同温度下,乙醇、硬脂酸、NaOH 用量相同时,用最佳加料方式进行实验,实验现象记录如下:
实验序号 温度/℃ 现象
④ 30 混合后立即生成“固体酒精”,产品不能混合均匀
⑤ 40 混合后立即生成少量“固体酒精”,产品局部混合不均匀
⑥ 60 混合后不立刻生成“固体酒精”,可以混合均匀
实验 3 探究硬脂酸的含量对“固体酒精”燃烧时凝固性能的影响
在最佳温度下,用最佳加料方式进行实验制备“固体酒精”并点燃,实验现象记录如下:
实验序号 乙醇/g 硬脂酸/g 氢氧化钠/g 燃烧现象
⑦ 96 3 1 熔化流淌
⑧ 93 6 1 少量熔化流淌
⑨ X 6.5 1 不熔化流淌
【解释与结论】
(1)硬脂酸与氢氧化钠混合后发生如下化学反应,补全化学方程式:______。
(2)在较高温度下,上述反应生成硬脂酸钠(C17H35COONa)均匀地分散在乙醇中,冷却后形成“固体酒精”。由此可知,“固体酒精”______固态乙醇(填“是”或“不是”)。
(3)实验 1 中,③为最佳加料方式的依据是______。
(4)实验 2 中,生成“固体酒精”过快,会导致产品均匀性较差,因此制备“固体酒精”的最佳温度是______
(5)实验⑨,x=______。
(6)实验 3,对比实验⑦~⑨得出的结论是______。
(7)下列关于“固体酒精”的说法正确的是______(填字母序号)。
A.“固体酒精”燃烧时保持固体状态提高了其使用时的安全性
B.“固体酒精”的优点之一是便于运输、携带
C.评价“固体酒精”的优劣还需考虑燃烧时长和热值
D.评价“固体酒精”的优劣还需考虑燃烧时是否产生黑烟异味
7. (2022北京海淀二模)碱式碳酸铜〔Cu2(OH)2CO3〕是孔雀石的主要成分,主要用于生产油漆、颜料等。兴趣小组探究碱式碳酸铜制备的最佳实验条件。
【查阅资料】碱式碳酸铜是翠绿色、难溶于水的固体,酸性条件下不稳定。
【进行实验】按下表中的数据进行图示实验,记录实验结果。
序号 CuSO4溶液体积/mL Na2CO3溶液体积/mL 水浴温度/℃ 固体颜色
i 50 60 60 蓝绿
ii 50 60 70 翠绿
iii 50 60 80 暗绿
iv 50 70 70 蓝绿
v 50 50 x 蓝绿
【解释与结论】
(1)为了使生成的碱式碳酸铜稳定,实验过程中需保持反应体系的pH___________7(填“<”或“>”)。
(2)ii、iv、v的目的是探究制备碱式碳酸铜时CuSO4溶液与Na2CO3溶液最佳配比,x=___________。
(3)设计i~iii的目的为___________。
(4)由表中数据知,制备碱式碳酸铜的最佳实验条件是___________。
【反思与评价】
(5)iii中所得固体颜色偏暗。查阅资料知碱式碳酸铜受热分解会生成CuO,猜想颜色变暗的原因与该反应有关。
①请将碱式碳酸铜分解反应的化学方程式补充完整:___________
②利用如图装置进行实验证明上述猜想。请在图中将实验方案补充完整___________、___________、___________,并说明:若出现___________的现象,则该猜想成立。
8. (2022北京门头沟二模)阅读下面科普短文。
84消毒液是一种以次氯酸钠(NaClO)为主要成分的高效消毒剂,广泛应用于杀灭细菌、病毒并抑制其传播,起到预防疾病的作用。1984年,北京第一传染病医院(地坛医院的前身)研制成功能迅速杀灭各类肝炎病毒的消毒液,定名为“84”肝炎洗消液,后更名为“84消毒液”。由于其消毒效果理想、价格低廉、使用方便,且具有广谱、高效的杀菌特点,深受大家的欢迎。84消毒液通常为无色或淡黄色液体,pH在12左右,有刺激性气味,有效氯含量为1.0%至6.5%不等。由于其有一定的刺激性和腐蚀性,浓度过高会损害呼吸道,危害身体健康,所以必须稀释后才能使用。一般认为,当杀菌率达到90%以上时,说明此时的消毒具有较好效果。表1、图1为某学校喷洒不同浓度的84消毒液,对教室进行消毒后的效果比较。
表1 不同浓度的84消毒液对教室的消毒效果
班级 一班 二班 三班 四班 五班 六班 七班 八班
喷洒消毒液的浓度(消毒液与水的体积比) 1:50 1:100 1:150 1:200 1:300 1:600 1:1000 作为对照不喷洒消毒液
菌落数 ① 2 2 4 6 10 19 45 53
② 3 3 5 4 11 18 42 50
③ 1 3 4 5 12 19 43 48
平均值 2 2.67 4.33 5 11 18.67 43.33 50.33
84消毒液除了具有腐蚀性,其使用过程中放出的氯气是一种有毒气体,有可能引起中毒。氯气主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,造成呼吸困难。症状重时,会发生肺水肿而致死亡。室内使用84消毒液后,可开窗通风一段时间。由于在酸性较高的条件下更易生成氯气,所以禁止将84消毒液与酸性物质混用,也不建议把84消毒液与洗涤剂或其他消毒液混合使用。84消毒液在日常生活中发挥着重要作用,我们要了解它的成分和原理,才能合理安全地使用。依据文章内容回答下列问题。
(1)84消毒液呈______(填“酸性”、“碱性”或“中性”)。
(2)84消毒液的物理性质为______(写一条即可)。
(3)结合表1和图1数据,关于不同浓度的84消毒液与其消毒效果可得到的结论为______。
(4)若想达到较好的消毒效果,同时又减少其对身体和环境的影响,学校喷洒消毒液浓度的最适合范围为______(填字母序号,下同)。
a.1:50~1:100 b.1:100~1:200 c.1:200~1:600 d.1:600~1:1000
(5)下列说法不正确是______。
A、浓度为1:1000的84消毒液不具有消毒效果
B、84消毒液可与洁厕灵(主要成分为HCl)混用
C、84消毒液名称由来是因为其中有效氯含量为84%
D、教室使用84消毒液消毒后,建议开窗通风一段时间
9. (2022北京海淀二模)维生素 C 又称抗坏血酸,是一种重要的营养物质。兴趣小组进行维生素 C 相关的化学实验。
实验一:验证维生素C具有酸的性质
序号 操作 现象
a 向 2 mL 维生素 C 溶液中加入紫色石蕊溶液 溶液变成 色
b 向 2 mL 维生素 C 溶液中加入少量 NaHCO3 粉末 粉末消失,有气泡生成
(1)a 中的现象为溶液变成____色。
(2)b 中生成的气体是____。
实验二:探究不同烹饪方法对苹果中维生素C含量损失的影响
资料:
维生素 C 能和 KMnO4 溶液反应使之褪色,可利用该反应检测维生素 C 含量。研究表明,苹果中其他成分不影响检测。
进行下图所示实验,每次实验所用苹果片相同,实验记录如下表。
模拟烹 调方法 常温放置 糖拌(常温下加入 5 g 白糖,搅拌后放置) 炖(放入70℃水中) 煮(放入100℃水中)
处理时间 30 min 30 min 20 min 40 min 20 min 40 min
混合液色度 1 4 1 3 2 4
注:混合液色度越大,维生素 C 含量损失越大。
(3)糖拌时,维生素 C 含量损失_____(填“大”或“小”)。
(4)对比“炖”和“煮”的实验数据,得到结论:____。
(5)继续探究实验二中糖拌导致维生素 C 含量下降的原因。
①甲同学对比常温放置和糖拌中的物质,提出猜想:____和维生素 C 反应,导致苹果中维生素 C 含量下降。
②乙同学发现糖拌时有较多汁液渗出,猜测维生素 C 随汁液渗出是导致固体中维生素 C含量下降的原因。并通过实验证实了渗出液中含维生素 C,他的实验是:
步骤 1.常温下,向 5 mL 水中加入 5 g 白糖,溶解,放置 30 min,加入 10 mL 0.1% KMnO4 溶液,测定混合液色度略大于 4。
步骤 2.常温下,收集糖拌苹果片放置 30 min 后的全部渗出汁液,加水稀释至 5 mL,____。
10. (2022北京门头沟二模)兴趣小组用稀盐酸除去铁钉表面的铁锈(主要成分是Fe2O3),发现反应开始时铁锈消失,有气泡产生,溶液颜色为黄色,一段时间后变为浅绿色。
【查阅资料】FeCl3的溶液呈黄色
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
实验编号 实验1-1 实验1-2 实验1-3
实验操作
实验现象 长时间放置,溶液颜色始终为黄色 长时间放置,溶液逐渐从黄色变浅绿色 长时间放置,产生红褐色沉淀
(1)用盐酸除铁锈的化学方程式为 _________ 。
(2)实验1-1的目的是 _________ 。
(3)综合分析实验1,溶液从黄色变浅绿色的可能原因是 _________ 。
乙同学用生锈程度相同的锈铁钉、5mL盐酸探究溶液颜色变化的影响因素。
实验编号 所用试剂 实验现象
反应开始时 24h后
2-1 铁锈和2%盐酸 铁锈、溶液均无明显变化 铁锈消失,溶液变黄色
2-2 生锈铁钉和2%盐酸 生锈铁钉、溶液均无明显变化 铁锈消失,溶液变浅绿色
2-3 生锈铁钉和6%盐酸 铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色 溶液变为浅绿色
2-4 生锈铁钉和10%盐酸 铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色 溶液变为浅绿色
(4)生锈铁钉与盐酸反应时,溶液的颜色变化与 ________ 有关。
(5)2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为 ______ 。
(6)基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是 ______ (填字母 序号)。
A 除铁锈时,所用盐酸的浓度越大越好
B 在除锈过程中,生成的FeCl3对铁也有腐蚀作用
C 用盐酸除锈时,应注意控制反应的时间
11. (2022北京密云二模)高纯CO可用于半导体领域某些芯片的刻蚀,利用甲酸(HCOOH)制取高纯CO的主要流程如图:
(1)甲酸中含有___________种元素。
(2)反应器中甲酸发生分解反应,生成一氧化碳和水,写出此反应的化学方程式___________。
(3)同时,反应器中还会发生副反应产生微量的CO2气体,这些CO2是在___________(填写设备名称)中被除去。
12. (2022北京密云二模)以镁矿石(主要成分为MgCO3和SiO2,其中SiO2难溶于水和常见的酸)为原料生产MgO的工艺流程如图,回答问题:
(1)在“酸浸”环节加入过量稀硫酸的目的是___________。
(2)“沉镁”环节物料之间反生了复分解反应: ,“沉镁”后过滤(Ⅱ)所得的滤液中一定不含有硫酸,理由是___________。
(3)“加热”环节,在不同温度下,充分加热等质量的Mg(OH)2,测得如图2是所示容器内剩余固体质量变化情况。“加热”时温度至少要达到350℃,原因是___________。
13. (2022北京密云二模)某兴趣小组对铁生锈的影响因素进行探究。
实验1:探究铁生锈的条件
【进行实验】
如图所示,取三根洁净无锈的铁钉,分别放置在三个不同环境中,一周后观察铁钉生锈情况并记录如下。
实验 A B C
现象 在液面附近,铁钉生锈严重 铁钉无明显变化 铁钉无明显变化
【解释与结论】
(1)对比实验_______(填序号),可以得出铁生锈与水有关。
(2)由上述实验可知,铁生锈的条件是_______。
实验2:探究NaCl溶液的浓度对铁生锈速率的影响
【进行实验】
室温下,取大小、形状相同的光亮铁丝,用下图装置完成实验并记录如下。
实验 编号 烧瓶内液体(用于浸润铁丝)用量 放置不同时间,导管内液面上升高度(cm)
1小时 2小时 3小时
① 2.0mL蒸馏水 0.1 0.7 3.2
② 1.5mL蒸馏水+0.5mL10%NaCl溶液 0.3 1.5 5.0
③ 1.0mL蒸馏水+amL10%NaCl溶液 0.8 3.3 7.9
④ 0.5mL蒸馏水+1.5mL10%NaCl溶液 1.1 4.7 9.1
⑤ 2mL10%NaCl溶液 0 0 0
【解释与结论】
(3)导管内液面上升的原因是_______。
(4)a=_______。
(5)依据实验①~④,可以得出的结论是_______。
【反思与评价】
(6)小组同学重复实验⑤,得到以下数据:
烧瓶内液体(用于浸润铁丝)用量 放置不同时间,导管内液面上升高度(cm)
1小时 2小时 3小时
2mL10%NaCl溶液 1.4 5.7 10.0
则原实验⑤失败的可能原因是_______。
(7)综合上述实验结果,铁制品的防护需尽量避免与水、氧气、_______接触。
14. (2022北京平谷一模)钙是人体所需的重要元素之一、某化学小组用常见的补钙剂进行如下实验。
【查阅资料】
1 白醋的主要成分是醋酸(CH3COOH),可与碳酸钙反应,不与补钙剂中的其他成分反应。
2 ppm常用来表示气体的浓度,数值越大,说明气体的浓度越高。
实验1:验证补钙剂能与白醋反应。
【进行实验】
装置 现象
试管中的固体逐渐减少,有气泡产生,烧杯中烧杯中石灰水变浑浊
【解释与结论】
(1)烧杯中石灰水变浑浊,用化学方程式解释产生这一现象的原因_______。
(2)由此推测补钙剂中的主要成分含有_______。
【小组交流】分组实验中,同学们发现产生气泡的速率不同,于是进行了如下探究。
实验2:探究影响补钙剂与白醋反应速率的因素。
【进行实验】室温条件下进行实验,记录如下:
实验操作 组别 实验 序号 补钙剂形态 白醋中醋酸浓度(g/100 mL) 二氧化碳浓度随 时间的变化曲线
第1组 ① 片状 6
② 片状 3
第2组 ③ 粉末 6
④ 粉末 3
【解释与结论】
(3)设计第1组实验的目的是_______。
(4)上述实验中,反应速率最快的是③,其理由是_______。
【反思与评价】
(5)继续实验,发现温度对该反应速率有影响。进行实验时,需要控制相同的因素是_______(填序号)。
A. 补钙剂的质量 B. 补钙剂形态 C. 温度 D. 白醋的体积 E. 白醋中醋酸浓度
(6)若人体缺少钙元素易患_____病。
A. 骨质疏松 B. 贫血 C. 佝偻病
15. (2022北京石景山二模)实验小组的同学探究不同的配制方法对紫色石蕊溶液显色的影响。
【查阅资料】石蕊能溶于水或乙醇中。
【进行实验1】分别用某品牌的石蕊1g进行4种方法的石蕊溶液配制。
方法 蒸馏水体积/mL 操作 石蕊溶液 溶液颜色
① 100 搅拌,静置1h,过滤 滤液 紫色
② 100 煮沸后过滤 滤液 紫色
③ 100 搅拌,静置24h,过滤 滤液 紫色
④ 50 搅拌,静置24h,过滤 滤液加30mL乙醇,再加蒸馏水稀释至100mL 紫色
【解释与结论】
(1)方法①配制的石蕊溶液中,溶质是______。
(2)方法④中,加蒸馏水稀释至100mL时,加入的蒸馏水体积大于20mL。说明分子具有的性质是______。
【进行实验2】用4种方法配制的石蕊溶液进行显色实验:向被测溶液中滴加石蕊溶液。
被试溶液 方法① 方法② 方法③ 方法④
10%盐酸 红 红 红 浅红
饱和二氧化碳溶液 浅红 浅红 浅红 不明显
饱和碳酸钠溶液 蓝 蓝 蓝 浅蓝
澄清石灰水 蓝 蓝 蓝 浅蓝
【解释与结论】
(3)通过实验可得出饱和碳酸钠溶液呈______(填“酸性”或“碱性”)。
(4)向饱和二氧化碳溶液中滴加石蕊溶液呈浅红色,用化学方程式解释其原因:______。
(5)进行实验2时,需要控制的相同条件是:取用被测溶液的体积相同、______。
【反思与评价】
(6)经实验证明,配制方法④的滤渣中还有较多未溶解的石蕊。实验方案是:向滤渣中加入50mL蒸馏水,______。
(7)用方法④配制的石蕊溶液进行显色实验时现象不明显,原因可能是______。
16. (2022北京石景山一模)含氯消毒剂是常用的消毒剂种类之一。实验室可以利用电解食盐水的稀溶液制备主要成分为次氯酸钠(NaClO)的含氯消毒剂,实验小组对适宜的实验条件进行了如下探究。
【查阅资料】
ⅰ、0.5 g/L(以有效氯含量计)的含氯消毒剂可用于一般物品的消毒。
ⅱ、工业上常用电解饱和食盐水制取氢氧化钠和氯气(Cl2),反应的化学方程式为,Cl2 有刺激性气味。
【进行实验】在烧杯中,电极长度 40 mm、电极间距 10 mm 的条件下,电解 300 mL不同浓度的食盐水,并分别取样测定其有效氯含量,数据结果如下:
实验 食盐水浓度/(g/L) 电压/V 电解时长/min 有效氯含量/(g/L)
1 20 3 150 0.09
2 20 6 150 0.65
3 20 9 150 0.72
4 20 12 150 0.77
5 40 6 20 0.41
6 40 6 40 0.67
7 a 6 80 0.10
8 40 6 150 1.55
9 50 6 150 2.25
【解释与结论】
(1)补全实验室电解食盐水的稀溶液反应的化学方程式:______。
(2)表中 a 的数值为______。
(3)进行实验 1-4 的目的是______。
(4)相同条件下,随着食盐水浓度增大,所得溶液中有效氯含量增大,依据的实验是______(填序号)。
【反思与评价】
(5)实验 9 电解过程中可闻到刺激性气味,其原因可能是______。
(6)在上述实验条件下,依据已有的实验数据分析,制备 0.5 g/L(以有效氯含量计)的含氯消毒剂较为适宜的条件为:电解时长 30 min 左右,食盐水浓度和电压分别为______。
17. (2022北京顺义一模)化学小组的同学在学习了铁生锈的条件后,对暖宝宝的成分(如图1)感到好奇,请参与他们的探究活动。
【查阅资料】
(1)暖宝宝的发热原理是铁粉腐蚀过程中放出热量;加入活性炭能形成微电池,反应更快。
(2)铁的腐蚀分为析氢腐蚀和吸氧腐蚀两种:
①铁在硫酸等酸性条件下发生析氢腐蚀。反应的化学方程式为______。
②铁吸氧腐蚀的总反应为4Fe+3O2+______=4Fe(OH)3,请补全反应的化学方程式。
【提出问题】
哪些因素会影响铁吸氧腐蚀的速率
【设计实验】
小组同学设计了图2所示的实验装置,进行如下5组实验。
【实验记录】
每组实验加入铁炭总质量为24g,食盐水体积为7.5mL,恰好能将固体润湿。
因素 序号 铁炭质量比 食盐水浓度/% 示数差3cm 所用时间/s 10分钟时 温度升高值/oC
1 2:1 26 90 7.8
2 4:1 26 170 4.2
3 6:1 26 190 3.3
4 2:1 13 140 6
5 2:1 6.5 140 6
【解释与结论】
(1)通过实验发现,铁炭质量比对铁吸氧腐蚀速率的影响是______。
(2)分析食盐水浓度对铁吸氧腐蚀速率的影响应对比实验______(填实验序号)。
(3)示数差3cm是指U型管左侧液面上升3cm。U型管内液面向左偏移的原因是______。
【反思与评价】
(1)有同学提出应该再加一组实验,研究铁炭质量比为2:1、食盐水浓度为3.3%时的实验数据,你觉得是否有必要,并说明理由______。
(2)依据上述数据,你认为制作发热贴应选择的原料配比,并说明理由______。
18. (2022北京延庆一模)北京冬奥会期间,各国运动健儿在比赛的同时,足不出村享受着中国美食,而一道道豆腐菜品也征服了各国健儿的胃。豆腐的制作工艺有多种,其中应用盐卤[主要成分氯化镁(MgCl2)]制作豆腐是一种比较成熟的工艺。
Ⅰ.查阅资料:
①豆腐的制作过程为
②氯化镁,无色六角晶体,通常含有六个分子结晶水,即MgCl2·6H2O,易潮解,有一定腐蚀性,加热时失水和氯化氢而成氧化镁。在工业生产、医药、视频等方面有广泛应用。
(1)实验室中,氯化镁的保存方法为_______。
Ⅱ.实验小组利用氯化镁代替盐卤,配制溶液,通过实验探究制作中影响豆腐口感的因素。
准确称取预处理的500g大豆,按照不同的料液比(黄豆的质量:水的质量)进行磨浆,在不同的温度下,使用不同量的盐卤,最后压制30分钟进行实验,并根据豆腐的形状、质地、口感等进行评分。
实验编号 温度(℃) 盐卤用量(mg·mL -1) 料液比 口感评分
第一组 1 85 48 1:4 70
2 85 48 1:5 88
3 85 48 1:6 80
第二组 4 85 44 1:5 83
5 85 52 1:5 75
第三组 6 80 a 1:5 76
7 90 48 1:5 72
(2)在点浆时,盐卤分3~4次加入豆浆中,同时不断搅拌,搅拌的目的是:_______。
(3)进行第一组实验的目的是:_______。
(4)为研究温度对豆腐口感的影响,应该对比的实验为:__(填实验编号)。实验6中a=__。
(5)通过实验,得出实验室制作出口感好的豆腐的最佳实验条件为:_______。
(6)你认为影响豆腐口感的因素还有哪些?_______(至少说出一条)。
19. (2022北京通州一模)柠檬的果皮、籽、果肉中均含有大量的柚皮苷和柠檬苦素类似物等苦味物质,在榨汁过程中常出现苦味,为了寻求去除苦味的方法,化学小组进行了实验,探究树脂添加量、脱苦时间、温度对其脱苦率的影响。
【进行实验】
实验一:室温下,分别取20 mL鲜榨柠檬汁进行实验,探究树脂添加量、脱苦时间与脱苦率的关系。记录如下:
组别 第1组 第2组 第3组
树脂添加量/g 0.04 0.06 0.08 0.04 x 0.08 0.04 0.06 0.08
脱苦时间/min 20 20 20 25 25 25 30 30 30
脱苦率(%) 20.4 22.7 23.4 28.5 30.1 34.7 36.8 39.8 40.3
实验二:分别在20 mL鲜榨柠檬汁中加入一定质量的树脂,脱苦时间相同,探究温度与脱苦率的关系。记录如下:
实验序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
树脂添加量/g 0.04 0.04 0.04 0.06 0.06 0.06 0.08 0.08 0.08
温度/℃ 20 30 40 20 30 40 20 30 40
脱苦率(%) 22.4 23.7 22.5 39.2 44.7 42.1 48.7 49.6 49.0
【解释与结论】
(1)实验一中,x应为_____。
(2)实验一中第3组的实验目的是_____。
(3)由实验一得到的结论是_____。
(4)实验二中探究温度与脱苦率的关系,可选做的实验是______(填实验序号) 。
(5)根据以上实验数据分析,柠檬榨汁过程中脱苦效果最好的实验条件是_____(填序号)。
A. 30min 0.08g 40℃ B. 30min 0.08g 30℃
C. 20min 0.04g 30℃ D. 25min 0.06g 20℃
【反思与评价】
(6)小组同学查阅资料发现,添加柚苷酶也可降低柠檬汁的苦味,设计实验比较在柠檬汁中添加树脂与添加柚苷酶的脱苦效果:室温下,分别取20 mL鲜榨柠檬汁于两个烧杯中,_____,取样测量柠檬汁的脱苦率。
20.(2022北京燕山二模) 管道疏通剂可以有效地疏通由毛发、油脂等各种原因引起的下水管道堵塞。某小组欲探究某品牌固体管道疏通剂中 Ca(OH)2、铝粉、缓蚀阻垢剂的用量对疏通效果的影响,寻找三者的最佳质量比;并探究该品牌管道疏通剂对下水管道的腐蚀情况。
【查阅资料】Ca(OH)2与铝粉混合遇水后发生化学反应,放出大量热和气体,可加快疏通毛发等物质。反应的化学方程式为:。
【进行实验 1】按表中数据将各固体物质混合均匀后,加入 20 mL 水,观察到有气体产生,并通过测定反应前后温度的变化比较疏通效果(温度升高值越大,疏通效果越好)。
实验数据记录如下:
序号 Ca(OH)2质量/g 铝粉质量/g 缓蚀阻垢剂质量/g 混合前后温度升高值/℃
① 1.3 0.55 0.18 63
② 1.3 0.75 0.18 78
③ 1.3 0.95 0.18 89
④ 1.3 1.15 0.18 83
⑤ 1.3 0.95 0.04 86
⑥ 1.3 0.95 0.09 87
⑦ 1.3 0.95 0.27 87
【解释与结论】
(1)Ca(OH)2溶液的 pH______7(填“<”、“>”或“=”)。
(2)Ca(AlO2)2中含有的金属元素是______。
(3)实验①~④的目的是______。
(4)欲探究缓蚀阻垢剂的用量对疏通效果的影响,需对比的实验是⑤、⑥、⑦和______(填实验序号)。
(5)由实验 1 可知,Ca(OH)2、铝粉、缓蚀阻垢剂的最佳质量比为 1.3∶______∶______。
【进行实验 2】在其他条件相同时。改变下水管道材料,测定管道疏通剂对各材料的腐蚀率。实验结果记录如下:
材料 塑料 铜 铁 钢 铝 铝合金
腐蚀率 0.1% 0.4% 0.5% 0.3% 100% 80%
【解释与结论】
(6)进行实验 2 时,除了控制下水管道材料的形状、大小相同,水的体积相同,腐蚀时间相同,还需要控制相同的是______。
(7)由实验 2 可得到的结论是______。
21. (2022北京顺义二模)含氯消毒剂是人类最早使用的化学消毒剂之一,电解食盐水可以制备含氯消毒剂。小组同学利用图1所示装置研究实验条件对消毒剂中有效氯含量的影响。
【查阅资料】该研究中含氯消毒剂的主要成分是NaClO,其中氯元素的化合价为______。
【猜想与假设】食盐水浓度、电压、电解时长可能影响消毒剂中有效氯含量。
【进行实验】在40mm电极长度、10mm电极间距的条件下电解300mL食盐水,实验数据记录如下表:
实验序号 食盐水浓度/(g/L) 电压/V 电解时长/min 有效氯含量/(g/L)
1 10 6 150 0.21
2 20 6 150 0.65
3 40 6 150 1.62
4 20 3 150 0.09
5 20 9 150 0.72
6 a 6 50 0.79
7 40 6 100 1.26
根据上表中的部分数据绘制有效氯含量--时间(电解时长)图,并进行了曲线拟合,所得曲线如图2所示。
【解释与结论】
(1)表中数值a为______。
(2)食盐水浓度对消毒剂中有效氯含量的影响是______。
(3)探究电压对消毒剂中有效氯含量影响的实验是______(填序号)。
(4)餐具消毒液的有效氯含量为0.34~0.46g/L。依据上述实验,制备餐具消毒液的适宜条件为______。
【反思与评价】
(5)实验研究表明,食盐水浓度为50g/L时,能发生如下反应,产生有毒的氯气,配平该反应的化学方程式。__________________
(6)结合以上实验,你还想探究的问题是______。
答案解析
【5年中考真题】
1. (2022北京中考)絮凝剂常用于水的净化,实验小组探究用絮凝剂净水时影响净化效果的因素。
【查阅资料】絮凝剂溶于水后能够吸附水中悬浮物并发生沉降,从而达到净水目的。硫酸铁是一种常见的絮凝剂。
【进行实验】
Ⅰ.配制水样和絮凝剂溶液
配制水样:向10L水中加入25g高岭土,搅拌、静置,取上层液作为水样。
配制絮凝剂溶液:用100mL水和5g硫酸铁进行配制。
Ⅱ.探究影响水样净化效果的因素
取水样,向其中加入絮凝剂溶液,搅拌,测定静置不同时间水样的浊度,并计算浊度去除率(浊度去除率越高代表净化效果越好)。实验记录如下:
实验序号 水样的体积/mL 加入絮凝剂溶液的体积/mL 静置时间/min 浊度去除率/%
① 200 0 20 12.48
② 200 0.2 20 76.54
③ 200 0.3 20 84.60
④ 200 0.4 5 64.45
⑤ 200 0.4 10 70.85
⑥ 200 0.4 15 81.04
⑦ 200 0.4 20 86.02
⑧ 200 0.5 20 88.15
⑨ 200 0.6 20 86.49
【解释与结论】
(1)配制絮凝剂溶液的操作如下图所示。
正确的操作顺序是______________(填序号),B中用玻璃棒搅拌的目的是______________。
(2)②中浊度去除率比①高的原因是______________。
(3)依据④~⑦得出的结论是______________。
(4)探究等量水样中加入絮凝剂溶液的体积对净化效果影响的实验是______________(填序号)。
【反思与评价】
(5)依据实验数据,不能得出“静置时间相同时,等量水样中加入絮凝剂溶液的体积越大,净化效果越好”的结论,其证据是______________。
【答案】(1) ①. CDAB ②. 加快溶解速度
(2)加入了絮凝剂 (3)静置时间越长,浊度去除率越高 (4)①②③或⑦⑧⑨
(5)⑧⑨实验对比得出,两组实验中水样的质量与静置时间都相同,⑧中絮凝剂加入体积较少,浊度去除率较高
【解析】
(1)配制絮凝剂溶液的操作为:计算出需要溶质的质量及溶剂的体积,先用天平称量出需要的絮凝剂的质量,将絮凝剂倒入烧杯中,用量筒量取需要水的体积,将水倒入烧杯中,用玻璃棒搅拌加快溶解,待全部溶解后溶液配制成功;故操作顺序为CDAB;玻璃棒搅拌的目的为加快溶解速度;
(2)②中加入了絮凝剂,①中没有絮凝剂,则②中浊度去除率比①高;
(3)实验④~⑦中等质量的水样中加入的絮凝剂体积也相同,根据表格数据得出静置时间越长,浊度去除率越高;
(4)观察表格数据得出实验①②③或者实验⑦⑧⑨中水样的体积相等,静置时间相等,加入絮凝剂的体积不一样,则实验①②③或者实验⑦⑧⑨可以探究等量水样中加入絮凝剂溶液的体积对净化效果影响;
(5)观察实验数据可以发现实验⑧与⑨可知,实验⑧中浊度去除率较高,但絮凝剂加入的体积较少,则不能得出结论“静置时间相同时,等量水样中加入絮凝剂溶液的体积越大,净化效果越好”。
2.(2021北京中考)(7分)硬水加热时易产生水垢,很多工业用水需要对硬水进行软化处理。小组同学利用1.5%的肥皂水比较水的硬度。
【查阅资料】硬水含较多可溶性钙、镁化合物;软水不含或含较少可溶性钙,镁化合物。
Ⅰ、探究水的硬度、肥皂水的用量与产生泡沫量的关系
【进行实验】向蒸馏水中加入CaCl2和MgCl2的混合溶液,配制两种不问硬度的硬水。
用蒸馏水和两种硬水完成三组实验,记录如下:
组别 第1组 第2组 第3组
实验操作
实验序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
混合溶液用量/滴 0 0 0 1 x 1 2 2 2
肥皂水用量/滴 5 10 20 5 10 20 5 10 20
产生泡沫量 少 多 很多 无 少 多 无 无 少
【解释与结论】
(1)对比②和⑧可知,肥皂水能区分软水和硬水,依据的现象是 。
(2)设计第2组实验时,为控制水的硬度相同,⑤中x应为 。
(3)第2组实验的目的是 。
(4)由上述三组实验得到的结论是 。
Ⅱ、比较不同水样的硬度
【进行实验】用四种水样完成实验,记录观察到泡沫产生时所需肥皂水的用量。
实验操作 水样 肥皂水用量/滴
市售纯净水 2
煮沸后的自来水 6
自来水 9
湖水 14
【解释与结论】
(5)硬度最大的水样是 。
(6)由上述实验可知,能将自来水硬度降低的方法有 。
(7)继续实验,发现山泉水的硬度大于自来水的硬度,其实验方案为 。
【答案】(1)产生泡沫多少。 (2)1。
(3)第2组实验以肥皂水为变量,探究肥皂水多少与产生泡沫量的关系。
(4)硬水中加肥皂水泡沫少,软水中加肥皂水泡沫多。(5)湖水。 (6)煮沸。
(7)另取相同量山泉水,滴加肥皂水记录产生泡沫所需肥皂水量,大于自来水所需肥皂水量,说明山泉水硬度大于自来水。
【解析】(1)②和⑧不同实验现象是产生的泡沫多少不同,因此据此判断区分软硬水;
故答案为:产生泡沫多少。
(2)根据对比实验唯一变量的原则可知,x加入混合液体积相同,也是1滴;
故答案为:1。
(3)第2组实验中验证不同催化剂 肥皂水的用量,产生泡沫量不同,因此是探究肥皂水用量与产生泡沫量的关系;
故答案为:第2组实验以肥皂水为变量,探究肥皂水多少与产生泡沫量的关系。
(4)从3组实验可以看出,当在相同体积蒸馏水加入不同量氯化钙和氯化镁溶液,同时加入相同量的肥皂水,则可以看出蒸馏水泡沫多,而加入氯化钙和氯化镁体积越多的泡沫越少,而水的硬度根据钙。镁离子含量来表示,所以说明硬水加入肥皂水泡沫少,软水加入肥皂水泡沫多;
故答案为:硬水中加肥皂水泡沫少,软水中加肥皂水泡沫多。
(5)根据题目数据可以看出,湖水硬度最大;
故答案为:湖水。
(6)根据煮沸自来水与自来水加入肥皂水的体积,可以知道煮沸可以降低水的硬度;
故答案为:煮沸。
(7)为了确保只改变水质,其他实验条件一致,因此需要取相同量的山泉水,然后滴加肥皂水,记录加入肥皂水产生泡沫时,使用的量,与自来水的数据相比,得出实验结论;
故答案为:另取相同量山泉水,滴加肥皂水记录产生泡沫所需肥皂水量,大于自来水所需肥皂水量,说明山泉水硬度大于自来水。
3.(2020北京中考)丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
I.探究丙酸钙的性质
进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
序号 ① ②
装置
现象 试管内壁有水雾 注入酸后,有气泡产生,石灰水变浑浊
【解释与结论】
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为________。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是_______。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
组别 第1组 第2组
序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
配方 面粉/ g 50 50 50 50 50 50 50 50
酵母/ g 0.75 0.75 0.75 0.75 0.75 0.75 0.75 0.75
蔗糖/ g 0 0 0 0 5 5 x 5
丙酸钙/g 0 0.06 0.10 0.15 0 0.06 0.10 0.15
开始发霉时间 第3天 第4天 第5天 第6天 第3天 第4天 第5天 第6天
【解释与结论】
(3)设计第1组实验的目的是____。
(4)第2组,⑦中x为_______。
(5)对比第1组、第2组实验可得到的结论是______。
【反思与评价】
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:_____。
【答案】 ①. ②. 丙酸钙受热后产生的物质能与稀盐酸反应且生成二氧化碳 ③. 探究丙酸钙的质量大小是否对于丙酸钙防霉效果有影响 ④. 5 ⑤. 在加入面粉质量相同,酵母质量相同时以及其他条件相同时,有无蔗糖对丙酸钙防霉效果无影响 ⑥. 不同意。国家标准规定了丙酸钙用于作面食、糕点时每千克面粉中的最大使用量,说明过量使用可能有害。故不是越多越好
【解析】
Ⅰ、解释与结论:
(1)二氧化碳与氢氧化钙反应生成碳酸钙和水,该反应的化学方程式为:;
(2)查阅资料得知丙酸钙与盐酸反应无气体生成,丙酸钙加热后生成的固体却能与稀盐酸反应生成二氧化碳气体,故可得出:丙酸钙受热后产生的物质能与稀盐酸反应且生成二氧化碳;
Ⅱ、解释与结论:
(3)由表中数据可知,第1组实验,其它因素相同,只有丙酸钙的质量不同,故该实验是探究丙酸钙的质量大小是否对于丙酸钙防霉效果有影响;
(4)由表中数据可知,第2组与第1组其它数据相同,只是第1组无蔗糖,而第2组有蔗糖,且第2组加入蔗糖的质量应相同,故x=5;
(5)由表中数据可知,在加入面粉质量相同,酵母质量相同时以及其他条件相同时,有无蔗糖,开始发霉的时间相同,故说明在加入面粉质量相同,酵母质量相同时以及其他条件相同时,有无蔗糖对丙酸钙防霉效果无影响;
反思与评价:
(6)由题干信息可知,丙酸钙属于食品防腐剂,且国家标准规定了丙酸钙用于作面食、糕点时每千克面粉中的最大使用量,说明过量使用可能有害。故不是越多越好。
故填:不同意;国家标准规定了丙酸钙用于作面食、糕点时每千克面粉中的最大使用量,说明过量使用可能有害。故不是越多越好。
4.(2019北京中考)下图“黑面包”实验中,蔗糖(C12H22O11)变黑,体积膨胀,变成疏松的炭,放出有刺激性气味的气体。
【提出问题】改变糖的种类、浓硫酸的体积、水的滴数和温度是否会影响实验效果呢
【进行实验】分别取5g糖粉进行实验,根据前2min的现象对实验效果进行评分,
记录如下:
表1实验记录
实验 糖 浓硫酸体积/mL 水的滴数 温度/℃ 效果得分
1 蔗糖 4 5 22 65
2 蔗糖 5 10 30 81
3 蔗糖 6 15 50 93
4 冰糖 4 10 50 91
5 冰糖 5 15 22 88
6 冰糖 a 5 30 75
7 葡萄糖 4 15 30 0
8 葡萄糖 5 5 50 0
9 葡萄糖 6 10 22 0
【处理数据】分析表1,计算效果得分均值,结果如下:
表2效果得分均值
因素 糖 浓硫酸体积/mL 水滴数 温度/℃
蔗糖 冰糖 葡萄糖 4 5 6 5 10 15 22 30 50
均值 79.7 84.7 0 52.0 56.3 56.0 46.7 57.3 60.3 51.0 52.0 61.3
依据均值推断最佳实验方案,均值越高,效果越好。
【解释与结论】
(1)蔗糖变成黑色的炭,发生了_____________(填“物理”或“化学”)变化。
(2)推测放出的气体含SO2,从元素守恒角度说明理由:________________________________。
(3)实验6中,a为_____________mL。
(4)根据表2推断,“黑面包”实验最好选择5g冰糖、5mL浓硫酸、_____滴水和50℃
【反思与评价】
(5)表2中,22℃对应的均值为51.0,计算该值所依据的3个数据分别是_____________________。
(6)综合分析,使实验3的效果得分高于实验4的因素有________________________________。
【答案】 ①. 化学 ②. 浓硫酸中有硫元素和氧元素,蔗糖中含有氧元素,则生成物中也会有硫元素和氧元素 ③. 6 ④. 15 ⑤. 65、88、0 ⑥. 浓硫酸的体积和水的滴数
【解析】
(1) 蔗糖的化学式为:C12H22O11,炭黑的化学式为:C,物质发生了变化,属于化学变化,故填写:化学;
(2)根据质量守恒定律的实质之一:化学反应前后,元素种类不变可得,浓硫酸中有硫元素和氧元素,蔗糖中含有氧元素,则生成物中也会有硫元素和氧元素;
(3)对比表1数据可得,糖为冰糖时,浓硫酸体积缺少6mL,故填写:6;
(4)分析表2可得,5g冰糖、5mL浓硫酸、15滴水和50℃时,数值同组最大,故填写:15;
(5) 表2中,22℃对应的均值为51.0,计算均值的方法是:,故填写:65、88、0;
(6)对比表1和表2数据可得,6mL浓硫酸比4mL效果要好,15滴水比10滴效果要好,故综合分析,使实验3的效果得分高于实验4的因素有浓硫酸的体积和水的滴数。
【点睛】该题为科学探究题,此题的解题关键是熟练掌握控制变量法。
5.(2018北京中考)为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+ H2SO4 = CuSO4 + H2O + Cu
【进行实验】
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 1-1 1-2
装置
反应后物质的颜色、状态 黑色粉末中混有少量红色固体 红色固体有金属光泽,混有极少量,黑色物质
实验2:取一定量的混合物,用1—2装置进行实验。
序号 木炭粉与氧化铜质量比 反应后物质的颜色、状态
2-1 1:9 红色固体有金属光泽 混有少量黑色物质
2-2 1:10 混有很少量黑色物质
2-3 1:11 混有极少量黑色物质
2-4 1:12 无黑色物质
2-5 1:13 混有较多黑色物质
【解释与结论】
(1)配平化学方程式: ___ C+ ___ CuO高温___ Cu+ ___ CO2↑。
(2)实验1—2中,证明产生CO2的现象是 _______________________ 。
(3)实验1的目的是 __________ 。
(4)实验2的结论是 _____________ 。
【反思与评价】
(5)实验2没有进行质量比为1:14的实验,理由是 ________________ 。
(6)为检验2—4的红色固体中是否含Cu2O,所需试剂是 __________ 。
【答案】 ①. 1 ②. 2 ③. 2 ④. 1; ⑤. 澄清石灰水变浑浊; ⑥. 探究木炭与氧化铜的受热面积对其反应的影响; ⑦. 木炭与氧化铜质量比为1:12是恰好反应,因此木炭与氧化铜反应的最佳质量比为1:12; ⑧. 木炭与氧化铜质量比为1:13时,氧化铜已过量; ⑨. 稀硫酸。
【解析】
(1)木炭与氧化铜反应方程式:C+2CuO高温 2Cu+CO2↑;
(2)二氧化碳使澄清石灰水变浑浊,故如看到澄清石灰水变浑浊,说明有二氧化碳生成;
(3)实验1-1,反应物受热面积较大,实验1-2反应物受热面积较小,故实验1与实验2形成对比实验,可以探究木炭与氧化铜的受热面积对其反应的影响;
(4)由表可知,当木炭与氧化铜质量比为1:12是恰好反应,即木炭与氧化铜反应的最佳质量比为1:12;
(5)由表可知,当木炭与氧化铜质量比为1:13时,氧化铜已过量,生成物中含有Cu和CuO,没有必要进行质量比为1:14的实验;
(6)因为Cu2O + H2SO4 = CuSO4 + H2O + Cu,所以向红色固体中加稀硫酸如溶液变为蓝色,可以可以说明有Cu2O。
【1年模拟题】
1. (2022北京大兴二模)实验小组同学对铁生锈的条件和影响因素进行探究。
【进行实验】
实验1:如下图所示进行实验,一段时间后观察到C中铁钉生锈,A、B中铁钉无明显变化。
实验2:为进一步探究影响铁生锈速率的因素,小组同学设计如图所示实验,利用传感器监测过程中氧气浓度的变化来判断铁生锈的情况。
实验记录如下:
序号 其他试剂 初始时氧气浓度/% 200s时氧气浓度/%
水/滴 食盐质量/g 稀醋酸/滴
① 0 0 0 20.8 20.8
② 10 0 0 20.8 15.2
③ 10 0 5 20.8 12.7
④ 10 1.0 0 20.8 8.0
【解释与结论】
(1)铁生锈属于______(填“物理变化”或“化学变化”)。
(2)由实验1能得出“与H2O接触是铁生锈条件之一”的结论,依据的实验现象是______。
(3)实验2,①中200s时氧气浓度没有发生变化的原因是______。
(4)由实验2得出“食盐能加速铁生锈”结论,依据的实验是______(填序号)。
(5)实验2,设计②③的目的是______。
【反思与评价】
(6)小明欲进一步探究NaOH稀溶液对铁生锈速率是否有影响,他又补充设计了如下实验:
其他试剂 初始时氧气浓度/% 200s时氧气浓度/%
水/滴 食盐质量/g 稀醋酸/滴 NaOH稀溶液/滴
5 20.8
该实验中水、食盐、稀醋酸的量分别是______。
【答案】 ①. 化学变化 ②. 试管A中铁钉不生锈,试管C中铁钉生锈 ③. 铁与水隔离,不能生锈,因此不能消耗氧气 ④. ②④##④② ⑤. 探究稀醋酸能否加速铁生锈 ⑥. 10、0、0
【解析】
解释与结论:
(1)铁生锈时铁与氧气、水反应生成铁锈,属于化学变化;
(2)试管A中铁钉只与空气接触,试管B中铁钉只与水接触,试管C中铁钉与水、空气同时接触,其中试管A中铁钉不生锈,试管C中铁钉生锈,则说明铁生锈时需与水接触。
(3)实验2中,①中铁粉没有与水接触,不能生锈,因此不消耗氧气,200s时氧气浓度也没有发生变化。
(4)实验2中,②中没有食盐、④中有食盐,其他条件都相同,且④中200s时氧气浓度更少,说明食盐能加快铁生锈。
(5)实验2中,②中滴有水滴,③中不仅滴有水滴,还滴有稀醋酸,则说明设计②③的目的是探究稀醋酸能否加速铁生锈。
反思与评价:
对比实验要单一变量,欲探究NaOH稀溶液对铁生锈速率是否有影响,则除了NaOH稀溶液不同,其他条件都相同,则该实验中水、食盐、稀醋酸的量分别是10、0、0。
2. (2022北京朝阳一模)化学小组对市售“茶垢清洁剂”进行如下探究。
【查阅资料】
①使用方法:将“茶垢清洁剂”粉末倒入容器中,加入50℃~70℃的水,浸泡10分钟,清水冲洗即可。
②过碳酸钠是常用的洗涤助剂。它是白色固体,溶于水时分解生成碳酸钠和过氧化氢。
实验1:验证“茶垢清洁剂”的主要成分是过碳酸钠
【进行实验】在分液漏斗a中加入新配制的“茶垢清洁剂”的饱和溶液。
实验装置 实验步骤 实验现象 实验结论
Ⅰ.打开分液漏斗a的活塞,加入适量溶液后,关闭活塞,然后_______。 产生大量气泡,带火星的木条复燃 “茶垢清洁剂”的主要成分是过碳酸钠
Ⅱ.待Ⅰ中反应停止后,打开分液漏斗b的活塞,加入适量溶液后,关闭活塞,将生成的气体通入澄清石灰水。 产生大量气泡,澄清石灰水变浑浊
【解释与结论】
(1)步骤I,关闭活塞后进行的实验操作是_______,产生大量气泡的化学方程式为_______。
(2)步骤Ⅱ,分液漏斗b中的液体是_______,依据步骤Ⅱ的现象得出的结论是_______。
实验2:探究影响过碳酸钠去茶渍效果的因素
【进行实验】25℃时,取洗碗基料15g于洗碗机中,分别加人不同质量的过碳酸钠,按照不同洗涤模式对具有相同茶渍的茶杯进行洗涤,洗涤后根据去茶渍效果打分,分数越高效果越好,记录如下:
组别 第1组(常规洗涤模式) 第2组(快洗模式)
实验序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
过碳酸钠用量/g 0 1 2 3 0 1 2 3
水的硬度/mg·kg 250 250 250 250 250 250 250 250
pH 11 11 11 11 11 11 11 11
去茶渍效果打分 2 5 7 9 2 4 6 8
【解释与结论】
(3)对比②和⑥可知,常规洗涤模式比快洗模式去茶渍效果好,依据是_______。
(4)第1组实验的目的是_______。
(5)生活中碳酸钠也是常用洗涤剂。继续实验,发现碳酸钠比过碳酸钠去茶渍效果差,其实验方案是:在25℃、水的硬度为250mg·kg-1、pH为11的条件下,取洗碗基料15g于洗碗机中,加入2g碳酸钠,_______。
【答案】 ①. 将带火星的木条放在c处 ②. ③. 稀盐酸(合理即可) ④. 溶液中含有碳酸钠 ⑤. 常规洗涤模式去茶渍效果打分更高 ⑥. 常规洗涤模式下,其他条件相同时,加入过碳酸钠的量是否影响去茶渍效果 ⑦. 记录去茶渍效果打分值
【解析】
(1)根据步骤I的现象:产生大量气泡,带火星的木条复燃,说明打开分液漏斗a的活塞,加入适量溶液后,生成了氧气,所以分液漏斗a的溶液中有过氧化氢,检验是否生成氧气应观察将带火星的木条放在c处是否复燃;过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为:;
(2)根据步骤Ⅱ的现象:产生大量气泡,澄清石灰水变浑浊,说明打开分液漏斗b的活塞,加入适量溶液后,生成了二氧化碳,所以分液漏斗b的溶液是稀盐酸,由此证明溶液中含有碳酸钠;
(3)洗涤后根据去茶渍效果打分,分数越高效果越好,对比②和⑥可知,常规洗涤模式比快洗模式去茶渍效果好,是因为常规洗涤模式去茶渍效果打分更高;
(4)对比①②③④可知,进行常规洗涤模式洗涤时,在水的硬度和酸碱性相同的条件下,加入过碳酸钠的量越多,去茶渍效果好越好;
(5)碳酸钠比过碳酸钠去茶渍效果差,由此可知:在25℃、水的硬度为250mg·kg-1、pH为11的条件下,取洗碗基料15g于洗碗机中,加入2g碳酸钠,记录去茶渍效果打分的结果是否小于6。
3. (2022北京丰台一模)食品脱氧剂主要成分有铁粉、活性炭、氯化钠,发生脱氧反应消耗食品包装袋内的氧气延长食品保质期。实验小组探究脱氧反应发生条件和影响脱氧反应速率的因素。
实验一 探究脱氧反应发生条件
按图1所示装置进行实验,利用氧气传感器测定密闭容器中氧气含量变化,如图2所示。
(1)结合图2分析,集气瓶②中铁粉发生脱氧反应的依据是______。
(2)实验一得出的结论是发生脱氧反应需要铁粉与氧气和______同时接触。
实验二 探究氯化钠、活性炭用量对脱氧反应速率的影响
室温下,利用5g铁粉和10滴水,改变活性炭和氯化钠的用量(见下表),用氧气传感器测定密闭容器中氧气含量变化,实验结果如图3、图4所示。
实验编号 铁粉/g 活性炭/g 氯化钠/g
1 5 0 1
2 5 0.75 0
3 5 0.75 1
4 5 1.5 1
5 5 a 2
(3)实验5中,a=______。
(4)实验1、3、4的目的是______。
(5)结合图4,对比实验2、3、5可以得到的结论是______。
实验三 探究硅藻土的用量对脱氧反应速率的影响
脱氧剂中还经常添加硅藻土,主要作用是吸附水分, 同时疏松配料,使铁粉更易于与氧气接触。室温下,在一定量的脱氧剂中加入不同质量的硅藻土,测定密闭容器中氧气耗尽所需时间,如图5所示。
(6)由图5可知,硅藻土用量和氧气耗尽所需时间的关系是______。
(7)结合以上实验分析,脱氧剂的反应速率还可能受哪些因素影响______(写出一条即可)。
【答案】(1)氧气含量减小
(2)水或H2O (3)0.75
(4)探究活性炭用量对脱氧反应速率的影响
(5)室温下,在铁粉、水、活性炭质量相同时,氯化钠用量在0、1、2g时,随着氯化钠用量增加,脱氧反应速率加快
(6)室温下,脱氧剂质量相同时,硅藻土用量在0.15g—0.65g范围内,随着硅藻土用量增加,氧气耗尽所需时间先减小后增加
(7)温度、疏松程度等
【解析】
(1)由图2可知,集气瓶②中氧气含量逐渐减小,说明铁粉发生了脱氧反应;
(2)集气瓶①和集气瓶②中变量是水,其它因素均相同,由图2可知,集气瓶①中氧气含量几乎不变,集气瓶②中氧气含量逐渐减小,说明集气瓶②中发生了脱氧反应,说明发生脱氧反应需要铁粉与氧气和水同时接触;
(3)由图4可知,实验2、3、5为一个实验组,故根据控制变量法,除了氯化钠的用量不同,其它因素均应相同,故a=0.75;
(4)由表可知,实验1、3、4中,活性炭的用量不同,其它因素均相同,故该实验的目的是探究活性炭用量对脱氧反应速率的影响;
(5)实验2、3、5中,氯化钠的用量不同,其它因素均相同,由图4可知,在其它条件相同的情况下,氯化钠的用量越大,氧气含量减少的越多,说明室温下,在铁粉、水、活性炭质量相同时,氯化钠用量在0、1、2g时,随着氯化钠用量增加,脱氧反应速率加快;
(6)由图可知,室温下,脱氧剂质量相同时,硅藻土用量在0.15g—0.65g范围内,随着硅藻土用量增加,氧气耗尽所需时间先减小后增加;
(7)由以上实验可知,脱氧剂的反应速率还可能受温度、疏松程度等影响。
4. (2022北京东城一模)实验小组探究金属与酸的置换反应。
【进行实验】
(1)实验1:向分别盛有Fe片、Cu片的试管中加入稀盐酸。
①Fe与稀盐酸发生反应,化学方程式为______。
②Cu与稀盐酸不反应,原因是______。
(2)实验2:探究Fe与硫酸的反应(Fe片大小相同且已除去表面氧化膜;硫酸溶液体积相等)
序号 药品 现章
① Fe片+硫酸溶液(V浓硫酸:V水=1:2) 快速产生气泡
② Fe片+硫酸溶液(V浓硫酸:V水=1:200) 缓慢产生气泡
③ Fe片+硫酸溶液(V浓硫酸:V水=1:200000) 无气泡产生
①对比实验①和②,可得到的结论是______。
②实验③中没有气泡产生的原因是______。
(3)实验3:探究Cu与浓盐酸的反应
用如下装置进行实验(硫酸溶液与浓盐酸中H+的浓度接近)。
装置 序号 药品 现象
④ 浓盐酸 24小时后仍无明显变化
⑤ Cu粉+硫酸溶液 24小时后得无明显变化
⑥ Cu粉+浓盐酸 24小时后气球变鼓
【解释与结论】
① ④是对照实验,目的是排除______的干扰。
② 点燃⑥中气球内的气体,发出爆鸣声,则⑥中气球变鼓是因为生成了______;经检测,⑥反应后的溶液中主要成分是H3CuCl4。
【反思与评价】
③综合以上实验,请写出你对金属与酸的置换反应的新认识______。
【答案】(1) ①. ②. 在金属活动性顺序里,铜排在氢后
(2) ①. 在其它条件相同的情况下,酸的浓度越低,铁与硫酸的反应速率越慢 ②. 酸的浓度太低,铁与氢离子接触少
(3) ①. 浓盐酸挥发 ②. 氢气或H2 ③. 一定条件下,氢后金属也能与酸发生置换反应
【解析】
(1)①铁与稀盐酸反应生成氯化亚铁和氢气,该反应的化学方程式为: ;
②在金属活动性顺序里,铜排在氢后,故铜与稀盐酸不反应;
(2)①实验①和②中,酸的浓度不同,其它因素均相同,且酸的浓度越低,产生气泡的速率越慢,说明在其它条件相同的情况下,酸的浓度越低,铁与硫酸的反应速率越慢;
②实验③中酸的浓度太低,铁与氢离子接触少,故没有气泡产生;
(3)①浓盐酸具有挥发性,会挥发出氯化氢气体,故④是对照实验,目的是排除浓盐酸挥发的干扰;
②点燃⑥中气球内的气体,发出爆鸣声,且根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Cu、H、Cl,生成的气体具有可燃性,故则⑥中气球变鼓是因为生成了氢气;
③由以上实验可知,铜与稀盐酸不反应,但是铜粉能与浓盐酸反应生成氢气,说明一定条件下,氢后金属也能与酸发生置换反应。
5. (2022北京房山二模)食用油是厨房中常见的食材,小组同学针对食用油的变质问题进行了探究。
【查阅资料】
①食用油不易溶于水,能溶于酒精和醋酸中。白酒和白醋的主要成分分别为酒精和醋酸。
②食用油变质后产生的过氧化物可使碘化钾淀粉试纸由白色变为蓝色。
Ⅰ.检验食用油是否变质
【进行实验】
ⅰ.空白对照组
实验操作 试剂 现象
52°白酒 碘化钾淀粉试纸不变色
白酷 碘化钾淀粉试纸不变色
ⅱ.对比实验组
实验操作
实验序号 1-1 1-2 1-3 1-4 1-5 1-6
溶剂 52°白酒 52°白酒 52°白酒 白醋 白醋 白醋
油样 新油 过期油 煎炸过的老油 新油 过期油 煎炸过的老油
现象 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸变为蓝色 碘化钾淀粉试纸轻微变蓝
【解释与结论】
(1)食用油中常含有 C18H34O2、C18H32O2、C16H32O2等,这些物质的相同点是_______ (写出一点即可)。
(2)依据空白对照组可知,用 52°白酒和白醋作溶剂 _____(填“会”或“不会”)影响实验结果。
(3)由对比实验组可知,适宜的溶剂为 _______。
(4)经上述实验检验,已经发生变质的是_____(填序号)。
A. 新油 B. 过期油 C. 煎炸过的老油
Ⅱ.去除食用油中过氧化物的方法
【进行实验】
实验方法 2-1隔绝氧气自降解法 2-2还原降解法
实验操作 在隔绝氧气条件下,取四份相同体积、不同温度的食用油,分别恒温放置,每隔一段时间测定油样的过氧化值。 30℃时,取若干份相同体积的食用油,添加不同质量的还原剂(半胱氨酸),测定油样的过氧化值。
实验结果
【解释与结论】
(5)设计实验 2-1 的目的是_______。
(6)由实验 2-2 得到的结论是______。
【反思与评价】
(7)根据上述实验,请从食用油的加工、储存或使用等方面,提出一条合理建议:______。
【答案】(1)组成元素相同或都是有机物等(合理即可) (2)不会 (3)白醋 (4)BC
(5)验证过氧化物开始降低的时间与温度的关系
(6)30 ℃时,半胱氨酸添加量在0~1.0%时,过氧化物降低率升高,半胱氨酸添加量在1.0%~1.4% 时,过氧化物降低率降低。
(7)好使用煎炸过的老油或隔绝氧气储存或使用时先加热至110 ℃左右
【解析】
(1)由这些物质的化学式可知,这些物质的相同点是组成元素相同、都是有机物等。故答案为:组成元素相同或都是有机物等。
(2)依据空白对照组可知,用52°白酒和白醋作溶剂不会影响实验结果。故答案为:不会。
(3)由对比实验组可知,适宜的溶剂为白醋,是因为利用白醋能够检测出过氧化物。故答案为:白醋。
(4)经上述实验检验,已经发生变质的是过期油、煎炸过的老油。故答案为:BC。
(5)设计实验2-1的目的是验证过氧化物开始降低的时间与温度的关系。故答案为:验证过氧化物开始降低的时间与温度的关系。
(6)由实验2-2得到的结论是30 ℃时,半胱氨酸添加量在0~1.0%时,过氧化物降低率升高,半胱氨酸添加量在1.0%~1.4% 时,过氧化物降低率降低。故答案为:30 ℃时,半胱氨酸添加量在0~1.0%时,过氧化物降低率升高,半胱氨酸添加量在1.0%~1.4% 时,过氧化物降低率降低。
(7)根据上述实验,从食用油的加工、储存或使用等方面的合理建议:最好使用煎炸过的老油、隔绝氧气储存、使用时先加热至110 ℃左右。故答案为:最好使用煎炸过的老油或隔绝氧气储存或使用时先加热至110 ℃左右。
6. (2022北京丰台二模)“固体酒精”是乙醇、硬脂酸、NaOH 混合而成的一种燃料,同学们对制备“固体酒精”的最佳反应条件进行了探究。
【查阅资料】制备“固体酒精”的工艺流程如下:
实验 1 探究加料方式对制备“固体酒精”的影响
一定温度下,乙醇、硬脂酸、NaOH 用量相同时,用不同的加料方式进行实验,实验现象记录如下:
实验序号 ① ② ③
加料方式 硬脂酸和NaOH同时加入乙醇 先将硬脂酸溶于乙醇,再加入NaOH 将硬脂酸和NaOH分别充分溶于2份乙醇后,再混合
完全溶解所需时间 60min 45min 30min
实验 2 探究制备“固体酒精”的最佳温度
在不同温度下,乙醇、硬脂酸、NaOH 用量相同时,用最佳加料方式进行实验,实验现象记录如下:
实验序号 温度/℃ 现象
④ 30 混合后立即生成“固体酒精”,产品不能混合均匀
⑤ 40 混合后立即生成少量“固体酒精”,产品局部混合不均匀
⑥ 60 混合后不立刻生成“固体酒精”,可以混合均匀
实验 3 探究硬脂酸的含量对“固体酒精”燃烧时凝固性能的影响
在最佳温度下,用最佳加料方式进行实验制备“固体酒精”并点燃,实验现象记录如下:
实验序号 乙醇/g 硬脂酸/g 氢氧化钠/g 燃烧现象
⑦ 96 3 1 熔化流淌
⑧ 93 6 1 少量熔化流淌
⑨ X 6.5 1 不熔化流淌
【解释与结论】
(1)硬脂酸与氢氧化钠混合后发生如下化学反应,补全化学方程式:______。
(2)在较高温度下,上述反应生成硬脂酸钠(C17H35COONa)均匀地分散在乙醇中,冷却后形成“固体酒精”。由此可知,“固体酒精”______固态乙醇(填“是”或“不是”)。
(3)实验 1 中,③为最佳加料方式的依据是______。
(4)实验 2 中,生成“固体酒精”过快,会导致产品均匀性较差,因此制备“固体酒精”的最佳温度是______
(5)实验⑨,x=______。
(6)实验 3,对比实验⑦~⑨得出的结论是______。
(7)下列关于“固体酒精”的说法正确的是______(填字母序号)。
A.“固体酒精”燃烧时保持固体状态提高了其使用时的安全性
B.“固体酒精”的优点之一是便于运输、携带
C.评价“固体酒精”的优劣还需考虑燃烧时长和热值
D.评价“固体酒精”的优劣还需考虑燃烧时是否产生黑烟异味
【答案】 ①. ②. 不是 ③. 一定温度下,乙醇、硬脂酸、氢氧化钠用量相同时,③完全溶解所需时间最少 ④. 60℃ ⑤. 92.5 ⑥. 氢氧化钠质量一定时,硬脂酸的质量越大,“固体酒精”燃烧时凝固性能越大 ⑦. ABCD
【解析】
(1)酸与碱反应生成盐和水,故硬脂酸与氢氧化钠混合后反应生成硬脂酸钠和水,该反应化学方程式:;
(2)在较高温度下,上述反应生成的硬脂酸钠(C17H35COONa)均匀地分散在乙醇中,冷却后形成“固体酒精”。由此可知,“固体酒精”不是固态乙醇;
(3)实验1中,③为最佳加料方式的依据是一定温度下,乙醇、硬脂酸、氢氧化钠用量相同时,③完全溶解所需时间最少;
(4)实验2中,生成“固体酒精”过快,会导致产品均匀性较差,因此制备“固体酒精”的最佳温度是60℃,此温度下,混合后不立刻生成“固体酒精”,可以混合均匀;
(5)由图中实验⑦⑧数据分析,⑦中氢氧化钠1g,硬脂酸3g,乙醇96g,⑧中氢氧化钠1g,硬脂酸6g,乙醇93g,当氢氧化钠质量都是1g时,硬脂酸每增加3g,乙醇减少3g,则当氢氧化钠1g时,硬脂酸增加3.5g,乙醇减少3.5g,故实验⑨中氢氧化钠1g时,硬脂酸3g+3.5g=6.5g时,乙醇为96g-3.5g=92.5g,即X=92.5;
(6)实验3,对比实验⑦~⑨得出的结论是氢氧化钠质量一定时,硬脂酸的质量越大,“固体酒精”燃烧时凝固性能越大;
(7)A.“固体酒精”燃烧时保持固体状态提高了其使用时的安全性,说法正确;
B.固体相比较液体气体来说,固体便于运输,“固体酒精”的优点之一是便于运输、携带,说法正确;
C.评价“固体酒精”的优劣还需考虑燃烧时长和热值,说法正确;
D.酒精中含有碳,评价“固体酒精”的优劣还需考虑燃烧时是否产生黑烟异味,说法正确;
故说法正确的选择ABCD。
7. (2022北京海淀二模)碱式碳酸铜〔Cu2(OH)2CO3〕是孔雀石的主要成分,主要用于生产油漆、颜料等。兴趣小组探究碱式碳酸铜制备的最佳实验条件。
【查阅资料】碱式碳酸铜是翠绿色、难溶于水的固体,酸性条件下不稳定。
【进行实验】按下表中的数据进行图示实验,记录实验结果。
序号 CuSO4溶液体积/mL Na2CO3溶液体积/mL 水浴温度/℃ 固体颜色
i 50 60 60 蓝绿
ii 50 60 70 翠绿
iii 50 60 80 暗绿
iv 50 70 70 蓝绿
v 50 50 x 蓝绿
【解释与结论】
(1)为了使生成的碱式碳酸铜稳定,实验过程中需保持反应体系的pH___________7(填“<”或“>”)。
(2)ii、iv、v的目的是探究制备碱式碳酸铜时CuSO4溶液与Na2CO3溶液最佳配比,x=___________。
(3)设计i~iii的目的为___________。
(4)由表中数据知,制备碱式碳酸铜的最佳实验条件是___________。
【反思与评价】
(5)iii中所得固体颜色偏暗。查阅资料知碱式碳酸铜受热分解会生成CuO,猜想颜色变暗的原因与该反应有关。
①请将碱式碳酸铜分解反应的化学方程式补充完整:___________
②利用如图装置进行实验证明上述猜想。请在图中将实验方案补充完整___________、___________、___________,并说明:若出现___________的现象,则该猜想成立。
【答案】(1)> (2)70
(3)探究碱式碳酸铜制备的最佳水浴温度
(4)CuSO4溶液与Na2CO3溶液最佳体积比为5:6,水浴温度为70℃
(5) ①. 1 Cu2(OH)2CO3 2CuO +1 H2O+ 1CO2↑ ②. 80℃ ③. 澄清石灰水 ④. 110 mL水 ⑤. 固体颜色变暗,澄清石灰水变浑浊
【解析】
(1)由题文可知,碱式碳酸铜在酸性条件下不稳定,所以为了使生成的碱式碳酸铜稳定,实验过程中需保持反应体系的pH>7,保障反应体系不呈酸性,故填>。
(2)由控制变量法可知,变量只有一个,ii、iv、v的目的是探究制备碱式碳酸铜时CuSO4溶液与Na2CO3溶液最佳配比,其中的变量是Na2CO3溶液体积,则水浴温度应该相同,即x为70,故填70。
(3)由题文可知,实验i~iii的变量是水浴的温度,其它的量相同,则实验目的为探究碱式碳酸铜制备的最佳水浴温度,故填探究碱式碳酸铜制备的最佳水浴温度。
(4)碱式碳酸铜是翠绿色、难溶于水的固体,由图可知,生成碱式碳酸铜的最佳条件是实验ii,即CuSO4溶液与Na2CO3溶液最佳体积比为5:6,水浴温度为70℃,故填CuSO4溶液与Na2CO3溶液最佳体积比为5:6,水浴温度为70℃。
(5)①由质量守恒定律可知,碱式碳酸铜在加热条件下反应生成氧化铜、二氧化碳和水,故反应的完整的化学方程式写为:1 Cu2(OH)2CO3 2CuO +1 H2O+ 1CO2↑。
②由题文可知,实验iii是水浴的温度为80℃,所以该实验中水浴的温度也应为80℃,故填80℃;
碱式碳酸铜受热分解会生成CuO,同时生成二氧化碳,检验二氧化碳的生成应选择澄清石灰水,故填澄清石灰水;
实验iii中的反应体系中含有50mLCuSO4溶液和60mLNa2CO3溶液,所以该实验的反应体系也应该含有110mL液体,可以加入110mL水,故填110 mL水;
碱式碳酸铜受热分解会生成CuO,猜想颜色变暗的原因与该反应有关,如果固体颜色真的与该变化有关,即猜想成立,则出现的现象是固体颜色变暗,澄清石灰水变浑浊,故填固体颜色变暗,澄清石灰水变浑浊。
8. (2022北京门头沟二模)阅读下面科普短文。
84消毒液是一种以次氯酸钠(NaClO)为主要成分的高效消毒剂,广泛应用于杀灭细菌、病毒并抑制其传播,起到预防疾病的作用。1984年,北京第一传染病医院(地坛医院的前身)研制成功能迅速杀灭各类肝炎病毒的消毒液,定名为“84”肝炎洗消液,后更名为“84消毒液”。由于其消毒效果理想、价格低廉、使用方便,且具有广谱、高效的杀菌特点,深受大家的欢迎。84消毒液通常为无色或淡黄色液体,pH在12左右,有刺激性气味,有效氯含量为1.0%至6.5%不等。由于其有一定的刺激性和腐蚀性,浓度过高会损害呼吸道,危害身体健康,所以必须稀释后才能使用。一般认为,当杀菌率达到90%以上时,说明此时的消毒具有较好效果。表1、图1为某学校喷洒不同浓度的84消毒液,对教室进行消毒后的效果比较。
表1 不同浓度的84消毒液对教室的消毒效果
班级 一班 二班 三班 四班 五班 六班 七班 八班
喷洒消毒液的浓度(消毒液与水的体积比) 1:50 1:100 1:150 1:200 1:300 1:600 1:1000 作为对照不喷洒消毒液
菌落数 ① 2 2 4 6 10 19 45 53
② 3 3 5 4 11 18 42 50
③ 1 3 4 5 12 19 43 48
平均值 2 2.67 4.33 5 11 18.67 43.33 50.33
84消毒液除了具有腐蚀性,其使用过程中放出的氯气是一种有毒气体,有可能引起中毒。氯气主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,造成呼吸困难。症状重时,会发生肺水肿而致死亡。室内使用84消毒液后,可开窗通风一段时间。由于在酸性较高的条件下更易生成氯气,所以禁止将84消毒液与酸性物质混用,也不建议把84消毒液与洗涤剂或其他消毒液混合使用。84消毒液在日常生活中发挥着重要作用,我们要了解它的成分和原理,才能合理安全地使用。依据文章内容回答下列问题。
(1)84消毒液呈______(填“酸性”、“碱性”或“中性”)。
(2)84消毒液的物理性质为______(写一条即可)。
(3)结合表1和图1数据,关于不同浓度的84消毒液与其消毒效果可得到的结论为______。
(4)若想达到较好的消毒效果,同时又减少其对身体和环境的影响,学校喷洒消毒液浓度的最适合范围为______(填字母序号,下同)。
a.1:50~1:100 b.1:100~1:200 c.1:200~1:600 d.1:600~1:1000
(5)下列说法不正确是______。
A、浓度为1:1000的84消毒液不具有消毒效果
B、84消毒液可与洁厕灵(主要成分为HCl)混用
C、84消毒液名称由来是因为其中有效氯含量为84%
D、教室使用84消毒液消毒后,建议开窗通风一段时间
【答案】 ①. 碱性 ②. 无色或淡黄色液体;或有刺激性气味 ③. 在其他条件相同的情况下,在1:50至1:1000的喷洒浓度范围内,喷洒消毒液的浓度越低,消毒效果越差 ④. b ⑤. ABC
【解析】
(1)由资料可知,84消毒液pH在12左右,pH<7,显碱性;
(2)物理性质是不需要通过化学变化便能表现出来的性质,如物质的颜色、状态、气味、硬度、熔点、沸点、密度等,故84消毒液的物理性质为:无色或淡黄色液体,有刺激性气味;
(3)由图1可以看出,一班的杀菌率最高,由表1可以看出,在其他条件相同的情况下,在1:50至1:1000的喷洒浓度范围内,喷洒消毒液的浓度越低,菌落数越多,故得出的结论是:在其他条件相同的情况下,在1:50至1:1000的喷洒浓度范围内,喷洒消毒液的浓度越低,消毒效果越差;
(4)由资料可知,84消毒液浓度过高会损害呼吸道,危害身体健康,所以必须稀释后才能使用。一般认为,当杀菌率达到90%以上时,说明此时的消毒具有较好效果。由图1和表1可知,浓度在1:200以上时,杀菌率在90%以上,故浓度较低且杀菌效果较好的浓度为1:100~1:200。
故选b;
(5)A、由表1和图1可知,浓度为1:1000的84消毒液杀菌效果较差,但是也具有一定的消毒效果,符合题意;
B、84消毒液为碱性,洁厕灵(主要成分为HCl)为酸性,两者混用,会发生中和反应,失效,符合题意;
C、由资料可知,84消毒液命名是因为1984年,北京第一传染病医院(地坛医院的前身)研制成功,因此定名为“84”肝炎洗消液,后更名为“84消毒液”,符合题意;
D、由资料可知,84消毒液除了具有腐蚀性,其使用过程中放出的氯气是一种有毒气体,有可能引起中毒。氯气主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,造成呼吸困难。症状重时,会发生肺水肿而致死亡。因此室内使用84消毒液后,可开窗通风一段时间,不符合题意。
故选ABC。
9. (2022北京海淀二模)维生素 C 又称抗坏血酸,是一种重要的营养物质。兴趣小组进行维生素 C 相关的化学实验。
实验一:验证维生素C具有酸的性质
序号 操作 现象
a 向 2 mL 维生素 C 溶液中加入紫色石蕊溶液 溶液变成 色
b 向 2 mL 维生素 C 溶液中加入少量 NaHCO3 粉末 粉末消失,有气泡生成
(1)a 中的现象为溶液变成____色。
(2)b 中生成的气体是____。
实验二:探究不同烹饪方法对苹果中维生素C含量损失的影响
资料:
维生素 C 能和 KMnO4 溶液反应使之褪色,可利用该反应检测维生素 C 含量。研究表明,苹果中其他成分不影响检测。
进行下图所示实验,每次实验所用苹果片相同,实验记录如下表。
模拟烹 调方法 常温放置 糖拌(常温下加入 5 g 白糖,搅拌后放置) 炖(放入70℃水中) 煮(放入100℃水中)
处理时间 30 min 30 min 20 min 40 min 20 min 40 min
混合液色度 1 4 1 3 2 4
注:混合液色度越大,维生素 C 含量损失越大。
(3)糖拌时,维生素 C 含量损失_____(填“大”或“小”)。
(4)对比“炖”和“煮”的实验数据,得到结论:____。
(5)继续探究实验二中糖拌导致维生素 C 含量下降的原因。
①甲同学对比常温放置和糖拌中的物质,提出猜想:____和维生素 C 反应,导致苹果中维生素 C 含量下降。
②乙同学发现糖拌时有较多汁液渗出,猜测维生素 C 随汁液渗出是导致固体中维生素 C含量下降的原因。并通过实验证实了渗出液中含维生素 C,他的实验是:
步骤 1.常温下,向 5 mL 水中加入 5 g 白糖,溶解,放置 30 min,加入 10 mL 0.1% KMnO4 溶液,测定混合液色度略大于 4。
步骤 2.常温下,收集糖拌苹果片放置 30 min 后的全部渗出汁液,加水稀释至 5 mL,____。
【答案】 ①. 红 ②. CO2 ③. 大 ④. 其他条件相同,处理时间均为20分钟时或40分钟时,“炖”比“煮”的维生素含量损失小 ⑤. 白糖 ⑥. 加入 10 mL 0.1% KMnO4 溶液,测定混合液色度小于 4
【解析】
(1)若维生素C具有酸的性质,则能使紫色石蕊溶液变红,向 2 mL 维生素 C 溶液中加入紫色石蕊溶液,溶液变成红色。
(2)若维生素C具有酸的性质,则能与碳酸氢钠反应生成二氧化碳,观察到粉末消失,有气泡生成。
(3)由表中数据可知,糖拌时混合液色度大于常温放置时的混合液色度,故糖拌时,维生素 C 含量损失大。
(4)对比表中“炖”和“煮”的实验数据,可知其他条件相同,处理时间均为20分钟时或40分钟时,“炖”比“煮”的维生素含量损失小。
(5)①对比常温放置和糖拌中的物质,其他条件相同,只有白糖一个变量,故可猜想白糖和维生素 C 反应,导致苹果中维生素 C 含量下降。
②由题意可知,混合液色度越大,维生素 C 含量损失越大,要证明通过实验证实了渗出液中含维生素 C,则可设置对比实验,控制其他条件相同,只有苹果一个变量,则步骤2的具体操作为常温下,收集糖拌苹果片放置 30 min 后的全
专题18 探究题
【5年中考真题】
1. (2022北京中考)絮凝剂常用于水的净化,实验小组探究用絮凝剂净水时影响净化效果的因素。
【查阅资料】絮凝剂溶于水后能够吸附水中悬浮物并发生沉降,从而达到净水目的。硫酸铁是一种常见的絮凝剂。
【进行实验】
Ⅰ.配制水样和絮凝剂溶液
配制水样:向10L水中加入25g高岭土,搅拌、静置,取上层液作为水样。
配制絮凝剂溶液:用100mL水和5g硫酸铁进行配制。
Ⅱ.探究影响水样净化效果的因素
取水样,向其中加入絮凝剂溶液,搅拌,测定静置不同时间水样的浊度,并计算浊度去除率(浊度去除率越高代表净化效果越好)。实验记录如下:
实验序号 水样的体积/mL 加入絮凝剂溶液的体积/mL 静置时间/min 浊度去除率/%
① 200 0 20 12.48
② 200 0.2 20 76.54
③ 200 0.3 20 84.60
④ 200 0.4 5 64.45
⑤ 200 0.4 10 70.85
⑥ 200 0.4 15 81.04
⑦ 200 0.4 20 86.02
⑧ 200 0.5 20 88.15
⑨ 200 0.6 20 86.49
【解释与结论】
(1)配制絮凝剂溶液的操作如下图所示。
正确的操作顺序是______________(填序号),B中用玻璃棒搅拌的目的是______________。
(2)②中浊度去除率比①高的原因是______________。
(3)依据④~⑦得出的结论是______________。
(4)探究等量水样中加入絮凝剂溶液的体积对净化效果影响的实验是______________(填序号)。
【反思与评价】
(5)依据实验数据,不能得出“静置时间相同时,等量水样中加入絮凝剂溶液的体积越大,净化效果越好”的结论,其证据是______________。
2.(2021北京中考)(7分)硬水加热时易产生水垢,很多工业用水需要对硬水进行软化处理。小组同学利用1.5%的肥皂水比较水的硬度。
【查阅资料】硬水含较多可溶性钙、镁化合物;软水不含或含较少可溶性钙,镁化合物。
Ⅰ、探究水的硬度、肥皂水的用量与产生泡沫量的关系
【进行实验】向蒸馏水中加入CaCl2和MgCl2的混合溶液,配制两种不问硬度的硬水。
用蒸馏水和两种硬水完成三组实验,记录如下:
组别 第1组 第2组 第3组
实验操作
实验序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
混合溶液用量/滴 0 0 0 1 x 1 2 2 2
肥皂水用量/滴 5 10 20 5 10 20 5 10 20
产生泡沫量 少 多 很多 无 少 多 无 无 少
【解释与结论】
(1)对比②和⑧可知,肥皂水能区分软水和硬水,依据的现象是 。
(2)设计第2组实验时,为控制水的硬度相同,⑤中x应为 。
(3)第2组实验的目的是 。
(4)由上述三组实验得到的结论是 。
Ⅱ、比较不同水样的硬度
【进行实验】用四种水样完成实验,记录观察到泡沫产生时所需肥皂水的用量。
实验操作 水样 肥皂水用量/滴
市售纯净水 2
煮沸后的自来水 6
自来水 9
湖水 14
【解释与结论】
(5)硬度最大的水样是 。
(6)由上述实验可知,能将自来水硬度降低的方法有 。
(7)继续实验,发现山泉水的硬度大于自来水的硬度,其实验方案为 。
3.(2020北京中考)丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
I.探究丙酸钙的性质
进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
序号 ① ②
装置
现象 试管内壁有水雾 注入酸后,有气泡产生,石灰水变浑浊
【解释与结论】
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为________。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是_______。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
组别 第1组 第2组
序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
配方 面粉/ g 50 50 50 50 50 50 50 50
酵母/ g 0.75 0.75 0.75 0.75 0.75 0.75 0.75 0.75
蔗糖/ g 0 0 0 0 5 5 x 5
丙酸钙/g 0 0.06 0.10 0.15 0 0.06 0.10 0.15
开始发霉时间 第3天 第4天 第5天 第6天 第3天 第4天 第5天 第6天
【解释与结论】
(3)设计第1组实验的目的是____。
(4)第2组,⑦中x为_______。
(5)对比第1组、第2组实验可得到的结论是______。
【反思与评价】
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:_____。
4.(2019北京中考)下图“黑面包”实验中,蔗糖(C12H22O11)变黑,体积膨胀,变成疏松的炭,放出有刺激性气味的气体。
【提出问题】改变糖的种类、浓硫酸的体积、水的滴数和温度是否会影响实验效果呢
【进行实验】分别取5g糖粉进行实验,根据前2min的现象对实验效果进行评分,
记录如下:
表1实验记录
实验 糖 浓硫酸体积/mL 水的滴数 温度/℃ 效果得分
1 蔗糖 4 5 22 65
2 蔗糖 5 10 30 81
3 蔗糖 6 15 50 93
4 冰糖 4 10 50 91
5 冰糖 5 15 22 88
6 冰糖 a 5 30 75
7 葡萄糖 4 15 30 0
8 葡萄糖 5 5 50 0
9 葡萄糖 6 10 22 0
【处理数据】分析表1,计算效果得分均值,结果如下:
表2效果得分均值
因素 糖 浓硫酸体积/mL 水滴数 温度/℃
蔗糖 冰糖 葡萄糖 4 5 6 5 10 15 22 30 50
均值 79.7 84.7 0 52.0 56.3 56.0 46.7 57.3 60.3 51.0 52.0 61.3
依据均值推断最佳实验方案,均值越高,效果越好。
【解释与结论】
(1)蔗糖变成黑色的炭,发生了_____________(填“物理”或“化学”)变化。
(2)推测放出的气体含SO2,从元素守恒角度说明理由:________________________________。
(3)实验6中,a为_____________mL。
(4)根据表2推断,“黑面包”实验最好选择5g冰糖、5mL浓硫酸、_____滴水和50℃
【反思与评价】
(5)表2中,22℃对应的均值为51.0,计算该值所依据的3个数据分别是_____________________。
(6)综合分析,使实验3的效果得分高于实验4的因素有________________________________。
5.(2018北京中考)为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+ H2SO4 = CuSO4 + H2O + Cu
【进行实验】
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 1-1 1-2
装置
反应后物质的颜色、状态 黑色粉末中混有少量红色固体 红色固体有金属光泽,混有极少量,黑色物质
实验2:取一定量的混合物,用1—2装置进行实验。
序号 木炭粉与氧化铜质量比 反应后物质的颜色、状态
2-1 1:9 红色固体有金属光泽 混有少量黑色物质
2-2 1:10 混有很少量黑色物质
2-3 1:11 混有极少量黑色物质
2-4 1:12 无黑色物质
2-5 1:13 混有较多黑色物质
【解释与结论】
(1)配平化学方程式: ___ C+ ___ CuO高温___ Cu+ ___ CO2↑。
(2)实验1—2中,证明产生CO2的现象是 _______________________ 。
(3)实验1的目的是 __________ 。
(4)实验2的结论是 _____________ 。
【反思与评价】
(5)实验2没有进行质量比为1:14的实验,理由是 ________________ 。
(6)为检验2—4的红色固体中是否含Cu2O,所需试剂是 __________ 。
【1年模拟题】
1. (2022北京大兴二模)实验小组同学对铁生锈的条件和影响因素进行探究。
【进行实验】
实验1:如下图所示进行实验,一段时间后观察到C中铁钉生锈,A、B中铁钉无明显变化。
实验2:为进一步探究影响铁生锈速率的因素,小组同学设计如图所示实验,利用传感器监测过程中氧气浓度的变化来判断铁生锈的情况。
实验记录如下:
序号 其他试剂 初始时氧气浓度/% 200s时氧气浓度/%
水/滴 食盐质量/g 稀醋酸/滴
① 0 0 0 20.8 20.8
② 10 0 0 20.8 15.2
③ 10 0 5 20.8 12.7
④ 10 1.0 0 20.8 8.0
【解释与结论】
(1)铁生锈属于______(填“物理变化”或“化学变化”)。
(2)由实验1能得出“与H2O接触是铁生锈条件之一”的结论,依据的实验现象是______。
(3)实验2,①中200s时氧气浓度没有发生变化的原因是______。
(4)由实验2得出“食盐能加速铁生锈”结论,依据的实验是______(填序号)。
(5)实验2,设计②③的目的是______。
【反思与评价】
(6)小明欲进一步探究NaOH稀溶液对铁生锈速率是否有影响,他又补充设计了如下实验:
其他试剂 初始时氧气浓度/% 200s时氧气浓度/%
水/滴 食盐质量/g 稀醋酸/滴 NaOH稀溶液/滴
5 20.8
该实验中水、食盐、稀醋酸的量分别是______。
2. (2022北京朝阳一模)化学小组对市售“茶垢清洁剂”进行如下探究。
【查阅资料】
①使用方法:将“茶垢清洁剂”粉末倒入容器中,加入50℃~70℃的水,浸泡10分钟,清水冲洗即可。
②过碳酸钠是常用的洗涤助剂。它是白色固体,溶于水时分解生成碳酸钠和过氧化氢。
实验1:验证“茶垢清洁剂”的主要成分是过碳酸钠
【进行实验】在分液漏斗a中加入新配制的“茶垢清洁剂”的饱和溶液。
实验装置 实验步骤 实验现象 实验结论
Ⅰ.打开分液漏斗a的活塞,加入适量溶液后,关闭活塞,然后_______。 产生大量气泡,带火星的木条复燃 “茶垢清洁剂”的主要成分是过碳酸钠
Ⅱ.待Ⅰ中反应停止后,打开分液漏斗b的活塞,加入适量溶液后,关闭活塞,将生成的气体通入澄清石灰水。 产生大量气泡,澄清石灰水变浑浊
【解释与结论】
(1)步骤I,关闭活塞后进行的实验操作是_______,产生大量气泡的化学方程式为_______。
(2)步骤Ⅱ,分液漏斗b中的液体是_______,依据步骤Ⅱ的现象得出的结论是_______。
实验2:探究影响过碳酸钠去茶渍效果的因素
【进行实验】25℃时,取洗碗基料15g于洗碗机中,分别加人不同质量的过碳酸钠,按照不同洗涤模式对具有相同茶渍的茶杯进行洗涤,洗涤后根据去茶渍效果打分,分数越高效果越好,记录如下:
组别 第1组(常规洗涤模式) 第2组(快洗模式)
实验序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
过碳酸钠用量/g 0 1 2 3 0 1 2 3
水的硬度/mg·kg 250 250 250 250 250 250 250 250
pH 11 11 11 11 11 11 11 11
去茶渍效果打分 2 5 7 9 2 4 6 8
【解释与结论】
(3)对比②和⑥可知,常规洗涤模式比快洗模式去茶渍效果好,依据是_______。
(4)第1组实验的目的是_______。
(5)生活中碳酸钠也是常用洗涤剂。继续实验,发现碳酸钠比过碳酸钠去茶渍效果差,其实验方案是:在25℃、水的硬度为250mg·kg-1、pH为11的条件下,取洗碗基料15g于洗碗机中,加入2g碳酸钠,_______。
3. (2022北京丰台一模)食品脱氧剂主要成分有铁粉、活性炭、氯化钠,发生脱氧反应消耗食品包装袋内的氧气延长食品保质期。实验小组探究脱氧反应发生条件和影响脱氧反应速率的因素。
实验一 探究脱氧反应发生条件
按图1所示装置进行实验,利用氧气传感器测定密闭容器中氧气含量变化,如图2所示。
(1)结合图2分析,集气瓶②中铁粉发生脱氧反应的依据是______。
(2)实验一得出的结论是发生脱氧反应需要铁粉与氧气和______同时接触。
实验二 探究氯化钠、活性炭用量对脱氧反应速率的影响
室温下,利用5g铁粉和10滴水,改变活性炭和氯化钠的用量(见下表),用氧气传感器测定密闭容器中氧气含量变化,实验结果如图3、图4所示。
实验编号 铁粉/g 活性炭/g 氯化钠/g
1 5 0 1
2 5 0.75 0
3 5 0.75 1
4 5 1.5 1
5 5 a 2
(3)实验5中,a=______。
(4)实验1、3、4的目的是______。
(5)结合图4,对比实验2、3、5可以得到的结论是______。
实验三 探究硅藻土的用量对脱氧反应速率的影响
脱氧剂中还经常添加硅藻土,主要作用是吸附水分, 同时疏松配料,使铁粉更易于与氧气接触。室温下,在一定量的脱氧剂中加入不同质量的硅藻土,测定密闭容器中氧气耗尽所需时间,如图5所示。
(6)由图5可知,硅藻土用量和氧气耗尽所需时间的关系是______。
(7)结合以上实验分析,脱氧剂的反应速率还可能受哪些因素影响______(写出一条即可)。
4. (2022北京东城一模)实验小组探究金属与酸的置换反应。
【进行实验】
(1)实验1:向分别盛有Fe片、Cu片的试管中加入稀盐酸。
①Fe与稀盐酸发生反应,化学方程式为______。
②Cu与稀盐酸不反应,原因是______。
(2)实验2:探究Fe与硫酸的反应(Fe片大小相同且已除去表面氧化膜;硫酸溶液体积相等)
序号 药品 现章
① Fe片+硫酸溶液(V浓硫酸:V水=1:2) 快速产生气泡
② Fe片+硫酸溶液(V浓硫酸:V水=1:200) 缓慢产生气泡
③ Fe片+硫酸溶液(V浓硫酸:V水=1:200000) 无气泡产生
①对比实验①和②,可得到的结论是______。
②实验③中没有气泡产生的原因是______。
(3)实验3:探究Cu与浓盐酸的反应
用如下装置进行实验(硫酸溶液与浓盐酸中H+的浓度接近)。
装置 序号 药品 现象
④ 浓盐酸 24小时后仍无明显变化
⑤ Cu粉+硫酸溶液 24小时后得无明显变化
⑥ Cu粉+浓盐酸 24小时后气球变鼓
【解释与结论】
① ④是对照实验,目的是排除______的干扰。
② 点燃⑥中气球内的气体,发出爆鸣声,则⑥中气球变鼓是因为生成了______;经检测,⑥反应后的溶液中主要成分是H3CuCl4。
【反思与评价】
③综合以上实验,请写出你对金属与酸的置换反应的新认识______。
5. (2022北京房山二模)食用油是厨房中常见的食材,小组同学针对食用油的变质问题进行了探究。
【查阅资料】
①食用油不易溶于水,能溶于酒精和醋酸中。白酒和白醋的主要成分分别为酒精和醋酸。
②食用油变质后产生的过氧化物可使碘化钾淀粉试纸由白色变为蓝色。
Ⅰ.检验食用油是否变质
【进行实验】
ⅰ.空白对照组
实验操作 试剂 现象
52°白酒 碘化钾淀粉试纸不变色
白酷 碘化钾淀粉试纸不变色
ⅱ.对比实验组
实验操作
实验序号 1-1 1-2 1-3 1-4 1-5 1-6
溶剂 52°白酒 52°白酒 52°白酒 白醋 白醋 白醋
油样 新油 过期油 煎炸过的老油 新油 过期油 煎炸过的老油
现象 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸变为蓝色 碘化钾淀粉试纸轻微变蓝
【解释与结论】
(1)食用油中常含有 C18H34O2、C18H32O2、C16H32O2等,这些物质的相同点是_______ (写出一点即可)。
(2)依据空白对照组可知,用 52°白酒和白醋作溶剂 _____(填“会”或“不会”)影响实验结果。
(3)由对比实验组可知,适宜的溶剂为 _______。
(4)经上述实验检验,已经发生变质的是_____(填序号)。
A. 新油 B. 过期油 C. 煎炸过的老油
Ⅱ.去除食用油中过氧化物的方法
【进行实验】
实验方法 2-1隔绝氧气自降解法 2-2还原降解法
实验操作 在隔绝氧气条件下,取四份相同体积、不同温度的食用油,分别恒温放置,每隔一段时间测定油样的过氧化值。 30℃时,取若干份相同体积的食用油,添加不同质量的还原剂(半胱氨酸),测定油样的过氧化值。
实验结果
【解释与结论】
(5)设计实验 2-1 的目的是_______。
(6)由实验 2-2 得到的结论是______。
【反思与评价】
(7)根据上述实验,请从食用油的加工、储存或使用等方面,提出一条合理建议:______。
6. (2022北京丰台二模)“固体酒精”是乙醇、硬脂酸、NaOH 混合而成的一种燃料,同学们对制备“固体酒精”的最佳反应条件进行了探究。
【查阅资料】制备“固体酒精”的工艺流程如下:
实验 1 探究加料方式对制备“固体酒精”的影响
一定温度下,乙醇、硬脂酸、NaOH 用量相同时,用不同的加料方式进行实验,实验现象记录如下:
实验序号 ① ② ③
加料方式 硬脂酸和NaOH同时加入乙醇 先将硬脂酸溶于乙醇,再加入NaOH 将硬脂酸和NaOH分别充分溶于2份乙醇后,再混合
完全溶解所需时间 60min 45min 30min
实验 2 探究制备“固体酒精”的最佳温度
在不同温度下,乙醇、硬脂酸、NaOH 用量相同时,用最佳加料方式进行实验,实验现象记录如下:
实验序号 温度/℃ 现象
④ 30 混合后立即生成“固体酒精”,产品不能混合均匀
⑤ 40 混合后立即生成少量“固体酒精”,产品局部混合不均匀
⑥ 60 混合后不立刻生成“固体酒精”,可以混合均匀
实验 3 探究硬脂酸的含量对“固体酒精”燃烧时凝固性能的影响
在最佳温度下,用最佳加料方式进行实验制备“固体酒精”并点燃,实验现象记录如下:
实验序号 乙醇/g 硬脂酸/g 氢氧化钠/g 燃烧现象
⑦ 96 3 1 熔化流淌
⑧ 93 6 1 少量熔化流淌
⑨ X 6.5 1 不熔化流淌
【解释与结论】
(1)硬脂酸与氢氧化钠混合后发生如下化学反应,补全化学方程式:______。
(2)在较高温度下,上述反应生成硬脂酸钠(C17H35COONa)均匀地分散在乙醇中,冷却后形成“固体酒精”。由此可知,“固体酒精”______固态乙醇(填“是”或“不是”)。
(3)实验 1 中,③为最佳加料方式的依据是______。
(4)实验 2 中,生成“固体酒精”过快,会导致产品均匀性较差,因此制备“固体酒精”的最佳温度是______
(5)实验⑨,x=______。
(6)实验 3,对比实验⑦~⑨得出的结论是______。
(7)下列关于“固体酒精”的说法正确的是______(填字母序号)。
A.“固体酒精”燃烧时保持固体状态提高了其使用时的安全性
B.“固体酒精”的优点之一是便于运输、携带
C.评价“固体酒精”的优劣还需考虑燃烧时长和热值
D.评价“固体酒精”的优劣还需考虑燃烧时是否产生黑烟异味
7. (2022北京海淀二模)碱式碳酸铜〔Cu2(OH)2CO3〕是孔雀石的主要成分,主要用于生产油漆、颜料等。兴趣小组探究碱式碳酸铜制备的最佳实验条件。
【查阅资料】碱式碳酸铜是翠绿色、难溶于水的固体,酸性条件下不稳定。
【进行实验】按下表中的数据进行图示实验,记录实验结果。
序号 CuSO4溶液体积/mL Na2CO3溶液体积/mL 水浴温度/℃ 固体颜色
i 50 60 60 蓝绿
ii 50 60 70 翠绿
iii 50 60 80 暗绿
iv 50 70 70 蓝绿
v 50 50 x 蓝绿
【解释与结论】
(1)为了使生成的碱式碳酸铜稳定,实验过程中需保持反应体系的pH___________7(填“<”或“>”)。
(2)ii、iv、v的目的是探究制备碱式碳酸铜时CuSO4溶液与Na2CO3溶液最佳配比,x=___________。
(3)设计i~iii的目的为___________。
(4)由表中数据知,制备碱式碳酸铜的最佳实验条件是___________。
【反思与评价】
(5)iii中所得固体颜色偏暗。查阅资料知碱式碳酸铜受热分解会生成CuO,猜想颜色变暗的原因与该反应有关。
①请将碱式碳酸铜分解反应的化学方程式补充完整:___________
②利用如图装置进行实验证明上述猜想。请在图中将实验方案补充完整___________、___________、___________,并说明:若出现___________的现象,则该猜想成立。
8. (2022北京门头沟二模)阅读下面科普短文。
84消毒液是一种以次氯酸钠(NaClO)为主要成分的高效消毒剂,广泛应用于杀灭细菌、病毒并抑制其传播,起到预防疾病的作用。1984年,北京第一传染病医院(地坛医院的前身)研制成功能迅速杀灭各类肝炎病毒的消毒液,定名为“84”肝炎洗消液,后更名为“84消毒液”。由于其消毒效果理想、价格低廉、使用方便,且具有广谱、高效的杀菌特点,深受大家的欢迎。84消毒液通常为无色或淡黄色液体,pH在12左右,有刺激性气味,有效氯含量为1.0%至6.5%不等。由于其有一定的刺激性和腐蚀性,浓度过高会损害呼吸道,危害身体健康,所以必须稀释后才能使用。一般认为,当杀菌率达到90%以上时,说明此时的消毒具有较好效果。表1、图1为某学校喷洒不同浓度的84消毒液,对教室进行消毒后的效果比较。
表1 不同浓度的84消毒液对教室的消毒效果
班级 一班 二班 三班 四班 五班 六班 七班 八班
喷洒消毒液的浓度(消毒液与水的体积比) 1:50 1:100 1:150 1:200 1:300 1:600 1:1000 作为对照不喷洒消毒液
菌落数 ① 2 2 4 6 10 19 45 53
② 3 3 5 4 11 18 42 50
③ 1 3 4 5 12 19 43 48
平均值 2 2.67 4.33 5 11 18.67 43.33 50.33
84消毒液除了具有腐蚀性,其使用过程中放出的氯气是一种有毒气体,有可能引起中毒。氯气主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,造成呼吸困难。症状重时,会发生肺水肿而致死亡。室内使用84消毒液后,可开窗通风一段时间。由于在酸性较高的条件下更易生成氯气,所以禁止将84消毒液与酸性物质混用,也不建议把84消毒液与洗涤剂或其他消毒液混合使用。84消毒液在日常生活中发挥着重要作用,我们要了解它的成分和原理,才能合理安全地使用。依据文章内容回答下列问题。
(1)84消毒液呈______(填“酸性”、“碱性”或“中性”)。
(2)84消毒液的物理性质为______(写一条即可)。
(3)结合表1和图1数据,关于不同浓度的84消毒液与其消毒效果可得到的结论为______。
(4)若想达到较好的消毒效果,同时又减少其对身体和环境的影响,学校喷洒消毒液浓度的最适合范围为______(填字母序号,下同)。
a.1:50~1:100 b.1:100~1:200 c.1:200~1:600 d.1:600~1:1000
(5)下列说法不正确是______。
A、浓度为1:1000的84消毒液不具有消毒效果
B、84消毒液可与洁厕灵(主要成分为HCl)混用
C、84消毒液名称由来是因为其中有效氯含量为84%
D、教室使用84消毒液消毒后,建议开窗通风一段时间
9. (2022北京海淀二模)维生素 C 又称抗坏血酸,是一种重要的营养物质。兴趣小组进行维生素 C 相关的化学实验。
实验一:验证维生素C具有酸的性质
序号 操作 现象
a 向 2 mL 维生素 C 溶液中加入紫色石蕊溶液 溶液变成 色
b 向 2 mL 维生素 C 溶液中加入少量 NaHCO3 粉末 粉末消失,有气泡生成
(1)a 中的现象为溶液变成____色。
(2)b 中生成的气体是____。
实验二:探究不同烹饪方法对苹果中维生素C含量损失的影响
资料:
维生素 C 能和 KMnO4 溶液反应使之褪色,可利用该反应检测维生素 C 含量。研究表明,苹果中其他成分不影响检测。
进行下图所示实验,每次实验所用苹果片相同,实验记录如下表。
模拟烹 调方法 常温放置 糖拌(常温下加入 5 g 白糖,搅拌后放置) 炖(放入70℃水中) 煮(放入100℃水中)
处理时间 30 min 30 min 20 min 40 min 20 min 40 min
混合液色度 1 4 1 3 2 4
注:混合液色度越大,维生素 C 含量损失越大。
(3)糖拌时,维生素 C 含量损失_____(填“大”或“小”)。
(4)对比“炖”和“煮”的实验数据,得到结论:____。
(5)继续探究实验二中糖拌导致维生素 C 含量下降的原因。
①甲同学对比常温放置和糖拌中的物质,提出猜想:____和维生素 C 反应,导致苹果中维生素 C 含量下降。
②乙同学发现糖拌时有较多汁液渗出,猜测维生素 C 随汁液渗出是导致固体中维生素 C含量下降的原因。并通过实验证实了渗出液中含维生素 C,他的实验是:
步骤 1.常温下,向 5 mL 水中加入 5 g 白糖,溶解,放置 30 min,加入 10 mL 0.1% KMnO4 溶液,测定混合液色度略大于 4。
步骤 2.常温下,收集糖拌苹果片放置 30 min 后的全部渗出汁液,加水稀释至 5 mL,____。
10. (2022北京门头沟二模)兴趣小组用稀盐酸除去铁钉表面的铁锈(主要成分是Fe2O3),发现反应开始时铁锈消失,有气泡产生,溶液颜色为黄色,一段时间后变为浅绿色。
【查阅资料】FeCl3的溶液呈黄色
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
实验编号 实验1-1 实验1-2 实验1-3
实验操作
实验现象 长时间放置,溶液颜色始终为黄色 长时间放置,溶液逐渐从黄色变浅绿色 长时间放置,产生红褐色沉淀
(1)用盐酸除铁锈的化学方程式为 _________ 。
(2)实验1-1的目的是 _________ 。
(3)综合分析实验1,溶液从黄色变浅绿色的可能原因是 _________ 。
乙同学用生锈程度相同的锈铁钉、5mL盐酸探究溶液颜色变化的影响因素。
实验编号 所用试剂 实验现象
反应开始时 24h后
2-1 铁锈和2%盐酸 铁锈、溶液均无明显变化 铁锈消失,溶液变黄色
2-2 生锈铁钉和2%盐酸 生锈铁钉、溶液均无明显变化 铁锈消失,溶液变浅绿色
2-3 生锈铁钉和6%盐酸 铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色 溶液变为浅绿色
2-4 生锈铁钉和10%盐酸 铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色 溶液变为浅绿色
(4)生锈铁钉与盐酸反应时,溶液的颜色变化与 ________ 有关。
(5)2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为 ______ 。
(6)基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是 ______ (填字母 序号)。
A 除铁锈时,所用盐酸的浓度越大越好
B 在除锈过程中,生成的FeCl3对铁也有腐蚀作用
C 用盐酸除锈时,应注意控制反应的时间
11. (2022北京密云二模)高纯CO可用于半导体领域某些芯片的刻蚀,利用甲酸(HCOOH)制取高纯CO的主要流程如图:
(1)甲酸中含有___________种元素。
(2)反应器中甲酸发生分解反应,生成一氧化碳和水,写出此反应的化学方程式___________。
(3)同时,反应器中还会发生副反应产生微量的CO2气体,这些CO2是在___________(填写设备名称)中被除去。
12. (2022北京密云二模)以镁矿石(主要成分为MgCO3和SiO2,其中SiO2难溶于水和常见的酸)为原料生产MgO的工艺流程如图,回答问题:
(1)在“酸浸”环节加入过量稀硫酸的目的是___________。
(2)“沉镁”环节物料之间反生了复分解反应: ,“沉镁”后过滤(Ⅱ)所得的滤液中一定不含有硫酸,理由是___________。
(3)“加热”环节,在不同温度下,充分加热等质量的Mg(OH)2,测得如图2是所示容器内剩余固体质量变化情况。“加热”时温度至少要达到350℃,原因是___________。
13. (2022北京密云二模)某兴趣小组对铁生锈的影响因素进行探究。
实验1:探究铁生锈的条件
【进行实验】
如图所示,取三根洁净无锈的铁钉,分别放置在三个不同环境中,一周后观察铁钉生锈情况并记录如下。
实验 A B C
现象 在液面附近,铁钉生锈严重 铁钉无明显变化 铁钉无明显变化
【解释与结论】
(1)对比实验_______(填序号),可以得出铁生锈与水有关。
(2)由上述实验可知,铁生锈的条件是_______。
实验2:探究NaCl溶液的浓度对铁生锈速率的影响
【进行实验】
室温下,取大小、形状相同的光亮铁丝,用下图装置完成实验并记录如下。
实验 编号 烧瓶内液体(用于浸润铁丝)用量 放置不同时间,导管内液面上升高度(cm)
1小时 2小时 3小时
① 2.0mL蒸馏水 0.1 0.7 3.2
② 1.5mL蒸馏水+0.5mL10%NaCl溶液 0.3 1.5 5.0
③ 1.0mL蒸馏水+amL10%NaCl溶液 0.8 3.3 7.9
④ 0.5mL蒸馏水+1.5mL10%NaCl溶液 1.1 4.7 9.1
⑤ 2mL10%NaCl溶液 0 0 0
【解释与结论】
(3)导管内液面上升的原因是_______。
(4)a=_______。
(5)依据实验①~④,可以得出的结论是_______。
【反思与评价】
(6)小组同学重复实验⑤,得到以下数据:
烧瓶内液体(用于浸润铁丝)用量 放置不同时间,导管内液面上升高度(cm)
1小时 2小时 3小时
2mL10%NaCl溶液 1.4 5.7 10.0
则原实验⑤失败的可能原因是_______。
(7)综合上述实验结果,铁制品的防护需尽量避免与水、氧气、_______接触。
14. (2022北京平谷一模)钙是人体所需的重要元素之一、某化学小组用常见的补钙剂进行如下实验。
【查阅资料】
1 白醋的主要成分是醋酸(CH3COOH),可与碳酸钙反应,不与补钙剂中的其他成分反应。
2 ppm常用来表示气体的浓度,数值越大,说明气体的浓度越高。
实验1:验证补钙剂能与白醋反应。
【进行实验】
装置 现象
试管中的固体逐渐减少,有气泡产生,烧杯中烧杯中石灰水变浑浊
【解释与结论】
(1)烧杯中石灰水变浑浊,用化学方程式解释产生这一现象的原因_______。
(2)由此推测补钙剂中的主要成分含有_______。
【小组交流】分组实验中,同学们发现产生气泡的速率不同,于是进行了如下探究。
实验2:探究影响补钙剂与白醋反应速率的因素。
【进行实验】室温条件下进行实验,记录如下:
实验操作 组别 实验 序号 补钙剂形态 白醋中醋酸浓度(g/100 mL) 二氧化碳浓度随 时间的变化曲线
第1组 ① 片状 6
② 片状 3
第2组 ③ 粉末 6
④ 粉末 3
【解释与结论】
(3)设计第1组实验的目的是_______。
(4)上述实验中,反应速率最快的是③,其理由是_______。
【反思与评价】
(5)继续实验,发现温度对该反应速率有影响。进行实验时,需要控制相同的因素是_______(填序号)。
A. 补钙剂的质量 B. 补钙剂形态 C. 温度 D. 白醋的体积 E. 白醋中醋酸浓度
(6)若人体缺少钙元素易患_____病。
A. 骨质疏松 B. 贫血 C. 佝偻病
15. (2022北京石景山二模)实验小组的同学探究不同的配制方法对紫色石蕊溶液显色的影响。
【查阅资料】石蕊能溶于水或乙醇中。
【进行实验1】分别用某品牌的石蕊1g进行4种方法的石蕊溶液配制。
方法 蒸馏水体积/mL 操作 石蕊溶液 溶液颜色
① 100 搅拌,静置1h,过滤 滤液 紫色
② 100 煮沸后过滤 滤液 紫色
③ 100 搅拌,静置24h,过滤 滤液 紫色
④ 50 搅拌,静置24h,过滤 滤液加30mL乙醇,再加蒸馏水稀释至100mL 紫色
【解释与结论】
(1)方法①配制的石蕊溶液中,溶质是______。
(2)方法④中,加蒸馏水稀释至100mL时,加入的蒸馏水体积大于20mL。说明分子具有的性质是______。
【进行实验2】用4种方法配制的石蕊溶液进行显色实验:向被测溶液中滴加石蕊溶液。
被试溶液 方法① 方法② 方法③ 方法④
10%盐酸 红 红 红 浅红
饱和二氧化碳溶液 浅红 浅红 浅红 不明显
饱和碳酸钠溶液 蓝 蓝 蓝 浅蓝
澄清石灰水 蓝 蓝 蓝 浅蓝
【解释与结论】
(3)通过实验可得出饱和碳酸钠溶液呈______(填“酸性”或“碱性”)。
(4)向饱和二氧化碳溶液中滴加石蕊溶液呈浅红色,用化学方程式解释其原因:______。
(5)进行实验2时,需要控制的相同条件是:取用被测溶液的体积相同、______。
【反思与评价】
(6)经实验证明,配制方法④的滤渣中还有较多未溶解的石蕊。实验方案是:向滤渣中加入50mL蒸馏水,______。
(7)用方法④配制的石蕊溶液进行显色实验时现象不明显,原因可能是______。
16. (2022北京石景山一模)含氯消毒剂是常用的消毒剂种类之一。实验室可以利用电解食盐水的稀溶液制备主要成分为次氯酸钠(NaClO)的含氯消毒剂,实验小组对适宜的实验条件进行了如下探究。
【查阅资料】
ⅰ、0.5 g/L(以有效氯含量计)的含氯消毒剂可用于一般物品的消毒。
ⅱ、工业上常用电解饱和食盐水制取氢氧化钠和氯气(Cl2),反应的化学方程式为,Cl2 有刺激性气味。
【进行实验】在烧杯中,电极长度 40 mm、电极间距 10 mm 的条件下,电解 300 mL不同浓度的食盐水,并分别取样测定其有效氯含量,数据结果如下:
实验 食盐水浓度/(g/L) 电压/V 电解时长/min 有效氯含量/(g/L)
1 20 3 150 0.09
2 20 6 150 0.65
3 20 9 150 0.72
4 20 12 150 0.77
5 40 6 20 0.41
6 40 6 40 0.67
7 a 6 80 0.10
8 40 6 150 1.55
9 50 6 150 2.25
【解释与结论】
(1)补全实验室电解食盐水的稀溶液反应的化学方程式:______。
(2)表中 a 的数值为______。
(3)进行实验 1-4 的目的是______。
(4)相同条件下,随着食盐水浓度增大,所得溶液中有效氯含量增大,依据的实验是______(填序号)。
【反思与评价】
(5)实验 9 电解过程中可闻到刺激性气味,其原因可能是______。
(6)在上述实验条件下,依据已有的实验数据分析,制备 0.5 g/L(以有效氯含量计)的含氯消毒剂较为适宜的条件为:电解时长 30 min 左右,食盐水浓度和电压分别为______。
17. (2022北京顺义一模)化学小组的同学在学习了铁生锈的条件后,对暖宝宝的成分(如图1)感到好奇,请参与他们的探究活动。
【查阅资料】
(1)暖宝宝的发热原理是铁粉腐蚀过程中放出热量;加入活性炭能形成微电池,反应更快。
(2)铁的腐蚀分为析氢腐蚀和吸氧腐蚀两种:
①铁在硫酸等酸性条件下发生析氢腐蚀。反应的化学方程式为______。
②铁吸氧腐蚀的总反应为4Fe+3O2+______=4Fe(OH)3,请补全反应的化学方程式。
【提出问题】
哪些因素会影响铁吸氧腐蚀的速率
【设计实验】
小组同学设计了图2所示的实验装置,进行如下5组实验。
【实验记录】
每组实验加入铁炭总质量为24g,食盐水体积为7.5mL,恰好能将固体润湿。
因素 序号 铁炭质量比 食盐水浓度/% 示数差3cm 所用时间/s 10分钟时 温度升高值/oC
1 2:1 26 90 7.8
2 4:1 26 170 4.2
3 6:1 26 190 3.3
4 2:1 13 140 6
5 2:1 6.5 140 6
【解释与结论】
(1)通过实验发现,铁炭质量比对铁吸氧腐蚀速率的影响是______。
(2)分析食盐水浓度对铁吸氧腐蚀速率的影响应对比实验______(填实验序号)。
(3)示数差3cm是指U型管左侧液面上升3cm。U型管内液面向左偏移的原因是______。
【反思与评价】
(1)有同学提出应该再加一组实验,研究铁炭质量比为2:1、食盐水浓度为3.3%时的实验数据,你觉得是否有必要,并说明理由______。
(2)依据上述数据,你认为制作发热贴应选择的原料配比,并说明理由______。
18. (2022北京延庆一模)北京冬奥会期间,各国运动健儿在比赛的同时,足不出村享受着中国美食,而一道道豆腐菜品也征服了各国健儿的胃。豆腐的制作工艺有多种,其中应用盐卤[主要成分氯化镁(MgCl2)]制作豆腐是一种比较成熟的工艺。
Ⅰ.查阅资料:
①豆腐的制作过程为
②氯化镁,无色六角晶体,通常含有六个分子结晶水,即MgCl2·6H2O,易潮解,有一定腐蚀性,加热时失水和氯化氢而成氧化镁。在工业生产、医药、视频等方面有广泛应用。
(1)实验室中,氯化镁的保存方法为_______。
Ⅱ.实验小组利用氯化镁代替盐卤,配制溶液,通过实验探究制作中影响豆腐口感的因素。
准确称取预处理的500g大豆,按照不同的料液比(黄豆的质量:水的质量)进行磨浆,在不同的温度下,使用不同量的盐卤,最后压制30分钟进行实验,并根据豆腐的形状、质地、口感等进行评分。
实验编号 温度(℃) 盐卤用量(mg·mL -1) 料液比 口感评分
第一组 1 85 48 1:4 70
2 85 48 1:5 88
3 85 48 1:6 80
第二组 4 85 44 1:5 83
5 85 52 1:5 75
第三组 6 80 a 1:5 76
7 90 48 1:5 72
(2)在点浆时,盐卤分3~4次加入豆浆中,同时不断搅拌,搅拌的目的是:_______。
(3)进行第一组实验的目的是:_______。
(4)为研究温度对豆腐口感的影响,应该对比的实验为:__(填实验编号)。实验6中a=__。
(5)通过实验,得出实验室制作出口感好的豆腐的最佳实验条件为:_______。
(6)你认为影响豆腐口感的因素还有哪些?_______(至少说出一条)。
19. (2022北京通州一模)柠檬的果皮、籽、果肉中均含有大量的柚皮苷和柠檬苦素类似物等苦味物质,在榨汁过程中常出现苦味,为了寻求去除苦味的方法,化学小组进行了实验,探究树脂添加量、脱苦时间、温度对其脱苦率的影响。
【进行实验】
实验一:室温下,分别取20 mL鲜榨柠檬汁进行实验,探究树脂添加量、脱苦时间与脱苦率的关系。记录如下:
组别 第1组 第2组 第3组
树脂添加量/g 0.04 0.06 0.08 0.04 x 0.08 0.04 0.06 0.08
脱苦时间/min 20 20 20 25 25 25 30 30 30
脱苦率(%) 20.4 22.7 23.4 28.5 30.1 34.7 36.8 39.8 40.3
实验二:分别在20 mL鲜榨柠檬汁中加入一定质量的树脂,脱苦时间相同,探究温度与脱苦率的关系。记录如下:
实验序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
树脂添加量/g 0.04 0.04 0.04 0.06 0.06 0.06 0.08 0.08 0.08
温度/℃ 20 30 40 20 30 40 20 30 40
脱苦率(%) 22.4 23.7 22.5 39.2 44.7 42.1 48.7 49.6 49.0
【解释与结论】
(1)实验一中,x应为_____。
(2)实验一中第3组的实验目的是_____。
(3)由实验一得到的结论是_____。
(4)实验二中探究温度与脱苦率的关系,可选做的实验是______(填实验序号) 。
(5)根据以上实验数据分析,柠檬榨汁过程中脱苦效果最好的实验条件是_____(填序号)。
A. 30min 0.08g 40℃ B. 30min 0.08g 30℃
C. 20min 0.04g 30℃ D. 25min 0.06g 20℃
【反思与评价】
(6)小组同学查阅资料发现,添加柚苷酶也可降低柠檬汁的苦味,设计实验比较在柠檬汁中添加树脂与添加柚苷酶的脱苦效果:室温下,分别取20 mL鲜榨柠檬汁于两个烧杯中,_____,取样测量柠檬汁的脱苦率。
20.(2022北京燕山二模) 管道疏通剂可以有效地疏通由毛发、油脂等各种原因引起的下水管道堵塞。某小组欲探究某品牌固体管道疏通剂中 Ca(OH)2、铝粉、缓蚀阻垢剂的用量对疏通效果的影响,寻找三者的最佳质量比;并探究该品牌管道疏通剂对下水管道的腐蚀情况。
【查阅资料】Ca(OH)2与铝粉混合遇水后发生化学反应,放出大量热和气体,可加快疏通毛发等物质。反应的化学方程式为:。
【进行实验 1】按表中数据将各固体物质混合均匀后,加入 20 mL 水,观察到有气体产生,并通过测定反应前后温度的变化比较疏通效果(温度升高值越大,疏通效果越好)。
实验数据记录如下:
序号 Ca(OH)2质量/g 铝粉质量/g 缓蚀阻垢剂质量/g 混合前后温度升高值/℃
① 1.3 0.55 0.18 63
② 1.3 0.75 0.18 78
③ 1.3 0.95 0.18 89
④ 1.3 1.15 0.18 83
⑤ 1.3 0.95 0.04 86
⑥ 1.3 0.95 0.09 87
⑦ 1.3 0.95 0.27 87
【解释与结论】
(1)Ca(OH)2溶液的 pH______7(填“<”、“>”或“=”)。
(2)Ca(AlO2)2中含有的金属元素是______。
(3)实验①~④的目的是______。
(4)欲探究缓蚀阻垢剂的用量对疏通效果的影响,需对比的实验是⑤、⑥、⑦和______(填实验序号)。
(5)由实验 1 可知,Ca(OH)2、铝粉、缓蚀阻垢剂的最佳质量比为 1.3∶______∶______。
【进行实验 2】在其他条件相同时。改变下水管道材料,测定管道疏通剂对各材料的腐蚀率。实验结果记录如下:
材料 塑料 铜 铁 钢 铝 铝合金
腐蚀率 0.1% 0.4% 0.5% 0.3% 100% 80%
【解释与结论】
(6)进行实验 2 时,除了控制下水管道材料的形状、大小相同,水的体积相同,腐蚀时间相同,还需要控制相同的是______。
(7)由实验 2 可得到的结论是______。
21. (2022北京顺义二模)含氯消毒剂是人类最早使用的化学消毒剂之一,电解食盐水可以制备含氯消毒剂。小组同学利用图1所示装置研究实验条件对消毒剂中有效氯含量的影响。
【查阅资料】该研究中含氯消毒剂的主要成分是NaClO,其中氯元素的化合价为______。
【猜想与假设】食盐水浓度、电压、电解时长可能影响消毒剂中有效氯含量。
【进行实验】在40mm电极长度、10mm电极间距的条件下电解300mL食盐水,实验数据记录如下表:
实验序号 食盐水浓度/(g/L) 电压/V 电解时长/min 有效氯含量/(g/L)
1 10 6 150 0.21
2 20 6 150 0.65
3 40 6 150 1.62
4 20 3 150 0.09
5 20 9 150 0.72
6 a 6 50 0.79
7 40 6 100 1.26
根据上表中的部分数据绘制有效氯含量--时间(电解时长)图,并进行了曲线拟合,所得曲线如图2所示。
【解释与结论】
(1)表中数值a为______。
(2)食盐水浓度对消毒剂中有效氯含量的影响是______。
(3)探究电压对消毒剂中有效氯含量影响的实验是______(填序号)。
(4)餐具消毒液的有效氯含量为0.34~0.46g/L。依据上述实验,制备餐具消毒液的适宜条件为______。
【反思与评价】
(5)实验研究表明,食盐水浓度为50g/L时,能发生如下反应,产生有毒的氯气,配平该反应的化学方程式。__________________
(6)结合以上实验,你还想探究的问题是______。
答案解析
【5年中考真题】
1. (2022北京中考)絮凝剂常用于水的净化,实验小组探究用絮凝剂净水时影响净化效果的因素。
【查阅资料】絮凝剂溶于水后能够吸附水中悬浮物并发生沉降,从而达到净水目的。硫酸铁是一种常见的絮凝剂。
【进行实验】
Ⅰ.配制水样和絮凝剂溶液
配制水样:向10L水中加入25g高岭土,搅拌、静置,取上层液作为水样。
配制絮凝剂溶液:用100mL水和5g硫酸铁进行配制。
Ⅱ.探究影响水样净化效果的因素
取水样,向其中加入絮凝剂溶液,搅拌,测定静置不同时间水样的浊度,并计算浊度去除率(浊度去除率越高代表净化效果越好)。实验记录如下:
实验序号 水样的体积/mL 加入絮凝剂溶液的体积/mL 静置时间/min 浊度去除率/%
① 200 0 20 12.48
② 200 0.2 20 76.54
③ 200 0.3 20 84.60
④ 200 0.4 5 64.45
⑤ 200 0.4 10 70.85
⑥ 200 0.4 15 81.04
⑦ 200 0.4 20 86.02
⑧ 200 0.5 20 88.15
⑨ 200 0.6 20 86.49
【解释与结论】
(1)配制絮凝剂溶液的操作如下图所示。
正确的操作顺序是______________(填序号),B中用玻璃棒搅拌的目的是______________。
(2)②中浊度去除率比①高的原因是______________。
(3)依据④~⑦得出的结论是______________。
(4)探究等量水样中加入絮凝剂溶液的体积对净化效果影响的实验是______________(填序号)。
【反思与评价】
(5)依据实验数据,不能得出“静置时间相同时,等量水样中加入絮凝剂溶液的体积越大,净化效果越好”的结论,其证据是______________。
【答案】(1) ①. CDAB ②. 加快溶解速度
(2)加入了絮凝剂 (3)静置时间越长,浊度去除率越高 (4)①②③或⑦⑧⑨
(5)⑧⑨实验对比得出,两组实验中水样的质量与静置时间都相同,⑧中絮凝剂加入体积较少,浊度去除率较高
【解析】
(1)配制絮凝剂溶液的操作为:计算出需要溶质的质量及溶剂的体积,先用天平称量出需要的絮凝剂的质量,将絮凝剂倒入烧杯中,用量筒量取需要水的体积,将水倒入烧杯中,用玻璃棒搅拌加快溶解,待全部溶解后溶液配制成功;故操作顺序为CDAB;玻璃棒搅拌的目的为加快溶解速度;
(2)②中加入了絮凝剂,①中没有絮凝剂,则②中浊度去除率比①高;
(3)实验④~⑦中等质量的水样中加入的絮凝剂体积也相同,根据表格数据得出静置时间越长,浊度去除率越高;
(4)观察表格数据得出实验①②③或者实验⑦⑧⑨中水样的体积相等,静置时间相等,加入絮凝剂的体积不一样,则实验①②③或者实验⑦⑧⑨可以探究等量水样中加入絮凝剂溶液的体积对净化效果影响;
(5)观察实验数据可以发现实验⑧与⑨可知,实验⑧中浊度去除率较高,但絮凝剂加入的体积较少,则不能得出结论“静置时间相同时,等量水样中加入絮凝剂溶液的体积越大,净化效果越好”。
2.(2021北京中考)(7分)硬水加热时易产生水垢,很多工业用水需要对硬水进行软化处理。小组同学利用1.5%的肥皂水比较水的硬度。
【查阅资料】硬水含较多可溶性钙、镁化合物;软水不含或含较少可溶性钙,镁化合物。
Ⅰ、探究水的硬度、肥皂水的用量与产生泡沫量的关系
【进行实验】向蒸馏水中加入CaCl2和MgCl2的混合溶液,配制两种不问硬度的硬水。
用蒸馏水和两种硬水完成三组实验,记录如下:
组别 第1组 第2组 第3组
实验操作
实验序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨
混合溶液用量/滴 0 0 0 1 x 1 2 2 2
肥皂水用量/滴 5 10 20 5 10 20 5 10 20
产生泡沫量 少 多 很多 无 少 多 无 无 少
【解释与结论】
(1)对比②和⑧可知,肥皂水能区分软水和硬水,依据的现象是 。
(2)设计第2组实验时,为控制水的硬度相同,⑤中x应为 。
(3)第2组实验的目的是 。
(4)由上述三组实验得到的结论是 。
Ⅱ、比较不同水样的硬度
【进行实验】用四种水样完成实验,记录观察到泡沫产生时所需肥皂水的用量。
实验操作 水样 肥皂水用量/滴
市售纯净水 2
煮沸后的自来水 6
自来水 9
湖水 14
【解释与结论】
(5)硬度最大的水样是 。
(6)由上述实验可知,能将自来水硬度降低的方法有 。
(7)继续实验,发现山泉水的硬度大于自来水的硬度,其实验方案为 。
【答案】(1)产生泡沫多少。 (2)1。
(3)第2组实验以肥皂水为变量,探究肥皂水多少与产生泡沫量的关系。
(4)硬水中加肥皂水泡沫少,软水中加肥皂水泡沫多。(5)湖水。 (6)煮沸。
(7)另取相同量山泉水,滴加肥皂水记录产生泡沫所需肥皂水量,大于自来水所需肥皂水量,说明山泉水硬度大于自来水。
【解析】(1)②和⑧不同实验现象是产生的泡沫多少不同,因此据此判断区分软硬水;
故答案为:产生泡沫多少。
(2)根据对比实验唯一变量的原则可知,x加入混合液体积相同,也是1滴;
故答案为:1。
(3)第2组实验中验证不同催化剂 肥皂水的用量,产生泡沫量不同,因此是探究肥皂水用量与产生泡沫量的关系;
故答案为:第2组实验以肥皂水为变量,探究肥皂水多少与产生泡沫量的关系。
(4)从3组实验可以看出,当在相同体积蒸馏水加入不同量氯化钙和氯化镁溶液,同时加入相同量的肥皂水,则可以看出蒸馏水泡沫多,而加入氯化钙和氯化镁体积越多的泡沫越少,而水的硬度根据钙。镁离子含量来表示,所以说明硬水加入肥皂水泡沫少,软水加入肥皂水泡沫多;
故答案为:硬水中加肥皂水泡沫少,软水中加肥皂水泡沫多。
(5)根据题目数据可以看出,湖水硬度最大;
故答案为:湖水。
(6)根据煮沸自来水与自来水加入肥皂水的体积,可以知道煮沸可以降低水的硬度;
故答案为:煮沸。
(7)为了确保只改变水质,其他实验条件一致,因此需要取相同量的山泉水,然后滴加肥皂水,记录加入肥皂水产生泡沫时,使用的量,与自来水的数据相比,得出实验结论;
故答案为:另取相同量山泉水,滴加肥皂水记录产生泡沫所需肥皂水量,大于自来水所需肥皂水量,说明山泉水硬度大于自来水。
3.(2020北京中考)丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
I.探究丙酸钙的性质
进行实验】用下图装置(夹持仪器已略去)完成实验,记录如下:
序号 ① ②
装置
现象 试管内壁有水雾 注入酸后,有气泡产生,石灰水变浑浊
【解释与结论】
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为________。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是_______。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
组别 第1组 第2组
序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
配方 面粉/ g 50 50 50 50 50 50 50 50
酵母/ g 0.75 0.75 0.75 0.75 0.75 0.75 0.75 0.75
蔗糖/ g 0 0 0 0 5 5 x 5
丙酸钙/g 0 0.06 0.10 0.15 0 0.06 0.10 0.15
开始发霉时间 第3天 第4天 第5天 第6天 第3天 第4天 第5天 第6天
【解释与结论】
(3)设计第1组实验的目的是____。
(4)第2组,⑦中x为_______。
(5)对比第1组、第2组实验可得到的结论是______。
【反思与评价】
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:_____。
【答案】 ①. ②. 丙酸钙受热后产生的物质能与稀盐酸反应且生成二氧化碳 ③. 探究丙酸钙的质量大小是否对于丙酸钙防霉效果有影响 ④. 5 ⑤. 在加入面粉质量相同,酵母质量相同时以及其他条件相同时,有无蔗糖对丙酸钙防霉效果无影响 ⑥. 不同意。国家标准规定了丙酸钙用于作面食、糕点时每千克面粉中的最大使用量,说明过量使用可能有害。故不是越多越好
【解析】
Ⅰ、解释与结论:
(1)二氧化碳与氢氧化钙反应生成碳酸钙和水,该反应的化学方程式为:;
(2)查阅资料得知丙酸钙与盐酸反应无气体生成,丙酸钙加热后生成的固体却能与稀盐酸反应生成二氧化碳气体,故可得出:丙酸钙受热后产生的物质能与稀盐酸反应且生成二氧化碳;
Ⅱ、解释与结论:
(3)由表中数据可知,第1组实验,其它因素相同,只有丙酸钙的质量不同,故该实验是探究丙酸钙的质量大小是否对于丙酸钙防霉效果有影响;
(4)由表中数据可知,第2组与第1组其它数据相同,只是第1组无蔗糖,而第2组有蔗糖,且第2组加入蔗糖的质量应相同,故x=5;
(5)由表中数据可知,在加入面粉质量相同,酵母质量相同时以及其他条件相同时,有无蔗糖,开始发霉的时间相同,故说明在加入面粉质量相同,酵母质量相同时以及其他条件相同时,有无蔗糖对丙酸钙防霉效果无影响;
反思与评价:
(6)由题干信息可知,丙酸钙属于食品防腐剂,且国家标准规定了丙酸钙用于作面食、糕点时每千克面粉中的最大使用量,说明过量使用可能有害。故不是越多越好。
故填:不同意;国家标准规定了丙酸钙用于作面食、糕点时每千克面粉中的最大使用量,说明过量使用可能有害。故不是越多越好。
4.(2019北京中考)下图“黑面包”实验中,蔗糖(C12H22O11)变黑,体积膨胀,变成疏松的炭,放出有刺激性气味的气体。
【提出问题】改变糖的种类、浓硫酸的体积、水的滴数和温度是否会影响实验效果呢
【进行实验】分别取5g糖粉进行实验,根据前2min的现象对实验效果进行评分,
记录如下:
表1实验记录
实验 糖 浓硫酸体积/mL 水的滴数 温度/℃ 效果得分
1 蔗糖 4 5 22 65
2 蔗糖 5 10 30 81
3 蔗糖 6 15 50 93
4 冰糖 4 10 50 91
5 冰糖 5 15 22 88
6 冰糖 a 5 30 75
7 葡萄糖 4 15 30 0
8 葡萄糖 5 5 50 0
9 葡萄糖 6 10 22 0
【处理数据】分析表1,计算效果得分均值,结果如下:
表2效果得分均值
因素 糖 浓硫酸体积/mL 水滴数 温度/℃
蔗糖 冰糖 葡萄糖 4 5 6 5 10 15 22 30 50
均值 79.7 84.7 0 52.0 56.3 56.0 46.7 57.3 60.3 51.0 52.0 61.3
依据均值推断最佳实验方案,均值越高,效果越好。
【解释与结论】
(1)蔗糖变成黑色的炭,发生了_____________(填“物理”或“化学”)变化。
(2)推测放出的气体含SO2,从元素守恒角度说明理由:________________________________。
(3)实验6中,a为_____________mL。
(4)根据表2推断,“黑面包”实验最好选择5g冰糖、5mL浓硫酸、_____滴水和50℃
【反思与评价】
(5)表2中,22℃对应的均值为51.0,计算该值所依据的3个数据分别是_____________________。
(6)综合分析,使实验3的效果得分高于实验4的因素有________________________________。
【答案】 ①. 化学 ②. 浓硫酸中有硫元素和氧元素,蔗糖中含有氧元素,则生成物中也会有硫元素和氧元素 ③. 6 ④. 15 ⑤. 65、88、0 ⑥. 浓硫酸的体积和水的滴数
【解析】
(1) 蔗糖的化学式为:C12H22O11,炭黑的化学式为:C,物质发生了变化,属于化学变化,故填写:化学;
(2)根据质量守恒定律的实质之一:化学反应前后,元素种类不变可得,浓硫酸中有硫元素和氧元素,蔗糖中含有氧元素,则生成物中也会有硫元素和氧元素;
(3)对比表1数据可得,糖为冰糖时,浓硫酸体积缺少6mL,故填写:6;
(4)分析表2可得,5g冰糖、5mL浓硫酸、15滴水和50℃时,数值同组最大,故填写:15;
(5) 表2中,22℃对应的均值为51.0,计算均值的方法是:,故填写:65、88、0;
(6)对比表1和表2数据可得,6mL浓硫酸比4mL效果要好,15滴水比10滴效果要好,故综合分析,使实验3的效果得分高于实验4的因素有浓硫酸的体积和水的滴数。
【点睛】该题为科学探究题,此题的解题关键是熟练掌握控制变量法。
5.(2018北京中考)为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
【查阅资料】①氧化铜(CuO)为黑色固体。
②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+ H2SO4 = CuSO4 + H2O + Cu
【进行实验】
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 1-1 1-2
装置
反应后物质的颜色、状态 黑色粉末中混有少量红色固体 红色固体有金属光泽,混有极少量,黑色物质
实验2:取一定量的混合物,用1—2装置进行实验。
序号 木炭粉与氧化铜质量比 反应后物质的颜色、状态
2-1 1:9 红色固体有金属光泽 混有少量黑色物质
2-2 1:10 混有很少量黑色物质
2-3 1:11 混有极少量黑色物质
2-4 1:12 无黑色物质
2-5 1:13 混有较多黑色物质
【解释与结论】
(1)配平化学方程式: ___ C+ ___ CuO高温___ Cu+ ___ CO2↑。
(2)实验1—2中,证明产生CO2的现象是 _______________________ 。
(3)实验1的目的是 __________ 。
(4)实验2的结论是 _____________ 。
【反思与评价】
(5)实验2没有进行质量比为1:14的实验,理由是 ________________ 。
(6)为检验2—4的红色固体中是否含Cu2O,所需试剂是 __________ 。
【答案】 ①. 1 ②. 2 ③. 2 ④. 1; ⑤. 澄清石灰水变浑浊; ⑥. 探究木炭与氧化铜的受热面积对其反应的影响; ⑦. 木炭与氧化铜质量比为1:12是恰好反应,因此木炭与氧化铜反应的最佳质量比为1:12; ⑧. 木炭与氧化铜质量比为1:13时,氧化铜已过量; ⑨. 稀硫酸。
【解析】
(1)木炭与氧化铜反应方程式:C+2CuO高温 2Cu+CO2↑;
(2)二氧化碳使澄清石灰水变浑浊,故如看到澄清石灰水变浑浊,说明有二氧化碳生成;
(3)实验1-1,反应物受热面积较大,实验1-2反应物受热面积较小,故实验1与实验2形成对比实验,可以探究木炭与氧化铜的受热面积对其反应的影响;
(4)由表可知,当木炭与氧化铜质量比为1:12是恰好反应,即木炭与氧化铜反应的最佳质量比为1:12;
(5)由表可知,当木炭与氧化铜质量比为1:13时,氧化铜已过量,生成物中含有Cu和CuO,没有必要进行质量比为1:14的实验;
(6)因为Cu2O + H2SO4 = CuSO4 + H2O + Cu,所以向红色固体中加稀硫酸如溶液变为蓝色,可以可以说明有Cu2O。
【1年模拟题】
1. (2022北京大兴二模)实验小组同学对铁生锈的条件和影响因素进行探究。
【进行实验】
实验1:如下图所示进行实验,一段时间后观察到C中铁钉生锈,A、B中铁钉无明显变化。
实验2:为进一步探究影响铁生锈速率的因素,小组同学设计如图所示实验,利用传感器监测过程中氧气浓度的变化来判断铁生锈的情况。
实验记录如下:
序号 其他试剂 初始时氧气浓度/% 200s时氧气浓度/%
水/滴 食盐质量/g 稀醋酸/滴
① 0 0 0 20.8 20.8
② 10 0 0 20.8 15.2
③ 10 0 5 20.8 12.7
④ 10 1.0 0 20.8 8.0
【解释与结论】
(1)铁生锈属于______(填“物理变化”或“化学变化”)。
(2)由实验1能得出“与H2O接触是铁生锈条件之一”的结论,依据的实验现象是______。
(3)实验2,①中200s时氧气浓度没有发生变化的原因是______。
(4)由实验2得出“食盐能加速铁生锈”结论,依据的实验是______(填序号)。
(5)实验2,设计②③的目的是______。
【反思与评价】
(6)小明欲进一步探究NaOH稀溶液对铁生锈速率是否有影响,他又补充设计了如下实验:
其他试剂 初始时氧气浓度/% 200s时氧气浓度/%
水/滴 食盐质量/g 稀醋酸/滴 NaOH稀溶液/滴
5 20.8
该实验中水、食盐、稀醋酸的量分别是______。
【答案】 ①. 化学变化 ②. 试管A中铁钉不生锈,试管C中铁钉生锈 ③. 铁与水隔离,不能生锈,因此不能消耗氧气 ④. ②④##④② ⑤. 探究稀醋酸能否加速铁生锈 ⑥. 10、0、0
【解析】
解释与结论:
(1)铁生锈时铁与氧气、水反应生成铁锈,属于化学变化;
(2)试管A中铁钉只与空气接触,试管B中铁钉只与水接触,试管C中铁钉与水、空气同时接触,其中试管A中铁钉不生锈,试管C中铁钉生锈,则说明铁生锈时需与水接触。
(3)实验2中,①中铁粉没有与水接触,不能生锈,因此不消耗氧气,200s时氧气浓度也没有发生变化。
(4)实验2中,②中没有食盐、④中有食盐,其他条件都相同,且④中200s时氧气浓度更少,说明食盐能加快铁生锈。
(5)实验2中,②中滴有水滴,③中不仅滴有水滴,还滴有稀醋酸,则说明设计②③的目的是探究稀醋酸能否加速铁生锈。
反思与评价:
对比实验要单一变量,欲探究NaOH稀溶液对铁生锈速率是否有影响,则除了NaOH稀溶液不同,其他条件都相同,则该实验中水、食盐、稀醋酸的量分别是10、0、0。
2. (2022北京朝阳一模)化学小组对市售“茶垢清洁剂”进行如下探究。
【查阅资料】
①使用方法:将“茶垢清洁剂”粉末倒入容器中,加入50℃~70℃的水,浸泡10分钟,清水冲洗即可。
②过碳酸钠是常用的洗涤助剂。它是白色固体,溶于水时分解生成碳酸钠和过氧化氢。
实验1:验证“茶垢清洁剂”的主要成分是过碳酸钠
【进行实验】在分液漏斗a中加入新配制的“茶垢清洁剂”的饱和溶液。
实验装置 实验步骤 实验现象 实验结论
Ⅰ.打开分液漏斗a的活塞,加入适量溶液后,关闭活塞,然后_______。 产生大量气泡,带火星的木条复燃 “茶垢清洁剂”的主要成分是过碳酸钠
Ⅱ.待Ⅰ中反应停止后,打开分液漏斗b的活塞,加入适量溶液后,关闭活塞,将生成的气体通入澄清石灰水。 产生大量气泡,澄清石灰水变浑浊
【解释与结论】
(1)步骤I,关闭活塞后进行的实验操作是_______,产生大量气泡的化学方程式为_______。
(2)步骤Ⅱ,分液漏斗b中的液体是_______,依据步骤Ⅱ的现象得出的结论是_______。
实验2:探究影响过碳酸钠去茶渍效果的因素
【进行实验】25℃时,取洗碗基料15g于洗碗机中,分别加人不同质量的过碳酸钠,按照不同洗涤模式对具有相同茶渍的茶杯进行洗涤,洗涤后根据去茶渍效果打分,分数越高效果越好,记录如下:
组别 第1组(常规洗涤模式) 第2组(快洗模式)
实验序号 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
过碳酸钠用量/g 0 1 2 3 0 1 2 3
水的硬度/mg·kg 250 250 250 250 250 250 250 250
pH 11 11 11 11 11 11 11 11
去茶渍效果打分 2 5 7 9 2 4 6 8
【解释与结论】
(3)对比②和⑥可知,常规洗涤模式比快洗模式去茶渍效果好,依据是_______。
(4)第1组实验的目的是_______。
(5)生活中碳酸钠也是常用洗涤剂。继续实验,发现碳酸钠比过碳酸钠去茶渍效果差,其实验方案是:在25℃、水的硬度为250mg·kg-1、pH为11的条件下,取洗碗基料15g于洗碗机中,加入2g碳酸钠,_______。
【答案】 ①. 将带火星的木条放在c处 ②. ③. 稀盐酸(合理即可) ④. 溶液中含有碳酸钠 ⑤. 常规洗涤模式去茶渍效果打分更高 ⑥. 常规洗涤模式下,其他条件相同时,加入过碳酸钠的量是否影响去茶渍效果 ⑦. 记录去茶渍效果打分值
【解析】
(1)根据步骤I的现象:产生大量气泡,带火星的木条复燃,说明打开分液漏斗a的活塞,加入适量溶液后,生成了氧气,所以分液漏斗a的溶液中有过氧化氢,检验是否生成氧气应观察将带火星的木条放在c处是否复燃;过氧化氢在二氧化锰催化作用下生成水和氧气,反应的化学方程式为:;
(2)根据步骤Ⅱ的现象:产生大量气泡,澄清石灰水变浑浊,说明打开分液漏斗b的活塞,加入适量溶液后,生成了二氧化碳,所以分液漏斗b的溶液是稀盐酸,由此证明溶液中含有碳酸钠;
(3)洗涤后根据去茶渍效果打分,分数越高效果越好,对比②和⑥可知,常规洗涤模式比快洗模式去茶渍效果好,是因为常规洗涤模式去茶渍效果打分更高;
(4)对比①②③④可知,进行常规洗涤模式洗涤时,在水的硬度和酸碱性相同的条件下,加入过碳酸钠的量越多,去茶渍效果好越好;
(5)碳酸钠比过碳酸钠去茶渍效果差,由此可知:在25℃、水的硬度为250mg·kg-1、pH为11的条件下,取洗碗基料15g于洗碗机中,加入2g碳酸钠,记录去茶渍效果打分的结果是否小于6。
3. (2022北京丰台一模)食品脱氧剂主要成分有铁粉、活性炭、氯化钠,发生脱氧反应消耗食品包装袋内的氧气延长食品保质期。实验小组探究脱氧反应发生条件和影响脱氧反应速率的因素。
实验一 探究脱氧反应发生条件
按图1所示装置进行实验,利用氧气传感器测定密闭容器中氧气含量变化,如图2所示。
(1)结合图2分析,集气瓶②中铁粉发生脱氧反应的依据是______。
(2)实验一得出的结论是发生脱氧反应需要铁粉与氧气和______同时接触。
实验二 探究氯化钠、活性炭用量对脱氧反应速率的影响
室温下,利用5g铁粉和10滴水,改变活性炭和氯化钠的用量(见下表),用氧气传感器测定密闭容器中氧气含量变化,实验结果如图3、图4所示。
实验编号 铁粉/g 活性炭/g 氯化钠/g
1 5 0 1
2 5 0.75 0
3 5 0.75 1
4 5 1.5 1
5 5 a 2
(3)实验5中,a=______。
(4)实验1、3、4的目的是______。
(5)结合图4,对比实验2、3、5可以得到的结论是______。
实验三 探究硅藻土的用量对脱氧反应速率的影响
脱氧剂中还经常添加硅藻土,主要作用是吸附水分, 同时疏松配料,使铁粉更易于与氧气接触。室温下,在一定量的脱氧剂中加入不同质量的硅藻土,测定密闭容器中氧气耗尽所需时间,如图5所示。
(6)由图5可知,硅藻土用量和氧气耗尽所需时间的关系是______。
(7)结合以上实验分析,脱氧剂的反应速率还可能受哪些因素影响______(写出一条即可)。
【答案】(1)氧气含量减小
(2)水或H2O (3)0.75
(4)探究活性炭用量对脱氧反应速率的影响
(5)室温下,在铁粉、水、活性炭质量相同时,氯化钠用量在0、1、2g时,随着氯化钠用量增加,脱氧反应速率加快
(6)室温下,脱氧剂质量相同时,硅藻土用量在0.15g—0.65g范围内,随着硅藻土用量增加,氧气耗尽所需时间先减小后增加
(7)温度、疏松程度等
【解析】
(1)由图2可知,集气瓶②中氧气含量逐渐减小,说明铁粉发生了脱氧反应;
(2)集气瓶①和集气瓶②中变量是水,其它因素均相同,由图2可知,集气瓶①中氧气含量几乎不变,集气瓶②中氧气含量逐渐减小,说明集气瓶②中发生了脱氧反应,说明发生脱氧反应需要铁粉与氧气和水同时接触;
(3)由图4可知,实验2、3、5为一个实验组,故根据控制变量法,除了氯化钠的用量不同,其它因素均应相同,故a=0.75;
(4)由表可知,实验1、3、4中,活性炭的用量不同,其它因素均相同,故该实验的目的是探究活性炭用量对脱氧反应速率的影响;
(5)实验2、3、5中,氯化钠的用量不同,其它因素均相同,由图4可知,在其它条件相同的情况下,氯化钠的用量越大,氧气含量减少的越多,说明室温下,在铁粉、水、活性炭质量相同时,氯化钠用量在0、1、2g时,随着氯化钠用量增加,脱氧反应速率加快;
(6)由图可知,室温下,脱氧剂质量相同时,硅藻土用量在0.15g—0.65g范围内,随着硅藻土用量增加,氧气耗尽所需时间先减小后增加;
(7)由以上实验可知,脱氧剂的反应速率还可能受温度、疏松程度等影响。
4. (2022北京东城一模)实验小组探究金属与酸的置换反应。
【进行实验】
(1)实验1:向分别盛有Fe片、Cu片的试管中加入稀盐酸。
①Fe与稀盐酸发生反应,化学方程式为______。
②Cu与稀盐酸不反应,原因是______。
(2)实验2:探究Fe与硫酸的反应(Fe片大小相同且已除去表面氧化膜;硫酸溶液体积相等)
序号 药品 现章
① Fe片+硫酸溶液(V浓硫酸:V水=1:2) 快速产生气泡
② Fe片+硫酸溶液(V浓硫酸:V水=1:200) 缓慢产生气泡
③ Fe片+硫酸溶液(V浓硫酸:V水=1:200000) 无气泡产生
①对比实验①和②,可得到的结论是______。
②实验③中没有气泡产生的原因是______。
(3)实验3:探究Cu与浓盐酸的反应
用如下装置进行实验(硫酸溶液与浓盐酸中H+的浓度接近)。
装置 序号 药品 现象
④ 浓盐酸 24小时后仍无明显变化
⑤ Cu粉+硫酸溶液 24小时后得无明显变化
⑥ Cu粉+浓盐酸 24小时后气球变鼓
【解释与结论】
① ④是对照实验,目的是排除______的干扰。
② 点燃⑥中气球内的气体,发出爆鸣声,则⑥中气球变鼓是因为生成了______;经检测,⑥反应后的溶液中主要成分是H3CuCl4。
【反思与评价】
③综合以上实验,请写出你对金属与酸的置换反应的新认识______。
【答案】(1) ①. ②. 在金属活动性顺序里,铜排在氢后
(2) ①. 在其它条件相同的情况下,酸的浓度越低,铁与硫酸的反应速率越慢 ②. 酸的浓度太低,铁与氢离子接触少
(3) ①. 浓盐酸挥发 ②. 氢气或H2 ③. 一定条件下,氢后金属也能与酸发生置换反应
【解析】
(1)①铁与稀盐酸反应生成氯化亚铁和氢气,该反应的化学方程式为: ;
②在金属活动性顺序里,铜排在氢后,故铜与稀盐酸不反应;
(2)①实验①和②中,酸的浓度不同,其它因素均相同,且酸的浓度越低,产生气泡的速率越慢,说明在其它条件相同的情况下,酸的浓度越低,铁与硫酸的反应速率越慢;
②实验③中酸的浓度太低,铁与氢离子接触少,故没有气泡产生;
(3)①浓盐酸具有挥发性,会挥发出氯化氢气体,故④是对照实验,目的是排除浓盐酸挥发的干扰;
②点燃⑥中气球内的气体,发出爆鸣声,且根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Cu、H、Cl,生成的气体具有可燃性,故则⑥中气球变鼓是因为生成了氢气;
③由以上实验可知,铜与稀盐酸不反应,但是铜粉能与浓盐酸反应生成氢气,说明一定条件下,氢后金属也能与酸发生置换反应。
5. (2022北京房山二模)食用油是厨房中常见的食材,小组同学针对食用油的变质问题进行了探究。
【查阅资料】
①食用油不易溶于水,能溶于酒精和醋酸中。白酒和白醋的主要成分分别为酒精和醋酸。
②食用油变质后产生的过氧化物可使碘化钾淀粉试纸由白色变为蓝色。
Ⅰ.检验食用油是否变质
【进行实验】
ⅰ.空白对照组
实验操作 试剂 现象
52°白酒 碘化钾淀粉试纸不变色
白酷 碘化钾淀粉试纸不变色
ⅱ.对比实验组
实验操作
实验序号 1-1 1-2 1-3 1-4 1-5 1-6
溶剂 52°白酒 52°白酒 52°白酒 白醋 白醋 白醋
油样 新油 过期油 煎炸过的老油 新油 过期油 煎炸过的老油
现象 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸不变色 碘化钾淀粉试纸变为蓝色 碘化钾淀粉试纸轻微变蓝
【解释与结论】
(1)食用油中常含有 C18H34O2、C18H32O2、C16H32O2等,这些物质的相同点是_______ (写出一点即可)。
(2)依据空白对照组可知,用 52°白酒和白醋作溶剂 _____(填“会”或“不会”)影响实验结果。
(3)由对比实验组可知,适宜的溶剂为 _______。
(4)经上述实验检验,已经发生变质的是_____(填序号)。
A. 新油 B. 过期油 C. 煎炸过的老油
Ⅱ.去除食用油中过氧化物的方法
【进行实验】
实验方法 2-1隔绝氧气自降解法 2-2还原降解法
实验操作 在隔绝氧气条件下,取四份相同体积、不同温度的食用油,分别恒温放置,每隔一段时间测定油样的过氧化值。 30℃时,取若干份相同体积的食用油,添加不同质量的还原剂(半胱氨酸),测定油样的过氧化值。
实验结果
【解释与结论】
(5)设计实验 2-1 的目的是_______。
(6)由实验 2-2 得到的结论是______。
【反思与评价】
(7)根据上述实验,请从食用油的加工、储存或使用等方面,提出一条合理建议:______。
【答案】(1)组成元素相同或都是有机物等(合理即可) (2)不会 (3)白醋 (4)BC
(5)验证过氧化物开始降低的时间与温度的关系
(6)30 ℃时,半胱氨酸添加量在0~1.0%时,过氧化物降低率升高,半胱氨酸添加量在1.0%~1.4% 时,过氧化物降低率降低。
(7)好使用煎炸过的老油或隔绝氧气储存或使用时先加热至110 ℃左右
【解析】
(1)由这些物质的化学式可知,这些物质的相同点是组成元素相同、都是有机物等。故答案为:组成元素相同或都是有机物等。
(2)依据空白对照组可知,用52°白酒和白醋作溶剂不会影响实验结果。故答案为:不会。
(3)由对比实验组可知,适宜的溶剂为白醋,是因为利用白醋能够检测出过氧化物。故答案为:白醋。
(4)经上述实验检验,已经发生变质的是过期油、煎炸过的老油。故答案为:BC。
(5)设计实验2-1的目的是验证过氧化物开始降低的时间与温度的关系。故答案为:验证过氧化物开始降低的时间与温度的关系。
(6)由实验2-2得到的结论是30 ℃时,半胱氨酸添加量在0~1.0%时,过氧化物降低率升高,半胱氨酸添加量在1.0%~1.4% 时,过氧化物降低率降低。故答案为:30 ℃时,半胱氨酸添加量在0~1.0%时,过氧化物降低率升高,半胱氨酸添加量在1.0%~1.4% 时,过氧化物降低率降低。
(7)根据上述实验,从食用油的加工、储存或使用等方面的合理建议:最好使用煎炸过的老油、隔绝氧气储存、使用时先加热至110 ℃左右。故答案为:最好使用煎炸过的老油或隔绝氧气储存或使用时先加热至110 ℃左右。
6. (2022北京丰台二模)“固体酒精”是乙醇、硬脂酸、NaOH 混合而成的一种燃料,同学们对制备“固体酒精”的最佳反应条件进行了探究。
【查阅资料】制备“固体酒精”的工艺流程如下:
实验 1 探究加料方式对制备“固体酒精”的影响
一定温度下,乙醇、硬脂酸、NaOH 用量相同时,用不同的加料方式进行实验,实验现象记录如下:
实验序号 ① ② ③
加料方式 硬脂酸和NaOH同时加入乙醇 先将硬脂酸溶于乙醇,再加入NaOH 将硬脂酸和NaOH分别充分溶于2份乙醇后,再混合
完全溶解所需时间 60min 45min 30min
实验 2 探究制备“固体酒精”的最佳温度
在不同温度下,乙醇、硬脂酸、NaOH 用量相同时,用最佳加料方式进行实验,实验现象记录如下:
实验序号 温度/℃ 现象
④ 30 混合后立即生成“固体酒精”,产品不能混合均匀
⑤ 40 混合后立即生成少量“固体酒精”,产品局部混合不均匀
⑥ 60 混合后不立刻生成“固体酒精”,可以混合均匀
实验 3 探究硬脂酸的含量对“固体酒精”燃烧时凝固性能的影响
在最佳温度下,用最佳加料方式进行实验制备“固体酒精”并点燃,实验现象记录如下:
实验序号 乙醇/g 硬脂酸/g 氢氧化钠/g 燃烧现象
⑦ 96 3 1 熔化流淌
⑧ 93 6 1 少量熔化流淌
⑨ X 6.5 1 不熔化流淌
【解释与结论】
(1)硬脂酸与氢氧化钠混合后发生如下化学反应,补全化学方程式:______。
(2)在较高温度下,上述反应生成硬脂酸钠(C17H35COONa)均匀地分散在乙醇中,冷却后形成“固体酒精”。由此可知,“固体酒精”______固态乙醇(填“是”或“不是”)。
(3)实验 1 中,③为最佳加料方式的依据是______。
(4)实验 2 中,生成“固体酒精”过快,会导致产品均匀性较差,因此制备“固体酒精”的最佳温度是______
(5)实验⑨,x=______。
(6)实验 3,对比实验⑦~⑨得出的结论是______。
(7)下列关于“固体酒精”的说法正确的是______(填字母序号)。
A.“固体酒精”燃烧时保持固体状态提高了其使用时的安全性
B.“固体酒精”的优点之一是便于运输、携带
C.评价“固体酒精”的优劣还需考虑燃烧时长和热值
D.评价“固体酒精”的优劣还需考虑燃烧时是否产生黑烟异味
【答案】 ①. ②. 不是 ③. 一定温度下,乙醇、硬脂酸、氢氧化钠用量相同时,③完全溶解所需时间最少 ④. 60℃ ⑤. 92.5 ⑥. 氢氧化钠质量一定时,硬脂酸的质量越大,“固体酒精”燃烧时凝固性能越大 ⑦. ABCD
【解析】
(1)酸与碱反应生成盐和水,故硬脂酸与氢氧化钠混合后反应生成硬脂酸钠和水,该反应化学方程式:;
(2)在较高温度下,上述反应生成的硬脂酸钠(C17H35COONa)均匀地分散在乙醇中,冷却后形成“固体酒精”。由此可知,“固体酒精”不是固态乙醇;
(3)实验1中,③为最佳加料方式的依据是一定温度下,乙醇、硬脂酸、氢氧化钠用量相同时,③完全溶解所需时间最少;
(4)实验2中,生成“固体酒精”过快,会导致产品均匀性较差,因此制备“固体酒精”的最佳温度是60℃,此温度下,混合后不立刻生成“固体酒精”,可以混合均匀;
(5)由图中实验⑦⑧数据分析,⑦中氢氧化钠1g,硬脂酸3g,乙醇96g,⑧中氢氧化钠1g,硬脂酸6g,乙醇93g,当氢氧化钠质量都是1g时,硬脂酸每增加3g,乙醇减少3g,则当氢氧化钠1g时,硬脂酸增加3.5g,乙醇减少3.5g,故实验⑨中氢氧化钠1g时,硬脂酸3g+3.5g=6.5g时,乙醇为96g-3.5g=92.5g,即X=92.5;
(6)实验3,对比实验⑦~⑨得出的结论是氢氧化钠质量一定时,硬脂酸的质量越大,“固体酒精”燃烧时凝固性能越大;
(7)A.“固体酒精”燃烧时保持固体状态提高了其使用时的安全性,说法正确;
B.固体相比较液体气体来说,固体便于运输,“固体酒精”的优点之一是便于运输、携带,说法正确;
C.评价“固体酒精”的优劣还需考虑燃烧时长和热值,说法正确;
D.酒精中含有碳,评价“固体酒精”的优劣还需考虑燃烧时是否产生黑烟异味,说法正确;
故说法正确的选择ABCD。
7. (2022北京海淀二模)碱式碳酸铜〔Cu2(OH)2CO3〕是孔雀石的主要成分,主要用于生产油漆、颜料等。兴趣小组探究碱式碳酸铜制备的最佳实验条件。
【查阅资料】碱式碳酸铜是翠绿色、难溶于水的固体,酸性条件下不稳定。
【进行实验】按下表中的数据进行图示实验,记录实验结果。
序号 CuSO4溶液体积/mL Na2CO3溶液体积/mL 水浴温度/℃ 固体颜色
i 50 60 60 蓝绿
ii 50 60 70 翠绿
iii 50 60 80 暗绿
iv 50 70 70 蓝绿
v 50 50 x 蓝绿
【解释与结论】
(1)为了使生成的碱式碳酸铜稳定,实验过程中需保持反应体系的pH___________7(填“<”或“>”)。
(2)ii、iv、v的目的是探究制备碱式碳酸铜时CuSO4溶液与Na2CO3溶液最佳配比,x=___________。
(3)设计i~iii的目的为___________。
(4)由表中数据知,制备碱式碳酸铜的最佳实验条件是___________。
【反思与评价】
(5)iii中所得固体颜色偏暗。查阅资料知碱式碳酸铜受热分解会生成CuO,猜想颜色变暗的原因与该反应有关。
①请将碱式碳酸铜分解反应的化学方程式补充完整:___________
②利用如图装置进行实验证明上述猜想。请在图中将实验方案补充完整___________、___________、___________,并说明:若出现___________的现象,则该猜想成立。
【答案】(1)> (2)70
(3)探究碱式碳酸铜制备的最佳水浴温度
(4)CuSO4溶液与Na2CO3溶液最佳体积比为5:6,水浴温度为70℃
(5) ①. 1 Cu2(OH)2CO3 2CuO +1 H2O+ 1CO2↑ ②. 80℃ ③. 澄清石灰水 ④. 110 mL水 ⑤. 固体颜色变暗,澄清石灰水变浑浊
【解析】
(1)由题文可知,碱式碳酸铜在酸性条件下不稳定,所以为了使生成的碱式碳酸铜稳定,实验过程中需保持反应体系的pH>7,保障反应体系不呈酸性,故填>。
(2)由控制变量法可知,变量只有一个,ii、iv、v的目的是探究制备碱式碳酸铜时CuSO4溶液与Na2CO3溶液最佳配比,其中的变量是Na2CO3溶液体积,则水浴温度应该相同,即x为70,故填70。
(3)由题文可知,实验i~iii的变量是水浴的温度,其它的量相同,则实验目的为探究碱式碳酸铜制备的最佳水浴温度,故填探究碱式碳酸铜制备的最佳水浴温度。
(4)碱式碳酸铜是翠绿色、难溶于水的固体,由图可知,生成碱式碳酸铜的最佳条件是实验ii,即CuSO4溶液与Na2CO3溶液最佳体积比为5:6,水浴温度为70℃,故填CuSO4溶液与Na2CO3溶液最佳体积比为5:6,水浴温度为70℃。
(5)①由质量守恒定律可知,碱式碳酸铜在加热条件下反应生成氧化铜、二氧化碳和水,故反应的完整的化学方程式写为:1 Cu2(OH)2CO3 2CuO +1 H2O+ 1CO2↑。
②由题文可知,实验iii是水浴的温度为80℃,所以该实验中水浴的温度也应为80℃,故填80℃;
碱式碳酸铜受热分解会生成CuO,同时生成二氧化碳,检验二氧化碳的生成应选择澄清石灰水,故填澄清石灰水;
实验iii中的反应体系中含有50mLCuSO4溶液和60mLNa2CO3溶液,所以该实验的反应体系也应该含有110mL液体,可以加入110mL水,故填110 mL水;
碱式碳酸铜受热分解会生成CuO,猜想颜色变暗的原因与该反应有关,如果固体颜色真的与该变化有关,即猜想成立,则出现的现象是固体颜色变暗,澄清石灰水变浑浊,故填固体颜色变暗,澄清石灰水变浑浊。
8. (2022北京门头沟二模)阅读下面科普短文。
84消毒液是一种以次氯酸钠(NaClO)为主要成分的高效消毒剂,广泛应用于杀灭细菌、病毒并抑制其传播,起到预防疾病的作用。1984年,北京第一传染病医院(地坛医院的前身)研制成功能迅速杀灭各类肝炎病毒的消毒液,定名为“84”肝炎洗消液,后更名为“84消毒液”。由于其消毒效果理想、价格低廉、使用方便,且具有广谱、高效的杀菌特点,深受大家的欢迎。84消毒液通常为无色或淡黄色液体,pH在12左右,有刺激性气味,有效氯含量为1.0%至6.5%不等。由于其有一定的刺激性和腐蚀性,浓度过高会损害呼吸道,危害身体健康,所以必须稀释后才能使用。一般认为,当杀菌率达到90%以上时,说明此时的消毒具有较好效果。表1、图1为某学校喷洒不同浓度的84消毒液,对教室进行消毒后的效果比较。
表1 不同浓度的84消毒液对教室的消毒效果
班级 一班 二班 三班 四班 五班 六班 七班 八班
喷洒消毒液的浓度(消毒液与水的体积比) 1:50 1:100 1:150 1:200 1:300 1:600 1:1000 作为对照不喷洒消毒液
菌落数 ① 2 2 4 6 10 19 45 53
② 3 3 5 4 11 18 42 50
③ 1 3 4 5 12 19 43 48
平均值 2 2.67 4.33 5 11 18.67 43.33 50.33
84消毒液除了具有腐蚀性,其使用过程中放出的氯气是一种有毒气体,有可能引起中毒。氯气主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,造成呼吸困难。症状重时,会发生肺水肿而致死亡。室内使用84消毒液后,可开窗通风一段时间。由于在酸性较高的条件下更易生成氯气,所以禁止将84消毒液与酸性物质混用,也不建议把84消毒液与洗涤剂或其他消毒液混合使用。84消毒液在日常生活中发挥着重要作用,我们要了解它的成分和原理,才能合理安全地使用。依据文章内容回答下列问题。
(1)84消毒液呈______(填“酸性”、“碱性”或“中性”)。
(2)84消毒液的物理性质为______(写一条即可)。
(3)结合表1和图1数据,关于不同浓度的84消毒液与其消毒效果可得到的结论为______。
(4)若想达到较好的消毒效果,同时又减少其对身体和环境的影响,学校喷洒消毒液浓度的最适合范围为______(填字母序号,下同)。
a.1:50~1:100 b.1:100~1:200 c.1:200~1:600 d.1:600~1:1000
(5)下列说法不正确是______。
A、浓度为1:1000的84消毒液不具有消毒效果
B、84消毒液可与洁厕灵(主要成分为HCl)混用
C、84消毒液名称由来是因为其中有效氯含量为84%
D、教室使用84消毒液消毒后,建议开窗通风一段时间
【答案】 ①. 碱性 ②. 无色或淡黄色液体;或有刺激性气味 ③. 在其他条件相同的情况下,在1:50至1:1000的喷洒浓度范围内,喷洒消毒液的浓度越低,消毒效果越差 ④. b ⑤. ABC
【解析】
(1)由资料可知,84消毒液pH在12左右,pH<7,显碱性;
(2)物理性质是不需要通过化学变化便能表现出来的性质,如物质的颜色、状态、气味、硬度、熔点、沸点、密度等,故84消毒液的物理性质为:无色或淡黄色液体,有刺激性气味;
(3)由图1可以看出,一班的杀菌率最高,由表1可以看出,在其他条件相同的情况下,在1:50至1:1000的喷洒浓度范围内,喷洒消毒液的浓度越低,菌落数越多,故得出的结论是:在其他条件相同的情况下,在1:50至1:1000的喷洒浓度范围内,喷洒消毒液的浓度越低,消毒效果越差;
(4)由资料可知,84消毒液浓度过高会损害呼吸道,危害身体健康,所以必须稀释后才能使用。一般认为,当杀菌率达到90%以上时,说明此时的消毒具有较好效果。由图1和表1可知,浓度在1:200以上时,杀菌率在90%以上,故浓度较低且杀菌效果较好的浓度为1:100~1:200。
故选b;
(5)A、由表1和图1可知,浓度为1:1000的84消毒液杀菌效果较差,但是也具有一定的消毒效果,符合题意;
B、84消毒液为碱性,洁厕灵(主要成分为HCl)为酸性,两者混用,会发生中和反应,失效,符合题意;
C、由资料可知,84消毒液命名是因为1984年,北京第一传染病医院(地坛医院的前身)研制成功,因此定名为“84”肝炎洗消液,后更名为“84消毒液”,符合题意;
D、由资料可知,84消毒液除了具有腐蚀性,其使用过程中放出的氯气是一种有毒气体,有可能引起中毒。氯气主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,造成呼吸困难。症状重时,会发生肺水肿而致死亡。因此室内使用84消毒液后,可开窗通风一段时间,不符合题意。
故选ABC。
9. (2022北京海淀二模)维生素 C 又称抗坏血酸,是一种重要的营养物质。兴趣小组进行维生素 C 相关的化学实验。
实验一:验证维生素C具有酸的性质
序号 操作 现象
a 向 2 mL 维生素 C 溶液中加入紫色石蕊溶液 溶液变成 色
b 向 2 mL 维生素 C 溶液中加入少量 NaHCO3 粉末 粉末消失,有气泡生成
(1)a 中的现象为溶液变成____色。
(2)b 中生成的气体是____。
实验二:探究不同烹饪方法对苹果中维生素C含量损失的影响
资料:
维生素 C 能和 KMnO4 溶液反应使之褪色,可利用该反应检测维生素 C 含量。研究表明,苹果中其他成分不影响检测。
进行下图所示实验,每次实验所用苹果片相同,实验记录如下表。
模拟烹 调方法 常温放置 糖拌(常温下加入 5 g 白糖,搅拌后放置) 炖(放入70℃水中) 煮(放入100℃水中)
处理时间 30 min 30 min 20 min 40 min 20 min 40 min
混合液色度 1 4 1 3 2 4
注:混合液色度越大,维生素 C 含量损失越大。
(3)糖拌时,维生素 C 含量损失_____(填“大”或“小”)。
(4)对比“炖”和“煮”的实验数据,得到结论:____。
(5)继续探究实验二中糖拌导致维生素 C 含量下降的原因。
①甲同学对比常温放置和糖拌中的物质,提出猜想:____和维生素 C 反应,导致苹果中维生素 C 含量下降。
②乙同学发现糖拌时有较多汁液渗出,猜测维生素 C 随汁液渗出是导致固体中维生素 C含量下降的原因。并通过实验证实了渗出液中含维生素 C,他的实验是:
步骤 1.常温下,向 5 mL 水中加入 5 g 白糖,溶解,放置 30 min,加入 10 mL 0.1% KMnO4 溶液,测定混合液色度略大于 4。
步骤 2.常温下,收集糖拌苹果片放置 30 min 后的全部渗出汁液,加水稀释至 5 mL,____。
【答案】 ①. 红 ②. CO2 ③. 大 ④. 其他条件相同,处理时间均为20分钟时或40分钟时,“炖”比“煮”的维生素含量损失小 ⑤. 白糖 ⑥. 加入 10 mL 0.1% KMnO4 溶液,测定混合液色度小于 4
【解析】
(1)若维生素C具有酸的性质,则能使紫色石蕊溶液变红,向 2 mL 维生素 C 溶液中加入紫色石蕊溶液,溶液变成红色。
(2)若维生素C具有酸的性质,则能与碳酸氢钠反应生成二氧化碳,观察到粉末消失,有气泡生成。
(3)由表中数据可知,糖拌时混合液色度大于常温放置时的混合液色度,故糖拌时,维生素 C 含量损失大。
(4)对比表中“炖”和“煮”的实验数据,可知其他条件相同,处理时间均为20分钟时或40分钟时,“炖”比“煮”的维生素含量损失小。
(5)①对比常温放置和糖拌中的物质,其他条件相同,只有白糖一个变量,故可猜想白糖和维生素 C 反应,导致苹果中维生素 C 含量下降。
②由题意可知,混合液色度越大,维生素 C 含量损失越大,要证明通过实验证实了渗出液中含维生素 C,则可设置对比实验,控制其他条件相同,只有苹果一个变量,则步骤2的具体操作为常温下,收集糖拌苹果片放置 30 min 后的全
同课章节目录
