专题3第二单元离子键离子晶体同步练习(含答案)2022——2023学年高中化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题3第二单元离子键离子晶体同步练习(含答案)2022——2023学年高中化学苏教版(2019)选择性必修2 |
|
|
| 格式 | zip | ||
| 文件大小 | 930.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-09 21:00:16 | ||
图片预览



文档简介
专题3第二单元离子键离子晶体同步练习
2022——2023学年下学期高二化学苏教版(2019)选择性必修2
一、单选题(本大题共15小题,共45.0分)
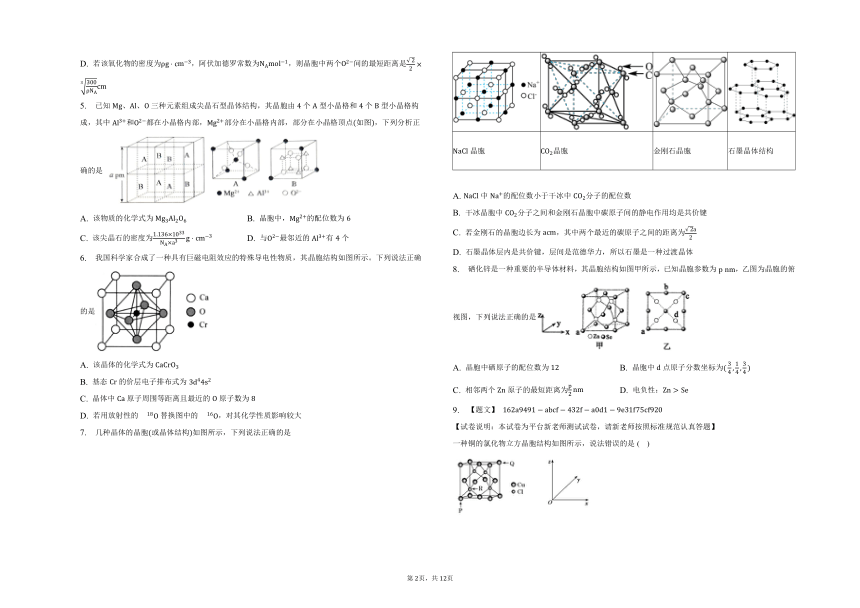
1. 的晶胞结构如图所示,已知其晶胞边长为。下列说法错误的是 ( )
A. 每个钠离子周围距离相等且最近的氢离子有个 B. 该晶胞中含有氢离子的数目为
C. 该晶胞中两个氢离子之间的最短距离为 D. 基态钠离子的电子排布式为
2. 有关晶体的结构如图所示,下列说法中错误的是 ( )
A. 在晶体中,距最近且等距的有个,距最近且等距的共个
B. 在晶体中,每个晶胞平均占有个,的配位数是
C. 在金刚石晶体中,每个碳原子被个六元环共同占有,每个六元环最多有个碳原子共面
D. 该气态团簇分子的分子式为或,其晶体不导电
3. 有关晶体的结构如图所示,下列说法中错误的是 ( )
A. 在晶体中,距最近且等距的有个,距最近且等距的共个
B. 在晶体中,每个晶胞平均占有个,的配位数是
C. 金刚石晶体中,每个碳原子被个六元环共同占有,每个六元环最多有个碳原子共面
D. 该气态团簇分子的分子式为或,其晶体不导电
4. 钴的某种氧化物广泛应用于硬质合金、超耐热合金、绝缘材料和磁性材料的生产,其晶胞结构如图所示。下列有关说法正确的是
A. 该氧化物的化学式为
B. 晶胞中的配位数为
C. 根据晶体类型推测,该物质熔点低于硫
D. 若该氧化物的密度为,阿伏加德罗常数为,则晶胞中两个间的最短距离是
5. 已知、、三种元素组成尖晶石型晶体结构,其晶胞由个型小晶格和个型小晶格构成,其中和都在小晶格内部,部分在小晶格内部,部分在小晶格顶点如图,下列分析正确的是
A. 该物质的化学式为 B. 晶胞中,的配位数为
C. 该尖晶石的密度为 D. 与最邻近的有个
6. 我国科学家合成了一种具有巨磁电阻效应的特殊导电性物质,其晶胞结构如图所示。下列说法正确的是
A. 该晶体的化学式为
B. 基态的价层电子排布式为
C. 晶体中原子周围等距离且最近的原子数为
D. 若用放射性的替换图中的,对其化学性质影响较大
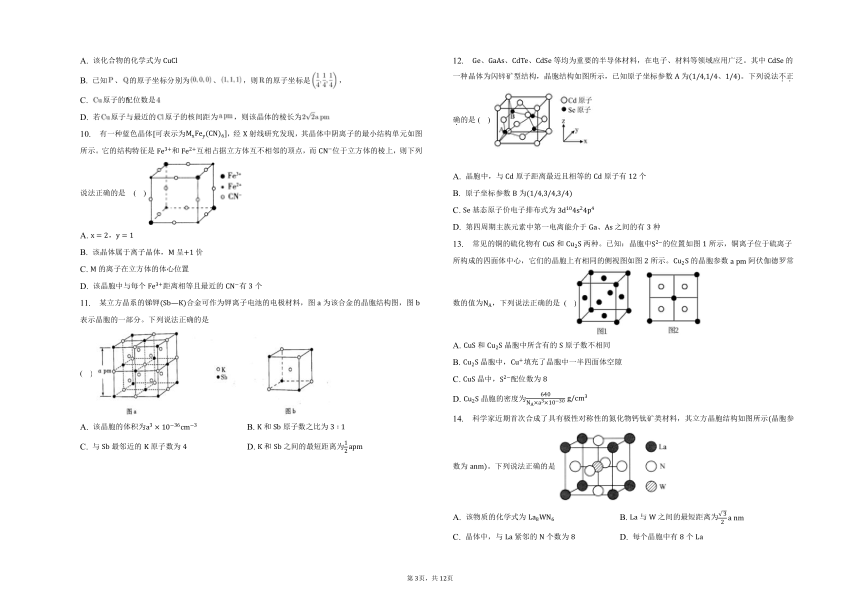
7. 几种晶体的晶胞或晶体结构如图所示,下列说法正确的是
晶胞 晶胞 金刚石晶胞 石墨晶体结构
A. 中的配位数小于干冰中分子的配位数
B. 干冰晶胞中分子之间和金刚石晶胞中碳原子间的静电作用均是共价键
C. 若金刚石的晶胞边长为,其中两个最近的碳原子之间的距离为
D. 石墨晶体层内是共价键,层间是范德华力,所以石墨是一种过渡晶体
8. 硒化锌是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞参数为,乙图为晶胞的俯视图,下列说法正确的是
A. 晶胞中硒原子的配位数为 B. 晶胞中点原子分数坐标为
C. 相邻两个原子的最短距离为 D. 电负性:
9. 【题文】
【试卷说明:本试卷为平台新老师测试试卷,请新老师按照标准规范认真答题】
一种铜的氯化物立方晶胞结构如图所示,说法错误的是( )
A. 该化合物的化学式为
B. 已知、的原子坐标分别为、,则的原子坐标是,
C. 原子的配位数是
D. 若原子与最近的原子的核间距为,则该晶体的棱长为
10. 有一种蓝色晶体可表示为,经射线研究发现,其晶体中阴离子的最小结构单元如图所示。它的结构特征是和互相占据立方体互不相邻的顶点,而位于立方体的棱上,则下列说法正确的是 ( )
A. ,
B. 该晶体属于离子晶体,呈价
C. 的离子在立方体的体心位置
D. 该晶胞中与每个距离相等且最近的有个
11. 某立方晶系的锑钾合金可作为钾离子电池的电极材料,图为该合金的晶胞结构图,图表示晶胞的一部分。下列说法正确的是( )
A. 该晶胞的体积为 B. 和原子数之比为
C. 与最邻近的原子数为 D. 和之间的最短距离为
12. 、、、等均为重要的半导体材料,在电子、材料等领域应用广泛。其中的一种晶体为闪锌矿型结构,晶胞结构如图所示,已知原子坐标参数为、。下列说法不正确的是( )
A. 晶胞中,与原子距离最近且相等的原子有个
B. 原子坐标参数为
C. 基态原子价电子排布式为
D. 第四周期主族元素中第一电离能介于、之间的有种
13. 常见的铜的硫化物有和两种。已知:晶胞中的位置如图所示,铜离子位于硫离子所构成的四面体中心,它们的晶胞上有相同的侧视图如图所示。的晶胞参数阿伏伽德罗常数的值为,下列说法正确的是 ( )
A. 和晶胞中所含有的原子数不相同
B. 晶胞中,填充了晶胞中一半四面体空隙
C. 晶中,配位数为
D. 晶胞的密度为
14. 科学家近期首次合成了具有极性对称性的氮化物钙钛矿类材料,其立方晶胞结构如图所示晶胞参数为。下列说法正确的是
A. 该物质的化学式为 B. 与之间的最短距离为
C. 晶体中,与紧邻的个数为 D. 每个晶胞中有个
15. 钴的某种氧化物广泛应用于硬质合金、超耐热合金、绝缘材料和磁性材料的生产,其晶胞结构如图所示。下列有关说法错误的是
A. 该氧化物的化学式为
B. 晶胞中的配位数为
C. 根据晶体类型推测,该物质熔点高于硫
D. 若该氧化物的密度为,阿伏加德罗常 数为,则晶胞中两个间的最短距离是
二、实验题(本大题共2小题,共20.0分)
16. 氧化铍和氧化铋为电子陶瓷粉体材料中的重要添加剂。
Ⅰ实验室中常用氯氧化铋制备。回答下列问题:
工业上将金属铋溶于足量的稀硝酸得到硝酸铋溶液,所得溶液经浓缩结晶、过滤、洗涤、干燥后得硝酸铋晶体,最后煅烧硝酸铋晶体即得氧化铋产品。金属铋溶于足量稀硝酸得到硝酸铋溶液的离子方程式:_____________________________________。
将氯氧化铋,白色,难溶于水与碳酸氢铵溶液混合,加入氨水调节溶液,下反应脱氯可得到沉淀,反应装置如图甲所示加热及夹持装置已省略,再将所得沉淀干燥并在下煅烧,可得到氧化铋产品。
图甲中仪器的名称为_______,当观察到澄清石灰水变浑浊时说明反应过程中产生了,写出产生沉淀的化学方程式:_____________。
加氨水调节为有利于生成沉淀的原因是____________________________。
某研究小组探究温度对沉淀制备的影响,得到温度与所得沉淀产率的关系如图乙所示。结合图像分析,时沉淀产率最高的原因是温度低于时,固体在水中的溶解度小,导致沉淀的产率降低;温度高于时,_____________________________________。
煅烧时用到的硅酸盐制品有_______、酒精灯、玻璃棒、泥三角。
Ⅱ晶体的晶胞结构与的相似,如图所示。
原子的配位数是_______。
设原子与原子的最近距离为,晶体的密度为,则阿伏加德罗常数的值为_______用含和的代数式表示。
17. 三元锂离子电池是新能源电动车广泛采用的一种电池技术,其中钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
钴元素的常见价态为和。写出价基态钴离子的价电子排布图:________________。
钴离子极易形成配合物,制备配合物的实验过程如下:
已知:配合物能溶于水,且溶解度随温度升高而增大。
是不溶于水的沉淀
参与反应时,明显放热。当温度高于时,开始分解。
“”时,如果不加固体,对制备过程的不利影响是________________。
加时应选择________填标号。
A.冷水浴 温水浴 沸水浴 酒精灯直接加热
本实验条件下,下列物质均可将Ⅱ氧化为Ⅲ。其中可替代“”的是________填标号。
A. 溶液
的此类配合物离子较稳定,但加碱再煮沸可促进其内界解离,如:。某实验小组用以下思路验证实验所制备的配合物的组成:取一定量加入过量浓溶液,煮沸,将生成的通入的稀硫酸过量中,再用标准溶液滴定剩余。若滴定过程平均消耗标准溶液,则所取样品中含有的物质的量________。
钴的一种化合物晶胞结构如下图所示:
已知该晶体的密度为,则晶胞中与的最近距离是________用含、的代数式表示。
三、简答题(本大题共2小题,共16.0分)
18. 分
铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
铁、铬、锰属于周期表中的______________区元素。
基态铬原子和基态锰原子中第一电离能较大的是______________填元素符号,原因为:___________________________________________________________。
化学式为的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知的配位数均为,将它们配制成等体积等浓度的溶液,分别加入足量溶液,所得沉淀的物质的量之比为::。
呈暗绿色的配合物内界的化学式为_______________。
分子的模型为______________。
和均为离子化合物,的熔点高于熔点的原因为 ________________________。
一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。
该晶胞中由形成的正八面体空隙数目为 ______________。
设为阿伏加德罗常数的值,晶胞中距离最近的两个之间的距离为,则晶体的密度
______________。用含、的代数式表示。
19. 蛋氨酸铬Ⅲ配合物是一种治疗Ⅱ型糖尿病的药物,其结构简式如图所示。回答下列相关问题:
基态原子核外有_______种运动状态的电子,下列不同状态的微粒中,电离最外层一个电子所需能量最大的是_______填标号。
A.
蛋氨酸铬Ⅲ配合物的中心铬离子的配位数为_______;的_______杂化轨道与的空轨道形成配位键。
哈勃韦斯原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的轨道可以存取电子,降低活化能,使分解反应容易发生。_______填“能”或“不能”催化双氧水分解。
化学式为的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,的配位数均为,将它们配制成等体积等物质的量浓度的溶液,分别加入足量溶液,依次所得沉淀的物质的量之比为,则呈亮绿色的配合物,其内界离子的化学式为_______。分子与形成配位键后键角_______填“变大”“变小”或“不变”。
氮化铬的晶体结构类型与氯化钠相似,其晶胞结构如图所示。点分数坐标为,则点分数坐标为_______。已知氮化铬的晶体密度为,摩尔质量为,为阿伏加德罗常数,则晶胞参数为_______只要求列表达式,不必计算数值。
四、推断题(本大题共1小题,共10.0分)
20. 已知、、、是原子序数依次增大的前四周期的元素,在周期表中,与相邻且的基态原子的轨道中均有电子且电子的自旋方向相同,是号元素,的能层有个电子,最高正价为价。
的基态原子的价电子排布式为____________,基态原子最高能级上的电子共有____________种运动状态。
原子的第一电离能比同周期左右相邻的原子第一电离能都大,其原因是______________________________________________________________________________。
、、可与氯元素形成、、、等化合物,这些物质中,中心原子轨道杂化类型为的分子是______________________________,分子构型为正四面体的是____________。
、、三种元素形成的最简单氢化物沸点的高低顺序为,其原因是______________________________________________________________________________。
的一种单质单层的结构的球棍模型如下左图所示,则该单层结构中的六元环数目为____________设为阿伏加德罗常数的值,若该单质中每个原子的最外层均达到个电子的稳定结构,则其晶体中键与键数目之比为____________。
与镓形成的一种化合物的晶胞结构如上右图所示,则原子的配位数是____________,若该晶体的密度为,为阿伏加德罗常数的值,则晶胞中与的中心距是____________可以不化简。
答案和解析
1.【答案】
【解析】由图可知,每个钠离子周围距离相等且最近的氢离子有个,项正确;
该晶胞中含有氢离子的数目为,项正确;
由图可得,该晶胞中两个氢离子之间的最短距离为面对角线长的一半,即,项错误;
基态钠离子核外有个电子,其电子排布式为,项正确。
2.【答案】
【解析】
【分析】
本题考查物质结构与性质,涉及化学键,晶胞计算等内容,其中晶胞计算为解题难点,需要结合均摊法进行分析,掌握基础为解题关键,整体难度适中。
【解答】
A.氯化钠晶体中,距最近且等距的有个,距最近且距离相等的有个,A正确;
B.位于晶胞顶点和面心,数目为,即每个晶胞平均占有个,距离最近且等距的有个,即的配位数为,B正确;
C.在金刚石晶体中,原子所连接的最小环为六元环,每个原子连接个碳原子,连接的个原子中每个原子形成个六元环,所以金刚石晶体中每个碳原子被个六元环共同占有,晶胞中共平面的原子如图,共个,C正确;
D.该气态团簇分子含有个原子和个原子,则该气态团簇分子的分子式为或,该晶体为分子晶体,其中不含能自由移动的电子或离子,因此不能导电,D错误。
3.【答案】
【解析】
【分析】
本题考查晶胞的计算,难度一般,关键是掌握晶胞的“分摊法”计算方法,注意气态团簇分子与晶胞的区别。
【解答】
A. 在晶体中,距最近的有个,所以钠离子的配位数是,距最近且等距的共个,故A正确;
B.位于晶胞的顶点和面心,晶胞中含有的个数为:,最近的有个,即的配位数是,故B正确;
C. 在金刚石晶体中,原子所连接的最小环为六元环,每个原子连接个碳原子,连接的个原子中每个原子形成个六元环,所以金刚石晶体中每个原子能形成个六元环,晶胞中共平面的原子如图,共个,故C正确;
D. 气态团簇分子不同于晶胞,气态团簇分子中含有个原子,个原子,则分子式为或,该晶体为分子晶体,其中不含能自由移动的电子或离子,因此不能导电,故D错误;
故选D。
4.【答案】
【解析】
【分析】
本题考查了物质的结构组成,掌握“均摊法”确定化学式、晶胞的计算为解答的关键,题目难度中等。
【解答】
A.该晶胞中含阳离子个数:,含有阴离子的个数:,该氧化物的化学式为,项错误
B.晶胞中的配位数为,项错误
C.阴离子、阳离子构成离子晶体,根据晶体类型推测,硫 熔为分子晶体,硫 熔点低于离子晶体,项错误
D.晶胞棱长,两个间的最短距离为面对角线的一半,即,项正确。
5.【答案】
【解析】
【分析】
本题主要考查的是晶胞结构分析和相关计算,意在考查学生的分析能力和空间想象能力,解题的关键是理清不同微粒在晶胞中的相对位置。
【解答】
A.由晶胞结构可知,个晶格中有个镁离子在顶点,个在体心,个中的镁离子个数为:,个晶格中有个镁离子在顶点,个中的镁离子个数为:,则该晶胞中镁离子个数为:;个晶格和个晶格中均含有个氧离子,则氧离子个数为个,每个晶格中含有个铝离子,铝离子个数为,该物质的化学式为,A错误;
B.由晶格结构可知每个与个氧离子紧相邻,其配位数为,B错误;
C.由项可知晶体中含有、、的个数,晶胞的质量为,晶胞边长为所以晶体的密度,C正确;
D.与最邻近的在区,由图可知,、构成的立方体中,与最临近的为顶点的个,在区中无铝离子,D错误。
6.【答案】
【解析】
【分析】
本题考查晶胞的有关计算等,难度不大,解题的关键是对基础知识灵活运用。
【解答】
A.从晶胞图中可看到在晶胞的顶点,数目为,在体心,数目是个;原子在晶胞的面心,数目为,化学式为,故A正确;
B.基态的价层电子排布式为,故B错误;
C.与配位的位于晶胞面对角线的中点,距离相等的共有个,故C错误;
D.互为同位素,形成的化合物在化学性质上无差异,故D错误。
7.【答案】
【解析】
【分析】
本题考查晶体结构,难度一般,理解晶体结构是解题关键。
【解答】
A.晶胞中每个周围有个,所以配位数为,晶胞中的配位数为:,A正确
B.干冰晶胞中分子之间是分子间作用力,金刚石晶胞中碳原子间是共价键,B错误
C.若金刚石的晶胞边长为,两个碳原子之间的最短距离为体对角线的四分之一,即,C错误
D.石墨晶体层内是共价键,层间是范德华力,所以石墨晶体兼有共价晶体、分子晶体、金属晶体的特征,属于混合晶体, D错误。
8.【答案】
【解析】
【分析】
本题考查晶胞的结构计算,明确图示晶胞结构为解答关键,注意掌握元素周期律内容及粒子空间构型的判断方法,题目难度中等。
【解答】
A.该晶胞中原子的配位数是,则晶胞中原子的配位数也是,A错误;
B.该晶胞中点坐标为,点坐标为为,则原子位于坐标原点,原子在坐标轴正方向空间内,由图乙可知原子也在坐标轴正方向空间内,且到轴、轴、轴的距离分别为、、,即原子的坐标为,B正确;
C.面对角线的两个原子距离最短,为,故C错误;
D.、为同周期元素,根据非金属性越强,电负性越大,非金属性:,电负性:,故D错误。
9.【答案】
【解析】
【分析】
本题考查晶胞计算,侧重考查分析判断及空间想像能力,利用均摊法确定化学式,明确铜原子与氯原子的空间位置和坐标是解答的关键,题目难度中等。
【解答】
A.由晶胞结构可知,原子处于晶胞内部,晶胞中含有个原子,原子属于顶点与面心上,晶胞中含有原子数目为,故该化合物的化学式为,故A正确
B.已知、的原子坐标分别为、,则为包含在内的八分之一个晶胞的中心,故原子坐标是
,故B正确
C.由图知,距离最近且等距的氯原子有个,则原子的配位数是,故C正确
D.若原子与最近的原子的核间距为,即为晶胞立方体体对角线的,而体对角线为晶胞边长的倍,则该晶体的棱长为,故D错误
故选D。
10.【答案】
【解析】在立方体的顶点,每个被个晶胞共用,故每个晶胞中的个数为,同理每个晶胞中的个数为,位于棱的中点,每个被个晶胞共用,故每个晶胞中的个数为,已知晶体的化学式为,则,晶体中的阴离子为,根据化合物中各元素的化合价代数和为得晶体的化学式为。
综上可知,,,项错误;
因为有阴、阳离子,故该晶体属于离子晶体,呈价,项正确;
若的离子在立方体的体心位置,则该晶体的化学式可表示为,项错误;
该晶胞中与每个距离相等且最近的有个,项错误。
11.【答案】
【解析】
【分析】
本题考查了晶胞相关计算,整体难度中等,掌握晶胞中原子数目计算方法解答本题的关键。
【解答】
A.该晶胞为正四面体结构,边长为,该晶胞的体积为 ,A错误;
B.原子数为,原子数为,和原子数之比为,B正确;
C.与最邻近的原子数为,C错误;
D.和之间的最短距离为晶胞体对角线的,即,D错误。
12.【答案】
【解析】
【分析】
本题考查原子结构和晶体结构,侧重考查学生核外电子排布和晶胞结构的掌握情况,试题难度中等。
【解答】
A.晶胞中,原子位于晶胞的顶点和面心,两个原子距离最近且相等的距离为面对角线的一半,以顶点的原子为中心,每个晶胞有个原子距离最近且相等,每个顶点属于个晶胞,且每个面上的原子重复一次,故与原子距离最近且相等的原子有个,故A正确;
B.由晶胞结构示意图可知,原子分别位于八个小立方体中两个立方体的体心上,根据相对位置分析,原子坐标参数为,故 B正确;
C.是号元素,基态原子核外有个电子,其基态原子价电子排布式为,故C错误;
D.同周期元素第一电离能从左到右有增大趋势,但第Ⅱ元素的大于第Ⅲ元素,第Ⅴ元素大于第Ⅵ元素,、分别是第Ⅲ、Ⅴ元素,因此第四周期主族元素中的第一电离能介于之间的元素有、、,故D正确;
13.【答案】
【解析】略
14.【答案】
【解析】
【分析】
本题考查晶胞的有关计算等,难度不大,解题的关键是对基础知识灵活运用。
【解答】
A.晶胞中,原子数目为,原子数目为,原子数目为,化学式为
B.与之间的最短距离为体对角线的,为;
C.与紧邻的个数为;
D.每个晶胞中有原子数目为
15.【答案】
【解析】略
16.【答案】
分液漏斗;
氨水会与反应生成
分解,使溶液的降低,不利于的形成,导致沉淀的产率降低
坩埚
【解析】
【分析】
本题以氧化铋的制取为载体,考查陌生方程式的书写、对原理的分析评价、仪器识别、对试剂与条件控制的分析评价、晶胞计算等,是对学生综合能力的考查。
【解答】
金属与稀硝酸反应时,硝酸一般被还原为,与稀硝酸生成、与水,反应离子方程式为:;
由仪器结构特征可知,仪器为分液漏斗;与反应有和生成,可以理解为:与反应生成、、,生成的又与反应生成、、产生沉淀的化学方程式:;
氨水显碱性,会与反应生成大量的,有利于生成沉淀;
温度高于时,分解,氨气逸出,溶液降低,不利于的形成,使沉淀产率降低;
灼烧时用到的硅酸盐制品有坩埚、酒精灯、玻璃棒、泥三角;
以顶面的原子为例,该晶胞中有个原子与其配位,该晶胞上方的晶胞中也含有个原子与其配位,所以原子的配位数为;
原子与原子的最近距离为面对角线的一半,设晶胞的棱长为,则有,所以,则晶胞的体积为,根据原子的个数可知晶胞中含有个单元,所以晶胞的质量为,所以有,解得。
17.【答案】
形成沉淀,影响配合物的生成
;
;
【解析】
【分析】
本题考查了物质的制备,涉及物质的制备原理、实验方案评价、滴定管的使用、物质的检验等,明确实验原理及实验基本操作方法、试题侧重于考查学生的分析问题和解决问题的能力,注意题目信息的与相关基础知识联合分析,题目难度中等。
【解答】
钴的电子排布式为,则价基态钴离子的价电子排布图:。
氨水显碱性,碱性条件下,会生成沉淀,影响配合物的生成,所以要加氯化铵;
双氧水不稳定,双氧水受热易分解,所以加双氧水时应该选择冷水浴;
将Ⅱ氧化为Ⅲ的过程中不能引入新的杂质,用氧气或氯气作氧化剂不会引入新的杂质,硝酸和高锰酸钾作氧化剂会引入新的杂质,故AC正确;
滴定过程平均消耗标准溶液,依据可得,则样品中含有的物质的量。
原子位于晶胞的内部,全部属于晶胞,位于顶点,属于该晶胞的个数为,氧原子位于面心,属于该晶胞的个数为,化学式为,晶胞的质量为,设晶胞边长为,晶胞的密度,晶胞的边长为,根据晶胞的结构,与最近的距离是面对角线的一半,即最近的距离是。
18.【答案】
基态原子的核外电子排布式为,能级是全满结构,更稳定,失去一个电子所需能量更高
正四面体形
半径更小,的晶格能更大,熔点更高
【解析】略
19.【答案】;;
;;
能;
;变大;
;或
【解析】
【分析】
本题考查物质的结构和晶胞计算,难度较大,掌握核外电子排布式、配合物理论和晶胞计算为解题关键,侧重考查分析能力和灵活运用能力。
【解答】
为号元素,电子排布在不同能级不同轨道上,电子运动状态不同,在同一轨道内的电子的自旋方向相反,则有种运动状态的电子,失去电子,为基态的第一电离能,
B.失去电子,为基态的第二电离能,
C.为激发态,失去电子所需能量很低,为激发态的第一电离能,
D.为激发态,失去电子所需能量很低,为激发态的第一电离能,
第二电离能大于第一电离能,故选B;
蛋氨酸铬Ⅲ配合物的中心铬离子与个原子形成配位键,配位数为;原子形成个键包括个普通共价键和一个配位键,杂化类型为;杂化轨道与的空轨道形成配位键
价层电子排布式为,有个单电子和个空轨道,则能催化双氧水分解;
化学式为的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,的配位数均为,将它们配制成等体积等物质的量浓度的溶液,分别加入足量溶液,依次所得沉淀的物质的量之比为,则呈亮绿色的配合物,其外界有个氯离子,配位体为个氯离子和个水分子,化学式为;分子与形成配位键后,原子的孤电子对减少,根据价层电子互斥理论,键角变大;
点分数坐标为,则点位于晶胞后面的上棱中心,轴上坐标为,轴上坐标为,轴坐标为,则分数坐标为;利用均摊法计算,晶胞平均含有:,:,晶胞质量为,晶胞体积为,晶胞参数为或。
20.【答案】;;
镁的原子核对电子吸引能力强于钠基态镁原子的能级处于较稳定的全充满状态而铝的能级不是
、、;;
分子间能形成氢键,的分子间作用力比甲烷的大;
; ;
;;
【解析】
【分析】本题考查元素推断,结合信息推断元素,掌握电子排布、电离能、杂化轨道、分子间作用力、晶胞分析计算是关键,难度一般。
【解答】根据题干信息知、、、分别为、、、,据此解题,
的基态原子的价电子排布式为:;基态原子最高能级上的电子共有种运动状态;
因镁的核电荷数大于钠且原子半径小于钠,核对电子的吸引力大于钠,故镁的第一电离能比钠的第一电离能大;但镁的能级上有两个电子,属于较稳定的全充满状态铝的能级上只有一个电子,故镁的第一电离能也比铝的第一电离能大;
形成个键,分子的中心原子形成个键为杂化,、分子的中心原子均形成了个键,同时都有一个孤电子对,故二者均为杂化,为正四面体分子;
三种物质的氢化物均为分子晶体,分子间能形成氢键,故沸点最高,的相对分子质量远大于,分子间作用力比甲烷的大,故沸点高于甲烷;
的物质的量是,含有个碳原子,由图知,每个碳原子均为三个环所共用,故每个六元环上碳原子数目为,故六元环的总数目为.;由图知,每个碳原子均与另外三个碳原子成键,因碳原子最外层达到个电子的稳定结构时需要形成个共价键,故三个碳原子中有一个碳原子与中心碳原子之间要形成一个双键,故 键与键数目之比为;
在砷化镓晶体中,一个晶胞中所含有的镓原子数目为,另有个砷原子,配位数均是,晶胞的质量为,由晶体密度为知晶胞参数为将晶胞均分为个小正方体,则每个原子均位于小正方体的体心,与的中心距离等于小正方体体对角线长度的一半,等于晶胞体对角线长度的四分之一,即。
第1页,共1页
2022——2023学年下学期高二化学苏教版(2019)选择性必修2
一、单选题(本大题共15小题,共45.0分)
1. 的晶胞结构如图所示,已知其晶胞边长为。下列说法错误的是 ( )
A. 每个钠离子周围距离相等且最近的氢离子有个 B. 该晶胞中含有氢离子的数目为
C. 该晶胞中两个氢离子之间的最短距离为 D. 基态钠离子的电子排布式为
2. 有关晶体的结构如图所示,下列说法中错误的是 ( )
A. 在晶体中,距最近且等距的有个,距最近且等距的共个
B. 在晶体中,每个晶胞平均占有个,的配位数是
C. 在金刚石晶体中,每个碳原子被个六元环共同占有,每个六元环最多有个碳原子共面
D. 该气态团簇分子的分子式为或,其晶体不导电
3. 有关晶体的结构如图所示,下列说法中错误的是 ( )
A. 在晶体中,距最近且等距的有个,距最近且等距的共个
B. 在晶体中,每个晶胞平均占有个,的配位数是
C. 金刚石晶体中,每个碳原子被个六元环共同占有,每个六元环最多有个碳原子共面
D. 该气态团簇分子的分子式为或,其晶体不导电
4. 钴的某种氧化物广泛应用于硬质合金、超耐热合金、绝缘材料和磁性材料的生产,其晶胞结构如图所示。下列有关说法正确的是
A. 该氧化物的化学式为
B. 晶胞中的配位数为
C. 根据晶体类型推测,该物质熔点低于硫
D. 若该氧化物的密度为,阿伏加德罗常数为,则晶胞中两个间的最短距离是
5. 已知、、三种元素组成尖晶石型晶体结构,其晶胞由个型小晶格和个型小晶格构成,其中和都在小晶格内部,部分在小晶格内部,部分在小晶格顶点如图,下列分析正确的是
A. 该物质的化学式为 B. 晶胞中,的配位数为
C. 该尖晶石的密度为 D. 与最邻近的有个
6. 我国科学家合成了一种具有巨磁电阻效应的特殊导电性物质,其晶胞结构如图所示。下列说法正确的是
A. 该晶体的化学式为
B. 基态的价层电子排布式为
C. 晶体中原子周围等距离且最近的原子数为
D. 若用放射性的替换图中的,对其化学性质影响较大
7. 几种晶体的晶胞或晶体结构如图所示,下列说法正确的是
晶胞 晶胞 金刚石晶胞 石墨晶体结构
A. 中的配位数小于干冰中分子的配位数
B. 干冰晶胞中分子之间和金刚石晶胞中碳原子间的静电作用均是共价键
C. 若金刚石的晶胞边长为,其中两个最近的碳原子之间的距离为
D. 石墨晶体层内是共价键,层间是范德华力,所以石墨是一种过渡晶体
8. 硒化锌是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞参数为,乙图为晶胞的俯视图,下列说法正确的是
A. 晶胞中硒原子的配位数为 B. 晶胞中点原子分数坐标为
C. 相邻两个原子的最短距离为 D. 电负性:
9. 【题文】
【试卷说明:本试卷为平台新老师测试试卷,请新老师按照标准规范认真答题】
一种铜的氯化物立方晶胞结构如图所示,说法错误的是( )
A. 该化合物的化学式为
B. 已知、的原子坐标分别为、,则的原子坐标是,
C. 原子的配位数是
D. 若原子与最近的原子的核间距为,则该晶体的棱长为
10. 有一种蓝色晶体可表示为,经射线研究发现,其晶体中阴离子的最小结构单元如图所示。它的结构特征是和互相占据立方体互不相邻的顶点,而位于立方体的棱上,则下列说法正确的是 ( )
A. ,
B. 该晶体属于离子晶体,呈价
C. 的离子在立方体的体心位置
D. 该晶胞中与每个距离相等且最近的有个
11. 某立方晶系的锑钾合金可作为钾离子电池的电极材料,图为该合金的晶胞结构图,图表示晶胞的一部分。下列说法正确的是( )
A. 该晶胞的体积为 B. 和原子数之比为
C. 与最邻近的原子数为 D. 和之间的最短距离为
12. 、、、等均为重要的半导体材料,在电子、材料等领域应用广泛。其中的一种晶体为闪锌矿型结构,晶胞结构如图所示,已知原子坐标参数为、。下列说法不正确的是( )
A. 晶胞中,与原子距离最近且相等的原子有个
B. 原子坐标参数为
C. 基态原子价电子排布式为
D. 第四周期主族元素中第一电离能介于、之间的有种
13. 常见的铜的硫化物有和两种。已知:晶胞中的位置如图所示,铜离子位于硫离子所构成的四面体中心,它们的晶胞上有相同的侧视图如图所示。的晶胞参数阿伏伽德罗常数的值为,下列说法正确的是 ( )
A. 和晶胞中所含有的原子数不相同
B. 晶胞中,填充了晶胞中一半四面体空隙
C. 晶中,配位数为
D. 晶胞的密度为
14. 科学家近期首次合成了具有极性对称性的氮化物钙钛矿类材料,其立方晶胞结构如图所示晶胞参数为。下列说法正确的是
A. 该物质的化学式为 B. 与之间的最短距离为
C. 晶体中,与紧邻的个数为 D. 每个晶胞中有个
15. 钴的某种氧化物广泛应用于硬质合金、超耐热合金、绝缘材料和磁性材料的生产,其晶胞结构如图所示。下列有关说法错误的是
A. 该氧化物的化学式为
B. 晶胞中的配位数为
C. 根据晶体类型推测,该物质熔点高于硫
D. 若该氧化物的密度为,阿伏加德罗常 数为,则晶胞中两个间的最短距离是
二、实验题(本大题共2小题,共20.0分)
16. 氧化铍和氧化铋为电子陶瓷粉体材料中的重要添加剂。
Ⅰ实验室中常用氯氧化铋制备。回答下列问题:
工业上将金属铋溶于足量的稀硝酸得到硝酸铋溶液,所得溶液经浓缩结晶、过滤、洗涤、干燥后得硝酸铋晶体,最后煅烧硝酸铋晶体即得氧化铋产品。金属铋溶于足量稀硝酸得到硝酸铋溶液的离子方程式:_____________________________________。
将氯氧化铋,白色,难溶于水与碳酸氢铵溶液混合,加入氨水调节溶液,下反应脱氯可得到沉淀,反应装置如图甲所示加热及夹持装置已省略,再将所得沉淀干燥并在下煅烧,可得到氧化铋产品。
图甲中仪器的名称为_______,当观察到澄清石灰水变浑浊时说明反应过程中产生了,写出产生沉淀的化学方程式:_____________。
加氨水调节为有利于生成沉淀的原因是____________________________。
某研究小组探究温度对沉淀制备的影响,得到温度与所得沉淀产率的关系如图乙所示。结合图像分析,时沉淀产率最高的原因是温度低于时,固体在水中的溶解度小,导致沉淀的产率降低;温度高于时,_____________________________________。
煅烧时用到的硅酸盐制品有_______、酒精灯、玻璃棒、泥三角。
Ⅱ晶体的晶胞结构与的相似,如图所示。
原子的配位数是_______。
设原子与原子的最近距离为,晶体的密度为,则阿伏加德罗常数的值为_______用含和的代数式表示。
17. 三元锂离子电池是新能源电动车广泛采用的一种电池技术,其中钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
钴元素的常见价态为和。写出价基态钴离子的价电子排布图:________________。
钴离子极易形成配合物,制备配合物的实验过程如下:
已知:配合物能溶于水,且溶解度随温度升高而增大。
是不溶于水的沉淀
参与反应时,明显放热。当温度高于时,开始分解。
“”时,如果不加固体,对制备过程的不利影响是________________。
加时应选择________填标号。
A.冷水浴 温水浴 沸水浴 酒精灯直接加热
本实验条件下,下列物质均可将Ⅱ氧化为Ⅲ。其中可替代“”的是________填标号。
A. 溶液
的此类配合物离子较稳定,但加碱再煮沸可促进其内界解离,如:。某实验小组用以下思路验证实验所制备的配合物的组成:取一定量加入过量浓溶液,煮沸,将生成的通入的稀硫酸过量中,再用标准溶液滴定剩余。若滴定过程平均消耗标准溶液,则所取样品中含有的物质的量________。
钴的一种化合物晶胞结构如下图所示:
已知该晶体的密度为,则晶胞中与的最近距离是________用含、的代数式表示。
三、简答题(本大题共2小题,共16.0分)
18. 分
铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
铁、铬、锰属于周期表中的______________区元素。
基态铬原子和基态锰原子中第一电离能较大的是______________填元素符号,原因为:___________________________________________________________。
化学式为的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知的配位数均为,将它们配制成等体积等浓度的溶液,分别加入足量溶液,所得沉淀的物质的量之比为::。
呈暗绿色的配合物内界的化学式为_______________。
分子的模型为______________。
和均为离子化合物,的熔点高于熔点的原因为 ________________________。
一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。
该晶胞中由形成的正八面体空隙数目为 ______________。
设为阿伏加德罗常数的值,晶胞中距离最近的两个之间的距离为,则晶体的密度
______________。用含、的代数式表示。
19. 蛋氨酸铬Ⅲ配合物是一种治疗Ⅱ型糖尿病的药物,其结构简式如图所示。回答下列相关问题:
基态原子核外有_______种运动状态的电子,下列不同状态的微粒中,电离最外层一个电子所需能量最大的是_______填标号。
A.
蛋氨酸铬Ⅲ配合物的中心铬离子的配位数为_______;的_______杂化轨道与的空轨道形成配位键。
哈勃韦斯原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的轨道可以存取电子,降低活化能,使分解反应容易发生。_______填“能”或“不能”催化双氧水分解。
化学式为的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,的配位数均为,将它们配制成等体积等物质的量浓度的溶液,分别加入足量溶液,依次所得沉淀的物质的量之比为,则呈亮绿色的配合物,其内界离子的化学式为_______。分子与形成配位键后键角_______填“变大”“变小”或“不变”。
氮化铬的晶体结构类型与氯化钠相似,其晶胞结构如图所示。点分数坐标为,则点分数坐标为_______。已知氮化铬的晶体密度为,摩尔质量为,为阿伏加德罗常数,则晶胞参数为_______只要求列表达式,不必计算数值。
四、推断题(本大题共1小题,共10.0分)
20. 已知、、、是原子序数依次增大的前四周期的元素,在周期表中,与相邻且的基态原子的轨道中均有电子且电子的自旋方向相同,是号元素,的能层有个电子,最高正价为价。
的基态原子的价电子排布式为____________,基态原子最高能级上的电子共有____________种运动状态。
原子的第一电离能比同周期左右相邻的原子第一电离能都大,其原因是______________________________________________________________________________。
、、可与氯元素形成、、、等化合物,这些物质中,中心原子轨道杂化类型为的分子是______________________________,分子构型为正四面体的是____________。
、、三种元素形成的最简单氢化物沸点的高低顺序为,其原因是______________________________________________________________________________。
的一种单质单层的结构的球棍模型如下左图所示,则该单层结构中的六元环数目为____________设为阿伏加德罗常数的值,若该单质中每个原子的最外层均达到个电子的稳定结构,则其晶体中键与键数目之比为____________。
与镓形成的一种化合物的晶胞结构如上右图所示,则原子的配位数是____________,若该晶体的密度为,为阿伏加德罗常数的值,则晶胞中与的中心距是____________可以不化简。
答案和解析
1.【答案】
【解析】由图可知,每个钠离子周围距离相等且最近的氢离子有个,项正确;
该晶胞中含有氢离子的数目为,项正确;
由图可得,该晶胞中两个氢离子之间的最短距离为面对角线长的一半,即,项错误;
基态钠离子核外有个电子,其电子排布式为,项正确。
2.【答案】
【解析】
【分析】
本题考查物质结构与性质,涉及化学键,晶胞计算等内容,其中晶胞计算为解题难点,需要结合均摊法进行分析,掌握基础为解题关键,整体难度适中。
【解答】
A.氯化钠晶体中,距最近且等距的有个,距最近且距离相等的有个,A正确;
B.位于晶胞顶点和面心,数目为,即每个晶胞平均占有个,距离最近且等距的有个,即的配位数为,B正确;
C.在金刚石晶体中,原子所连接的最小环为六元环,每个原子连接个碳原子,连接的个原子中每个原子形成个六元环,所以金刚石晶体中每个碳原子被个六元环共同占有,晶胞中共平面的原子如图,共个,C正确;
D.该气态团簇分子含有个原子和个原子,则该气态团簇分子的分子式为或,该晶体为分子晶体,其中不含能自由移动的电子或离子,因此不能导电,D错误。
3.【答案】
【解析】
【分析】
本题考查晶胞的计算,难度一般,关键是掌握晶胞的“分摊法”计算方法,注意气态团簇分子与晶胞的区别。
【解答】
A. 在晶体中,距最近的有个,所以钠离子的配位数是,距最近且等距的共个,故A正确;
B.位于晶胞的顶点和面心,晶胞中含有的个数为:,最近的有个,即的配位数是,故B正确;
C. 在金刚石晶体中,原子所连接的最小环为六元环,每个原子连接个碳原子,连接的个原子中每个原子形成个六元环,所以金刚石晶体中每个原子能形成个六元环,晶胞中共平面的原子如图,共个,故C正确;
D. 气态团簇分子不同于晶胞,气态团簇分子中含有个原子,个原子,则分子式为或,该晶体为分子晶体,其中不含能自由移动的电子或离子,因此不能导电,故D错误;
故选D。
4.【答案】
【解析】
【分析】
本题考查了物质的结构组成,掌握“均摊法”确定化学式、晶胞的计算为解答的关键,题目难度中等。
【解答】
A.该晶胞中含阳离子个数:,含有阴离子的个数:,该氧化物的化学式为,项错误
B.晶胞中的配位数为,项错误
C.阴离子、阳离子构成离子晶体,根据晶体类型推测,硫 熔为分子晶体,硫 熔点低于离子晶体,项错误
D.晶胞棱长,两个间的最短距离为面对角线的一半,即,项正确。
5.【答案】
【解析】
【分析】
本题主要考查的是晶胞结构分析和相关计算,意在考查学生的分析能力和空间想象能力,解题的关键是理清不同微粒在晶胞中的相对位置。
【解答】
A.由晶胞结构可知,个晶格中有个镁离子在顶点,个在体心,个中的镁离子个数为:,个晶格中有个镁离子在顶点,个中的镁离子个数为:,则该晶胞中镁离子个数为:;个晶格和个晶格中均含有个氧离子,则氧离子个数为个,每个晶格中含有个铝离子,铝离子个数为,该物质的化学式为,A错误;
B.由晶格结构可知每个与个氧离子紧相邻,其配位数为,B错误;
C.由项可知晶体中含有、、的个数,晶胞的质量为,晶胞边长为所以晶体的密度,C正确;
D.与最邻近的在区,由图可知,、构成的立方体中,与最临近的为顶点的个,在区中无铝离子,D错误。
6.【答案】
【解析】
【分析】
本题考查晶胞的有关计算等,难度不大,解题的关键是对基础知识灵活运用。
【解答】
A.从晶胞图中可看到在晶胞的顶点,数目为,在体心,数目是个;原子在晶胞的面心,数目为,化学式为,故A正确;
B.基态的价层电子排布式为,故B错误;
C.与配位的位于晶胞面对角线的中点,距离相等的共有个,故C错误;
D.互为同位素,形成的化合物在化学性质上无差异,故D错误。
7.【答案】
【解析】
【分析】
本题考查晶体结构,难度一般,理解晶体结构是解题关键。
【解答】
A.晶胞中每个周围有个,所以配位数为,晶胞中的配位数为:,A正确
B.干冰晶胞中分子之间是分子间作用力,金刚石晶胞中碳原子间是共价键,B错误
C.若金刚石的晶胞边长为,两个碳原子之间的最短距离为体对角线的四分之一,即,C错误
D.石墨晶体层内是共价键,层间是范德华力,所以石墨晶体兼有共价晶体、分子晶体、金属晶体的特征,属于混合晶体, D错误。
8.【答案】
【解析】
【分析】
本题考查晶胞的结构计算,明确图示晶胞结构为解答关键,注意掌握元素周期律内容及粒子空间构型的判断方法,题目难度中等。
【解答】
A.该晶胞中原子的配位数是,则晶胞中原子的配位数也是,A错误;
B.该晶胞中点坐标为,点坐标为为,则原子位于坐标原点,原子在坐标轴正方向空间内,由图乙可知原子也在坐标轴正方向空间内,且到轴、轴、轴的距离分别为、、,即原子的坐标为,B正确;
C.面对角线的两个原子距离最短,为,故C错误;
D.、为同周期元素,根据非金属性越强,电负性越大,非金属性:,电负性:,故D错误。
9.【答案】
【解析】
【分析】
本题考查晶胞计算,侧重考查分析判断及空间想像能力,利用均摊法确定化学式,明确铜原子与氯原子的空间位置和坐标是解答的关键,题目难度中等。
【解答】
A.由晶胞结构可知,原子处于晶胞内部,晶胞中含有个原子,原子属于顶点与面心上,晶胞中含有原子数目为,故该化合物的化学式为,故A正确
B.已知、的原子坐标分别为、,则为包含在内的八分之一个晶胞的中心,故原子坐标是
,故B正确
C.由图知,距离最近且等距的氯原子有个,则原子的配位数是,故C正确
D.若原子与最近的原子的核间距为,即为晶胞立方体体对角线的,而体对角线为晶胞边长的倍,则该晶体的棱长为,故D错误
故选D。
10.【答案】
【解析】在立方体的顶点,每个被个晶胞共用,故每个晶胞中的个数为,同理每个晶胞中的个数为,位于棱的中点,每个被个晶胞共用,故每个晶胞中的个数为,已知晶体的化学式为,则,晶体中的阴离子为,根据化合物中各元素的化合价代数和为得晶体的化学式为。
综上可知,,,项错误;
因为有阴、阳离子,故该晶体属于离子晶体,呈价,项正确;
若的离子在立方体的体心位置,则该晶体的化学式可表示为,项错误;
该晶胞中与每个距离相等且最近的有个,项错误。
11.【答案】
【解析】
【分析】
本题考查了晶胞相关计算,整体难度中等,掌握晶胞中原子数目计算方法解答本题的关键。
【解答】
A.该晶胞为正四面体结构,边长为,该晶胞的体积为 ,A错误;
B.原子数为,原子数为,和原子数之比为,B正确;
C.与最邻近的原子数为,C错误;
D.和之间的最短距离为晶胞体对角线的,即,D错误。
12.【答案】
【解析】
【分析】
本题考查原子结构和晶体结构,侧重考查学生核外电子排布和晶胞结构的掌握情况,试题难度中等。
【解答】
A.晶胞中,原子位于晶胞的顶点和面心,两个原子距离最近且相等的距离为面对角线的一半,以顶点的原子为中心,每个晶胞有个原子距离最近且相等,每个顶点属于个晶胞,且每个面上的原子重复一次,故与原子距离最近且相等的原子有个,故A正确;
B.由晶胞结构示意图可知,原子分别位于八个小立方体中两个立方体的体心上,根据相对位置分析,原子坐标参数为,故 B正确;
C.是号元素,基态原子核外有个电子,其基态原子价电子排布式为,故C错误;
D.同周期元素第一电离能从左到右有增大趋势,但第Ⅱ元素的大于第Ⅲ元素,第Ⅴ元素大于第Ⅵ元素,、分别是第Ⅲ、Ⅴ元素,因此第四周期主族元素中的第一电离能介于之间的元素有、、,故D正确;
13.【答案】
【解析】略
14.【答案】
【解析】
【分析】
本题考查晶胞的有关计算等,难度不大,解题的关键是对基础知识灵活运用。
【解答】
A.晶胞中,原子数目为,原子数目为,原子数目为,化学式为
B.与之间的最短距离为体对角线的,为;
C.与紧邻的个数为;
D.每个晶胞中有原子数目为
15.【答案】
【解析】略
16.【答案】
分液漏斗;
氨水会与反应生成
分解,使溶液的降低,不利于的形成,导致沉淀的产率降低
坩埚
【解析】
【分析】
本题以氧化铋的制取为载体,考查陌生方程式的书写、对原理的分析评价、仪器识别、对试剂与条件控制的分析评价、晶胞计算等,是对学生综合能力的考查。
【解答】
金属与稀硝酸反应时,硝酸一般被还原为,与稀硝酸生成、与水,反应离子方程式为:;
由仪器结构特征可知,仪器为分液漏斗;与反应有和生成,可以理解为:与反应生成、、,生成的又与反应生成、、产生沉淀的化学方程式:;
氨水显碱性,会与反应生成大量的,有利于生成沉淀;
温度高于时,分解,氨气逸出,溶液降低,不利于的形成,使沉淀产率降低;
灼烧时用到的硅酸盐制品有坩埚、酒精灯、玻璃棒、泥三角;
以顶面的原子为例,该晶胞中有个原子与其配位,该晶胞上方的晶胞中也含有个原子与其配位,所以原子的配位数为;
原子与原子的最近距离为面对角线的一半,设晶胞的棱长为,则有,所以,则晶胞的体积为,根据原子的个数可知晶胞中含有个单元,所以晶胞的质量为,所以有,解得。
17.【答案】
形成沉淀,影响配合物的生成
;
;
【解析】
【分析】
本题考查了物质的制备,涉及物质的制备原理、实验方案评价、滴定管的使用、物质的检验等,明确实验原理及实验基本操作方法、试题侧重于考查学生的分析问题和解决问题的能力,注意题目信息的与相关基础知识联合分析,题目难度中等。
【解答】
钴的电子排布式为,则价基态钴离子的价电子排布图:。
氨水显碱性,碱性条件下,会生成沉淀,影响配合物的生成,所以要加氯化铵;
双氧水不稳定,双氧水受热易分解,所以加双氧水时应该选择冷水浴;
将Ⅱ氧化为Ⅲ的过程中不能引入新的杂质,用氧气或氯气作氧化剂不会引入新的杂质,硝酸和高锰酸钾作氧化剂会引入新的杂质,故AC正确;
滴定过程平均消耗标准溶液,依据可得,则样品中含有的物质的量。
原子位于晶胞的内部,全部属于晶胞,位于顶点,属于该晶胞的个数为,氧原子位于面心,属于该晶胞的个数为,化学式为,晶胞的质量为,设晶胞边长为,晶胞的密度,晶胞的边长为,根据晶胞的结构,与最近的距离是面对角线的一半,即最近的距离是。
18.【答案】
基态原子的核外电子排布式为,能级是全满结构,更稳定,失去一个电子所需能量更高
正四面体形
半径更小,的晶格能更大,熔点更高
【解析】略
19.【答案】;;
;;
能;
;变大;
;或
【解析】
【分析】
本题考查物质的结构和晶胞计算,难度较大,掌握核外电子排布式、配合物理论和晶胞计算为解题关键,侧重考查分析能力和灵活运用能力。
【解答】
为号元素,电子排布在不同能级不同轨道上,电子运动状态不同,在同一轨道内的电子的自旋方向相反,则有种运动状态的电子,失去电子,为基态的第一电离能,
B.失去电子,为基态的第二电离能,
C.为激发态,失去电子所需能量很低,为激发态的第一电离能,
D.为激发态,失去电子所需能量很低,为激发态的第一电离能,
第二电离能大于第一电离能,故选B;
蛋氨酸铬Ⅲ配合物的中心铬离子与个原子形成配位键,配位数为;原子形成个键包括个普通共价键和一个配位键,杂化类型为;杂化轨道与的空轨道形成配位键
价层电子排布式为,有个单电子和个空轨道,则能催化双氧水分解;
化学式为的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,的配位数均为,将它们配制成等体积等物质的量浓度的溶液,分别加入足量溶液,依次所得沉淀的物质的量之比为,则呈亮绿色的配合物,其外界有个氯离子,配位体为个氯离子和个水分子,化学式为;分子与形成配位键后,原子的孤电子对减少,根据价层电子互斥理论,键角变大;
点分数坐标为,则点位于晶胞后面的上棱中心,轴上坐标为,轴上坐标为,轴坐标为,则分数坐标为;利用均摊法计算,晶胞平均含有:,:,晶胞质量为,晶胞体积为,晶胞参数为或。
20.【答案】;;
镁的原子核对电子吸引能力强于钠基态镁原子的能级处于较稳定的全充满状态而铝的能级不是
、、;;
分子间能形成氢键,的分子间作用力比甲烷的大;
; ;
;;
【解析】
【分析】本题考查元素推断,结合信息推断元素,掌握电子排布、电离能、杂化轨道、分子间作用力、晶胞分析计算是关键,难度一般。
【解答】根据题干信息知、、、分别为、、、,据此解题,
的基态原子的价电子排布式为:;基态原子最高能级上的电子共有种运动状态;
因镁的核电荷数大于钠且原子半径小于钠,核对电子的吸引力大于钠,故镁的第一电离能比钠的第一电离能大;但镁的能级上有两个电子,属于较稳定的全充满状态铝的能级上只有一个电子,故镁的第一电离能也比铝的第一电离能大;
形成个键,分子的中心原子形成个键为杂化,、分子的中心原子均形成了个键,同时都有一个孤电子对,故二者均为杂化,为正四面体分子;
三种物质的氢化物均为分子晶体,分子间能形成氢键,故沸点最高,的相对分子质量远大于,分子间作用力比甲烷的大,故沸点高于甲烷;
的物质的量是,含有个碳原子,由图知,每个碳原子均为三个环所共用,故每个六元环上碳原子数目为,故六元环的总数目为.;由图知,每个碳原子均与另外三个碳原子成键,因碳原子最外层达到个电子的稳定结构时需要形成个共价键,故三个碳原子中有一个碳原子与中心碳原子之间要形成一个双键,故 键与键数目之比为;
在砷化镓晶体中,一个晶胞中所含有的镓原子数目为,另有个砷原子,配位数均是,晶胞的质量为,由晶体密度为知晶胞参数为将晶胞均分为个小正方体,则每个原子均位于小正方体的体心,与的中心距离等于小正方体体对角线长度的一半,等于晶胞体对角线长度的四分之一,即。
第1页,共1页
