第五章 化工生产中的重要非金属元素 测试题(含解析)2022-2023学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第五章 化工生产中的重要非金属元素 测试题(含解析)2022-2023学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-09 09:12:28 | ||
图片预览


文档简介
第五章《化工生产中的重要非金属元素》测试题
一、单选题(共12题)
1.鲁科版教材必修第一册6页图1-1-12,介绍了青蒿素的发现、研究与应用之旅。中国科学家屠呦呦因主持并参与研究抗疟疾药物青蒿素,“拯救了数百万人的生命”的突出贡献,获得2015年诺贝尔生理学或医学奖。青蒿素分子式为C15H22O5,相对分子质量282.33。无色针状晶体,味苦。在苯和冰醋酸中易溶,在乙醇和乙醚中可溶解,在水中几乎不溶。熔点:156℃,沸点:389.9℃。从青蒿中提取青蒿素的方法,主要有乙醚浸提法和汽油浸提法。下列叙述错误的是(提示:实验室制备CO2气体用过分液漏斗)
A.青蒿素和乙醚不反应 B.青蒿素溶于汽油
C.实验室用分液漏斗不能将苯和青蒿素分开 D.青蒿素晶体在沸水中熔化
2.下列实验操作不正确的是
A.过滤时如果发现滤液是浑浊的,则滤液还要进行过滤
B.在进行蒸馏时,要加少量碎瓷片,防止液体暴沸
C.在进行分液操作时,分液漏斗内外气体相通,眼睛要注视烧杯中的溶液
D.在进行蒸馏时,温度计不要插入溶液中
3.下列叙述正确的是
A.NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=2:1时,HCO完全转化为CaCO3
B.Fe与稀硝酸反应,当n(Fe) :n(HNO3)=1:1时,假定硝酸还原产物均为NO,则铁元素在溶液中主要以Fe2+形式存在
C.AlCl3溶液与氨水溶液反应,当体积比为1:4时,铝元素恰好以AlO形式存在
D.CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=2:3时,能得到澄清溶液
4.工业上以和纯碱为原料制备无水的主要流程如下,下列说法错误的是
A.吸收过程中有气体生成
B.结晶后可选择过滤操作分离出湿料
C.气流干燥湿料时可选择空气气流
D.中和后溶液中含和
5.下列对浓硫酸的叙述正确的是( )
A.常温下,浓硫酸与铁铝不反应,所以铁、铝制容器能盛装浓硫酸
B.浓硫酸具有吸水性,能使蔗糖炭化
C.浓硫酸和铜片加热既表现强酸性又表现强氧化性
D.浓硫酸和Na2SO3反应制取SO2时,浓硫酸表现出强氧化性
6.对于下列实验,能正确描述其反应的离子方程式是
A.用Na2SO3溶液吸收少量Cl2:3SO+Cl2+H2O=2HSO+2Cl-+SO
B.CuCl溶于氨水:Cu++2NH3 H2O=[Cu(NH3)2]++2H2O
C.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=AlO+H2↑
D.同浓度同体积NH4HSO3溶液与NaOH溶液混合:H++OH-=H2O
7.将100 mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是
A.OA段产生的气体是NO,BC段产生的气体是H2
B.A点对应消耗NO3-物质的量为0.2 mol
C.B点对应消耗铁粉的质量为8.4 g
D.原混合酸溶液中H2SO4的浓度为4.0 mol·L-1
8.下列有关化学用语的叙述中,最为合理的是
A.次氯酸的电子式:
B.水分子的比例模型:
C.的氧化物形式:
D.中子数为8的氧原子:
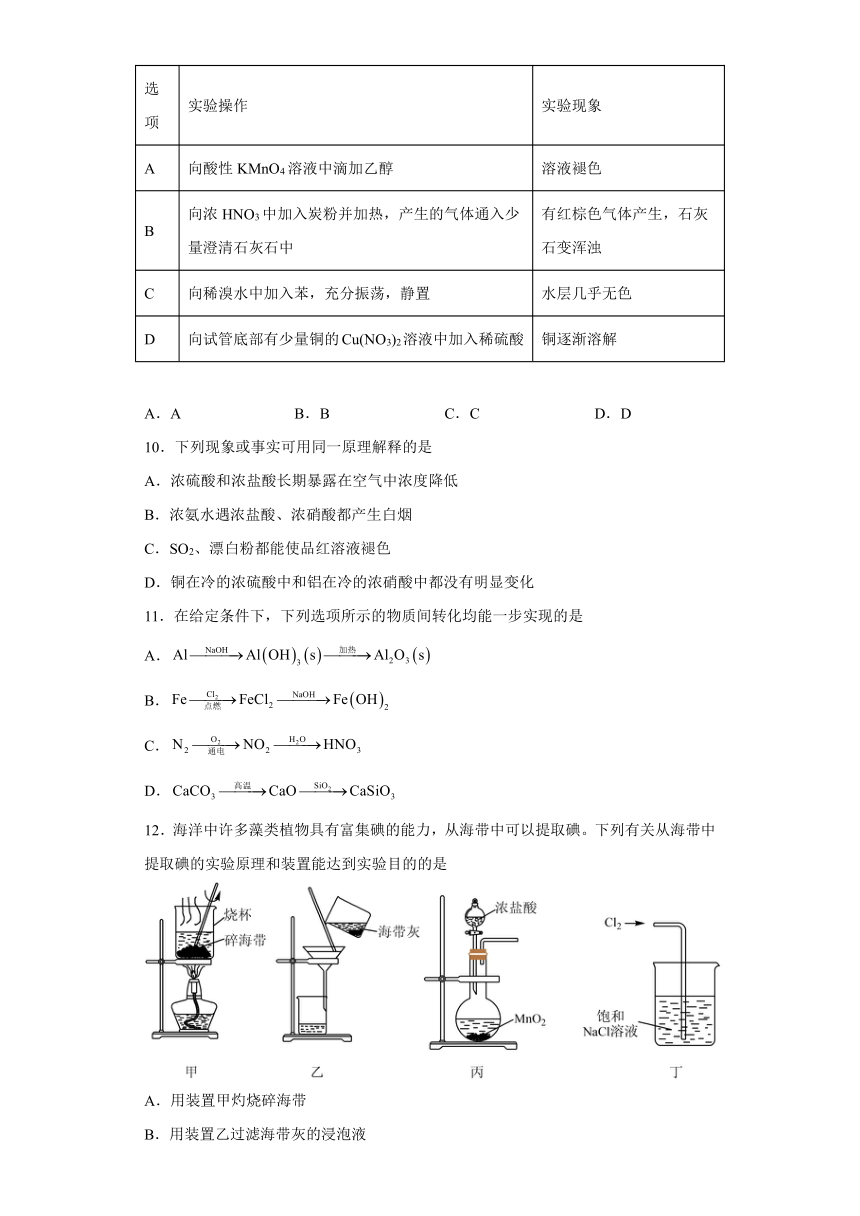
9.下列实验现象与实验操作不相匹配的是)( )
选项 实验操作 实验现象
A 向酸性KMnO4溶液中滴加乙醇 溶液褪色
B 向浓HNO3中加入炭粉并加热,产生的气体通入少量澄清石灰石中 有红棕色气体产生,石灰石变浑浊
C 向稀溴水中加入苯,充分振荡,静置 水层几乎无色
D 向试管底部有少量铜的Cu(NO3)2溶液中加入稀硫酸 铜逐渐溶解
A.A B.B C.C D.D
10.下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.浓氨水遇浓盐酸、浓硝酸都产生白烟
C.SO2、漂白粉都能使品红溶液褪色
D.铜在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化
11.在给定条件下,下列选项所示的物质间转化均能一步实现的是
A.
B.
C.
D.
12.海洋中许多藻类植物具有富集碘的能力,从海带中可以提取碘。下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中的
D.用装置丁吸收氧化浸泡液中后的尾气
二、非选择题(共10题)
13.氮是生命体的重要组成元素。氮在自然界中的循环示意图如下。回答下列问题:
(1)图中属于自然固氮的过程是___________(填序号)。
(2)过程②中合成氨的化学方程式为___________。
(3)自然界中产生硝酸的过程③涉及多种含氮物质的转化,其中的化学方程式为___________。
(4)在图中找出一条氮循环的完整路径:___________(用序号表示)。
(5)过程⑦在硝化细菌的作用下实现转化,在碱性条件下,被氧化为的总反应的离子方程式为___________。
(6)过量施用氮肥带来的主要环境问题是___________,从氮循环视角分析其原因是___________。
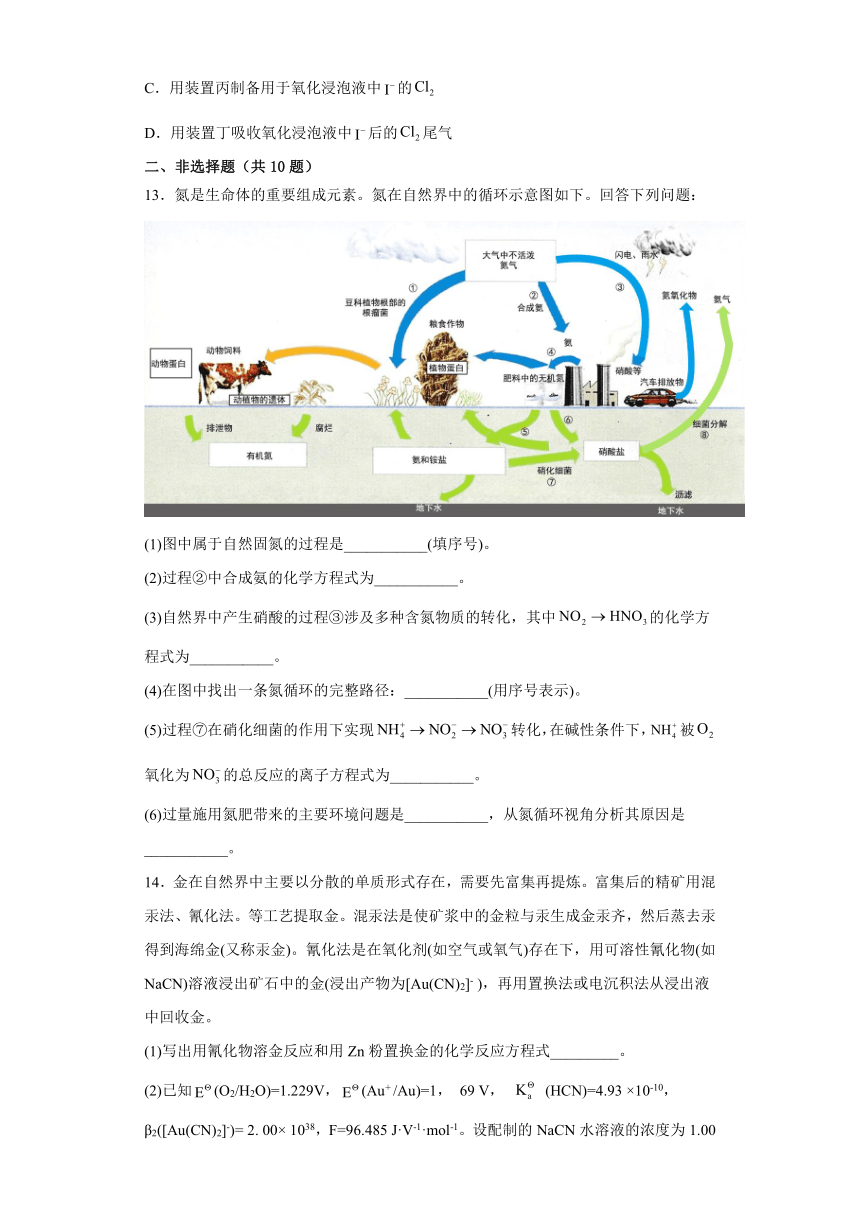
14.金在自然界中主要以分散的单质形式存在,需要先富集再提炼。富集后的精矿用混汞法、氰化法。等工艺提取金。混汞法是使矿浆中的金粒与汞生成金汞齐,然后蒸去汞得到海绵金(又称汞金)。氰化法是在氧化剂(如空气或氧气)存在下,用可溶性氰化物(如NaCN)溶液浸出矿石中的金(浸出产物为[Au(CN)2]- ),再用置换法或电沉积法从浸出液中回收金。
(1)写出用氰化物溶金反应和用Zn粉置换金的化学反应方程式_________。
(2)已知(O2/H2O)=1.229V,(Au+ /Au)=1, 69 V, (HCN)=4.93 ×10-10,β2([Au(CN)2]-)= 2. 00× 1038,F=96.485 J·V-1·mol-1。设配制的NaCN水溶液的浓度为1.00 ×10-3 mol/L、生成的[ Au(CN)2]-配离子的浓度为1.00 ×10-4 mol/L、空气中O2的体积分数为0.210,计算298K时在空气中溶金反应的自由能变_________。
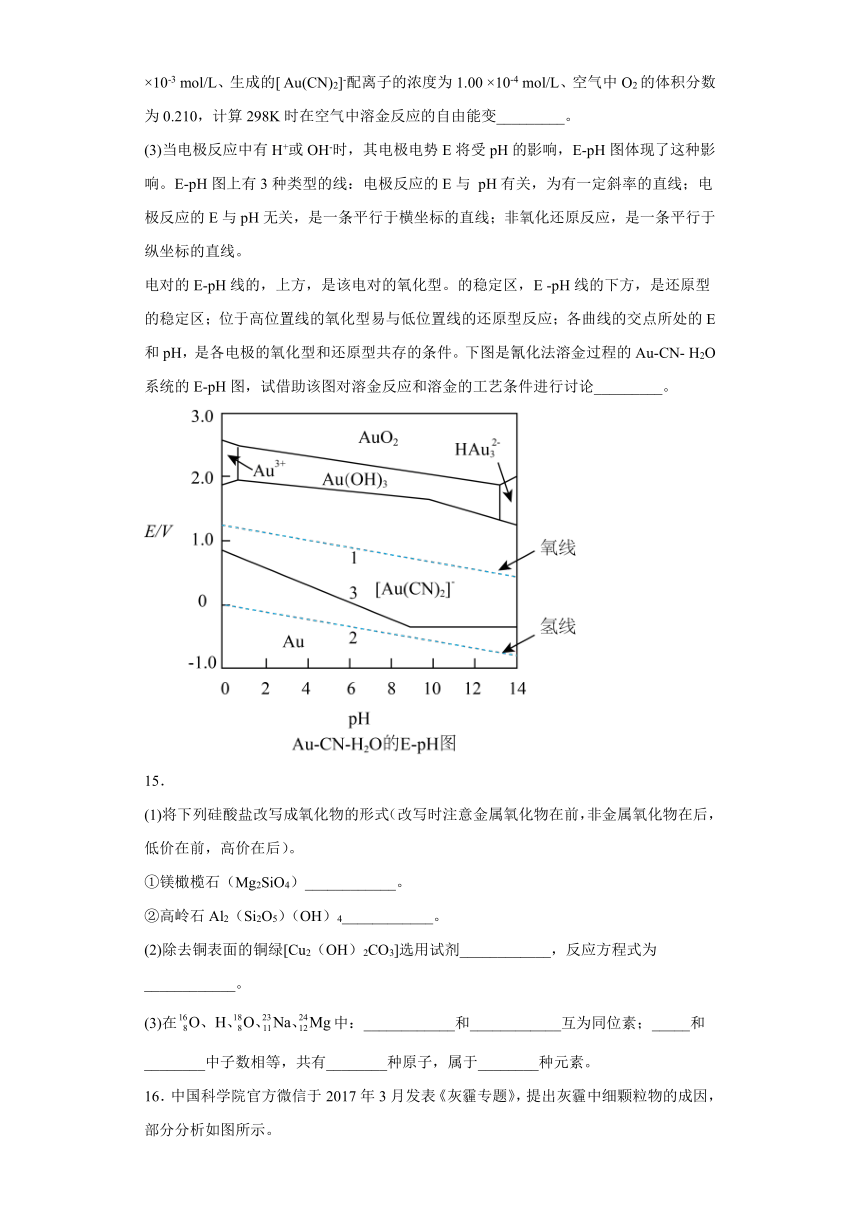
(3)当电极反应中有H+或OH-时,其电极电势E将受pH的影响,E-pH图体现了这种影响。E-pH图上有3种类型的线:电极反应的E与 pH有关,为有一定斜率的直线;电极反应的E与pH无关,是一条平行于横坐标的直线;非氧化还原反应,是一条平行于纵坐标的直线。
电对的E-pH线的,上方,是该电对的氧化型。的稳定区,E -pH线的下方,是还原型的稳定区;位于高位置线的氧化型易与低位置线的还原型反应;各曲线的交点所处的E和pH,是各电极的氧化型和还原型共存的条件。下图是氰化法溶金过程的Au-CN- H2O系统的E-pH图,试借助该图对溶金反应和溶金的工艺条件进行讨论_________。
15.
(1)将下列硅酸盐改写成氧化物的形式(改写时注意金属氧化物在前,非金属氧化物在后,低价在前,高价在后)。
①镁橄榄石(Mg2SiO4)____________。
②高岭石Al2(Si2O5)(OH)4____________。
(2)除去铜表面的铜绿[Cu2(OH)2CO3]选用试剂____________,反应方程式为____________。
(3)在中:____________和____________互为同位素;_____和________中子数相等,共有________种原子,属于________种元素。
16.中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如图所示。
请回答:
(1)下列气体污染物中,能形成酸雨的有__(填字母)。
a.SO2 b.NOx
(2)气体污染物的氨部分来源于农业活动。一种化肥分解生成NH3、CO2、和H2O,其化学式是___。
(3)二次颗粒物中(NH4)2SO4的来自于污染源中的__。
(4)取某空气样本处理制成待测液,测得有关数据如下(其他离子忽略不计):
离子 Na+ NH H+ SO NO
浓度(mol/L) 6×10-6 2×10-5 8.4×10-5 4×10-5 y
表中y=__。
17.某实验小组同学欲探究SO2的性质并测定空气中SO2的体积分数。他们设计了如图所示的实验装置,请你参与探究,并回答问题。
(1)使用倒扣漏斗的作用是___________。
(2)装置D用于检验SO2的___________(填“氧化性”或“还原性”)。
(3)装置C中发生的现象是___________,写出该反应的化学方程式___________。
(4)他们拟用以下方案测定空气中SO2的体积分数(假设空气中无其他还原性气体)。
方案I(如图装置):
①洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2的体积分数___________(填“偏大”“偏小”或“无影响”)。
方案Ⅱ:
②实验中若通入的空气的体积为33.6 L(标准状况),最终所得固体质量为0.233 g,计算该空气中SO2的体积分数:___________(写出计算过程)。
18.草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。现从草木灰中提取钾盐,并用实验检验其中的CO、SO和Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解沉降,③过滤,洗涤④_______,⑤冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示_______(填字母)。
A.左盘重,样品轻 B.左盘轻,砝码重 C.右盘重,砝码轻 D.右盘轻,样品重
(3)将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有_______生成,证明溶液中有CO离子。
②在第二支试管里加入足量稀盐酸后,再加入BaCl2溶液,可观察到有_______生成,证明溶液中有_______离子。
③在第三支试管里加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量稀硝酸后,再加入AgNO3溶液,可观察到有_______生成,证明溶液中有_______离子。
19.四碘化锡是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂。实验室制备四碘化锡的主要步骤如下:
步骤1:在干燥的圆底烧瓶中加入少量碎锡箔和稍过量的I2,再加入30mL冰醋酸和30mL醋酸酐[(CH3CO)2O]。
实验装置如图所示,组装好后用煤气灯加热至沸腾约1-1.5h,至反应完成;
步骤2:冷却结晶,过滤得到四碘化锡粗品;
步骤3:粗品中加入30mL氯仿,水浴加热回流溶解后,趁热过滤;
步骤4:将滤液倒入蒸发皿中,置于通风橱内,待氯仿全部挥发后得到四碘化锡晶体。回答下列问题:
(1)图中仪器a的名称为________ ;冷却水从________ (填“b”或“c”)进入。
(2)仪器a上连接装有无水CaCl2的干燥管的目的是________ ;锡箔需剪碎的目的是________ ;加入醋酸酐的目的是________。
(3)烧瓶中发生反应的化学方程式为________;单质碘需过量的主要目的是________。
(4)反应已到终点的现象是________。
(5)步骤3和步骤4的目的是________。
20.Cu—Fe合金由于长时间置于空气中,表面产生了一层氧化膜(成份为Fe2O3和CuO),现进行如下实验(以下气体体积均在标况下测得):
①将此合金块5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体为672mL,过滤得浅绿色溶液A,还有滤渣B。
②将滤渣B投入到一定浓度的HNO3中,完全溶解,得NO、NO2的混合气体896mL,经测定,同温同压下此混合气体对氢气的相对密度为17。
③将①中所得滤液加入到同浓度足量的HNO3中,用排水法收集一烧瓶气体,再向烧瓶中通入224mL O2,气体恰好完全溶于水。
(1)A中存在的阳离子有________________;
(2)896mL混合气体中NO、NO2的物质的量之比为______________;
(3)B的单质为______________,质量为_________________g;
(4)③中被HNO3氧化了的阳离子的物质的量为______________mol;
(5)此合金块中氧元素的质量为_______________g。
21.结晶水测定:称量干燥坩埚的质量为,加入胆矾后总质量为,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为。
(1)根据实验数据,胆矾分子中结晶水的个数为___________(写表达式)。
(2)下列操作中,会导致结晶水数目测定值偏高的是___________(填标号)。
①胆矾未充分干燥
②坩埚未置于干燥器中冷却
③加热时有少胆矾迸溅出来
22.铜及其化合物在生产、生活中有广泛应用,铜在化合物中的常见化合价有+1价、+2 价。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为_______。温度控制在50℃-60℃的两个原因除了加快反应速率外,还有_______。在CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式_______。
(2)现向Cu、Cu2O 和CuO组成的混合物中,加入1L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO 气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式_______。若将上述混合物用足量的H2加热还原,所得到固体的质量为_______g。若混合物中含0.1mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为_______。
参考答案:
1.D
A.题干信息显示,青蒿素在乙醚中可溶解,则青蒿素与乙醚不发生化学反应,A正确;
B.汽油与苯都是有机溶剂,二者的性质相似,青蒿素易溶于苯,则青蒿素溶于汽油,B正确;
C.青蒿素易溶于苯,二者不分层,所以用分液漏斗不能将苯和青蒿素分开,C正确;
D.青蒿素的熔点为156℃,高于水的沸点,所以青蒿素在沸水中不熔化,D错误;
故选D。
2.C
A.过滤时如果发现滤液浑浊,说明过滤不彻底,滤液还要进行再次过滤,A正确;
B.加入碎瓷片,可以通过孔隙凝聚水蒸气,使成为气泡浮出,防止爆沸,B正确;
C.分液时,应该使分液漏斗内外气体相通,以便于液体顺利流下,眼睛应注视分液漏斗里的液面,下层液体从下口放出后立即关闭活塞,将上层液体从上口倒出,C错误;
D.蒸馏时,温度计测量的是馏分的温度,因此温度计水银球应在蒸馏烧瓶支管口处,而不能插入溶液中,D正确;
故合理选项是C。
3.B
A.当n(NaHCO3):n[Ca(OH)2]=2:1时,反应为,HCO未全部转化为CaCO3,故A错误;
B.Fe与稀硝酸反应,铁过量时发生反应:3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,铁不足时发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O, 当n(Fe):n(HNO3)=1:1时,按3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,且铁有余,故铁元素在溶液中主要以Fe2+形式存在,故B正确;
C.AlCl3溶液与烧碱溶液反应,当体积比为1:4时,因为不知道两种溶液的物质的量浓度,故难以知道铝离子和氢氧根离子的物质的量,故不能知道铝元素的形式存在,故C错误;
D.CO2通入石灰水中,发生反应:Ca(OH)2+CO2═CaCO3↓+H2O、CaCO3+CO2+H2O═Ca(HCO3)2,CO2与Ca(OH)2的物质的量之比为1:1时,恰好反应生成CaCO3,即CO2与Ca(OH)2的物质的量之比为≤≤1时反应得到CaCO3,CO2与Ca(OH)2的物质的量之比为2:1时,恰好反应生成Ca(HCO3)2,即CO2与Ca(OH)2的物质的量之比为≥≥2时反应得到Ca(HCO3)2,当n(CO2):n[Ca(OH)2]=2:3时,得到CaCO3沉淀,氢氧化钙过量,故D错误;
故选:B。
4.C
根据工艺流程逆向分析可知,以二氧化硫和纯碱为原料,得到结晶成分为,则母液为饱和和过量的二氧化硫形成的亚硫酸,溶液呈酸性,所以加入纯碱进行中和,涉及的反应为,,所以调节为8进行中和后得到和,通入二氧化硫气体进行混合吸收,此时吸收过程中发生反应为,,此时会析出大量晶体,经过离心分离,将得到的湿料再进行气流干燥,最终得到产品。
A.根据上述分析可知,吸收过程中有二氧化碳生成,选项A正确;
B.结晶后分离出湿料是将固体和溶液分离,其操作为过滤,选项B正确;
C.易被氧化,所以气流干燥过程中不能选择空气气流,选项C错误;
D.结合上述分析可知,中和后溶液中含和,选项D正确;
答案选C。
5.C
A.浓硫酸具有强的氧化性,与铁、铝发生钝化,生成一层致密的氧化膜,故A错误;
B.能使蔗糖炭化体现了浓硫酸的脱水性,故B错误;
C.浓硫酸和铜片加热生成硫酸铜、二氧化硫和水,有盐生成,S元素的化合价降低,既表现强酸性又表现强氧化性,故C正确;
D.亚硫酸钠和浓硫酸发生反应生成硫酸钠、水和二氧化硫,有盐生成,但S元素的化合价不变,只表现为强酸性,故D错误;
故答案选C。
6.A
A.用Na2SO3溶液吸收少量Cl2:,符合电荷守恒,物料守恒,强制弱规律,A项正确;
B.氯化亚铜能与氨形成络合物,因此能溶解在浓氨水中,得到无色溶液:,B项错误;
C.用铝粉和NaOH溶液反应制取少量H2:,C项错误;
D.同浓度同体积NH4HSO3溶液与NaOH溶液混合亚硫酸根先反应:,D项错误;
答案选A。
7.B
A. OA段产生的气体是NO,生成硝酸铁,AB段是硝酸铁和铁反应生成硝酸亚铁,BC段是氢离子与铁反应产生H2,故A正确;
B. A点消耗5.6g铁即物质的量为0.1mol,失去电子为0.3mol,由于NO3-变为NO,因此对应消耗NO3-物质的量为0.1 mol,故B错误;
C. A点消耗0.1mol 铁,根据Fe + 2Fe3+ = 3Fe2+,根据方程式又消耗0.05mol铁,共消耗0.15mol铁,因此B点对应消耗铁粉的质量为0.15mol×56 g mol 1 = 8.4 g,故C正确;
D. C点消耗铁的质量为11.2g 即物质的量为0.2mol,C点溶质为FeSO4,根据元素守恒得到原混合酸溶液50mL中H2SO4的物质的量为0.2mol,则溶液中H2SO4的浓度为,故D正确。
综上所述,答案为B。
8.C
A.次氯酸中的共价键有氢氧键和氯氧键,氧原子应该放在中间位置,其电子式为,故A错误;
B.氧原子半径大于氢原子半径,水分子正确的比例模型为,故B错误;
C.Mg5(Si4O10)2(OH)2 4H2O可表示成氧化镁、二氧化硅和水,即5MgO 8SiO2 5H2O,故C正确;
D.中子数为8的氧原子,质子数为8,其质量数为16,原子符号168O,故D错误;
故选C。
9.B
A.酸性KMnO4溶液中滴加乙醇,乙醇被氧化,酸性KMnO4溶液溶液褪色,故A正确,不符合题意;
B. C与浓硝酸反应生成二氧化碳、二氧化氮,二氧化氮与水反应生成硝酸,即使生成了碳酸钙,也会被硝酸溶解,因此不会有浑浊现象,故B错误,符合题意;
C.苯与溴水发生萃取,水层接近无色,故C正确,不符合题意;
D. 向硝酸铜溶液中滴加稀硫酸,有氢离子和硝酸根离子,能使铜溶解,故D正确,不符合题意;
故选:B。
10.B
A.浓硫酸长期暴露在空气中浓度降低是因为吸收了空气中的水蒸气,而浓盐酸长期暴露在空气中浓度降低是因为浓盐酸易挥发,原理不同,故A不符合题意;
B.浓氨水挥发出的氨气,遇到浓盐酸挥发出的氯化氢,生成白色固体氯化铵小颗粒,悬浮在空气中产生白烟,浓氨水挥发出的氨气,遇到浓硝酸挥发出的硝酸,生成白色固体硝酸铵小颗粒,悬浮在空气中产生白烟,原理相同,故B符合题意;
C.SO2使品红溶液褪色是由于SO2具有漂白性,漂白粉使品红溶液褪色是由于漂白粉的氧化性,原理不同,故C不符合题意;
D.铜在冷的浓硫酸中由于没有加入不反应,所以无明显变化,铝在冷的浓硝酸中由于发生钝化,所以无明显变化,原理不同,故D不符合题意;
故答案为B。
11.D
A.Al和NaOH反应生成NaAlO2,不会生成Al(OH)3(s),A不符合题意;
B.氯气氧化性较强,Fe在氯气中燃烧生成FeCl3,B不符合题意;
C.N2和O2在放电条件下生成NO,NO再和O2反应生成NO2,C不符合题意;
D.碳酸钙高温分解生成CaO,CaO和SiO2在高温条件下生成硅酸钙,D符合题意;
答案选D。
12.B
A.灼烧碎海带应在坩埚中进行,A错误;
B.装置乙是过滤装置,所以可以过滤海带灰的浸泡液,B正确;
C.该装置需要加热才能生成氯气,C错误;
D.饱和氯化钠溶液对氯气的吸收效率很低,应改用显碱性的溶液,D错误;
故选B。
13.(1)③
(2)
(3)
(4)②④⑥⑧或②④⑤⑦⑧
(5)
(6) 酸雨 氮肥中的氮元素进入土壤中,会转变成硝酸盐,硝酸盐被细菌分解成氮的氧化物进入大气中,会形成酸雨
【解析】(1)
自然固氮是指氮气在自然条件下转化成氮的化合物的过程,由氮的循环图可知③属于自然固氮,故答案为:③;
(2)
过程②为用氮气和氢气反应生成氨气,反应的方程式为:,故答案为:;
(3)
二氧化氮与水反应生成硝酸,反应方程式为:,故答案为:;
(4)
由图示可知②④⑥⑧或②④⑤⑦⑧均是由氮气作为起点,最终转化成氮气,均能体现氮在自然界中循环过程,故答案为:②④⑥⑧或②④⑤⑦⑧;
(5)
被氧化为,1mol转化成失去8mol电子,1mol得4mol电子,根据得失电子守恒以及元素守恒可得反应方程式为:,故答案为:;
(6)
由氮的循环图可知过量施用氮肥,氮肥中的氮元素进入土壤中,会转变成硝酸盐,硝酸盐被细菌分解成氮的氧化物进入大气中,氮的氧化物与空气中的氧气和水反应生成硝酸,会形成酸雨,故答案为:酸雨;氮肥中的氮元素进入土壤中,会转变成硝酸盐,硝酸盐被细菌分解成氮的氧化物进入大气中,会形成酸雨;
14.(1)4Au+8CN- +O2 +2H2O=4[Au(CN)2] +OH-;2[ Au(CN)2]- +Zn= 2Au+[Zn(CN)4]2-
(2)-407(kJ·mol-1)
(3)在pH约小于9.2的范围内,E ([Au(CN)2]- / Au)随pH升高而降低,虽然氧线也随着pH增大而下降,但前者降低得快,后者降得慢,原电池电动势逐渐增大,说明在此范围内,提高pH对溶金有利;超过此范围,E ([Au(CN)2]- /Au)几乎不随pH而变,氧线随pH增大而下降,原电池电动势减小,对溶金产生不利影响
(1)氰化法是在氧化剂(如空气或氧气)存在下,用可溶性氰化物(如NaCN)溶液浸出矿石中的金(浸出产物为[Au(CN)2]- ),化学反应方程式为:4Au+8CN- +O2 +2H2O=4[Au(CN)2] +OH-,再用置换法或电沉积法从浸出液中回收金,化学反应方程式为:2[ Au(CN)2]- +Zn= 2Au+[Zn(CN)4]2-。
(2)CN-水解
CN- + H2O HCN+OH-
= / (HCN)=10-14/4.93×10-10=2.03 ×10-5
CN- +H2OHCN+ OH-
(10-3-2 ×10-4-x) x x+10-4
= 2.03 ×10-5
x=8.08 ×10-5 (mol/L)
[OH-]=(8.08 ×10-5+10-4)
=1.81 × 10-4(mol/L)
[H+]= /[OH-]=10-14/1.81 ×10-4。
= 5.52 ×10-11 (mol/L);
根据溶液的[H+ ]算出E (O2/ H2O):
已知 (O2/H2O)=1. 229 V
有O2+4e- +4H+ =2H2O
E(O2/H2O)= (O2/H2O)+(0. 0591/4)V×lg[H+]4·p (O2)/
=1.229 V+(0. 0591/4)V×lg[(5. 52 ×10-11)4×0.210]
=0.616 V;
由于Au+生成了[Au(CN)2]-,电对Au+/Au的电极电势将发生变化:
已知(Au+ /Au)=1.69 V
Au++e- =Au ① lg = /0.0591
β2([Au(CN)2]-)=2. 00× 1038
Au+ +2CN- =[Au(CN)2]-② lg =38. 3
[Au(CN)2]- +e- = Au+2CN- ③ lg = /0.0591
由于①-②=③,/ =
Lg -lg =lg
/0.0591 -38.3= /0.0591
1. 69/0. 0591- 38. 3= /0.0591
=1.690 V - 38.3×0. 0591 V= =-0.574 V
= +0.0591 V× lg[Au(CN)2] -/[CN- ]2
=-0.574 V+0. 0591 V ×lg 10-4/(7. 19 ×10-4)2=-0.438 V
其中,
[CN-]=c初(CN-) -[HCN]- 2[]
=1. 00 ×10-3-8. 08 ×10-5-2 ×1. 00 ×10-4
=7.19 ×10-4 (mol/L)
或者
[CN-]=c初(CN-) -[HCN]- 2[]
=1. 00 ×10-3-8. 08 ×10-5-2 ×1. 00 ×10-4
=7.19 ×10-4 (mol/L)
Au+ + 2CN- = [Au(CN)2]-
[Au+] 7. 19 ×10-4 1. 00 ×10-4
1.00 ×10- 4
2.0 ×1038=
[Au+ ]=9.67 ×10-37 (mol/L)
E(Au+ /Au)= (Au+ /Au) +0. 0591 V× lg[Au+ ]
= 1.69 V+0.0591 V ×lg (9. 67 ×10-37)=-0.438 V;
=-nFE
=-4 ×96.485 ×[0. 616-(-0.438)]
=-407(kJ·mol-1)。
(3)由 图可见,生成[Au(CN)2]-的电极电势比。生成游离金离子的电极电势低很多,所以氰化物是溶解金的良好溶剂(配合剂)。
③线位于①线之下,说明氧气可以把Au氧化。成[Au(CN)2]-。
③线和①线组成溶金原电池,其电动势是①线和③线的垂直距离,由图可见,在③线的转折处,两线间的距离最大,对应的pH大约为9. 2,电动势大约为1.1 V。
在pH约小于9.2的范围内,E ([Au(CN)2]- / Au)随pH升高而降低,虽然氧线也随着pH增大而下降,但前者降低得快,后者降得慢,原电池电动势逐渐增大,说明在此范围内,提高pH对溶金有利;超过此范围,E ([Au(CN)2]- /Au)几乎不随pH而变,氧线随pH增大而下降,原电池电动势减小,对溶金产生不利影响。
15.(1) 2MgO SiO2 Al2O3 2SiO2 2H2O
(2) HCl Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
(3) 5 4
(1)把硅酸盐写成二氧化硅和其它氧化物形式,要保证原子总数和化合价不变,按化合价分别写化学式。则
①镁橄榄石(Mg2SiO4)改写成氧化物形式为2MgO SiO2;
②高岭石Al2(Si2O5)(OH)4改写成氧化物形式为Al2O3 2SiO2 2H2O;
(2)铜表面的铜绿是Cu2(OH)2CO3,故可以用盐酸除去,反应的方程式为Cu(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O。
(3)具有相同质子数,不同中子数同一元素的不同原子互为同位素,故互为同位素;的中子数相同,均为12个;具有一定数目质子和一定数目中子的一种原子是核素,因此原子共有5种,具有相同的核电荷数即质子数的同一类原子的总称是元素,因此元素共有4种,分别是氧元素、氢元素、钠元素和镁元素。
16. ab NH4HCO3或(NH4)2CO3 工业燃煤、机动车行驶、农业活动 3×10-5
(1)形成酸雨的主要物质是SO2及氮氧化合物,故答案选ab;
(2)一种化肥分解生成NH3、CO2、和H2O,则该化肥为铵盐,阴离子为碳酸根或碳酸氢根,即该化肥的化学式为NH4HCO3或(NH4)2CO3;
(3)二次颗粒物中(NH4)2SO4的来自于污染源中的工业燃煤、机动车行驶、农业活动;
(4)根据电荷守恒可得,y+2×4×10-5=8.4×10-5+6×10-6+2×10-5,解得y=3×10-5。
17. 防止倒吸 氧化性 黄色逐渐褪色 Br2+SO2+2H2O=H2SO4+2HBr 偏小 0.067%
探究SO2的性质实验流程:在装置A中Cu与浓硫酸共热发生反应制取SO2,装置B用品红溶液检验漂白性;在装置C中SO2与溴水发生反应: Br2+SO2+2H2O=H2SO4+2HBr,检验SO2的还原性;在装置D中发生反应:SO2+2H2S=3S↓+H2O,检验SO2的氧化性;在装置E中用碱性的NaOH吸收尾气,防止污染环境。
方案I.若没有及时关闭活塞A,通过流量计的气体中的SO2不能完全被吸收;
方案II.②生成的沉淀0.233 g是BaSO4,根据硫元素守恒,可知n(SO2)=n(H2SO4)=n(BaSO4), 根据V=n·Vm计算SO2的体积,利用体积分数定义进行计算。
(1)SO2是有毒气体,不能直接排入大气,根据其能够与碱反应的性质,用NaOH溶液进行吸收。在导管末端按装一个倒扣的漏斗,既可以扩大气体的吸收面积,使气体被充分吸收,同时也能防止倒吸现象的发生;
(2)在装置D中H2S与SO2发生反应:SO2+2H2S=3S↓+H2O,在该反应中,S元素化合价由反应前SO2中的+4价变为反应后S单质的0价,化合价降低,得到电子被还原,所以SO2为氧化剂,表现氧化性;
(3)在装置C中SO2与溴水发生反应: Br2+SO2+2H2O=H2SO4+2HBr,反应消耗Br2,使溶液的黄色逐渐褪色;
(4)方案I.①洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,SO2气体未被充分吸收就排出,导致SO2含量偏小;
方案II.②最终产生0.233 g固体是硫酸钡,其物质的量n(BaSO4)==0.001 mol,根据硫元素守恒可知n(SO2)=n(H2SO4)=n(BaSO4)=0.001 mol,故SO2在标准状况下的体积V(SO2)=n·Vm=0.001 mol×22.4 L/mol=0.0224 L ,所以该空气中SO2的含量为: =0.067%。
18.(1)蒸发
(2)B
(3) 气泡 白色沉淀 SO 白色沉淀 Cl-
草木灰含可溶性钾盐和不溶性杂质,用水浸、过滤、蒸发的方法提取钾盐,由此分析玻璃棒在各步中所起作用。检验所提纯的钾盐中的阴离子,应防止与其共存的离子的干扰。
(1)
从草木灰中提取可溶性钾盐,实验操作为:①称量样品,②溶解沉降,③过滤,洗涤,④蒸发,⑤冷却结晶;
(2)
用托盘天平称量样品时,左盘放样品,右盘放砝码。若指针偏向右边,则表示左盘轻、砝码重,选B;
(3)
所得草木灰的主要成分是碳酸钾,还含有少量氯化钾和硫酸钾;
①样品溶液中加入稀盐酸,有气泡生成,证明溶液中有CO离子;
②样品溶液中加入足量稀盐酸除去CO后,再加入BaCl2溶液,有白色沉淀生成,证明溶液中有SO离子;
③样品溶液中加入足量Ba(NO3)2溶液使CO、SO完全沉淀,过滤后,向滤液中加入足量稀硝酸,再加入AgNO3溶液,有白色沉淀生成,证明溶液中有Cl-离子。
19.(1) (球形)冷凝管 b
(2) 防止空气中水蒸气进入反应器中 增大与I2的接触面,加快反应速率 除去体系中的水,防止四碘化锡水解
(3) Sn+2I2 SnI4 防止锡屑混入四碘化锡晶体中(或使锡反应完全)
(4)紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色(或其他合理答案)
(5)提纯SnI4产品
步骤1碎锡箔、I2反应生成SnI4,加入醋酸酐目的是除去体系中的水,防止四碘化锡水解,冷却结晶得到四碘化锡粗品,粗品中加入30mL氯仿,四碘化锡溶于氯仿过滤后的滤液倒入蒸发皿,待氯仿全部挥发即可得到四碘化锡晶体。
(1)根据图示可知图中仪器a的名称为(球形)冷凝管,为达到更好的冷却效果,冷却水从b口进入。
(2)四碘化锡遇水易水解,因此仪器a上连接有无水CaCl2的干燥管的目的是防止空气中的水蒸气进入反应器。锡箔剪碎的目的是增大与I2的接触面积,加快反应速率。加入醋酸酐的目的是与体系中的水反应产生醋酸,以除去体系中的水,防止四碘化锡水解。
(3)烧瓶中碘和锡反应生成四碘化锡,化学方程式为Sn+2I2 SnI4。单质碘过量可保证锡完全反应,防止过量的锡混合在四碘化锡晶体中。
(4)碘蒸气为紫红色,SnI4是橙红色的,反应达到终点的现象为紫红色的碘蒸气消失,溶液颜色由紫红色变为橙红色。
(5)步骤3加入氯仿,将四碘化锡溶解在氯仿中,过滤得到只含有四碘化锡的氯仿滤液,得到的滤液置于通风橱内,待氯仿全部挥发得到四碘化锡晶体,这两步的目的是提纯SnI4产品。
20.(1)Fe2+、H+
(2)3:1
(3) Cu 3.2
(4)0.04
(5)0.32
溶液呈绿色说明含有亚铁离子,溶液呈酸性,还含有氢离子;Cu不溶于稀硫酸,则滤渣B为铜,铜和硝酸反应生成氮氧化物NO、NO2,根据,求出混合气体的平均摩尔质量,利用十字相乘法确定一氧化氮和二氧化氮的物质的量之比;Cu不溶于稀硫酸,则滤渣B为铜,根据NO和NO2的物质的量,利用转移电子守恒计算铜的物质的量和质量;Fe2+与HNO3反应生成NO,反应中Fe元素失去电子,N元素得电子,生成的NO与水、氧气反应,NO又失电子,氧气得电子,整个过程中转移的电子守恒,据此计算;该合金中含有Cu、Fe和O三种元素,然后计算O的质量;据此分析解题。
(1)溶液呈绿色说明含有亚铁离子,溶液呈酸性,所以还含有氢离子,酸过量,则滤渣只含铜;故答案为Fe2+、H+。
(2)B中滤渣是铜,铜和硝酸反应生成氮氧化物,NO、NO2混合气体896mL,同温同压下此混合气体对氢气的相对密度为17,所以则混合气体的平均摩尔质量2×17=34g/mol;利用十字相乘法确定一氧化氮和二氧化氮的物质的量之比:,所以一氧化氮和二氧化氮的物质的量之比=12:4=3:1;故答案为3:1。
(3)Cu不溶于稀硫酸,则滤渣B为铜;氮氧化合物的物质的量,已知一氧化氮和二氧化氮的物质的量之比3:1,则一氧化氮的物质的量是0.03mol,二氧化氮的物质的量是0.01mol,根据转移电子守恒得铜的物质的量==0.05mol,所以m(Cu)=0.05×64=3.2g;故答案为Cu;3.2。
(4)Fe2+与HNO3反应生成NO,反应中Fe元素失去电子,N元素得电子,生成的NO与水、氧气反应,NO又失电子,氧气得电子,整个过程中转移的电子守恒,已知n(O2)=,则氧气得到的电子为n(电子)=0.01×4=0.04mol,所以Fe2+失去的电子的物质的量也是0.04mol,1molFe2+反应失去1mol电子,所以n(Fe2+)=0.04mol;故答案为0.04。
(5)该合金中含有Cu、Fe和O三种元素,由(3)可以知道Cu的质量为3.2g,由(4)可以知道m(Fe)=nM=0.04×56=2.24g;则O元素的质量为5.76-3.2-2.24=0.32g;故答案为0.32。
21.(1)
(2)①③
【解析】(1)
由题干数据可知,硫酸铜晶体的质量为:(m2-m1)g,结晶水的质量为:(m2-m3)g,无水硫酸铜的质量为:(m3-m1)g,故有: ,解得:x=,故答案为:;
(2)
①胆矾未充分干燥,则导致m2偏大,则偏高,①符合题意;
②坩埚未置于干燥器中冷却,硫酸铜具有吸水性,能吸收空气中的水蒸气,则导致m3偏大,则偏低,②不合题意;
③加热时有少胆矾迸溅出来,则导致m3偏小,则偏高,③符合题意;
故答案为:①③。
22. Cu+H2O2+2H+=Cu2++2H2O 同时防止H2O2 分解 2Cu2++2Cl-++H2O2CuCl↓++2H+ 3Cu2O+14H++2=6Cu2++2NO↑+7H2O 16 0.1mol
(1)少量铜丝放入适量的稀硫酸中,铜丝与稀硫酸不反应,但加入H2O2后由于双氧水具有强氧化性,在酸性条件下可以把铜氧化成二价铜离子,反应的离子方程式为:Cu+2H++H2O2=Cu2++2H2O;因为H2O2在较高温度时容易分解,所以温度控制在50℃-60℃,可以防止H2O2分解;在CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液加热,生成CuCl沉淀,铜元素的化合价降低,则被Cu2+氧化为,反应物除Cu2+、Cl 、外,还有H2O,产物有H+,根据得失电子守恒和原子守恒配平得:2Cu2++2Cl-++H2O2CuCl↓++2H+,故答案为Cu+2H++H2O2=Cu2++2H2O;同时防止H2O2分解;2Cu2++2Cl-++H2O2CuCl↓++2H+;
(2)稀硝酸可把+1价的Cu+氧化为+2价的Cu2+,自身被还原为NO,根据得失电子守恒和原子守恒,该反应的离子方程式为:3Cu2O+14H++2=6Cu2++2NO↑+7H2O;HNO3的物质的量为0.6mol,其中作氧化剂的HNO3被还原为NO,其物质的量为2.24L÷22.4L/mol=0.1mol,则起酸性作用的HNO3为:0.6mol-0.1mol=0.5mol,这部分HNO3转化为了Cu(NO3)2,根据原子守恒可知,原化合物中Cu原子的物质的量与起酸性作用的HNO3的物质的量之比为1:2,所以H2还原最终得到的Cu的质量为:0.5mol÷2×64g/mol=16g;若混合物中含0.1 mol Cu,根据得失电子守恒得:2×0.1mol+2×n(Cu2O)=3×0.1mol,n(Cu2O)=0.05mol,根据题目所给信息,Cu2O与稀硫酸反应,溶液呈蓝色,说明生成了Cu2+,离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,则0.05mol Cu2O完全反应需要H2SO40.05mol, n(CuO)=0.25mol-0.1mol-2×0.05mol=0.05mol,0.05molCuO 完全反应需要H2SO40.05mol,所以共消耗H2SO4的物质的量为0.1mol,故答案为3Cu2O+14H++2=6Cu2++2NO↑+7H2O;16;0.1mol
一、单选题(共12题)
1.鲁科版教材必修第一册6页图1-1-12,介绍了青蒿素的发现、研究与应用之旅。中国科学家屠呦呦因主持并参与研究抗疟疾药物青蒿素,“拯救了数百万人的生命”的突出贡献,获得2015年诺贝尔生理学或医学奖。青蒿素分子式为C15H22O5,相对分子质量282.33。无色针状晶体,味苦。在苯和冰醋酸中易溶,在乙醇和乙醚中可溶解,在水中几乎不溶。熔点:156℃,沸点:389.9℃。从青蒿中提取青蒿素的方法,主要有乙醚浸提法和汽油浸提法。下列叙述错误的是(提示:实验室制备CO2气体用过分液漏斗)
A.青蒿素和乙醚不反应 B.青蒿素溶于汽油
C.实验室用分液漏斗不能将苯和青蒿素分开 D.青蒿素晶体在沸水中熔化
2.下列实验操作不正确的是
A.过滤时如果发现滤液是浑浊的,则滤液还要进行过滤
B.在进行蒸馏时,要加少量碎瓷片,防止液体暴沸
C.在进行分液操作时,分液漏斗内外气体相通,眼睛要注视烧杯中的溶液
D.在进行蒸馏时,温度计不要插入溶液中
3.下列叙述正确的是
A.NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=2:1时,HCO完全转化为CaCO3
B.Fe与稀硝酸反应,当n(Fe) :n(HNO3)=1:1时,假定硝酸还原产物均为NO,则铁元素在溶液中主要以Fe2+形式存在
C.AlCl3溶液与氨水溶液反应,当体积比为1:4时,铝元素恰好以AlO形式存在
D.CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=2:3时,能得到澄清溶液
4.工业上以和纯碱为原料制备无水的主要流程如下,下列说法错误的是
A.吸收过程中有气体生成
B.结晶后可选择过滤操作分离出湿料
C.气流干燥湿料时可选择空气气流
D.中和后溶液中含和
5.下列对浓硫酸的叙述正确的是( )
A.常温下,浓硫酸与铁铝不反应,所以铁、铝制容器能盛装浓硫酸
B.浓硫酸具有吸水性,能使蔗糖炭化
C.浓硫酸和铜片加热既表现强酸性又表现强氧化性
D.浓硫酸和Na2SO3反应制取SO2时,浓硫酸表现出强氧化性
6.对于下列实验,能正确描述其反应的离子方程式是
A.用Na2SO3溶液吸收少量Cl2:3SO+Cl2+H2O=2HSO+2Cl-+SO
B.CuCl溶于氨水:Cu++2NH3 H2O=[Cu(NH3)2]++2H2O
C.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=AlO+H2↑
D.同浓度同体积NH4HSO3溶液与NaOH溶液混合:H++OH-=H2O
7.将100 mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是
A.OA段产生的气体是NO,BC段产生的气体是H2
B.A点对应消耗NO3-物质的量为0.2 mol
C.B点对应消耗铁粉的质量为8.4 g
D.原混合酸溶液中H2SO4的浓度为4.0 mol·L-1
8.下列有关化学用语的叙述中,最为合理的是
A.次氯酸的电子式:
B.水分子的比例模型:
C.的氧化物形式:
D.中子数为8的氧原子:
9.下列实验现象与实验操作不相匹配的是)( )
选项 实验操作 实验现象
A 向酸性KMnO4溶液中滴加乙醇 溶液褪色
B 向浓HNO3中加入炭粉并加热,产生的气体通入少量澄清石灰石中 有红棕色气体产生,石灰石变浑浊
C 向稀溴水中加入苯,充分振荡,静置 水层几乎无色
D 向试管底部有少量铜的Cu(NO3)2溶液中加入稀硫酸 铜逐渐溶解
A.A B.B C.C D.D
10.下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.浓氨水遇浓盐酸、浓硝酸都产生白烟
C.SO2、漂白粉都能使品红溶液褪色
D.铜在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化
11.在给定条件下,下列选项所示的物质间转化均能一步实现的是
A.
B.
C.
D.
12.海洋中许多藻类植物具有富集碘的能力,从海带中可以提取碘。下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中的
D.用装置丁吸收氧化浸泡液中后的尾气
二、非选择题(共10题)
13.氮是生命体的重要组成元素。氮在自然界中的循环示意图如下。回答下列问题:
(1)图中属于自然固氮的过程是___________(填序号)。
(2)过程②中合成氨的化学方程式为___________。
(3)自然界中产生硝酸的过程③涉及多种含氮物质的转化,其中的化学方程式为___________。
(4)在图中找出一条氮循环的完整路径:___________(用序号表示)。
(5)过程⑦在硝化细菌的作用下实现转化,在碱性条件下,被氧化为的总反应的离子方程式为___________。
(6)过量施用氮肥带来的主要环境问题是___________,从氮循环视角分析其原因是___________。
14.金在自然界中主要以分散的单质形式存在,需要先富集再提炼。富集后的精矿用混汞法、氰化法。等工艺提取金。混汞法是使矿浆中的金粒与汞生成金汞齐,然后蒸去汞得到海绵金(又称汞金)。氰化法是在氧化剂(如空气或氧气)存在下,用可溶性氰化物(如NaCN)溶液浸出矿石中的金(浸出产物为[Au(CN)2]- ),再用置换法或电沉积法从浸出液中回收金。
(1)写出用氰化物溶金反应和用Zn粉置换金的化学反应方程式_________。
(2)已知(O2/H2O)=1.229V,(Au+ /Au)=1, 69 V, (HCN)=4.93 ×10-10,β2([Au(CN)2]-)= 2. 00× 1038,F=96.485 J·V-1·mol-1。设配制的NaCN水溶液的浓度为1.00 ×10-3 mol/L、生成的[ Au(CN)2]-配离子的浓度为1.00 ×10-4 mol/L、空气中O2的体积分数为0.210,计算298K时在空气中溶金反应的自由能变_________。
(3)当电极反应中有H+或OH-时,其电极电势E将受pH的影响,E-pH图体现了这种影响。E-pH图上有3种类型的线:电极反应的E与 pH有关,为有一定斜率的直线;电极反应的E与pH无关,是一条平行于横坐标的直线;非氧化还原反应,是一条平行于纵坐标的直线。
电对的E-pH线的,上方,是该电对的氧化型。的稳定区,E -pH线的下方,是还原型的稳定区;位于高位置线的氧化型易与低位置线的还原型反应;各曲线的交点所处的E和pH,是各电极的氧化型和还原型共存的条件。下图是氰化法溶金过程的Au-CN- H2O系统的E-pH图,试借助该图对溶金反应和溶金的工艺条件进行讨论_________。
15.
(1)将下列硅酸盐改写成氧化物的形式(改写时注意金属氧化物在前,非金属氧化物在后,低价在前,高价在后)。
①镁橄榄石(Mg2SiO4)____________。
②高岭石Al2(Si2O5)(OH)4____________。
(2)除去铜表面的铜绿[Cu2(OH)2CO3]选用试剂____________,反应方程式为____________。
(3)在中:____________和____________互为同位素;_____和________中子数相等,共有________种原子,属于________种元素。
16.中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如图所示。
请回答:
(1)下列气体污染物中,能形成酸雨的有__(填字母)。
a.SO2 b.NOx
(2)气体污染物的氨部分来源于农业活动。一种化肥分解生成NH3、CO2、和H2O,其化学式是___。
(3)二次颗粒物中(NH4)2SO4的来自于污染源中的__。
(4)取某空气样本处理制成待测液,测得有关数据如下(其他离子忽略不计):
离子 Na+ NH H+ SO NO
浓度(mol/L) 6×10-6 2×10-5 8.4×10-5 4×10-5 y
表中y=__。
17.某实验小组同学欲探究SO2的性质并测定空气中SO2的体积分数。他们设计了如图所示的实验装置,请你参与探究,并回答问题。
(1)使用倒扣漏斗的作用是___________。
(2)装置D用于检验SO2的___________(填“氧化性”或“还原性”)。
(3)装置C中发生的现象是___________,写出该反应的化学方程式___________。
(4)他们拟用以下方案测定空气中SO2的体积分数(假设空气中无其他还原性气体)。
方案I(如图装置):
①洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2的体积分数___________(填“偏大”“偏小”或“无影响”)。
方案Ⅱ:
②实验中若通入的空气的体积为33.6 L(标准状况),最终所得固体质量为0.233 g,计算该空气中SO2的体积分数:___________(写出计算过程)。
18.草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾和硫酸钾。现从草木灰中提取钾盐,并用实验检验其中的CO、SO和Cl-。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解沉降,③过滤,洗涤④_______,⑤冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示_______(填字母)。
A.左盘重,样品轻 B.左盘轻,砝码重 C.右盘重,砝码轻 D.右盘轻,样品重
(3)将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有_______生成,证明溶液中有CO离子。
②在第二支试管里加入足量稀盐酸后,再加入BaCl2溶液,可观察到有_______生成,证明溶液中有_______离子。
③在第三支试管里加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量稀硝酸后,再加入AgNO3溶液,可观察到有_______生成,证明溶液中有_______离子。
19.四碘化锡是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂。实验室制备四碘化锡的主要步骤如下:
步骤1:在干燥的圆底烧瓶中加入少量碎锡箔和稍过量的I2,再加入30mL冰醋酸和30mL醋酸酐[(CH3CO)2O]。
实验装置如图所示,组装好后用煤气灯加热至沸腾约1-1.5h,至反应完成;
步骤2:冷却结晶,过滤得到四碘化锡粗品;
步骤3:粗品中加入30mL氯仿,水浴加热回流溶解后,趁热过滤;
步骤4:将滤液倒入蒸发皿中,置于通风橱内,待氯仿全部挥发后得到四碘化锡晶体。回答下列问题:
(1)图中仪器a的名称为________ ;冷却水从________ (填“b”或“c”)进入。
(2)仪器a上连接装有无水CaCl2的干燥管的目的是________ ;锡箔需剪碎的目的是________ ;加入醋酸酐的目的是________。
(3)烧瓶中发生反应的化学方程式为________;单质碘需过量的主要目的是________。
(4)反应已到终点的现象是________。
(5)步骤3和步骤4的目的是________。
20.Cu—Fe合金由于长时间置于空气中,表面产生了一层氧化膜(成份为Fe2O3和CuO),现进行如下实验(以下气体体积均在标况下测得):
①将此合金块5.76g置于烧杯中,然后将稀H2SO4逐渐缓慢加入至过量,收集产生的气体为672mL,过滤得浅绿色溶液A,还有滤渣B。
②将滤渣B投入到一定浓度的HNO3中,完全溶解,得NO、NO2的混合气体896mL,经测定,同温同压下此混合气体对氢气的相对密度为17。
③将①中所得滤液加入到同浓度足量的HNO3中,用排水法收集一烧瓶气体,再向烧瓶中通入224mL O2,气体恰好完全溶于水。
(1)A中存在的阳离子有________________;
(2)896mL混合气体中NO、NO2的物质的量之比为______________;
(3)B的单质为______________,质量为_________________g;
(4)③中被HNO3氧化了的阳离子的物质的量为______________mol;
(5)此合金块中氧元素的质量为_______________g。
21.结晶水测定:称量干燥坩埚的质量为,加入胆矾后总质量为,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为。
(1)根据实验数据,胆矾分子中结晶水的个数为___________(写表达式)。
(2)下列操作中,会导致结晶水数目测定值偏高的是___________(填标号)。
①胆矾未充分干燥
②坩埚未置于干燥器中冷却
③加热时有少胆矾迸溅出来
22.铜及其化合物在生产、生活中有广泛应用,铜在化合物中的常见化合价有+1价、+2 价。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,该反应的离子方程式为_______。温度控制在50℃-60℃的两个原因除了加快反应速率外,还有_______。在CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式_______。
(2)现向Cu、Cu2O 和CuO组成的混合物中,加入1L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO 气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式_______。若将上述混合物用足量的H2加热还原,所得到固体的质量为_______g。若混合物中含0.1mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为_______。
参考答案:
1.D
A.题干信息显示,青蒿素在乙醚中可溶解,则青蒿素与乙醚不发生化学反应,A正确;
B.汽油与苯都是有机溶剂,二者的性质相似,青蒿素易溶于苯,则青蒿素溶于汽油,B正确;
C.青蒿素易溶于苯,二者不分层,所以用分液漏斗不能将苯和青蒿素分开,C正确;
D.青蒿素的熔点为156℃,高于水的沸点,所以青蒿素在沸水中不熔化,D错误;
故选D。
2.C
A.过滤时如果发现滤液浑浊,说明过滤不彻底,滤液还要进行再次过滤,A正确;
B.加入碎瓷片,可以通过孔隙凝聚水蒸气,使成为气泡浮出,防止爆沸,B正确;
C.分液时,应该使分液漏斗内外气体相通,以便于液体顺利流下,眼睛应注视分液漏斗里的液面,下层液体从下口放出后立即关闭活塞,将上层液体从上口倒出,C错误;
D.蒸馏时,温度计测量的是馏分的温度,因此温度计水银球应在蒸馏烧瓶支管口处,而不能插入溶液中,D正确;
故合理选项是C。
3.B
A.当n(NaHCO3):n[Ca(OH)2]=2:1时,反应为,HCO未全部转化为CaCO3,故A错误;
B.Fe与稀硝酸反应,铁过量时发生反应:3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,铁不足时发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O, 当n(Fe):n(HNO3)=1:1时,按3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,且铁有余,故铁元素在溶液中主要以Fe2+形式存在,故B正确;
C.AlCl3溶液与烧碱溶液反应,当体积比为1:4时,因为不知道两种溶液的物质的量浓度,故难以知道铝离子和氢氧根离子的物质的量,故不能知道铝元素的形式存在,故C错误;
D.CO2通入石灰水中,发生反应:Ca(OH)2+CO2═CaCO3↓+H2O、CaCO3+CO2+H2O═Ca(HCO3)2,CO2与Ca(OH)2的物质的量之比为1:1时,恰好反应生成CaCO3,即CO2与Ca(OH)2的物质的量之比为≤≤1时反应得到CaCO3,CO2与Ca(OH)2的物质的量之比为2:1时,恰好反应生成Ca(HCO3)2,即CO2与Ca(OH)2的物质的量之比为≥≥2时反应得到Ca(HCO3)2,当n(CO2):n[Ca(OH)2]=2:3时,得到CaCO3沉淀,氢氧化钙过量,故D错误;
故选:B。
4.C
根据工艺流程逆向分析可知,以二氧化硫和纯碱为原料,得到结晶成分为,则母液为饱和和过量的二氧化硫形成的亚硫酸,溶液呈酸性,所以加入纯碱进行中和,涉及的反应为,,所以调节为8进行中和后得到和,通入二氧化硫气体进行混合吸收,此时吸收过程中发生反应为,,此时会析出大量晶体,经过离心分离,将得到的湿料再进行气流干燥,最终得到产品。
A.根据上述分析可知,吸收过程中有二氧化碳生成,选项A正确;
B.结晶后分离出湿料是将固体和溶液分离,其操作为过滤,选项B正确;
C.易被氧化,所以气流干燥过程中不能选择空气气流,选项C错误;
D.结合上述分析可知,中和后溶液中含和,选项D正确;
答案选C。
5.C
A.浓硫酸具有强的氧化性,与铁、铝发生钝化,生成一层致密的氧化膜,故A错误;
B.能使蔗糖炭化体现了浓硫酸的脱水性,故B错误;
C.浓硫酸和铜片加热生成硫酸铜、二氧化硫和水,有盐生成,S元素的化合价降低,既表现强酸性又表现强氧化性,故C正确;
D.亚硫酸钠和浓硫酸发生反应生成硫酸钠、水和二氧化硫,有盐生成,但S元素的化合价不变,只表现为强酸性,故D错误;
故答案选C。
6.A
A.用Na2SO3溶液吸收少量Cl2:,符合电荷守恒,物料守恒,强制弱规律,A项正确;
B.氯化亚铜能与氨形成络合物,因此能溶解在浓氨水中,得到无色溶液:,B项错误;
C.用铝粉和NaOH溶液反应制取少量H2:,C项错误;
D.同浓度同体积NH4HSO3溶液与NaOH溶液混合亚硫酸根先反应:,D项错误;
答案选A。
7.B
A. OA段产生的气体是NO,生成硝酸铁,AB段是硝酸铁和铁反应生成硝酸亚铁,BC段是氢离子与铁反应产生H2,故A正确;
B. A点消耗5.6g铁即物质的量为0.1mol,失去电子为0.3mol,由于NO3-变为NO,因此对应消耗NO3-物质的量为0.1 mol,故B错误;
C. A点消耗0.1mol 铁,根据Fe + 2Fe3+ = 3Fe2+,根据方程式又消耗0.05mol铁,共消耗0.15mol铁,因此B点对应消耗铁粉的质量为0.15mol×56 g mol 1 = 8.4 g,故C正确;
D. C点消耗铁的质量为11.2g 即物质的量为0.2mol,C点溶质为FeSO4,根据元素守恒得到原混合酸溶液50mL中H2SO4的物质的量为0.2mol,则溶液中H2SO4的浓度为,故D正确。
综上所述,答案为B。
8.C
A.次氯酸中的共价键有氢氧键和氯氧键,氧原子应该放在中间位置,其电子式为,故A错误;
B.氧原子半径大于氢原子半径,水分子正确的比例模型为,故B错误;
C.Mg5(Si4O10)2(OH)2 4H2O可表示成氧化镁、二氧化硅和水,即5MgO 8SiO2 5H2O,故C正确;
D.中子数为8的氧原子,质子数为8,其质量数为16,原子符号168O,故D错误;
故选C。
9.B
A.酸性KMnO4溶液中滴加乙醇,乙醇被氧化,酸性KMnO4溶液溶液褪色,故A正确,不符合题意;
B. C与浓硝酸反应生成二氧化碳、二氧化氮,二氧化氮与水反应生成硝酸,即使生成了碳酸钙,也会被硝酸溶解,因此不会有浑浊现象,故B错误,符合题意;
C.苯与溴水发生萃取,水层接近无色,故C正确,不符合题意;
D. 向硝酸铜溶液中滴加稀硫酸,有氢离子和硝酸根离子,能使铜溶解,故D正确,不符合题意;
故选:B。
10.B
A.浓硫酸长期暴露在空气中浓度降低是因为吸收了空气中的水蒸气,而浓盐酸长期暴露在空气中浓度降低是因为浓盐酸易挥发,原理不同,故A不符合题意;
B.浓氨水挥发出的氨气,遇到浓盐酸挥发出的氯化氢,生成白色固体氯化铵小颗粒,悬浮在空气中产生白烟,浓氨水挥发出的氨气,遇到浓硝酸挥发出的硝酸,生成白色固体硝酸铵小颗粒,悬浮在空气中产生白烟,原理相同,故B符合题意;
C.SO2使品红溶液褪色是由于SO2具有漂白性,漂白粉使品红溶液褪色是由于漂白粉的氧化性,原理不同,故C不符合题意;
D.铜在冷的浓硫酸中由于没有加入不反应,所以无明显变化,铝在冷的浓硝酸中由于发生钝化,所以无明显变化,原理不同,故D不符合题意;
故答案为B。
11.D
A.Al和NaOH反应生成NaAlO2,不会生成Al(OH)3(s),A不符合题意;
B.氯气氧化性较强,Fe在氯气中燃烧生成FeCl3,B不符合题意;
C.N2和O2在放电条件下生成NO,NO再和O2反应生成NO2,C不符合题意;
D.碳酸钙高温分解生成CaO,CaO和SiO2在高温条件下生成硅酸钙,D符合题意;
答案选D。
12.B
A.灼烧碎海带应在坩埚中进行,A错误;
B.装置乙是过滤装置,所以可以过滤海带灰的浸泡液,B正确;
C.该装置需要加热才能生成氯气,C错误;
D.饱和氯化钠溶液对氯气的吸收效率很低,应改用显碱性的溶液,D错误;
故选B。
13.(1)③
(2)
(3)
(4)②④⑥⑧或②④⑤⑦⑧
(5)
(6) 酸雨 氮肥中的氮元素进入土壤中,会转变成硝酸盐,硝酸盐被细菌分解成氮的氧化物进入大气中,会形成酸雨
【解析】(1)
自然固氮是指氮气在自然条件下转化成氮的化合物的过程,由氮的循环图可知③属于自然固氮,故答案为:③;
(2)
过程②为用氮气和氢气反应生成氨气,反应的方程式为:,故答案为:;
(3)
二氧化氮与水反应生成硝酸,反应方程式为:,故答案为:;
(4)
由图示可知②④⑥⑧或②④⑤⑦⑧均是由氮气作为起点,最终转化成氮气,均能体现氮在自然界中循环过程,故答案为:②④⑥⑧或②④⑤⑦⑧;
(5)
被氧化为,1mol转化成失去8mol电子,1mol得4mol电子,根据得失电子守恒以及元素守恒可得反应方程式为:,故答案为:;
(6)
由氮的循环图可知过量施用氮肥,氮肥中的氮元素进入土壤中,会转变成硝酸盐,硝酸盐被细菌分解成氮的氧化物进入大气中,氮的氧化物与空气中的氧气和水反应生成硝酸,会形成酸雨,故答案为:酸雨;氮肥中的氮元素进入土壤中,会转变成硝酸盐,硝酸盐被细菌分解成氮的氧化物进入大气中,会形成酸雨;
14.(1)4Au+8CN- +O2 +2H2O=4[Au(CN)2] +OH-;2[ Au(CN)2]- +Zn= 2Au+[Zn(CN)4]2-
(2)-407(kJ·mol-1)
(3)在pH约小于9.2的范围内,E ([Au(CN)2]- / Au)随pH升高而降低,虽然氧线也随着pH增大而下降,但前者降低得快,后者降得慢,原电池电动势逐渐增大,说明在此范围内,提高pH对溶金有利;超过此范围,E ([Au(CN)2]- /Au)几乎不随pH而变,氧线随pH增大而下降,原电池电动势减小,对溶金产生不利影响
(1)氰化法是在氧化剂(如空气或氧气)存在下,用可溶性氰化物(如NaCN)溶液浸出矿石中的金(浸出产物为[Au(CN)2]- ),化学反应方程式为:4Au+8CN- +O2 +2H2O=4[Au(CN)2] +OH-,再用置换法或电沉积法从浸出液中回收金,化学反应方程式为:2[ Au(CN)2]- +Zn= 2Au+[Zn(CN)4]2-。
(2)CN-水解
CN- + H2O HCN+OH-
= / (HCN)=10-14/4.93×10-10=2.03 ×10-5
CN- +H2OHCN+ OH-
(10-3-2 ×10-4-x) x x+10-4
= 2.03 ×10-5
x=8.08 ×10-5 (mol/L)
[OH-]=(8.08 ×10-5+10-4)
=1.81 × 10-4(mol/L)
[H+]= /[OH-]=10-14/1.81 ×10-4。
= 5.52 ×10-11 (mol/L);
根据溶液的[H+ ]算出E (O2/ H2O):
已知 (O2/H2O)=1. 229 V
有O2+4e- +4H+ =2H2O
E(O2/H2O)= (O2/H2O)+(0. 0591/4)V×lg[H+]4·p (O2)/
=1.229 V+(0. 0591/4)V×lg[(5. 52 ×10-11)4×0.210]
=0.616 V;
由于Au+生成了[Au(CN)2]-,电对Au+/Au的电极电势将发生变化:
已知(Au+ /Au)=1.69 V
Au++e- =Au ① lg = /0.0591
β2([Au(CN)2]-)=2. 00× 1038
Au+ +2CN- =[Au(CN)2]-② lg =38. 3
[Au(CN)2]- +e- = Au+2CN- ③ lg = /0.0591
由于①-②=③,/ =
Lg -lg =lg
/0.0591 -38.3= /0.0591
1. 69/0. 0591- 38. 3= /0.0591
=1.690 V - 38.3×0. 0591 V= =-0.574 V
= +0.0591 V× lg[Au(CN)2] -/[CN- ]2
=-0.574 V+0. 0591 V ×lg 10-4/(7. 19 ×10-4)2=-0.438 V
其中,
[CN-]=c初(CN-) -[HCN]- 2[]
=1. 00 ×10-3-8. 08 ×10-5-2 ×1. 00 ×10-4
=7.19 ×10-4 (mol/L)
或者
[CN-]=c初(CN-) -[HCN]- 2[]
=1. 00 ×10-3-8. 08 ×10-5-2 ×1. 00 ×10-4
=7.19 ×10-4 (mol/L)
Au+ + 2CN- = [Au(CN)2]-
[Au+] 7. 19 ×10-4 1. 00 ×10-4
1.00 ×10- 4
2.0 ×1038=
[Au+ ]=9.67 ×10-37 (mol/L)
E(Au+ /Au)= (Au+ /Au) +0. 0591 V× lg[Au+ ]
= 1.69 V+0.0591 V ×lg (9. 67 ×10-37)=-0.438 V;
=-nFE
=-4 ×96.485 ×[0. 616-(-0.438)]
=-407(kJ·mol-1)。
(3)由 图可见,生成[Au(CN)2]-的电极电势比。生成游离金离子的电极电势低很多,所以氰化物是溶解金的良好溶剂(配合剂)。
③线位于①线之下,说明氧气可以把Au氧化。成[Au(CN)2]-。
③线和①线组成溶金原电池,其电动势是①线和③线的垂直距离,由图可见,在③线的转折处,两线间的距离最大,对应的pH大约为9. 2,电动势大约为1.1 V。
在pH约小于9.2的范围内,E ([Au(CN)2]- / Au)随pH升高而降低,虽然氧线也随着pH增大而下降,但前者降低得快,后者降得慢,原电池电动势逐渐增大,说明在此范围内,提高pH对溶金有利;超过此范围,E ([Au(CN)2]- /Au)几乎不随pH而变,氧线随pH增大而下降,原电池电动势减小,对溶金产生不利影响。
15.(1) 2MgO SiO2 Al2O3 2SiO2 2H2O
(2) HCl Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
(3) 5 4
(1)把硅酸盐写成二氧化硅和其它氧化物形式,要保证原子总数和化合价不变,按化合价分别写化学式。则
①镁橄榄石(Mg2SiO4)改写成氧化物形式为2MgO SiO2;
②高岭石Al2(Si2O5)(OH)4改写成氧化物形式为Al2O3 2SiO2 2H2O;
(2)铜表面的铜绿是Cu2(OH)2CO3,故可以用盐酸除去,反应的方程式为Cu(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O。
(3)具有相同质子数,不同中子数同一元素的不同原子互为同位素,故互为同位素;的中子数相同,均为12个;具有一定数目质子和一定数目中子的一种原子是核素,因此原子共有5种,具有相同的核电荷数即质子数的同一类原子的总称是元素,因此元素共有4种,分别是氧元素、氢元素、钠元素和镁元素。
16. ab NH4HCO3或(NH4)2CO3 工业燃煤、机动车行驶、农业活动 3×10-5
(1)形成酸雨的主要物质是SO2及氮氧化合物,故答案选ab;
(2)一种化肥分解生成NH3、CO2、和H2O,则该化肥为铵盐,阴离子为碳酸根或碳酸氢根,即该化肥的化学式为NH4HCO3或(NH4)2CO3;
(3)二次颗粒物中(NH4)2SO4的来自于污染源中的工业燃煤、机动车行驶、农业活动;
(4)根据电荷守恒可得,y+2×4×10-5=8.4×10-5+6×10-6+2×10-5,解得y=3×10-5。
17. 防止倒吸 氧化性 黄色逐渐褪色 Br2+SO2+2H2O=H2SO4+2HBr 偏小 0.067%
探究SO2的性质实验流程:在装置A中Cu与浓硫酸共热发生反应制取SO2,装置B用品红溶液检验漂白性;在装置C中SO2与溴水发生反应: Br2+SO2+2H2O=H2SO4+2HBr,检验SO2的还原性;在装置D中发生反应:SO2+2H2S=3S↓+H2O,检验SO2的氧化性;在装置E中用碱性的NaOH吸收尾气,防止污染环境。
方案I.若没有及时关闭活塞A,通过流量计的气体中的SO2不能完全被吸收;
方案II.②生成的沉淀0.233 g是BaSO4,根据硫元素守恒,可知n(SO2)=n(H2SO4)=n(BaSO4), 根据V=n·Vm计算SO2的体积,利用体积分数定义进行计算。
(1)SO2是有毒气体,不能直接排入大气,根据其能够与碱反应的性质,用NaOH溶液进行吸收。在导管末端按装一个倒扣的漏斗,既可以扩大气体的吸收面积,使气体被充分吸收,同时也能防止倒吸现象的发生;
(2)在装置D中H2S与SO2发生反应:SO2+2H2S=3S↓+H2O,在该反应中,S元素化合价由反应前SO2中的+4价变为反应后S单质的0价,化合价降低,得到电子被还原,所以SO2为氧化剂,表现氧化性;
(3)在装置C中SO2与溴水发生反应: Br2+SO2+2H2O=H2SO4+2HBr,反应消耗Br2,使溶液的黄色逐渐褪色;
(4)方案I.①洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,SO2气体未被充分吸收就排出,导致SO2含量偏小;
方案II.②最终产生0.233 g固体是硫酸钡,其物质的量n(BaSO4)==0.001 mol,根据硫元素守恒可知n(SO2)=n(H2SO4)=n(BaSO4)=0.001 mol,故SO2在标准状况下的体积V(SO2)=n·Vm=0.001 mol×22.4 L/mol=0.0224 L ,所以该空气中SO2的含量为: =0.067%。
18.(1)蒸发
(2)B
(3) 气泡 白色沉淀 SO 白色沉淀 Cl-
草木灰含可溶性钾盐和不溶性杂质,用水浸、过滤、蒸发的方法提取钾盐,由此分析玻璃棒在各步中所起作用。检验所提纯的钾盐中的阴离子,应防止与其共存的离子的干扰。
(1)
从草木灰中提取可溶性钾盐,实验操作为:①称量样品,②溶解沉降,③过滤,洗涤,④蒸发,⑤冷却结晶;
(2)
用托盘天平称量样品时,左盘放样品,右盘放砝码。若指针偏向右边,则表示左盘轻、砝码重,选B;
(3)
所得草木灰的主要成分是碳酸钾,还含有少量氯化钾和硫酸钾;
①样品溶液中加入稀盐酸,有气泡生成,证明溶液中有CO离子;
②样品溶液中加入足量稀盐酸除去CO后,再加入BaCl2溶液,有白色沉淀生成,证明溶液中有SO离子;
③样品溶液中加入足量Ba(NO3)2溶液使CO、SO完全沉淀,过滤后,向滤液中加入足量稀硝酸,再加入AgNO3溶液,有白色沉淀生成,证明溶液中有Cl-离子。
19.(1) (球形)冷凝管 b
(2) 防止空气中水蒸气进入反应器中 增大与I2的接触面,加快反应速率 除去体系中的水,防止四碘化锡水解
(3) Sn+2I2 SnI4 防止锡屑混入四碘化锡晶体中(或使锡反应完全)
(4)紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色(或其他合理答案)
(5)提纯SnI4产品
步骤1碎锡箔、I2反应生成SnI4,加入醋酸酐目的是除去体系中的水,防止四碘化锡水解,冷却结晶得到四碘化锡粗品,粗品中加入30mL氯仿,四碘化锡溶于氯仿过滤后的滤液倒入蒸发皿,待氯仿全部挥发即可得到四碘化锡晶体。
(1)根据图示可知图中仪器a的名称为(球形)冷凝管,为达到更好的冷却效果,冷却水从b口进入。
(2)四碘化锡遇水易水解,因此仪器a上连接有无水CaCl2的干燥管的目的是防止空气中的水蒸气进入反应器。锡箔剪碎的目的是增大与I2的接触面积,加快反应速率。加入醋酸酐的目的是与体系中的水反应产生醋酸,以除去体系中的水,防止四碘化锡水解。
(3)烧瓶中碘和锡反应生成四碘化锡,化学方程式为Sn+2I2 SnI4。单质碘过量可保证锡完全反应,防止过量的锡混合在四碘化锡晶体中。
(4)碘蒸气为紫红色,SnI4是橙红色的,反应达到终点的现象为紫红色的碘蒸气消失,溶液颜色由紫红色变为橙红色。
(5)步骤3加入氯仿,将四碘化锡溶解在氯仿中,过滤得到只含有四碘化锡的氯仿滤液,得到的滤液置于通风橱内,待氯仿全部挥发得到四碘化锡晶体,这两步的目的是提纯SnI4产品。
20.(1)Fe2+、H+
(2)3:1
(3) Cu 3.2
(4)0.04
(5)0.32
溶液呈绿色说明含有亚铁离子,溶液呈酸性,还含有氢离子;Cu不溶于稀硫酸,则滤渣B为铜,铜和硝酸反应生成氮氧化物NO、NO2,根据,求出混合气体的平均摩尔质量,利用十字相乘法确定一氧化氮和二氧化氮的物质的量之比;Cu不溶于稀硫酸,则滤渣B为铜,根据NO和NO2的物质的量,利用转移电子守恒计算铜的物质的量和质量;Fe2+与HNO3反应生成NO,反应中Fe元素失去电子,N元素得电子,生成的NO与水、氧气反应,NO又失电子,氧气得电子,整个过程中转移的电子守恒,据此计算;该合金中含有Cu、Fe和O三种元素,然后计算O的质量;据此分析解题。
(1)溶液呈绿色说明含有亚铁离子,溶液呈酸性,所以还含有氢离子,酸过量,则滤渣只含铜;故答案为Fe2+、H+。
(2)B中滤渣是铜,铜和硝酸反应生成氮氧化物,NO、NO2混合气体896mL,同温同压下此混合气体对氢气的相对密度为17,所以则混合气体的平均摩尔质量2×17=34g/mol;利用十字相乘法确定一氧化氮和二氧化氮的物质的量之比:,所以一氧化氮和二氧化氮的物质的量之比=12:4=3:1;故答案为3:1。
(3)Cu不溶于稀硫酸,则滤渣B为铜;氮氧化合物的物质的量,已知一氧化氮和二氧化氮的物质的量之比3:1,则一氧化氮的物质的量是0.03mol,二氧化氮的物质的量是0.01mol,根据转移电子守恒得铜的物质的量==0.05mol,所以m(Cu)=0.05×64=3.2g;故答案为Cu;3.2。
(4)Fe2+与HNO3反应生成NO,反应中Fe元素失去电子,N元素得电子,生成的NO与水、氧气反应,NO又失电子,氧气得电子,整个过程中转移的电子守恒,已知n(O2)=,则氧气得到的电子为n(电子)=0.01×4=0.04mol,所以Fe2+失去的电子的物质的量也是0.04mol,1molFe2+反应失去1mol电子,所以n(Fe2+)=0.04mol;故答案为0.04。
(5)该合金中含有Cu、Fe和O三种元素,由(3)可以知道Cu的质量为3.2g,由(4)可以知道m(Fe)=nM=0.04×56=2.24g;则O元素的质量为5.76-3.2-2.24=0.32g;故答案为0.32。
21.(1)
(2)①③
【解析】(1)
由题干数据可知,硫酸铜晶体的质量为:(m2-m1)g,结晶水的质量为:(m2-m3)g,无水硫酸铜的质量为:(m3-m1)g,故有: ,解得:x=,故答案为:;
(2)
①胆矾未充分干燥,则导致m2偏大,则偏高,①符合题意;
②坩埚未置于干燥器中冷却,硫酸铜具有吸水性,能吸收空气中的水蒸气,则导致m3偏大,则偏低,②不合题意;
③加热时有少胆矾迸溅出来,则导致m3偏小,则偏高,③符合题意;
故答案为:①③。
22. Cu+H2O2+2H+=Cu2++2H2O 同时防止H2O2 分解 2Cu2++2Cl-++H2O2CuCl↓++2H+ 3Cu2O+14H++2=6Cu2++2NO↑+7H2O 16 0.1mol
(1)少量铜丝放入适量的稀硫酸中,铜丝与稀硫酸不反应,但加入H2O2后由于双氧水具有强氧化性,在酸性条件下可以把铜氧化成二价铜离子,反应的离子方程式为:Cu+2H++H2O2=Cu2++2H2O;因为H2O2在较高温度时容易分解,所以温度控制在50℃-60℃,可以防止H2O2分解;在CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液加热,生成CuCl沉淀,铜元素的化合价降低,则被Cu2+氧化为,反应物除Cu2+、Cl 、外,还有H2O,产物有H+,根据得失电子守恒和原子守恒配平得:2Cu2++2Cl-++H2O2CuCl↓++2H+,故答案为Cu+2H++H2O2=Cu2++2H2O;同时防止H2O2分解;2Cu2++2Cl-++H2O2CuCl↓++2H+;
(2)稀硝酸可把+1价的Cu+氧化为+2价的Cu2+,自身被还原为NO,根据得失电子守恒和原子守恒,该反应的离子方程式为:3Cu2O+14H++2=6Cu2++2NO↑+7H2O;HNO3的物质的量为0.6mol,其中作氧化剂的HNO3被还原为NO,其物质的量为2.24L÷22.4L/mol=0.1mol,则起酸性作用的HNO3为:0.6mol-0.1mol=0.5mol,这部分HNO3转化为了Cu(NO3)2,根据原子守恒可知,原化合物中Cu原子的物质的量与起酸性作用的HNO3的物质的量之比为1:2,所以H2还原最终得到的Cu的质量为:0.5mol÷2×64g/mol=16g;若混合物中含0.1 mol Cu,根据得失电子守恒得:2×0.1mol+2×n(Cu2O)=3×0.1mol,n(Cu2O)=0.05mol,根据题目所给信息,Cu2O与稀硫酸反应,溶液呈蓝色,说明生成了Cu2+,离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,则0.05mol Cu2O完全反应需要H2SO40.05mol, n(CuO)=0.25mol-0.1mol-2×0.05mol=0.05mol,0.05molCuO 完全反应需要H2SO40.05mol,所以共消耗H2SO4的物质的量为0.1mol,故答案为3Cu2O+14H++2=6Cu2++2NO↑+7H2O;16;0.1mol
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
