第2章 《微粒间相互作用与物质性质》 复习题(含解析) 2022-2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第2章 《微粒间相互作用与物质性质》 复习题(含解析) 2022-2023学年下学期高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-09 16:40:43 | ||
图片预览




文档简介
第2章《微粒间相互作用与物质性质》复习题
一、单选题
1.2020年人类在金星大气中探测到PH3.实验室制备PH3的方法有:①PH4I+NaOH=NaI+PH3↑+H2O;②P4+3KOH+3H2O3KH2PO2+PH3↑。已知H3PO2是一元弱酸,其结构式为。下列说法正确的是
A.基态P的轨道表示式为
B.1molP4分子中含有4molP-P键
C.PH中提供孤电子对的原子是P
D.反应②中若KOH过量会发生反应:P4+9KOH3K3PO2+PH3↑+3H2O
2.设NA是阿伏加德罗常数的值。下列说法正确的是
A.6g乙酸中sp2杂化的碳原子数为0.2NA
B.0.5molBF3成键后硼原子的价层电子对数为1.5NA
C.标准状况下,22.4LCH4与44.8LCl2在光照条件下充分反应后的分子总数为2NA
D.铅蓄电池放电时,若负极增重48g,则此时转移电子数为0.5NA
3.H2O、H2O2、HO2(超氧化氢)都属于氢氧化合物,其中HO2又叫超氧酸,与H2O2化学性质相似,又与HX(X=C1、Br、I等)的某些性质相似。下列说法错误的是
A.HO2为极性分子
B.H2O的沸点低于H2O2的沸点
C.HO2可与AgNO3反应:HO2+AgNO3=AgO2↓+HNO3
D.H2O、H2O2中O的杂化方式相同,H2O2为直线形分子
4.下列各物质中,含有化学键类型完全相同的一组化合物是( )
A.NaCl、MgCl2、 AlCl3 B.ClO2、 P4、NH3
C.CO2、 SO2、 Na2O2 D.Na2O2、 CaC2、 K2S2
5.关于键长、键能和键角的说法中不正确的是
A.键角是描述分子立体结构的重要参数 B.键长的大小与成键原子的半径有关
C.多原子分子的键角一定,表明共价键具有方向性 D.键能越大,键长就越长,共价化合物也就越稳定
6.下列说法正确的是
A.金刚石经锤易碎,原因是共价键具有方向性,外力作用下原子易错位而断裂
B.乙醛能与水任意比互溶,原因是其水溶液中形成了3种氢键
C.含钙化合物中的钙元素常显正二价,原因是钙的第二电离能小于其第一电离能
D.碳原子的轨道表示式为,原因是违反了泡利原理
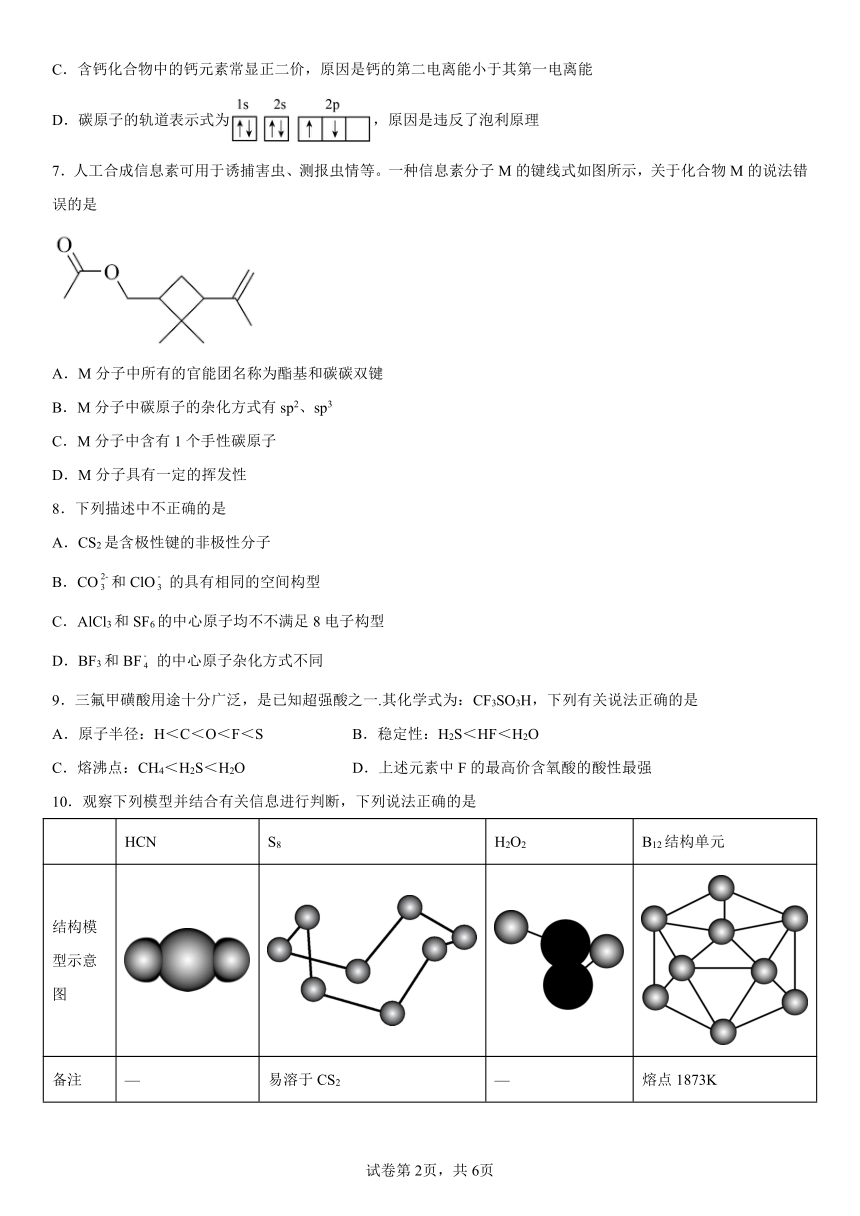
7.人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素分子M的键线式如图所示,关于化合物M的说法错误的是
A.M分子中所有的官能团名称为酯基和碳碳双键
B.M分子中碳原子的杂化方式有sp2、sp3
C.M分子中含有1个手性碳原子
D.M分子具有一定的挥发性
8.下列描述中不正确的是
A.CS2是含极性键的非极性分子
B.CO和ClO 的具有相同的空间构型
C.AlCl3和SF6的中心原子均不不满足8电子构型
D.BF3和BF 的中心原子杂化方式不同
9.三氟甲磺酸用途十分广泛,是已知超强酸之一.其化学式为:CF3SO3H,下列有关说法正确的是
A.原子半径:H<C<O<F<S B.稳定性:H2S<HF<H2O
C.熔沸点:CH4<H2S<H2O D.上述元素中F的最高价含氧酸的酸性最强
10.观察下列模型并结合有关信息进行判断,下列说法正确的是
HCN S8 H2O2 B12结构单元
结构模型示意图
备注 — 易溶于CS2 — 熔点1873K
A.HCN的结构式为H-C≡N,分子中σ键与π键数目之比为
B.固态硫S8属于共价晶体,分子中S原子采用sp3杂化
C.H2O2的结构式为H-O-O-H,所以为非极性分子
D.单质硼属于共价晶体
11.下列关于物质性质的说法中,正确的是
A.液溴在溶剂中的溶解性:
B.室温下,酸性:
C.相同压强下的沸点:乙醇>乙二醇>丙烷
D.室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷
12.电影《泰坦尼克号》讲述了一个凄婉的爱情故事,导致这一爱情悲剧的罪魁祸首就是冰山。以下对冰的描述中不正确的是
A.冰形成后,密度小于水,故冰山浮在水面上
B.水在4℃时达到最大密度,4℃后水的密度变小
C.范德华力与氢键可同时存在于分子之间
D.在冰中含有的作用力只有共价键和氢键
13.下列说法正确的是
A.基态原子的内层电子全部充满 B.中子数为8的氧原子可以表示为
C.与分子的极性相同 D.的空间构型为正四面体形
14.下列分子中所有原子都满足最外层为8电子结构的是( )
A.BCl3 B.H2O C.SiCl4 D.PCl5
15.某物质M是制造染料的中间体,它的球棍模型如图所示,由短周期X、Y、Z、W四种元素组成,X元素原子半径最小,W的3p轨道有一个未成对电子,Y、Z同主族。下列说法正确的是
A.简单离子半径:W>Z>Y
B.最简单氢化物沸点:YC.X2Y2是极性分子
D.Z最高价氧化物空间构型为三角锥形
二、填空题
16.回答下列问题:
(1)CO2能与OH-结合生成HCO,试写出HCO的电子式___。
(2)硼酸分子结构简式为B(OH)3,其晶体结构与石墨相似,为层型片状结构。其在冷水中的溶解度很小,在热水中的溶解度较大,原因是:___。
17.氮是地球上极为丰富的元素。
(1)中N以形式存在,基态的电子排布式为______。
(2)为三角锥形分子,键键能的含义是______(填字母)。
A.由N和H形成所放出的能量
B.把中的共价键全部拆开所吸收的能量
C.拆开约个键所吸收的能量
D.形成1个键所放出的能量
(3)键的键能为,键的键能为,计算说明中的______(填“”或“”,下同)键比______键稳定。
(4)已知:,,,。计算反应的反应热______。
18.(1)硫酸镍溶于氨水形成蓝色溶液。
①中阴离子的空间结构是______。
②在中,Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是_________(填元素符号)。
(2)银氨溶液的主要成分是,配制方法是向溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液。
①中阴离子的空间结构是________。
②中的配位数为___________。
(3)现代工业冶金中,。是常见的配体,提供孤电子对的是C不是N,其主要原因是__________。。
19.(1)比较结合H+能力的相对强弱:H2O__________(填“>”“<”或“=”)NH3;用一个化学方程式说明H2O和NH3结合H+能力的相对强弱:___________________________。
(2)NaNH2是离子化合物,各原子均满足8电子或2电子稳定结构。写出NaNH2的电子式:__________。
(3)异丁烷的沸点低于正丁烷,原因是____________________________________________。
20.VA、VIIA族单质及化合物在生产生活中有着重要的作用。
(1)N、P位于同一主族,NH3、PH3分子结构如下图所示:
①NH3和PH3中,N、P原子杂化方式相同,但H-N-H间的夹角比H-P-H间的大,其主要原因是______。
②NH3比PH3易液化,其主要原因是_____。
(2)基态氟原子核外电子的运动状态有______种,有______种不同能量的原子轨道。
(3)N与F可形成化合物N2F2,下列有关N2F2的说法正确的是______(填字母)。
a.分子中氮原子的杂化轨道类型为sp2
b.其结构式为F-N≡N一F
c. 1mol N2F2含有的σ键的数目为4NA
21.目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
I.(1)硫酸镍溶于氨水形成蓝色溶液。
①基态的核外电子排布式为_______。
②在中存在的化学键有_______。
A.离子键 B.共价键 C.配位键 D.键 E.键
II.丁二酮肟是检验的灵敏试剂。
(2)丁二酮肟分子()中C原子轨道杂化类型为_______,丁二酮肟分子所含键的数目为_______。
(3)配合物常温下为液态,易溶于、苯等有机溶剂。中与的C原子形成配位键。不考虑空间结构,的结构可用示意图表示为_______(用“→”表示出配位键)。
22.过氧化氢()是一种医用杀菌消毒剂,已知分子的结构如下图所示。2分子不是直线形,两个H原子犹如在半展开的书的两面纸上,书面夹角为,而两个键与键的夹角均为。试回答:
(1)下列关于的说法正确的是___________(填序号)。
a.该分子中有极性键 b.该分子中有非极性键
c.该分子中氧原子的轨道发生杂化 d.该分子是非极性分子
(2)分子间易形成氢键,该氢键的表示式是___________。
(3)难溶于,主要原因是___________。
(4)易溶于水,主要原因是___________。
(5)分子中氧元素的化合价为___________,原因是___________。
23.不同条件下,HgBr2溶液(必要时加HgO)与氨反应可得不同产物。向HgBr2溶液中加入氨性缓冲溶液,得到二氨合溴化汞A。向浓度适中的HgBr2溶液中加入氨水,得到白色沉淀B,B的化学式中汞离子、氨基和Br-的比例为1:1:1。将含NH4Br的HgBr2浓溶液与HgO混合,得到化合物C,C中汞离子、亚氨基和Br-的比例为2:1:2。HgBr2的浓溶液在搅拌下加入稀氨水,得到浅黄色沉淀D,D是一水合溴氮化汞。从A到D的结构中,Hg(II)与N的结合随N上所连氢原子的数目而变化,N均成4个键,N-Hg-N键角为180°。A中,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg(II),NH3位于立方体的体心。B中,Hg(II)与氨基形成一维链。C中存在Hg(II)与亚氨基形成的按六边形扩展的二维结构,Br-位于六边形中心。D中,(Hg2N)+形成具有类似SiO2的三维结构。
(1)写出生成C和D的方程式_______、_______。
(2)画出A的结构示意图(NH3以N表示)_______。
(3)画出B中Hg(II)与氨基(以N表示)形成的一维链式结构示意图_______。
(4)画出C中二维层的结构示意图_______,写出其组成式_______。层间还存在哪些物种_______?给出其比例_______。
(5)画出D中(Hg2N)+的三维结构示意图(示出Hg与N的连接方式即可)_______。
(6)令人惊奇的是,组成为HgNH2F的化合物并非与HgNH2X(X=Cl,Br,I)同构,而与D相似,存在三维结构的(Hg2N)+。写出表达HgNH2F结构特点的结构简式_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.选项中3p轨道填充的电子违背洪特规则,基态P的轨道表示式为,A错误;
B.P4分子的空间构型为正四面体,P原子位于4个顶点,所以一个P4分子中含有6个P-P键,则1molP4分子中含有6molP-P键,B错误;
C.P原子价层电子数为5,采取sp3杂化,和其中三个氢原子各形成一个σ键,还剩余一对孤对电子,与氢离子的空轨道形成配位键,C正确;
D.H3PO2是一元弱酸,KH2PO2属于正盐,不能与KOH反应,即反应②中若KOH过量,发的生反应仍是:P4+3KOH+3H2O3KH2PO2+PH3↑,D错误;
综上所述答案为C。
2.B
【详解】A.6g乙酸的物质的量为0.1mol,乙酸分子中只有—COOH中的碳原子为sp2杂化,sp2杂化的碳原子数为,A错误;
B.中硼原子的价层电子对数为,B正确;
C.甲烷与氯气反应前后分子数不发生改变,故充分反应后的分子总数为,C错误;
D.铅蓄电池放电时的总反应为,生成时每转移2mol电子,则负极增重96g,所以当负极增重48g时,转移电子数为,D错误;
故选B。
3.D
【详解】A.HO2与与HX(X=C1、Br、I等)的某些性质相似,HX为极性分子,HO2为极性分子,A正确;
B.H2O的沸点低于H2O2的沸点,沸点高是由于都含有氢键但过氧化氢的氢键强度大,B正确;
C.HO2与HX(X=Cl、Br、I等)某些性质相似,故HO2可与AgNO3反应:HO2+ AgNO3=AgO2↓+HNO3,C正确;
D.H2O、H2O2中O的杂化方式相同,H2O2为 ,非直线型,D错误;
故选D。
4.D
【详解】A.NaCl和MgCl2只含有离子键, AlCl3只含有共价键,所以化学键类型不一致,A错误;
B.ClO2、 P4、NH3均只含有共价键,化学键类型一致,但P4属于单质,不是化合物,B错误;
C.CO2和 SO2只含有共价键, Na2O2含有离子键和非极性共价键,所以化学键类型不一致,C错误;
D.Na2O2、 CaC2、 K2S2含有离子键和非极性共价键,所以化学键类型一致,D正确;
故选D。
5.D
【详解】A.键角是分子中两个共价键之间的夹角,是描述分子立体结构的重要参数,故A正确;
B.影响键长的因素有:参与成键的原子半径、成键原子的周围环境,与成键原子的半径和成键数目有关,故B正确;
C.多原子分子的键角一定,表明共价键具有方向性,故C正确;
D.键能越大,键长越短,共价化合物越稳定,故D错误。
故选D。
6.A
【详解】A.金刚石中只存在C-C共价键,共价键具有方向性,当受到大的外力作用会发生原子间错位而断裂,故A正确;
B.乙醛能与水任意比互溶是因为乙醛中的氧原子和水的氢原子之间能生成氢键,同时水分之间可以形成氢键,形成了2种氢键,故B错误;
C.含钙化合物中的钙元素常显正二价,原因是钙的第一电离能和第二电离能均较小,容易失去2个电子,但是第二电离能大于其第一电离能,故C错误;
D.碳原子的轨道表示式为 ,原因是违反了洪特规则,故D错误;
故选A.
7.C
【详解】A.M分子中的官能团为酯基和碳碳双键,A正确;
B.M中饱和碳原子杂化方式为sp3杂化,酯基和碳碳双键的碳原子为sp2杂化,B正确;
C.M分子中含两个手性原子,为四元环中左、右两个碳原子,C错误;
D.M为含酯基,酯类物质有一定的挥发性,D正确;
故选C。
8.B
【详解】A. CS2含有C=S键,是极性键,分子是直线型,是含极性键的非极性分子,A正确;
B. CO中C原子孤电子对数、价电子对数,则其空间构型为平面三角形,ClO中Cl原子孤电子对数、价电子对数,则其空间构型为三角锥体,空间构型不相同,B不正确;
C. AlCl3中Al原子满足6电子构型,SF6中的S原子满足12电子构型,故C正确;
D. BF3 中B原子孤电子对数、价电子对数,则其空间构型为平面三角形,中心原子为sp2杂化,BF 中B原子孤电子对数、价电子对数,则其空间构型为正四面体,中心原子为sp3杂化,故D正确;
答案选B。
9.C
【详解】A. H原子电子层最少,其原子半径最小;S原子电子层最多,其原子半径增最大;原子半径:HB. 非金属性F>O>S,则简单氢化物的稳定性:H2SC. H2O分子间存在氢键,其沸点最高,则熔沸点:CH4D. F元素非金属性最强,不存在最高价含氧酸,故D错误;
故选C。
10.D
【详解】A.由比例模型可以看出分子中有1个碳原子和1个氮原子,1个氢原子,碳原子半径大于氮原子半径,氮原子半径大于氢原子半径,所以该比例模型中最左端的是氢原子,中间的是碳原子,最右边的是氮原子,其结构式为H-C≡N,分子中“C≡N”键含有1个σ键和2个π键,“H-C”属于σ键,故分子中σ键与π键数目之比为,A项错误;
B.固态S是由S8构成的,根据其溶解性可知,该晶体中存在的微粒是分子,属于分子晶体,B项错误;
C.H2O2是共价化合物,由其结构模型示意图可知,其结构式为H-O-O-H,是极性分子,C项错误;
D.根据B的熔点1873K,该晶体熔点较高,属于共价晶体,D项正确;
答案选D。
11.D
【详解】A.溴和CCl4属于非极性分子,而水属于极性 分子,根据相似相容可知,液溴在溶剂中的溶解性:H2OB.分子中存在含有强吸引电子基团,能使-OH上的H原子活泼性增强而使该物质的酸性增强,三氟乙酸中,氟的电负性最大,吸引电子的能力强,而且数量多,所以室温下,酸性:CH3COOHC.乙二醇分子中含有的羟基多,比乙醇更容易形成分子间氢键,相同压强下的沸点:乙二醇>乙醇>丙烷,C错误;
D.丙三醇分子含有的羟基多,更易与水分子形成氨键,苯酚微溶于水,1- 氯丁烷难溶于水,室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷,D正确;
故选D。
12.D
【详解】A.水在形成冰时,由于氢键的存在,使得密度减小,故冰浮在水面上,A正确;
B.水在时密度最大,B正确;
C.范德华力与氢键可同时存在于分子之间,C正确;
D.在水分子内含有共价键,水分子间存在氢键,同时也存在范德华力,D错误。
故选D。
13.D
【详解】A.Ca的内层电子第三层只填了8个未全部充满,A项错误;
B.中子为8的氧原子的质量数为8+8=16,其表达为,B项错误;
C.CO2为对称直线型非极性分子,而H2O为V型为极性分子,C项错误;
D.的价层电子对为,无孤电子对,其立体构型为正四面体,D项正确;
故选D。
14.C
【分析】
【详解】A.BCl3中B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,B原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故A错误;
B.H2O中O元素化合价为-2,O原子最外层电子数为6,所以2+6=8,O原子满足8电子结构;H元素化合价为+1,H原子最外层电子数为1,所以1+1=2,H原子不满足8电子结构,故B错误;
C.SiCl4中Si元素化合价为+4,Si原子最外层电子数为4,所以4+4=8,Si原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故C正确;
D.PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,P原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故D错误;
答案选C。
15.C
【分析】根据球棍模型分析,由短周期X、Y、Z、W四种元素组成,X元素原子半径最小,则X为H,W的3p轨道有一个未成对电子,则W为Cl,Y、Z同主族,则Y为O,Z为S。
【详解】A.根据层多径大,同电子层结构核多径小,因此简单离子半径:Z>W>Y,故A错误;
B.水存在分子间氢键,因此最简单氢化物沸点:Z<Y,故B错误;
C.X2Y2(H2O2)的结构为 ,不是中心对称,是极性分子,故C正确;
D.Z最高价氧化物SO3中心原子价层电子对数为3+0=3,其空间构型为平面正三角形,故D错误。
综上所述,答案为C。
16.(1)
(2)硼酸分子间以氢键缔合在一起难溶解,在热水中部分氢键被破坏,溶解度增大
【解析】(1)
HCO的电子式为;
(2)
硼酸分子间以氢键缔合在一起难溶解,在热水中部分氢键被破坏,溶解度增大,故硼酸在冷水中的溶解度很小,在热水中的溶解度较大。
17. C π -456
【详解】(1)基态N原子的电子排布式为,得到3个电子转化为,故基态的电子排布式为。
(2)键的键能是指形成键放出的能量或拆开键所吸收的能量,不是指形成1个键释放的能量。分子中含有键,拆开或形成吸收或放出的能量应是键键能的3倍。
(3)键中有两个π键和一个键,而键为键,键能为,键的键能为,则键的键能大于键键能的3倍,故中键的稳定性比π键弱。
(4)
。
18. 正四面体形 配位键 N 平面三角形 2 C的电负性比N小,吸引孤电子对的能力比N弱
【详解】(1)①中S原子的孤电子对数为,价层电子对数为,故其空间结构为正四面体形;
②Ni2+提供空轨道,中N原子提供孤电子对,二者形成配位键;
(2)①中N原子价电子对数是,形成3个键,且不含孤电子对,根据价层电子对互斥模型可判断其空间结构为平面三角形;
②配位数即配体的个数,是配体,配位数为2;
(3)配体在形成配位键时需具备两个条件:一是有孤电子对,二是配位原子的电负性不能太大,如CO、CN-等配体中C原子提供孤电子对,因为C的电负性比N、O的小。
19. > 异丁烷有支链,分子间距离较大,分子间作用力较小,所以沸点低于正丁烷
【分析】(1)碱性气体结合氢离子能力更强。
(2)NaNH2是离子化合物,根据离子化合物书写原则书写电子式。
(3)相同碳原子的烷烃,支链越多,熔沸点越低。
【详解】(1)水呈中性,氨气溶于水显碱性,碱性气体结合氢离子能力更强,因此结合H+能力的相对强弱:H2O>NH3;能说明H2O和NH3结合H+能力的相对强弱是H3O+和NH3反应生成H2O和,反应方程式为;故答案为:>;。
(2)NaNH2是离子化合物,各原子均满足8电子或2电子稳定结构。则NaNH2的电子式:;故答案为:。
(3)相同碳原子的烷烃,支链越多,熔沸点越低,因此异丁烷的沸点低于正丁烷,原因是异丁烷有支链,分子间距离较大,分子间作用力较小,所以沸点低于正丁烷;故答案为:异丁烷有支链,分子间距离较大,分子间作用力较小,所以沸点低于正丁烷。
【点睛】对应酸越弱,结合氢离子能力越强。
20.(1) 中心原子的电负性N>P,NH3分子中的成键电子对更靠近中心原子,使成键电子对间的斥力变大,键角变大 NH3分子间存在氢键
(2) 9 3
(3)a
【详解】(1)①N、P位于同一主族,中心原子的电负性N>P,NH3分子中的成键电子对更靠近中心原子,使成键电子对间的斥力变大,键角变大;
②NH3分子间存在氢键,使氨的熔沸点升高,温度降低时,更易变为液体;
(2)基态氟原子核外电子排布式为1s22s22p5,基态氟原子核外电子不同能级运动状态不同,相同能级的电子在不同轨运动,运动状态不同,同一轨道中若有两个电子,两个电子自旋方向不同,状态也不同,则有9种运动状态;共有1s、2s、2p三种能量的轨道;
(3)a.N2F2的结构式为F-N=N-F,分子中氮原子有1个孤电子对,2条σ键,N的杂化轨道类型为sp2,a正确;
b.氮原子最外层有五个电子,其结构式为F-N=N一F,b错误;
c.根据N2F2的结构式可知, 1mol N2F2含有的σ键的数目为3NA,c错误;
答案为a。
21. BCE 和
【详解】I(1)①是28号元素,根据原子核外电子排布规律可知,基态的核外电子排布式为;
故答案为:。
②中与之间形成配位键,中N、H之间形成键,是键,属于共价键;
故答案为:BCE。
Ⅱ(2)丁二酮肟分子中甲基上碳原子价电子对个数是4,且不含孤电子对,为杂化,连接甲基的碳原子含有3个价电子对,且不含孤电子对,为杂化;丁二酮肟分子中含有13个单键和2个双键,则共含有15个键,所以丁二酮肟含有键的数目为;
故答案为:和;。
(3)中与形成配位键,空间结构为四面体形,其结构示意图为;
故答案为:。
22. (1)ab 为极性分子,为非极性分子 易与分子间形成氢键且和均为极性分子 -1 键为非极性键,键为极性键,且电负性:,共用电子对偏向氧,故氧元素显-1价
【详解】(1)a. 在中键为极性键,该分子中有极性键, a正确;
b. 在中键为非极性键;该分子中有非极性键,b正确;
c. 中O原子价层电子对数为4,O原子为杂化,c错误;
d. 为极性分子,d错误;
故答案选ab;
(2)中含有键,故分子间能形成氢键,表示为;
(3)为极性分子,为非极性分子,根据“相似相溶”规律知,难溶于;
(4)和均为极性分子,且与分子之间易形成氢键,因此易溶于水;
(5)共用电子对的偏移决定元素在化合物中的化合价,键为非极性键,键为极性键,且电负性:,共用电子对偏向氧,故氧元素显-1价。
23.(1) C的生成:3HgO + HgBr2+ 2NH4Br=2Hg2NHBr2 + 3H2O D的生成:2Hg2+ + 4NH3+ Br -+ H2O=Hg2NBr·H 2O+ 3
(2)
(3)
(4) 或 [Hg3(NH)2Br]+ Hg2+和Br- 1:3
(5)或
(6)()(Hg2N+)(F-)2
【详解】(1)C中汞离子、亚氨基和Br-的比例为2:1:2,则化合物C为Hg2NHBr2,反应生成C的化学方程式为3HgO + HgBr2+2NH4Br=2Hg2NHBr2 + 3H2O;D是一水合溴氮化汞,则反应生成D的化学方程式为2Hg2+ + 4NH3+ Br -+ H2O → Hg2NBr·H 2O+ 3;
(2)A中,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg(II),NH3位于立方体的体心,则A的结构示意图(NH3以N表示)为;
(3)B中,Hg(II)与氨基形成一维链,其结构示意图为;
(4)C中存在Hg(II)与亚氨基形成的按六边形扩展的二维结构,Br-位于六边形中心,则其二维层的结构示意图为或;取其中一个六边形,含6个亚氨基,6个Hg(II),每个亚氨基为3个六边形共用,则该六边形有个亚氨基,每个Hg(II)为2个六边形共用,则该六边形有个Hg(II),因此C的组成式为[Hg3(NH)2Br]+;层间还存在Hg2+和Br-;其比例为1:3;
(5)D中,(Hg2N)+形成具有类似SiO2的三维结构,其示意图为或;
(6)HgNH2F结构特点的结构简式为()(Hg2N+)(F-)2。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.2020年人类在金星大气中探测到PH3.实验室制备PH3的方法有:①PH4I+NaOH=NaI+PH3↑+H2O;②P4+3KOH+3H2O3KH2PO2+PH3↑。已知H3PO2是一元弱酸,其结构式为。下列说法正确的是
A.基态P的轨道表示式为
B.1molP4分子中含有4molP-P键
C.PH中提供孤电子对的原子是P
D.反应②中若KOH过量会发生反应:P4+9KOH3K3PO2+PH3↑+3H2O
2.设NA是阿伏加德罗常数的值。下列说法正确的是
A.6g乙酸中sp2杂化的碳原子数为0.2NA
B.0.5molBF3成键后硼原子的价层电子对数为1.5NA
C.标准状况下,22.4LCH4与44.8LCl2在光照条件下充分反应后的分子总数为2NA
D.铅蓄电池放电时,若负极增重48g,则此时转移电子数为0.5NA
3.H2O、H2O2、HO2(超氧化氢)都属于氢氧化合物,其中HO2又叫超氧酸,与H2O2化学性质相似,又与HX(X=C1、Br、I等)的某些性质相似。下列说法错误的是
A.HO2为极性分子
B.H2O的沸点低于H2O2的沸点
C.HO2可与AgNO3反应:HO2+AgNO3=AgO2↓+HNO3
D.H2O、H2O2中O的杂化方式相同,H2O2为直线形分子
4.下列各物质中,含有化学键类型完全相同的一组化合物是( )
A.NaCl、MgCl2、 AlCl3 B.ClO2、 P4、NH3
C.CO2、 SO2、 Na2O2 D.Na2O2、 CaC2、 K2S2
5.关于键长、键能和键角的说法中不正确的是
A.键角是描述分子立体结构的重要参数 B.键长的大小与成键原子的半径有关
C.多原子分子的键角一定,表明共价键具有方向性 D.键能越大,键长就越长,共价化合物也就越稳定
6.下列说法正确的是
A.金刚石经锤易碎,原因是共价键具有方向性,外力作用下原子易错位而断裂
B.乙醛能与水任意比互溶,原因是其水溶液中形成了3种氢键
C.含钙化合物中的钙元素常显正二价,原因是钙的第二电离能小于其第一电离能
D.碳原子的轨道表示式为,原因是违反了泡利原理
7.人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素分子M的键线式如图所示,关于化合物M的说法错误的是
A.M分子中所有的官能团名称为酯基和碳碳双键
B.M分子中碳原子的杂化方式有sp2、sp3
C.M分子中含有1个手性碳原子
D.M分子具有一定的挥发性
8.下列描述中不正确的是
A.CS2是含极性键的非极性分子
B.CO和ClO 的具有相同的空间构型
C.AlCl3和SF6的中心原子均不不满足8电子构型
D.BF3和BF 的中心原子杂化方式不同
9.三氟甲磺酸用途十分广泛,是已知超强酸之一.其化学式为:CF3SO3H,下列有关说法正确的是
A.原子半径:H<C<O<F<S B.稳定性:H2S<HF<H2O
C.熔沸点:CH4<H2S<H2O D.上述元素中F的最高价含氧酸的酸性最强
10.观察下列模型并结合有关信息进行判断,下列说法正确的是
HCN S8 H2O2 B12结构单元
结构模型示意图
备注 — 易溶于CS2 — 熔点1873K
A.HCN的结构式为H-C≡N,分子中σ键与π键数目之比为
B.固态硫S8属于共价晶体,分子中S原子采用sp3杂化
C.H2O2的结构式为H-O-O-H,所以为非极性分子
D.单质硼属于共价晶体
11.下列关于物质性质的说法中,正确的是
A.液溴在溶剂中的溶解性:
B.室温下,酸性:
C.相同压强下的沸点:乙醇>乙二醇>丙烷
D.室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷
12.电影《泰坦尼克号》讲述了一个凄婉的爱情故事,导致这一爱情悲剧的罪魁祸首就是冰山。以下对冰的描述中不正确的是
A.冰形成后,密度小于水,故冰山浮在水面上
B.水在4℃时达到最大密度,4℃后水的密度变小
C.范德华力与氢键可同时存在于分子之间
D.在冰中含有的作用力只有共价键和氢键
13.下列说法正确的是
A.基态原子的内层电子全部充满 B.中子数为8的氧原子可以表示为
C.与分子的极性相同 D.的空间构型为正四面体形
14.下列分子中所有原子都满足最外层为8电子结构的是( )
A.BCl3 B.H2O C.SiCl4 D.PCl5
15.某物质M是制造染料的中间体,它的球棍模型如图所示,由短周期X、Y、Z、W四种元素组成,X元素原子半径最小,W的3p轨道有一个未成对电子,Y、Z同主族。下列说法正确的是
A.简单离子半径:W>Z>Y
B.最简单氢化物沸点:Y
D.Z最高价氧化物空间构型为三角锥形
二、填空题
16.回答下列问题:
(1)CO2能与OH-结合生成HCO,试写出HCO的电子式___。
(2)硼酸分子结构简式为B(OH)3,其晶体结构与石墨相似,为层型片状结构。其在冷水中的溶解度很小,在热水中的溶解度较大,原因是:___。
17.氮是地球上极为丰富的元素。
(1)中N以形式存在,基态的电子排布式为______。
(2)为三角锥形分子,键键能的含义是______(填字母)。
A.由N和H形成所放出的能量
B.把中的共价键全部拆开所吸收的能量
C.拆开约个键所吸收的能量
D.形成1个键所放出的能量
(3)键的键能为,键的键能为,计算说明中的______(填“”或“”,下同)键比______键稳定。
(4)已知:,,,。计算反应的反应热______。
18.(1)硫酸镍溶于氨水形成蓝色溶液。
①中阴离子的空间结构是______。
②在中,Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是_________(填元素符号)。
(2)银氨溶液的主要成分是,配制方法是向溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液。
①中阴离子的空间结构是________。
②中的配位数为___________。
(3)现代工业冶金中,。是常见的配体,提供孤电子对的是C不是N,其主要原因是__________。。
19.(1)比较结合H+能力的相对强弱:H2O__________(填“>”“<”或“=”)NH3;用一个化学方程式说明H2O和NH3结合H+能力的相对强弱:___________________________。
(2)NaNH2是离子化合物,各原子均满足8电子或2电子稳定结构。写出NaNH2的电子式:__________。
(3)异丁烷的沸点低于正丁烷,原因是____________________________________________。
20.VA、VIIA族单质及化合物在生产生活中有着重要的作用。
(1)N、P位于同一主族,NH3、PH3分子结构如下图所示:
①NH3和PH3中,N、P原子杂化方式相同,但H-N-H间的夹角比H-P-H间的大,其主要原因是______。
②NH3比PH3易液化,其主要原因是_____。
(2)基态氟原子核外电子的运动状态有______种,有______种不同能量的原子轨道。
(3)N与F可形成化合物N2F2,下列有关N2F2的说法正确的是______(填字母)。
a.分子中氮原子的杂化轨道类型为sp2
b.其结构式为F-N≡N一F
c. 1mol N2F2含有的σ键的数目为4NA
21.目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
I.(1)硫酸镍溶于氨水形成蓝色溶液。
①基态的核外电子排布式为_______。
②在中存在的化学键有_______。
A.离子键 B.共价键 C.配位键 D.键 E.键
II.丁二酮肟是检验的灵敏试剂。
(2)丁二酮肟分子()中C原子轨道杂化类型为_______,丁二酮肟分子所含键的数目为_______。
(3)配合物常温下为液态,易溶于、苯等有机溶剂。中与的C原子形成配位键。不考虑空间结构,的结构可用示意图表示为_______(用“→”表示出配位键)。
22.过氧化氢()是一种医用杀菌消毒剂,已知分子的结构如下图所示。2分子不是直线形,两个H原子犹如在半展开的书的两面纸上,书面夹角为,而两个键与键的夹角均为。试回答:
(1)下列关于的说法正确的是___________(填序号)。
a.该分子中有极性键 b.该分子中有非极性键
c.该分子中氧原子的轨道发生杂化 d.该分子是非极性分子
(2)分子间易形成氢键,该氢键的表示式是___________。
(3)难溶于,主要原因是___________。
(4)易溶于水,主要原因是___________。
(5)分子中氧元素的化合价为___________,原因是___________。
23.不同条件下,HgBr2溶液(必要时加HgO)与氨反应可得不同产物。向HgBr2溶液中加入氨性缓冲溶液,得到二氨合溴化汞A。向浓度适中的HgBr2溶液中加入氨水,得到白色沉淀B,B的化学式中汞离子、氨基和Br-的比例为1:1:1。将含NH4Br的HgBr2浓溶液与HgO混合,得到化合物C,C中汞离子、亚氨基和Br-的比例为2:1:2。HgBr2的浓溶液在搅拌下加入稀氨水,得到浅黄色沉淀D,D是一水合溴氮化汞。从A到D的结构中,Hg(II)与N的结合随N上所连氢原子的数目而变化,N均成4个键,N-Hg-N键角为180°。A中,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg(II),NH3位于立方体的体心。B中,Hg(II)与氨基形成一维链。C中存在Hg(II)与亚氨基形成的按六边形扩展的二维结构,Br-位于六边形中心。D中,(Hg2N)+形成具有类似SiO2的三维结构。
(1)写出生成C和D的方程式_______、_______。
(2)画出A的结构示意图(NH3以N表示)_______。
(3)画出B中Hg(II)与氨基(以N表示)形成的一维链式结构示意图_______。
(4)画出C中二维层的结构示意图_______,写出其组成式_______。层间还存在哪些物种_______?给出其比例_______。
(5)画出D中(Hg2N)+的三维结构示意图(示出Hg与N的连接方式即可)_______。
(6)令人惊奇的是,组成为HgNH2F的化合物并非与HgNH2X(X=Cl,Br,I)同构,而与D相似,存在三维结构的(Hg2N)+。写出表达HgNH2F结构特点的结构简式_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.选项中3p轨道填充的电子违背洪特规则,基态P的轨道表示式为,A错误;
B.P4分子的空间构型为正四面体,P原子位于4个顶点,所以一个P4分子中含有6个P-P键,则1molP4分子中含有6molP-P键,B错误;
C.P原子价层电子数为5,采取sp3杂化,和其中三个氢原子各形成一个σ键,还剩余一对孤对电子,与氢离子的空轨道形成配位键,C正确;
D.H3PO2是一元弱酸,KH2PO2属于正盐,不能与KOH反应,即反应②中若KOH过量,发的生反应仍是:P4+3KOH+3H2O3KH2PO2+PH3↑,D错误;
综上所述答案为C。
2.B
【详解】A.6g乙酸的物质的量为0.1mol,乙酸分子中只有—COOH中的碳原子为sp2杂化,sp2杂化的碳原子数为,A错误;
B.中硼原子的价层电子对数为,B正确;
C.甲烷与氯气反应前后分子数不发生改变,故充分反应后的分子总数为,C错误;
D.铅蓄电池放电时的总反应为,生成时每转移2mol电子,则负极增重96g,所以当负极增重48g时,转移电子数为,D错误;
故选B。
3.D
【详解】A.HO2与与HX(X=C1、Br、I等)的某些性质相似,HX为极性分子,HO2为极性分子,A正确;
B.H2O的沸点低于H2O2的沸点,沸点高是由于都含有氢键但过氧化氢的氢键强度大,B正确;
C.HO2与HX(X=Cl、Br、I等)某些性质相似,故HO2可与AgNO3反应:HO2+ AgNO3=AgO2↓+HNO3,C正确;
D.H2O、H2O2中O的杂化方式相同,H2O2为 ,非直线型,D错误;
故选D。
4.D
【详解】A.NaCl和MgCl2只含有离子键, AlCl3只含有共价键,所以化学键类型不一致,A错误;
B.ClO2、 P4、NH3均只含有共价键,化学键类型一致,但P4属于单质,不是化合物,B错误;
C.CO2和 SO2只含有共价键, Na2O2含有离子键和非极性共价键,所以化学键类型不一致,C错误;
D.Na2O2、 CaC2、 K2S2含有离子键和非极性共价键,所以化学键类型一致,D正确;
故选D。
5.D
【详解】A.键角是分子中两个共价键之间的夹角,是描述分子立体结构的重要参数,故A正确;
B.影响键长的因素有:参与成键的原子半径、成键原子的周围环境,与成键原子的半径和成键数目有关,故B正确;
C.多原子分子的键角一定,表明共价键具有方向性,故C正确;
D.键能越大,键长越短,共价化合物越稳定,故D错误。
故选D。
6.A
【详解】A.金刚石中只存在C-C共价键,共价键具有方向性,当受到大的外力作用会发生原子间错位而断裂,故A正确;
B.乙醛能与水任意比互溶是因为乙醛中的氧原子和水的氢原子之间能生成氢键,同时水分之间可以形成氢键,形成了2种氢键,故B错误;
C.含钙化合物中的钙元素常显正二价,原因是钙的第一电离能和第二电离能均较小,容易失去2个电子,但是第二电离能大于其第一电离能,故C错误;
D.碳原子的轨道表示式为 ,原因是违反了洪特规则,故D错误;
故选A.
7.C
【详解】A.M分子中的官能团为酯基和碳碳双键,A正确;
B.M中饱和碳原子杂化方式为sp3杂化,酯基和碳碳双键的碳原子为sp2杂化,B正确;
C.M分子中含两个手性原子,为四元环中左、右两个碳原子,C错误;
D.M为含酯基,酯类物质有一定的挥发性,D正确;
故选C。
8.B
【详解】A. CS2含有C=S键,是极性键,分子是直线型,是含极性键的非极性分子,A正确;
B. CO中C原子孤电子对数、价电子对数,则其空间构型为平面三角形,ClO中Cl原子孤电子对数、价电子对数,则其空间构型为三角锥体,空间构型不相同,B不正确;
C. AlCl3中Al原子满足6电子构型,SF6中的S原子满足12电子构型,故C正确;
D. BF3 中B原子孤电子对数、价电子对数,则其空间构型为平面三角形,中心原子为sp2杂化,BF 中B原子孤电子对数、价电子对数,则其空间构型为正四面体,中心原子为sp3杂化,故D正确;
答案选B。
9.C
【详解】A. H原子电子层最少,其原子半径最小;S原子电子层最多,其原子半径增最大;原子半径:H
故选C。
10.D
【详解】A.由比例模型可以看出分子中有1个碳原子和1个氮原子,1个氢原子,碳原子半径大于氮原子半径,氮原子半径大于氢原子半径,所以该比例模型中最左端的是氢原子,中间的是碳原子,最右边的是氮原子,其结构式为H-C≡N,分子中“C≡N”键含有1个σ键和2个π键,“H-C”属于σ键,故分子中σ键与π键数目之比为,A项错误;
B.固态S是由S8构成的,根据其溶解性可知,该晶体中存在的微粒是分子,属于分子晶体,B项错误;
C.H2O2是共价化合物,由其结构模型示意图可知,其结构式为H-O-O-H,是极性分子,C项错误;
D.根据B的熔点1873K,该晶体熔点较高,属于共价晶体,D项正确;
答案选D。
11.D
【详解】A.溴和CCl4属于非极性分子,而水属于极性 分子,根据相似相容可知,液溴在溶剂中的溶解性:H2O
D.丙三醇分子含有的羟基多,更易与水分子形成氨键,苯酚微溶于水,1- 氯丁烷难溶于水,室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷,D正确;
故选D。
12.D
【详解】A.水在形成冰时,由于氢键的存在,使得密度减小,故冰浮在水面上,A正确;
B.水在时密度最大,B正确;
C.范德华力与氢键可同时存在于分子之间,C正确;
D.在水分子内含有共价键,水分子间存在氢键,同时也存在范德华力,D错误。
故选D。
13.D
【详解】A.Ca的内层电子第三层只填了8个未全部充满,A项错误;
B.中子为8的氧原子的质量数为8+8=16,其表达为,B项错误;
C.CO2为对称直线型非极性分子,而H2O为V型为极性分子,C项错误;
D.的价层电子对为,无孤电子对,其立体构型为正四面体,D项正确;
故选D。
14.C
【分析】
【详解】A.BCl3中B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,B原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故A错误;
B.H2O中O元素化合价为-2,O原子最外层电子数为6,所以2+6=8,O原子满足8电子结构;H元素化合价为+1,H原子最外层电子数为1,所以1+1=2,H原子不满足8电子结构,故B错误;
C.SiCl4中Si元素化合价为+4,Si原子最外层电子数为4,所以4+4=8,Si原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故C正确;
D.PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,P原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故D错误;
答案选C。
15.C
【分析】根据球棍模型分析,由短周期X、Y、Z、W四种元素组成,X元素原子半径最小,则X为H,W的3p轨道有一个未成对电子,则W为Cl,Y、Z同主族,则Y为O,Z为S。
【详解】A.根据层多径大,同电子层结构核多径小,因此简单离子半径:Z>W>Y,故A错误;
B.水存在分子间氢键,因此最简单氢化物沸点:Z<Y,故B错误;
C.X2Y2(H2O2)的结构为 ,不是中心对称,是极性分子,故C正确;
D.Z最高价氧化物SO3中心原子价层电子对数为3+0=3,其空间构型为平面正三角形,故D错误。
综上所述,答案为C。
16.(1)
(2)硼酸分子间以氢键缔合在一起难溶解,在热水中部分氢键被破坏,溶解度增大
【解析】(1)
HCO的电子式为;
(2)
硼酸分子间以氢键缔合在一起难溶解,在热水中部分氢键被破坏,溶解度增大,故硼酸在冷水中的溶解度很小,在热水中的溶解度较大。
17. C π -456
【详解】(1)基态N原子的电子排布式为,得到3个电子转化为,故基态的电子排布式为。
(2)键的键能是指形成键放出的能量或拆开键所吸收的能量,不是指形成1个键释放的能量。分子中含有键,拆开或形成吸收或放出的能量应是键键能的3倍。
(3)键中有两个π键和一个键,而键为键,键能为,键的键能为,则键的键能大于键键能的3倍,故中键的稳定性比π键弱。
(4)
。
18. 正四面体形 配位键 N 平面三角形 2 C的电负性比N小,吸引孤电子对的能力比N弱
【详解】(1)①中S原子的孤电子对数为,价层电子对数为,故其空间结构为正四面体形;
②Ni2+提供空轨道,中N原子提供孤电子对,二者形成配位键;
(2)①中N原子价电子对数是,形成3个键,且不含孤电子对,根据价层电子对互斥模型可判断其空间结构为平面三角形;
②配位数即配体的个数,是配体,配位数为2;
(3)配体在形成配位键时需具备两个条件:一是有孤电子对,二是配位原子的电负性不能太大,如CO、CN-等配体中C原子提供孤电子对,因为C的电负性比N、O的小。
19. > 异丁烷有支链,分子间距离较大,分子间作用力较小,所以沸点低于正丁烷
【分析】(1)碱性气体结合氢离子能力更强。
(2)NaNH2是离子化合物,根据离子化合物书写原则书写电子式。
(3)相同碳原子的烷烃,支链越多,熔沸点越低。
【详解】(1)水呈中性,氨气溶于水显碱性,碱性气体结合氢离子能力更强,因此结合H+能力的相对强弱:H2O>NH3;能说明H2O和NH3结合H+能力的相对强弱是H3O+和NH3反应生成H2O和,反应方程式为;故答案为:>;。
(2)NaNH2是离子化合物,各原子均满足8电子或2电子稳定结构。则NaNH2的电子式:;故答案为:。
(3)相同碳原子的烷烃,支链越多,熔沸点越低,因此异丁烷的沸点低于正丁烷,原因是异丁烷有支链,分子间距离较大,分子间作用力较小,所以沸点低于正丁烷;故答案为:异丁烷有支链,分子间距离较大,分子间作用力较小,所以沸点低于正丁烷。
【点睛】对应酸越弱,结合氢离子能力越强。
20.(1) 中心原子的电负性N>P,NH3分子中的成键电子对更靠近中心原子,使成键电子对间的斥力变大,键角变大 NH3分子间存在氢键
(2) 9 3
(3)a
【详解】(1)①N、P位于同一主族,中心原子的电负性N>P,NH3分子中的成键电子对更靠近中心原子,使成键电子对间的斥力变大,键角变大;
②NH3分子间存在氢键,使氨的熔沸点升高,温度降低时,更易变为液体;
(2)基态氟原子核外电子排布式为1s22s22p5,基态氟原子核外电子不同能级运动状态不同,相同能级的电子在不同轨运动,运动状态不同,同一轨道中若有两个电子,两个电子自旋方向不同,状态也不同,则有9种运动状态;共有1s、2s、2p三种能量的轨道;
(3)a.N2F2的结构式为F-N=N-F,分子中氮原子有1个孤电子对,2条σ键,N的杂化轨道类型为sp2,a正确;
b.氮原子最外层有五个电子,其结构式为F-N=N一F,b错误;
c.根据N2F2的结构式可知, 1mol N2F2含有的σ键的数目为3NA,c错误;
答案为a。
21. BCE 和
【详解】I(1)①是28号元素,根据原子核外电子排布规律可知,基态的核外电子排布式为;
故答案为:。
②中与之间形成配位键,中N、H之间形成键,是键,属于共价键;
故答案为:BCE。
Ⅱ(2)丁二酮肟分子中甲基上碳原子价电子对个数是4,且不含孤电子对,为杂化,连接甲基的碳原子含有3个价电子对,且不含孤电子对,为杂化;丁二酮肟分子中含有13个单键和2个双键,则共含有15个键,所以丁二酮肟含有键的数目为;
故答案为:和;。
(3)中与形成配位键,空间结构为四面体形,其结构示意图为;
故答案为:。
22. (1)ab 为极性分子,为非极性分子 易与分子间形成氢键且和均为极性分子 -1 键为非极性键,键为极性键,且电负性:,共用电子对偏向氧,故氧元素显-1价
【详解】(1)a. 在中键为极性键,该分子中有极性键, a正确;
b. 在中键为非极性键;该分子中有非极性键,b正确;
c. 中O原子价层电子对数为4,O原子为杂化,c错误;
d. 为极性分子,d错误;
故答案选ab;
(2)中含有键,故分子间能形成氢键,表示为;
(3)为极性分子,为非极性分子,根据“相似相溶”规律知,难溶于;
(4)和均为极性分子,且与分子之间易形成氢键,因此易溶于水;
(5)共用电子对的偏移决定元素在化合物中的化合价,键为非极性键,键为极性键,且电负性:,共用电子对偏向氧,故氧元素显-1价。
23.(1) C的生成:3HgO + HgBr2+ 2NH4Br=2Hg2NHBr2 + 3H2O D的生成:2Hg2+ + 4NH3+ Br -+ H2O=Hg2NBr·H 2O+ 3
(2)
(3)
(4) 或 [Hg3(NH)2Br]+ Hg2+和Br- 1:3
(5)或
(6)()(Hg2N+)(F-)2
【详解】(1)C中汞离子、亚氨基和Br-的比例为2:1:2,则化合物C为Hg2NHBr2,反应生成C的化学方程式为3HgO + HgBr2+2NH4Br=2Hg2NHBr2 + 3H2O;D是一水合溴氮化汞,则反应生成D的化学方程式为2Hg2+ + 4NH3+ Br -+ H2O → Hg2NBr·H 2O+ 3;
(2)A中,Br-作简单立方堆积,两个立方体共用的面中心存在一个Hg(II),NH3位于立方体的体心,则A的结构示意图(NH3以N表示)为;
(3)B中,Hg(II)与氨基形成一维链,其结构示意图为;
(4)C中存在Hg(II)与亚氨基形成的按六边形扩展的二维结构,Br-位于六边形中心,则其二维层的结构示意图为或;取其中一个六边形,含6个亚氨基,6个Hg(II),每个亚氨基为3个六边形共用,则该六边形有个亚氨基,每个Hg(II)为2个六边形共用,则该六边形有个Hg(II),因此C的组成式为[Hg3(NH)2Br]+;层间还存在Hg2+和Br-;其比例为1:3;
(5)D中,(Hg2N)+形成具有类似SiO2的三维结构,其示意图为或;
(6)HgNH2F结构特点的结构简式为()(Hg2N+)(F-)2。
答案第1页,共2页
答案第1页,共2页
