3.4.4羧酸+羧酸的衍生物——酰胺课件2022-2023学年高二化学人教版(2019)选择性必修3(共20张PPT)
文档属性
| 名称 | 3.4.4羧酸+羧酸的衍生物——酰胺课件2022-2023学年高二化学人教版(2019)选择性必修3(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-09 17:33:08 | ||
图片预览





文档简介
(共20张PPT)
该作品属于《WJ化学研究院》原创,如有需要请
通过wj-chem@与我联系

选择性必修三 第三章 第四节 羧酸 羧酸的衍生物
第4学时 酰胺
WJ化学研究院
第三章
Institute of Chemistry
2023
学习目标
原创:WJ化学研究院
邮箱wj-chem@
1、了解胺、酰胺的结构特点、主要性质及其应用。培养“宏观辨识与微观探析”的核心素养;
一、引入
原创:WJ化学研究院
邮箱wj-chem@
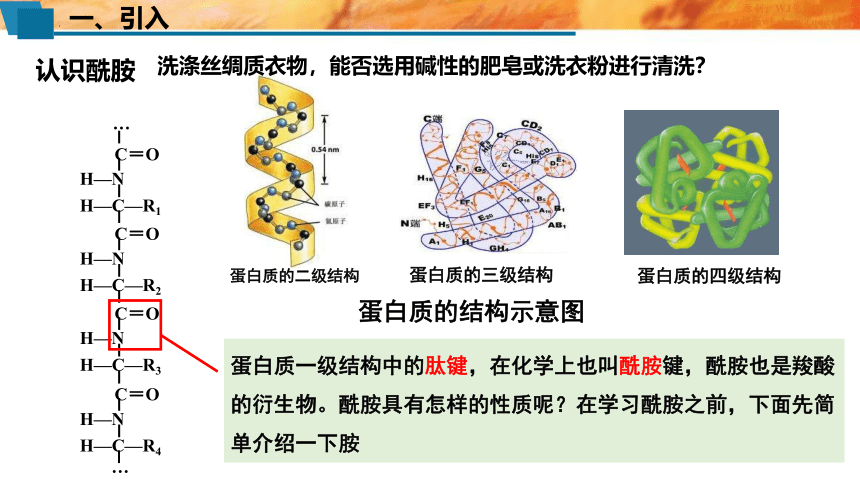
认识酰胺
蛋白质一级结构中的肽键,在化学上也叫酰胺键,酰胺也是羧酸的衍生物。酰胺具有怎样的性质呢?在学习酰胺之前,下面先简单介绍一下胺
…
C=O
H—N
H—C—R1
C=O
H—N
H—C—R2
C=O
H—N
H—C—R3
C=O
H—N
H—C—R4
…
蛋白质的结构示意图
蛋白质的三级结构
蛋白质的二级结构
蛋白质的四级结构
洗涤丝绸质衣物,能否选用碱性的肥皂或洗衣粉进行清洗?
一、引入
原创:WJ化学研究院
邮箱wj-chem@
烟酰胺(维生素B3)的美白功效一直以来都广受好评,烟酰胺的结构简式如图
羧酸分子 中羧基去掉羟基后剩余部分为酰基
R—C—OH
O
=
R—C—OR’
O
=
酯
R—C—X
O
=
酰卤
R—C—NH2
O
=
酰胺
R—C—
O
=
R—C-O-
O
=
C—R
O
=
酸酐
酰胺基
二、胺--概念
原创:WJ化学研究院
邮箱wj-chem@
1、胺
烃基取代氨分子中的氢原子而形成的化合物。
通式:R—NH2
胺也可以看作烃分子中的氢原子被氨基所替代的化合物
或取代的氨基(-NRR’)(R和R’可以是氢原子或烃基)
官能团:
氨基—NH2
注意:
“氨”“铵”“胺”的区别
氨(ān)指氨气(NH3);
铵(ǎn)一般出现在铵盐中;
胺(àn)是指一类含氨基(-NH2)的有机物。
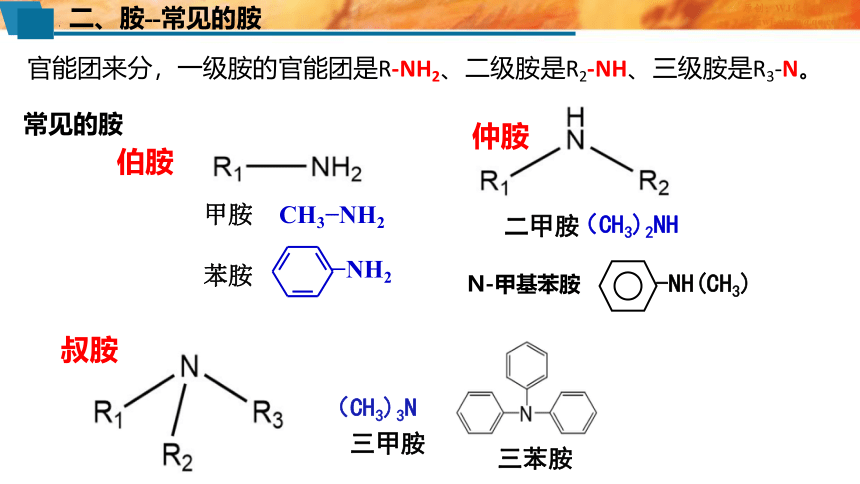
二、胺--常见的胺
原创:WJ化学研究院
邮箱wj-chem@
常见的胺
CH3 NH2
甲胺
苯胺
NH2
(CH3)2NH
二甲胺
-NH(CH3)
N-甲基苯胺
伯胺
仲胺
叔胺
(CH3)3N
三甲胺
三苯胺
官能团来分,一级胺的官能团是R-NH2、二级胺是R2-NH、三级胺是R3-N。
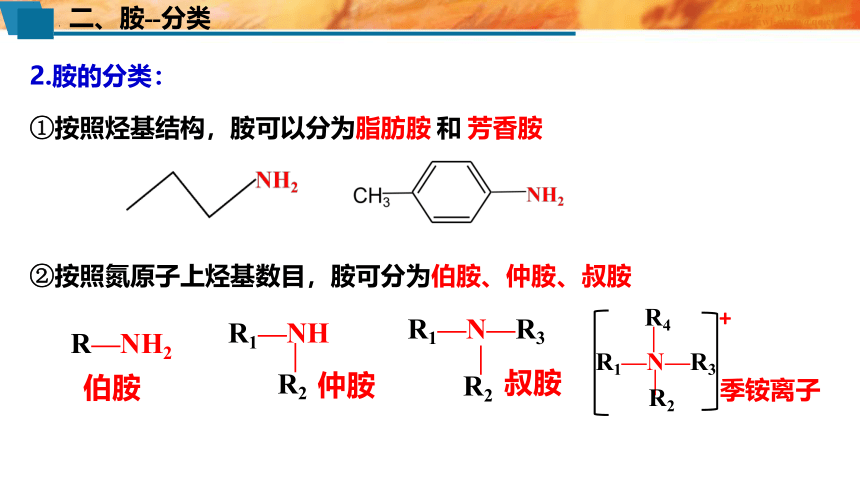
二、胺--分类
原创:WJ化学研究院
邮箱wj-chem@
2.胺的分类:
①按照烃基结构,胺可以分为脂肪胺 和 芳香胺
②按照氮原子上烃基数目,胺可分为伯胺、仲胺、叔胺
R—NH2
R1—NH
—
R2
R1—N—R3
—
R2
伯胺
叔胺
仲胺
R1—N—R3
—
R2
—
R4
+
季铵离子
三、胺--物理性质与用途
原创:WJ化学研究院
邮箱wj-chem@
①低级胺是气体或易挥发液体,气味与氨相似,
高级胺为固体,胺的沸点比相对分子质量相近的烃高,但比醇和羧酸的沸点低。
②胺都能与水分子形成氢键,低级胺易溶于水,
随碳原子数增加,胺的溶解度迅速降低,6个碳以上的胺难就溶于水。
③芳香胺的毒性很大,能致癌。
例如,甲胺和苯胺都是合成医药、农药和染料等的重要原料。
3.胺的物理性质(了解)
胺的用途很广,是重要的化工原料。
(3)用途:
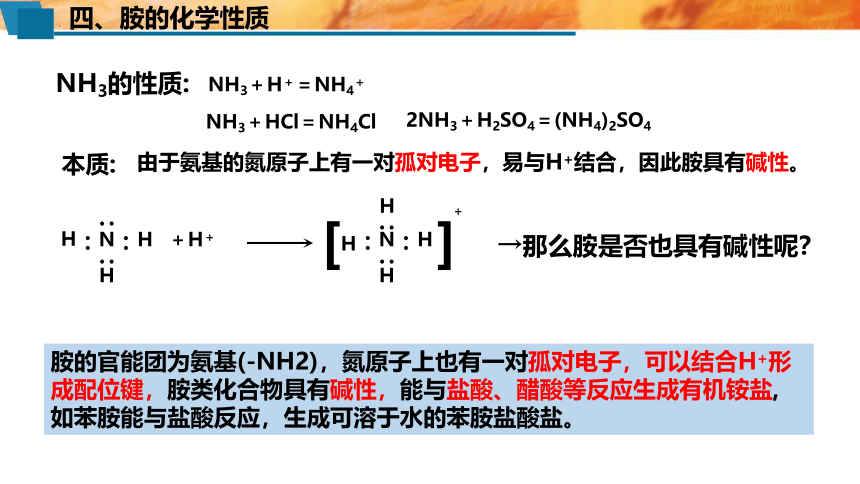
四、胺的化学性质
原创:WJ化学研究院
邮箱wj-chem@
NH3+HCl=NH4Cl
2NH3+H2SO4=(NH4)2SO4
NH3+H+=NH4+
本质:
+H+
N
H
H
H
N
H
H
H
H
[ ]
+
由于氨基的氮原子上有一对孤对电子,易与H+结合,因此胺具有碱性。
NH3的性质:
胺的官能团为氨基(-NH2),氮原子上也有一对孤对电子,可以结合H+形成配位键,胺类化合物具有碱性,能与盐酸、醋酸等反应生成有机铵盐,
如苯胺能与盐酸反应,生成可溶于水的苯胺盐酸盐。
→那么胺是否也具有碱性呢?
四、胺的化学性质
原创:WJ化学研究院
邮箱wj-chem@
胺类化合物具有碱性,可与强酸反应生成有机铵盐.
CH3-NH2+HCl
(CH3)2NH+HCl
(CH3)3N+HCl
(苯胺盐酸盐)
如,苯胺与盐酸反应的化学方程式
+HCl
迁移练习:完成下列反应
CH3-NH3Cl 或 CH3NH2·HCl
(CH3)2NH2Cl 或 (CH3)2NH·HCl
(CH3)3NHCl 或 (CH3)3N·HCl
五、酰胺--概念
原创:WJ化学研究院
邮箱wj-chem@
酰胺是羧酸分子中羟基被氨基所替代得到的化合物。
被取代的氨基(-NH2或-NHR或-NRR')
酰胺基
乙酰胺
苯甲酰胺
N,N 二甲基甲酰胺
常见酰胺
酰胺的命名:
酰基名称+某胺
1、酰胺概念
六、酰胺的物理性质与用途
原创:WJ化学研究院
邮箱wj-chem@
(1)通常甲酰胺为液体,其它酰胺多为无色晶体,因为酰胺分子之间能形成氢键,其熔、沸点一般较高。
(2)低级酰胺易溶于水,随碳原子数增加,酰胺的溶解度逐渐减小。
酰胺常被用作溶剂和化工原料,N,N-二甲基甲酰胺是良好的溶剂,可以溶解很多有机化合物和无机化合物,是生产多种化学纤维的溶剂,也用于合成农药、医药等
注意:—NH2和—CONH2都是亲水基团,与水分子间能形成氢键,
故低级胺、酰胺都能溶于水。
2、物理性质
3、用途
七、酰胺的化学性质——酰胺的水解反应(取代反应)
原创:WJ化学研究院
邮箱wj-chem@
①酰胺的水解反应(取代反应)
酰胺在酸或碱存在并加热的条件下可以发生水解反应。
RCONH2 + NaOH RCOONa + NH3↑
如果水解时加入碱,生成的酸就会变成盐,同时有氨气逸出。
H-OH
R-C-NH2
O
=
+
R-C-OH
O
=
+
NH3
反应机理:
①与HCl溶液反应:
②与NaOH溶液反应:
RCONH2 + H2O + HCl RCOOH + NH4Cl
RCONH2+H2O+HCl RCOOH+NH4Cl
RCONH2+NaOH RCOONa+NH3↑
七、酰胺的化学性质——酰胺的水解反应(取代反应)
原创:WJ化学研究院
邮箱wj-chem@
写出苯甲酰胺加入HCl、NaOH水解时的化学方程式:
思考:尿素H2NCONH2的水解产物是什么?
NH2—C—NH2+2H2O H2CO3+2NH3
O
催化剂
△
×
CO2+H2O
NH2—C—NH2+H2O CO2+2NH3
O
催化剂
△
酸性水解:
CO2+NH4Cl
碱性水解:
Na2CO3+2NH3
八、综合对比
原创:WJ化学研究院
邮箱wj-chem@
对比分析 氨 胺 酰胺 铵盐
组成元素
结构特点
化学性质
用途
NH3
三角锥形分子
N、H
C、N、H
C、O、N、H
N、H及其他元素
含有氨基
R-NH2
含有酰胺基
R
C
O
NH2
NH4+
具有碱性,
与酸反应生成铵盐
具有碱性,
与酸反应生成盐
水解反应:酸性时生成羧酸与铵盐,碱性时生成羧酸盐和NH3
受热易分解,与碱共热生成盐和NH3
制冷剂,生产硝酸和尿素
合成医药、
农药和染料
溶剂和化工原料
生产化肥和炸药
九、应用
原创:WJ化学研究院
邮箱wj-chem@
1.烟酰胺分子中含有的含氧官能团是什么?
2.烟酰胺在酸性条件下水解产物是什么?
提示:烟酰胺在酸性条件下水解生成 和铵盐。
3.烟酰胺在碱性条件下水解产物是什么?
提示:酰胺在碱性条件下水解生成羧酸盐和氨气。
提示:酰胺基( )。
烟酰胺
维生素B3
思考与讨论
九、应用
原创:WJ化学研究院
邮箱wj-chem@
洗涤丝绸质衣物,能否选用肥皂或洗衣粉进行清洗?为什么?
【提示】丝绸本质上是蛋白质,里面含有肽键,即酰胺键。肥皂或洗衣粉水溶液呈碱性,在碱性条件下,酰胺键易水解。所以洗涤丝绸,不能用肥皂或洗衣粉(pH约为 10),最好用洗发水(pH值大多在5.9左右)。
思考与讨论
九、应用
原创:WJ化学研究院
邮箱wj-chem@
思考与讨论
1.甲胺与乙酰胺分子中均有—NH2,二者互为同系物吗?为什么?
2.酰胺与酯类化学性质有什么相似性?
提示:不是。因为二者不是同类物质,结构不相似,且不相差若干个CH2。
提示: 二者均可以在酸性、碱性条件下发生水解反应。
练习:食品中含有过量的丙烯酰胺( )可能引起令人不安的食品安全问题。下列关于丙烯酰胺的叙述不正确的是( )
A.既属于酰胺类又属于烯烃 B.能发生加聚反应生成高分子
C.能在酸或碱中发生水解 D.能与氢气发生加成反应
A
十、课堂练习
原创:WJ化学研究院
邮箱wj-chem@
已知有机物的结构简式如图所示,下列说法错误的是
A.存在官能团酰胺键
B.分子中所有碳原子不可能共平面
C.一氯代物有10种
D.酸性条件下完全水解能得到3种有机物
C
12种
十一、酰胺的用途
原创:WJ化学研究院
邮箱wj-chem@
酰胺的用途
P79
该作品属于《WJ化学研究院》原创,如有需要请
通过wj-chem@与我联系

选择性必修三 第三章 第四节 羧酸 羧酸的衍生物
第4学时 酰胺
WJ化学研究院
第三章
Institute of Chemistry
2023
学习目标
原创:WJ化学研究院
邮箱wj-chem@
1、了解胺、酰胺的结构特点、主要性质及其应用。培养“宏观辨识与微观探析”的核心素养;
一、引入
原创:WJ化学研究院
邮箱wj-chem@
认识酰胺
蛋白质一级结构中的肽键,在化学上也叫酰胺键,酰胺也是羧酸的衍生物。酰胺具有怎样的性质呢?在学习酰胺之前,下面先简单介绍一下胺
…
C=O
H—N
H—C—R1
C=O
H—N
H—C—R2
C=O
H—N
H—C—R3
C=O
H—N
H—C—R4
…
蛋白质的结构示意图
蛋白质的三级结构
蛋白质的二级结构
蛋白质的四级结构
洗涤丝绸质衣物,能否选用碱性的肥皂或洗衣粉进行清洗?
一、引入
原创:WJ化学研究院
邮箱wj-chem@
烟酰胺(维生素B3)的美白功效一直以来都广受好评,烟酰胺的结构简式如图
羧酸分子 中羧基去掉羟基后剩余部分为酰基
R—C—OH
O
=
R—C—OR’
O
=
酯
R—C—X
O
=
酰卤
R—C—NH2
O
=
酰胺
R—C—
O
=
R—C-O-
O
=
C—R
O
=
酸酐
酰胺基
二、胺--概念
原创:WJ化学研究院
邮箱wj-chem@
1、胺
烃基取代氨分子中的氢原子而形成的化合物。
通式:R—NH2
胺也可以看作烃分子中的氢原子被氨基所替代的化合物
或取代的氨基(-NRR’)(R和R’可以是氢原子或烃基)
官能团:
氨基—NH2
注意:
“氨”“铵”“胺”的区别
氨(ān)指氨气(NH3);
铵(ǎn)一般出现在铵盐中;
胺(àn)是指一类含氨基(-NH2)的有机物。
二、胺--常见的胺
原创:WJ化学研究院
邮箱wj-chem@
常见的胺
CH3 NH2
甲胺
苯胺
NH2
(CH3)2NH
二甲胺
-NH(CH3)
N-甲基苯胺
伯胺
仲胺
叔胺
(CH3)3N
三甲胺
三苯胺
官能团来分,一级胺的官能团是R-NH2、二级胺是R2-NH、三级胺是R3-N。
二、胺--分类
原创:WJ化学研究院
邮箱wj-chem@
2.胺的分类:
①按照烃基结构,胺可以分为脂肪胺 和 芳香胺
②按照氮原子上烃基数目,胺可分为伯胺、仲胺、叔胺
R—NH2
R1—NH
—
R2
R1—N—R3
—
R2
伯胺
叔胺
仲胺
R1—N—R3
—
R2
—
R4
+
季铵离子
三、胺--物理性质与用途
原创:WJ化学研究院
邮箱wj-chem@
①低级胺是气体或易挥发液体,气味与氨相似,
高级胺为固体,胺的沸点比相对分子质量相近的烃高,但比醇和羧酸的沸点低。
②胺都能与水分子形成氢键,低级胺易溶于水,
随碳原子数增加,胺的溶解度迅速降低,6个碳以上的胺难就溶于水。
③芳香胺的毒性很大,能致癌。
例如,甲胺和苯胺都是合成医药、农药和染料等的重要原料。
3.胺的物理性质(了解)
胺的用途很广,是重要的化工原料。
(3)用途:
四、胺的化学性质
原创:WJ化学研究院
邮箱wj-chem@
NH3+HCl=NH4Cl
2NH3+H2SO4=(NH4)2SO4
NH3+H+=NH4+
本质:
+H+
N
H
H
H
N
H
H
H
H
[ ]
+
由于氨基的氮原子上有一对孤对电子,易与H+结合,因此胺具有碱性。
NH3的性质:
胺的官能团为氨基(-NH2),氮原子上也有一对孤对电子,可以结合H+形成配位键,胺类化合物具有碱性,能与盐酸、醋酸等反应生成有机铵盐,
如苯胺能与盐酸反应,生成可溶于水的苯胺盐酸盐。
→那么胺是否也具有碱性呢?
四、胺的化学性质
原创:WJ化学研究院
邮箱wj-chem@
胺类化合物具有碱性,可与强酸反应生成有机铵盐.
CH3-NH2+HCl
(CH3)2NH+HCl
(CH3)3N+HCl
(苯胺盐酸盐)
如,苯胺与盐酸反应的化学方程式
+HCl
迁移练习:完成下列反应
CH3-NH3Cl 或 CH3NH2·HCl
(CH3)2NH2Cl 或 (CH3)2NH·HCl
(CH3)3NHCl 或 (CH3)3N·HCl
五、酰胺--概念
原创:WJ化学研究院
邮箱wj-chem@
酰胺是羧酸分子中羟基被氨基所替代得到的化合物。
被取代的氨基(-NH2或-NHR或-NRR')
酰胺基
乙酰胺
苯甲酰胺
N,N 二甲基甲酰胺
常见酰胺
酰胺的命名:
酰基名称+某胺
1、酰胺概念
六、酰胺的物理性质与用途
原创:WJ化学研究院
邮箱wj-chem@
(1)通常甲酰胺为液体,其它酰胺多为无色晶体,因为酰胺分子之间能形成氢键,其熔、沸点一般较高。
(2)低级酰胺易溶于水,随碳原子数增加,酰胺的溶解度逐渐减小。
酰胺常被用作溶剂和化工原料,N,N-二甲基甲酰胺是良好的溶剂,可以溶解很多有机化合物和无机化合物,是生产多种化学纤维的溶剂,也用于合成农药、医药等
注意:—NH2和—CONH2都是亲水基团,与水分子间能形成氢键,
故低级胺、酰胺都能溶于水。
2、物理性质
3、用途
七、酰胺的化学性质——酰胺的水解反应(取代反应)
原创:WJ化学研究院
邮箱wj-chem@
①酰胺的水解反应(取代反应)
酰胺在酸或碱存在并加热的条件下可以发生水解反应。
RCONH2 + NaOH RCOONa + NH3↑
如果水解时加入碱,生成的酸就会变成盐,同时有氨气逸出。
H-OH
R-C-NH2
O
=
+
R-C-OH
O
=
+
NH3
反应机理:
①与HCl溶液反应:
②与NaOH溶液反应:
RCONH2 + H2O + HCl RCOOH + NH4Cl
RCONH2+H2O+HCl RCOOH+NH4Cl
RCONH2+NaOH RCOONa+NH3↑
七、酰胺的化学性质——酰胺的水解反应(取代反应)
原创:WJ化学研究院
邮箱wj-chem@
写出苯甲酰胺加入HCl、NaOH水解时的化学方程式:
思考:尿素H2NCONH2的水解产物是什么?
NH2—C—NH2+2H2O H2CO3+2NH3
O
催化剂
△
×
CO2+H2O
NH2—C—NH2+H2O CO2+2NH3
O
催化剂
△
酸性水解:
CO2+NH4Cl
碱性水解:
Na2CO3+2NH3
八、综合对比
原创:WJ化学研究院
邮箱wj-chem@
对比分析 氨 胺 酰胺 铵盐
组成元素
结构特点
化学性质
用途
NH3
三角锥形分子
N、H
C、N、H
C、O、N、H
N、H及其他元素
含有氨基
R-NH2
含有酰胺基
R
C
O
NH2
NH4+
具有碱性,
与酸反应生成铵盐
具有碱性,
与酸反应生成盐
水解反应:酸性时生成羧酸与铵盐,碱性时生成羧酸盐和NH3
受热易分解,与碱共热生成盐和NH3
制冷剂,生产硝酸和尿素
合成医药、
农药和染料
溶剂和化工原料
生产化肥和炸药
九、应用
原创:WJ化学研究院
邮箱wj-chem@
1.烟酰胺分子中含有的含氧官能团是什么?
2.烟酰胺在酸性条件下水解产物是什么?
提示:烟酰胺在酸性条件下水解生成 和铵盐。
3.烟酰胺在碱性条件下水解产物是什么?
提示:酰胺在碱性条件下水解生成羧酸盐和氨气。
提示:酰胺基( )。
烟酰胺
维生素B3
思考与讨论
九、应用
原创:WJ化学研究院
邮箱wj-chem@
洗涤丝绸质衣物,能否选用肥皂或洗衣粉进行清洗?为什么?
【提示】丝绸本质上是蛋白质,里面含有肽键,即酰胺键。肥皂或洗衣粉水溶液呈碱性,在碱性条件下,酰胺键易水解。所以洗涤丝绸,不能用肥皂或洗衣粉(pH约为 10),最好用洗发水(pH值大多在5.9左右)。
思考与讨论
九、应用
原创:WJ化学研究院
邮箱wj-chem@
思考与讨论
1.甲胺与乙酰胺分子中均有—NH2,二者互为同系物吗?为什么?
2.酰胺与酯类化学性质有什么相似性?
提示:不是。因为二者不是同类物质,结构不相似,且不相差若干个CH2。
提示: 二者均可以在酸性、碱性条件下发生水解反应。
练习:食品中含有过量的丙烯酰胺( )可能引起令人不安的食品安全问题。下列关于丙烯酰胺的叙述不正确的是( )
A.既属于酰胺类又属于烯烃 B.能发生加聚反应生成高分子
C.能在酸或碱中发生水解 D.能与氢气发生加成反应
A
十、课堂练习
原创:WJ化学研究院
邮箱wj-chem@
已知有机物的结构简式如图所示,下列说法错误的是
A.存在官能团酰胺键
B.分子中所有碳原子不可能共平面
C.一氯代物有10种
D.酸性条件下完全水解能得到3种有机物
C
12种
十一、酰胺的用途
原创:WJ化学研究院
邮箱wj-chem@
酰胺的用途
P79
