第1章《原子结构元素周期律》同步练习(含解析)2022-2023学年下学期高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章《原子结构元素周期律》同步练习(含解析)2022-2023学年下学期高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 215.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-11 08:23:33 | ||
图片预览



文档简介
第1章《原子结构 元素周期律》同步练习
一、单选题
1.短周期主族元素W、X、Y、Z的原子序数依次增大,W在大气中有两种同素异形体且均能支持燃烧,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是( )
A.Y、Z元素的简单氢化物稳定性Y>Z B.ZW2、X2W2都能使品红溶液褪色,且褪色原理相同
C.X、W、Z能形成具有强氧化性的XZW D.X2YW3的水溶液显碱性
2.下列各项中所列举的物质与所属类别对应不正确的是
A.酸性氧化物:CO2、SO2、SiO2、Cl2O7
B.非电解质:蔗糖、四氯化碳、氨气、氯气
C.同素异形体:石墨与金刚石、单斜硫与斜方硫
D.混合物:铝热剂、纯净矿泉水、水玻璃、焦炉气
3.下列有关同主族元素从上到下原子结构和性质的说法正确的是( )
A.电子层数递增,最外层电子数递增
B.原子半径逐渐增大,得电子能力逐渐增强
C.单质的密度逐渐增大,熔沸点逐渐升高
D.最高价氧化物的水化物酸性逐渐减弱,碱性逐渐增强
4.根据元素周期表和元素周期律推断,下列说法正确的是
A.Cl2的氧化性比Br2弱 B.硼原子失电子能力比铝强
C.磷酸的酸性比砷酸强 D.氢氧化锶的碱性比氢氧化钙弱
5.下列物质性质与应用对应关系正确的是
A.二氧化硅能与氢氟酸反应,可用于制光导纤维
B.浓硫酸具有脱水性,可用于干燥氯气
C.漂白粉在空气中不稳定,可用于漂白纸张
D.氧化铝熔点很高,可用于制耐火材料
6.下列对科学家的相关成果的说法正确的是( )
A.屠呦呦发现抗疟新药青蒿素(C15H22O5),青蒿素属于烃类
B.闵恩泽研发重油裂解的催化剂,催化裂解可以获得很多重要的化工原料
C.凯库勒研究了苯环的结构,苯环是碳碳单键和碳碳双键交替的结构
D.门捷列夫提出元素周期律,元素周期律指元素的性质随相对原子质量的递增而呈周期性的变化
7.由下列实验操作和现象能得出相应结论的是
选项 实验操作 实验现象 实验结论
A 向某溶液中滴加溶液 产生白色沉淀 该溶液中含
B 向水玻璃中通入少量 产生白色胶状沉淀 的非金属性比的强
C 用坩埚钳夹持铝箔在火焰上加热 铝箔熔化,外边有膜兜住而不滴落 氧化铝的熔点比铝的熔点高
D 向蔗糖中加入适量浓硫酸,搅拌 产生黑色“面包” 浓硫酸具有吸水性
A.A B.B C.C D.D
8.部分含硫物质的分类与相应硫元素的化合价关系如图所示。下列说法正确的是
A.a的稳定性弱于水 B.S在氧气中燃烧可生成c
C.a、b都可用d的浓溶液干燥 D.常温下,d的浓溶液与Fe反应可生成H2
9.下列有关化学用语正确的是
A.硫化钠电子式 B.Cl-的结构示意图
C.CO2的电子式 D.中子数为18的氯原子符号
10.新中国成立70年来,我国在载人飞船、北斗卫星、高铁、5G技术等领域取得了举世瞩目的成就。它们均与化学有着密切联系。下列说法正确的是
A.国庆阅兵中出现的直-20直升机使用了大量的新型材料,其中锂铝合金属于金属材料
B.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料,其主要成分是硅酸盐
C.截止2019年11月我国光缆线路总长超过三千万公里,光纤的主要成分是碳化硅
D.我国2020年发射的首颗火星探测器,其太阳能电池帆板的材料是二氧化硅
11.下列递变规律不正确的是
A.Na、Mg、Al还原性依次减弱
B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高
12.、、为原子序数依次增大的短周期元素,原子的最外层电子数是其电子层数的3倍。、在同一主族,且、均与相邻。下列说法正确的是
A.非金属性:
B.元素最高价氧化物对应水化物属于强酸
C.简单氢化物的稳定性:
D.简单离子半径:
13.在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是
A.34S原子核内中子数为16 B.16O2比18O2沸点更低
C.2H+的酸性比1H+的酸性更强 D.13C和15N原子核内的质子数相差2
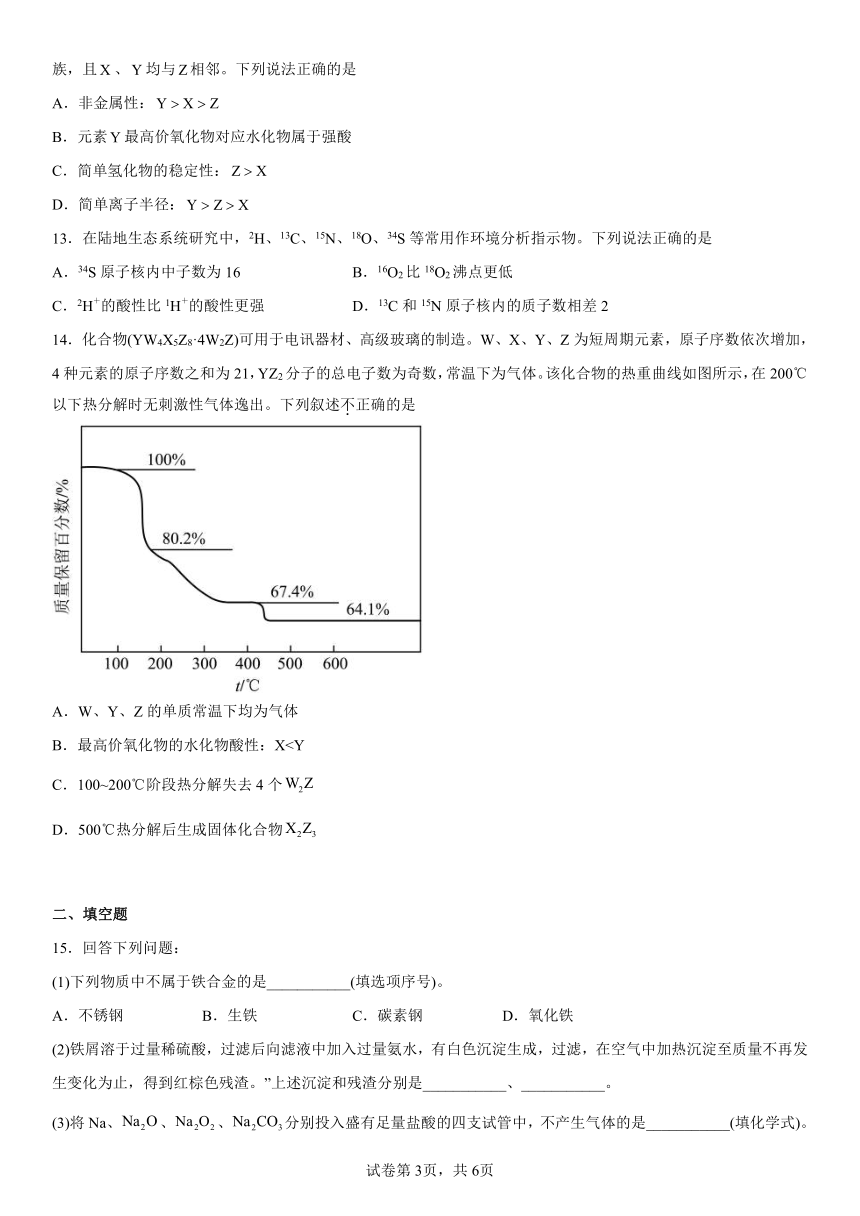
14.化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,4种元素的原子序数之和为21,YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200℃以下热分解时无刺激性气体逸出。下列叙述不正确的是
A.W、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物酸性:XC.100~200℃阶段热分解失去4个
D.500℃热分解后生成固体化合物
二、填空题
15.回答下列问题:
(1)下列物质中不属于铁合金的是___________(填选项序号)。
A.不锈钢 B.生铁 C.碳素钢 D.氧化铁
(2)铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣。”上述沉淀和残渣分别是___________、___________。
(3)将Na、、、分别投入盛有足量盐酸的四支试管中,不产生气体的是___________(填化学式)。
(4)HClO的结构式为___________。
(5)已知质量数为A的某阳离子Rn+,核外有X个电子,则核内中子数为___________。
16.NaOH被大量用于制皂、造纸和纺织品生产。回答下列问题。
(1)Na元素位于元素周期表的第_______周期第IA族。
(2)Na元素位于第IA族H元素下方,H的原子半径比Na的 _______(填“大”或“小”)。
(3)NaOH所含的两种非金属元素中,非金属性较强的是_______(填“H”或“O”)。
(4)Na的最高价氧化物的化学式为_______。
17.周期表中,F、Cl、Br这3种元素的气态氢化物的热稳定性由强至弱的顺序依次为___________(用化学式表示)。与Cl元素同周期的所有金属元素的最高价氧化物对应的水化物的碱性由强至弱的顺序依次为___________ (用化学式表示)。
18.(1)磁铁矿的主要成分是_______;
(2)钾云母的化学式是K2H4Al6Si6O24,以氧化物形式可表示为_________________________;
(3)向FeSO4溶液中滴加NaOH溶液,实验现象是__________________________________;
(4)高温分解碳酸钙,选择合适的坩埚_____(A.瓷坩埚 B.铁坩埚 C.氧化铝坩埚)
(5)生产玻璃的原料有_________、________、石灰石
(6)用于太阳能电池板,进行光电转化的重要半导体材料,其主要成分是________,
(7)写出一种和氯水漂白原理相同的物质______。
19.完成下列各题。
(1)制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为__________________。
(2)如果胃酸过多,可服用______________(填写化学式)缓解症状,但如果患有胃溃疡,则不能服用,以防止胃穿孔。
(3)雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的,这一过程中发生反应的化学方程式为______________。
(4)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂,工业上是用氯酸钠(NaClO3)与盐酸反应生产ClO2的,反应过程中同时会生成氯气。写出该反应的化学方程式____________。
20.氮化硅()可由石英与焦炭在高温的氮气流中通过以下反应制备:
(1)请写出氮化硅中氮元素的化合价__,以及以上反应中的氧化剂和还原剂__、____。
(2)若该反应生成11.2L一氧化碳(标准状况),则生成氮化硅的质量是________。
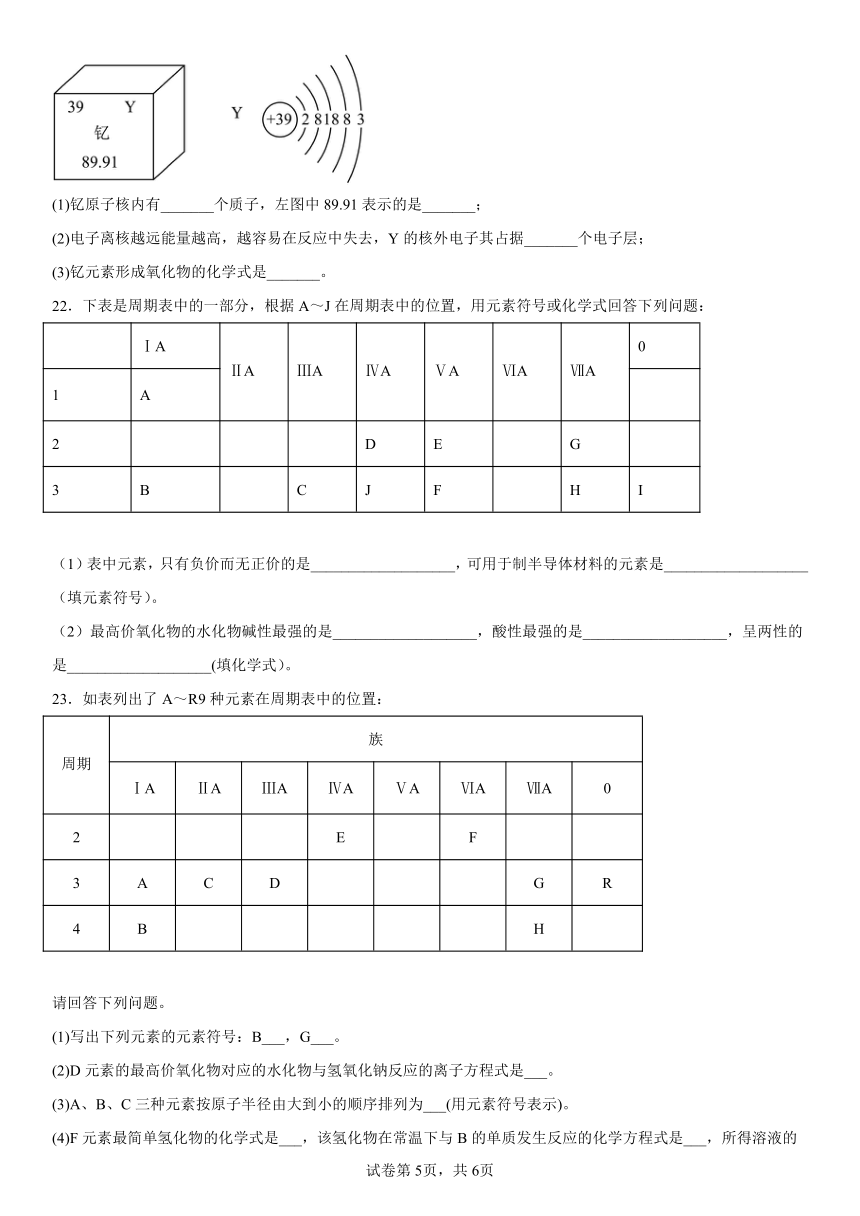
21.新疆也要建造磁悬浮列车了。在磁悬浮列车制造过程中将使用大量含钇(Y)元素的超导材料。钇(Y)元素在元素周期表中的信息如图所示:
(1)钇原子核内有_______个质子,左图中89.91表示的是_______;
(2)电子离核越远能量越高,越容易在反应中失去,Y的核外电子其占据_______个电子层;
(3)钇元素形成氧化物的化学式是_______。
22.下表是周期表中的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 A
2 D E G
3 B C J F H I
(1)表中元素,只有负价而无正价的是___________________,可用于制半导体材料的元素是___________________(填元素符号)。
(2)最高价氧化物的水化物碱性最强的是___________________,酸性最强的是___________________,呈两性的是___________________(填化学式)。
23.如表列出了A~R9种元素在周期表中的位置:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 E F
3 A C D G R
4 B H
请回答下列问题。
(1)写出下列元素的元素符号:B___,G___。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为___(用元素符号表示)。
(4)F元素最简单氢化物的化学式是___,该氢化物在常温下与B的单质发生反应的化学方程式是___,所得溶液的pH___(填“>”、“<”或“=”)7。
(5)H元素与A元素形成的化合物的化学式是___,高温灼烧该化合物时,火焰呈___色。
24.已知单质碘受热易升华(固体变为气体)。可用于分离或提纯物质的方法有:
A.过滤B.加热升华C.加热分解D.洗气法
下列各组混合物的分离或提纯应选用上述哪种方法最合适(填对应字母)?
(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒:___________。
(2)除去O2中少量的水蒸气:___________。
(3)除去固体碘中混有的少量NaI:___________。
(4)除去氧化钙中的CaCO3:___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【分析】W在大气中有两种同素异形体且均能支持燃烧,W为O元素;X的原子半径是所有短周期主族元素中最大的,X为Na元素;短周期主族元素 W、X、Y、Z的原子序数依次增大,非金属元素Y的原子序数是Z的最外层电子数的 2 倍,则Y为Si、Z为Cl元素。
【详解】根据分析可知,W为O,X为Na,Y为Si,Z为Cl元素。
A.非金属性Si<Cl,则Y、Z的氢化物的稳定性Si(Y)<Cl(Z),故A错误;
B.ClO2、Na2O2都能使品红溶液褪色,因为两种物质都具有强氧化性,褪色原理相同,故B正确;
C.X(Na)、W(O)、Z(Cl)形成的化合物NaClO具有强氧化性,故C正确;
D.Na2SiO3属于强碱弱酸盐,水解后水溶液显碱性,故D正确;
故选A。
【点睛】本题考查原子结构与元素周期律的应用,推断元素为解答关键,注意掌握元素周期律内容及常见元素化合物性质,试题侧重考查学生的分析能力及灵活应用基础知识的能力,难点B,ClO2、Na2O2都能使品红溶液褪色,因为两种物质都具有强氧化性。
2.B
【详解】A、CO2、SO2、SiO2、Cl2O7都能与碱反应生成盐和水,为酸性氧化物,A项正确;
B、非电解质属于化合物,氯气为单质,不属于非电解质,B项错误;
C、石墨与金刚石、单斜硫与斜方硫,都是由同种元素形成的不同单质,为同素异形体,C项正确;
D、铝热剂、纯净矿泉水、水玻璃、焦炉气都含有多种成分,为混合物,D项正确;
本题答案选B。
3.D
【详解】A.同主族元素从上到下,原子的最外层电子数相同,故A错误;
B.原子半径逐渐增大,原子核对最外层电子的吸引力逐渐减弱,因此原子的得电子能力逐渐减弱,失电子能力逐渐增强,故B错误;
C.单质的密度逐渐增大,但有特例,而熔沸点变化不一致,如碱金属单质的熔沸点逐渐降低,卤素单质的熔沸点逐渐升高,故C错误;
D.从上到下,金属性逐渐增强,最高价氧化物的水化物的碱性逐渐增强,从上到下,非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,故D正确。
综上所述,答案为D。
4.C
【详解】A.Cl、Br为同一主族的元素,原子核外电子层越多,元素的非金属性越弱,单质的氧化性就越弱,由于元素的非金属性Cl>Br,所以Cl2的氧化性比Br2强,A错误;
B.B、Al同一主族且电子层增多,元素的金属性B<Al,则硼原子失电子能力比铝弱,B错误;
C.P、As同一主族且电子层增多,元素的非金属性P>As,则磷酸的酸性比砷酸强,C正确;
D.Ca、Sr同一主族且电子层增多,元素的金属性Sr>Ca,则氢氧化锶的碱性比氢氧化钙弱强,D错误;
故合理选项是C。
5.D
【详解】试题分析:A.二氧化硅能与氢氟酸反应与可用于制光导纤维没有关系,A错误;B.浓硫酸具有吸水性,可用于干燥氯气,B错误;C.漂白粉具有强氧化性,可用于漂白纸张,C错误;D.氧化铝熔点很高,可用于制耐火材料,D正确,答案选D。
考点:考查物质性质应用的有关判断
6.B
【详解】A.青蒿素(C15H22O5)中含有O元素,则青蒿素属于烃的衍生物,A错误;
B.重油裂解的催化剂可以获得乙烯等很多重要的化工原料,B正确;
C. 凯库勒研究了苯环的结构,苯环不是碳碳单键和碳碳双键交替的结构,苯环的六个碳碳键完全相同,是介于单键和双键之间的特殊共价键,6个碳原子还共同形成一个大键,C错误;
D. 门捷列夫提出元素周期律,元素周期律指元素的性质随原子序数的递增而呈周期性的变化,D错误;
答案为B
7.C
【详解】A.氯化银、碳酸银等都是沉淀,向某溶液中滴加溶液,产生白色沉淀,该溶液中可能含、CO等,故A错误;
B.向水玻璃中通入少量,生成白色胶状硅酸沉淀,说明盐酸的酸性大于硅酸,盐酸是无氧酸,不能证明的非金属性比的强,故B错误;
C.用坩埚钳夹持铝箔在火焰上加热,铝表面被氧化,氧化铝的熔点比铝的熔点高,所以铝箔熔化,外边有膜兜住而不滴落,故C正确;
D.向蔗糖中加入适量浓硫酸,搅拌,产生黑色“面包”现象,浓硫酸具有脱水性,故D错误;
选C。
8.A
【分析】由价-类图可推知,a为H2S,b为SO2,c为SO3,d为H2SO4。
【详解】A.S的非金属性比O弱,所以a(H2S)的稳定性弱于水,A正确;
B.S在氧气中燃烧只能生成SO2,不能生成SO3,B错误;
C.a为H2S,具有较强的还原性,不能用浓硫酸干燥,C错误;
D.常温下,浓硫酸能使Fe发生钝化,不生成H2,D错误;
答案选A。
9.B
【详解】A.硫化钠由钠离子和硫离子构成,硫离子带2个单位负电荷,并且外围达到8电子结构,其电子式为 ,A错误;
B.Cl-的核电荷数为17,核外电子总数为18,其离子结构示意图为:,B正确;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为,C错误;
D.中子数为18的氯原子的质量数为18+17=35,所以符号为,D错误;
综上所述答案为B。
10.A
【详解】A.金属材料包括纯金属、合金、特种金属材料等,锂铝合金属于合金,为金属材料,故A正确;
B.硅酸盐材料传统无机非金属材料,高温结构陶瓷主要有氧化铝陶瓷、氮化硅陶瓷、氮化硼陶瓷,故B错误;
C.光纤的主要成分是二氧化硅,故C错误;
D.太阳能电池帆板的材料是单晶硅,不是二氧化硅,故D错误;
综上所述答案为A。
11.C
【详解】A.同一周期,从左到右金属性减弱,Na、Mg、Al金属性减弱,还原性依次减弱,A正确;
B.同一主族,从下到上,非金属性增强, I2、Br2、Cl2非金属增强,其单质的氧化性依次增强,B正确;
C.C、N、O同属于周期元素,核电荷数增大,原子半径依次减小,C错误;
D.P、S、Cl最高正价依次为+5、+6、+7,依次升高,D正确;
故选C。
12.D
【分析】短周期元素原子的最外层电子数是其电子层数的3倍,X是氧元素;、在同一主族,Z是硫元素;原子序数依次增大,、均与相邻,Y是磷元素。综上,、、元素分别是O、P、S。
【详解】A.非金属性:O>S>P,即X>Z>Y, A错误;
B.元素最高价氧化物对应水化物H3PO4属于弱酸,B错误;
C.单氢化物的稳定性:H2SD.简单离子半径:P3->S2->O2-,D正确;
故选D。
13.B
【详解】A、34S原子核内中子数为:34—16=18,错误;
B、16O2比18O2相对分子质量小,所以16O2比18O2范德华力小,故16O2比18O2沸点更低,正确;
C、2H+的酸性与1H+的酸性相同,错误;
D、13C原子核内的质子数为6,15N原子核内的质子数为7,相差1,错误。
14.C
【分析】YZ2分子的总电子数为奇数,常温下为气体,该气体应为NO2;Y为N元素,Z为O元素;在化合物(YW4X5Z8·4W2Z )中W2Z应为结晶水,则W为H元素;W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21,则X的核电外电子总数为21-1-7-8=5,则X为B元素。
【详解】A.根据分析,W、Y、Z分别为H、N、O,常温下H2、N2、O2均为气体,A正确;
B.同一周期从左到右非金属性依次增强,因此非金属性B<N,非金属性越强,最高价氧化物的水化物酸性越强,因此酸性H3BO3<HNO3,B正确;
C.化合物(YW4X5Z8·4W2Z )为NH4B5O8·4H2O,已知该200℃以下热分解时无刺激性气体逸出,说明失去的是结晶水,若100 ~ 200℃阶段热分解失去4个H2O,该化合物的化学式变为NH4B5O8,此时的质量保留百分数为,与图示曲线数据( 80.2% )不一致,说明100~200℃阶段不是失去4个H2O,C错误;
D.假设化合物NH4B5O8·4H2O在500℃热分解后生成固体化合物B2O3,根据硼元素守恒,则得到关系式2NH4B5O8·4H2O~5B2O3,则固体化合物B2O3质量分数为≈64.1%,与图象中的数据相符,说明假设正确,D正确;
故选C。
15.(1)D
(2)
(3)
(4)H-O-Cl
(5)A-X-n
【解析】(1)
合金是指一种金属中加热熔合其他金属或非金属而形成的具有金属特性的物质。不锈钢是铁的合金,生铁是含碳量为2%~4.3%的铁碳合金,碳素钢是含碳量低于2%,并有少量硅、锰以及磷、硫等杂质的铁碳合金,故A、B、C选项不符合题意;氧化铁是氧化物,属于纯净物,故D符合题意;
故选D。
(2)
铁屑溶于过量稀硫酸,反应生成硫酸亚铁,硫酸亚铁与过量氨水反应生成氢氧化亚铁白色沉淀,在空气中氢氧化亚铁容易被空气中的氧气氧化为氢氧化铁,氢氧化铁为红褐色沉淀,受热分解生成红棕色三氧化二铁,即上述沉淀和残渣分别是、,故答案为:;。
(3)
与盐酸反应生成氯化钠和氢气,与盐酸反应生成氯化钠、水和氧气,和盐酸反应生成氯化钠、水和二氧化碳,均有气体产生,和盐酸反应生成氯化钠和水,没有气体产生,则不产生气体的是,故答案为:。
(4)
HClO为共价化合物,O原子分别和H原子、Cl原子各共用一对电子,其结构式为H-O-Cl,故答案为:H-O-Cl。
(5)
阳离子Rn+,质量数为A,核外有X个电子,所以其质子数Z=X+n,由于中子数=质量数-质子数,故中子数=A-(X+n)= A-X-n,故答案为:A-X-n。
16.(1)三
(2)小
(3)O
(4)Na2O
【详解】(1)根据元素周期表的结构可知,Na元素位于第三周期第IA族;
故答案为:三;
(2)Na原子电子层数为3,H原子电子层数为1,因此H原子半径小于Na原子;
故答案为:小;
(3)NaOH中含两种非金属元素H、O,其中非金属性较强的是O;
故答案为:O;
(4)Na的最高价氧化物为Na2O;
故答案为:Na2O。
17. HF>HCl>HBr NaOH>Mg(OH)2>Al(OH)3
【详解】物质的非金属性越强,对应的氢化物稳定性越强,非金属性F>Cl>Br,气态氢化物的热稳定性由强至弱的顺序依次为HF>HCl>HBr;与Cl元素同周期的所有金属元素为Na、Mg、Al,同周期从左到右,元素的金属性逐渐减弱,对应的最高价氧化物对应的水化物的碱性逐渐减弱,则碱性由强至弱的顺序依次为NaOH>Mg(OH)2>Al(OH)3。
18. Fe3O4 K2O · 3Al2O3 · 6SiO2 · 2H2O 生成白色沉淀,迅速变成灰绿色,最终变成红褐色 B 纯碱 石英 硅 Na2O2或HClO、氯水、O3
【分析】(2)硅酸盐改写为氧化物形式,按照活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水的顺序书写,注意氧化物形式与盐中原子数目关系对应;
(3)FeSO4溶液中滴加NaOH溶液,FeSO4和NaOH发生复分解反应生成氢Fe(OH)2,Fe(OH)2不稳定,易被氧气氧化生成Fe(OH)3;
(4)根据高温分解碳酸钙生成氧化钙和二氧化碳,根据坩埚本身不能参与反应选择;
(7)氯水、H2O2、O3、HClO均具有强氧化性,能使有色物质褪色。
【详解】(1)磁铁矿的主要成分是Fe3O4,故答案为:Fe3O4;
(2)K2H4Al6Si6O24改用氧化物的形式表示其组成为K2O · 3Al2O3 · 6SiO2 · 2H2O,故答案为:K2O · 3Al2O3 · 6SiO2 · 2H2O;
(3)FeSO4溶液中滴加NaOH溶液立即生成氢氧化亚铁白色沉淀,后被空气中氧气氧化为红褐色沉淀,所以实验现象是生成白色沉淀,迅速变成灰绿色,最终变成红褐色,故答案为:
生成白色沉淀,迅速变成灰绿色,最终变成红褐色;
(4)CaCO3CaO+CO2,瓷坩埚的主要成分是二氧化硅与氧化钙反应,不能选,氧化铝与氧化钙反应,不能选,故答案为:B;
(5)生产玻璃的原料有纯碱、石英、石灰石,故答案为:纯碱;石英;
(6)用作半导体材料的是单质硅,故答案为:硅;
(7)氯水是利用强氧化性漂白,原理相同的有Na2O2、HClO、氯水、O3等,故答案为:Na2O2或HClO、氯水、O3。
19. Al2O3·2SiO2·2H2O NaHCO3 SiO2+4HF=SiF4↑+2H2O 2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2NaCl+2H2O
【详解】(1)复杂硅酸盐书写成氧化物,金属氧化物在前,非金属氧化物在后,因此黏土的氧化物:Al2O3·2SiO2·2H2O,故答案为:Al2O3·2SiO2·2H2O;
(2)治疗胃酸过多,常有Al(OH)3和NaHCO3,如果患有胃溃疡,不能服用NaHCO3,因此产生的CO2是酸性氧化物,加速胃溃疡,因此应服用氢氧化铝,故答案为:NaHCO3;
(3)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅,反应的化学方程式为SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;
(4)NaClO3作氧化剂,Cl转化成ClO2,HCl作还原剂,Cl→Cl2,根据化合价的升降法进行配平,因此反应方程式2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2NaCl+2H2O,故答案为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2NaCl+2H2O。
20.(1) -3价 氮气 碳
(2)11.7g
【解析】(1)
中,氮化硅中氮元素的电负性大于硅元素,所以氮元素显负价,硅元素显正价,硅元素的化合价是+4价,化合物中各元素的化合价代数和为,所以氮元素的化合价是-3价,二氧化硅中各元素的化合价不变,碳的化合价升高,氮元素的化合价降低,反应中的氧化剂是氮气和还原剂是碳,故答案为:-3价;氮气;碳;
(2)
11.2L一氧化碳(标准状况)的物质的量为0.5mol,由方程式可知关系式:,解得n=,则生成氮化硅的质量=,故答案为:11.7g。
21.(1) 39 钇元素的相对原子质量
(2)5
(3)Y2O3
【分析】根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;元素名称(汉字)下面的数字表示相对原子质量;当质子数=核外电子数,为原子;原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层。若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子、通常,其氧化物中元素化合价呈+3、化合价数值=最外层电子数。
【详解】(1)据分析,钇原子核内有39个质子,左图中89.91表示的是表示钇元素的相对原子质量;
(2)由原子结构示意图可知,Y的核外电子其占据5个电子层;
(3)钇原子最外层有3个电子,则钇元素形成氧化物的化学式是Y2O3。
22. F Si NaOH HClO4 Al(OH)3
【详解】根据元素A~J在周期表中的位置判断它们分别是H、Na、Al、C、N、P、F、Cl、Ar、Si。则
(1)表中元素,只有负价而无正价的是活泼性最强的非金属元素F,可用于制半导体材料的元素是Si。
(2)所给元素中金属性最强的是Na,则最高价氧化物的水化物碱性最强的是NaOH。F没有含氧酸,则酸性最强的是HClO4,呈两性的是Al(OH)3。
23. K Cl Al(OH)3+OH-=AlO+2H2O K>Na>Mg H2O 2K+2H2O=2KOH+H2↑ > NaBr 黄
【分析】根据9中元素所在周期中的位置,推出A为Na,B为K,C为Mg,D为Al,E为C,F为O,G为Cl、H为Br,R为Ar;
【详解】(1)B位于第四周期ⅠA族,即B为K,G位于第三周期ⅦA族,推出F为Cl;故答案为K;Cl;
(2)根据D所在周期位置,D为Al,其最高价氧化物对应水化物为Al(OH)3,Al(OH)3为两性氢氧化物,能与氢氧化钠发生反应,即离子方程式为Al(OH)3+OH-=AlO+2H2O;故答案为Al(OH)3+OH-=AlO+2H2O;
(3)根据所在周期位置,A为Na,B为K,C为Mg,同周期从左向右原子半径依次减小,同主族从上到下原子半径依次增大,因此原子半径大小顺序是K>Na>Mg;故答案为K>Na>Mg;
(4)根据元素周期表,F为O,其最简单氢化物的化学式为H2O;K为活泼的金属,能与H2O反应,其反应方程式为2K+2H2O=2KOH+H2↑;所得溶液为KOH,溶液显碱性,即pH>7;故答案为H2O;2K+2H2O=2KOH+H2↑;>;
(5)H元素为Br,A为Na,形成的化合物为NaBr;高温灼烧该化合物,因为含有钠元素,则火焰呈黄色;故答案为NaBr;黄。
24.(1)A
(2)D
(3)B
(4)C
【解析】(1)
除去Ca(OH)2溶液中悬浮的CaCO3颗粒,属于固液分离,用过滤法,选A;
(2)
浓硫酸可以干燥氧气,O2中的水蒸气可通过装有浓H2SO4的洗气瓶,用洗气法,选D;
(3)
碘易升华,加热升华可除去固体碘中混有的少量NaI,选B;
(4)
碳酸钙高温分解为氧化钙和二氧化碳,加热分解可除去氧化钙中的CaCO3,选C。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.短周期主族元素W、X、Y、Z的原子序数依次增大,W在大气中有两种同素异形体且均能支持燃烧,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是( )
A.Y、Z元素的简单氢化物稳定性Y>Z B.ZW2、X2W2都能使品红溶液褪色,且褪色原理相同
C.X、W、Z能形成具有强氧化性的XZW D.X2YW3的水溶液显碱性
2.下列各项中所列举的物质与所属类别对应不正确的是
A.酸性氧化物:CO2、SO2、SiO2、Cl2O7
B.非电解质:蔗糖、四氯化碳、氨气、氯气
C.同素异形体:石墨与金刚石、单斜硫与斜方硫
D.混合物:铝热剂、纯净矿泉水、水玻璃、焦炉气
3.下列有关同主族元素从上到下原子结构和性质的说法正确的是( )
A.电子层数递增,最外层电子数递增
B.原子半径逐渐增大,得电子能力逐渐增强
C.单质的密度逐渐增大,熔沸点逐渐升高
D.最高价氧化物的水化物酸性逐渐减弱,碱性逐渐增强
4.根据元素周期表和元素周期律推断,下列说法正确的是
A.Cl2的氧化性比Br2弱 B.硼原子失电子能力比铝强
C.磷酸的酸性比砷酸强 D.氢氧化锶的碱性比氢氧化钙弱
5.下列物质性质与应用对应关系正确的是
A.二氧化硅能与氢氟酸反应,可用于制光导纤维
B.浓硫酸具有脱水性,可用于干燥氯气
C.漂白粉在空气中不稳定,可用于漂白纸张
D.氧化铝熔点很高,可用于制耐火材料
6.下列对科学家的相关成果的说法正确的是( )
A.屠呦呦发现抗疟新药青蒿素(C15H22O5),青蒿素属于烃类
B.闵恩泽研发重油裂解的催化剂,催化裂解可以获得很多重要的化工原料
C.凯库勒研究了苯环的结构,苯环是碳碳单键和碳碳双键交替的结构
D.门捷列夫提出元素周期律,元素周期律指元素的性质随相对原子质量的递增而呈周期性的变化
7.由下列实验操作和现象能得出相应结论的是
选项 实验操作 实验现象 实验结论
A 向某溶液中滴加溶液 产生白色沉淀 该溶液中含
B 向水玻璃中通入少量 产生白色胶状沉淀 的非金属性比的强
C 用坩埚钳夹持铝箔在火焰上加热 铝箔熔化,外边有膜兜住而不滴落 氧化铝的熔点比铝的熔点高
D 向蔗糖中加入适量浓硫酸,搅拌 产生黑色“面包” 浓硫酸具有吸水性
A.A B.B C.C D.D
8.部分含硫物质的分类与相应硫元素的化合价关系如图所示。下列说法正确的是
A.a的稳定性弱于水 B.S在氧气中燃烧可生成c
C.a、b都可用d的浓溶液干燥 D.常温下,d的浓溶液与Fe反应可生成H2
9.下列有关化学用语正确的是
A.硫化钠电子式 B.Cl-的结构示意图
C.CO2的电子式 D.中子数为18的氯原子符号
10.新中国成立70年来,我国在载人飞船、北斗卫星、高铁、5G技术等领域取得了举世瞩目的成就。它们均与化学有着密切联系。下列说法正确的是
A.国庆阅兵中出现的直-20直升机使用了大量的新型材料,其中锂铝合金属于金属材料
B.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料,其主要成分是硅酸盐
C.截止2019年11月我国光缆线路总长超过三千万公里,光纤的主要成分是碳化硅
D.我国2020年发射的首颗火星探测器,其太阳能电池帆板的材料是二氧化硅
11.下列递变规律不正确的是
A.Na、Mg、Al还原性依次减弱
B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高
12.、、为原子序数依次增大的短周期元素,原子的最外层电子数是其电子层数的3倍。、在同一主族,且、均与相邻。下列说法正确的是
A.非金属性:
B.元素最高价氧化物对应水化物属于强酸
C.简单氢化物的稳定性:
D.简单离子半径:
13.在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是
A.34S原子核内中子数为16 B.16O2比18O2沸点更低
C.2H+的酸性比1H+的酸性更强 D.13C和15N原子核内的质子数相差2
14.化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,4种元素的原子序数之和为21,YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200℃以下热分解时无刺激性气体逸出。下列叙述不正确的是
A.W、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物酸性:X
D.500℃热分解后生成固体化合物
二、填空题
15.回答下列问题:
(1)下列物质中不属于铁合金的是___________(填选项序号)。
A.不锈钢 B.生铁 C.碳素钢 D.氧化铁
(2)铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣。”上述沉淀和残渣分别是___________、___________。
(3)将Na、、、分别投入盛有足量盐酸的四支试管中,不产生气体的是___________(填化学式)。
(4)HClO的结构式为___________。
(5)已知质量数为A的某阳离子Rn+,核外有X个电子,则核内中子数为___________。
16.NaOH被大量用于制皂、造纸和纺织品生产。回答下列问题。
(1)Na元素位于元素周期表的第_______周期第IA族。
(2)Na元素位于第IA族H元素下方,H的原子半径比Na的 _______(填“大”或“小”)。
(3)NaOH所含的两种非金属元素中,非金属性较强的是_______(填“H”或“O”)。
(4)Na的最高价氧化物的化学式为_______。
17.周期表中,F、Cl、Br这3种元素的气态氢化物的热稳定性由强至弱的顺序依次为___________(用化学式表示)。与Cl元素同周期的所有金属元素的最高价氧化物对应的水化物的碱性由强至弱的顺序依次为___________ (用化学式表示)。
18.(1)磁铁矿的主要成分是_______;
(2)钾云母的化学式是K2H4Al6Si6O24,以氧化物形式可表示为_________________________;
(3)向FeSO4溶液中滴加NaOH溶液,实验现象是__________________________________;
(4)高温分解碳酸钙,选择合适的坩埚_____(A.瓷坩埚 B.铁坩埚 C.氧化铝坩埚)
(5)生产玻璃的原料有_________、________、石灰石
(6)用于太阳能电池板,进行光电转化的重要半导体材料,其主要成分是________,
(7)写出一种和氯水漂白原理相同的物质______。
19.完成下列各题。
(1)制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为__________________。
(2)如果胃酸过多,可服用______________(填写化学式)缓解症状,但如果患有胃溃疡,则不能服用,以防止胃穿孔。
(3)雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的,这一过程中发生反应的化学方程式为______________。
(4)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂,工业上是用氯酸钠(NaClO3)与盐酸反应生产ClO2的,反应过程中同时会生成氯气。写出该反应的化学方程式____________。
20.氮化硅()可由石英与焦炭在高温的氮气流中通过以下反应制备:
(1)请写出氮化硅中氮元素的化合价__,以及以上反应中的氧化剂和还原剂__、____。
(2)若该反应生成11.2L一氧化碳(标准状况),则生成氮化硅的质量是________。
21.新疆也要建造磁悬浮列车了。在磁悬浮列车制造过程中将使用大量含钇(Y)元素的超导材料。钇(Y)元素在元素周期表中的信息如图所示:
(1)钇原子核内有_______个质子,左图中89.91表示的是_______;
(2)电子离核越远能量越高,越容易在反应中失去,Y的核外电子其占据_______个电子层;
(3)钇元素形成氧化物的化学式是_______。
22.下表是周期表中的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 A
2 D E G
3 B C J F H I
(1)表中元素,只有负价而无正价的是___________________,可用于制半导体材料的元素是___________________(填元素符号)。
(2)最高价氧化物的水化物碱性最强的是___________________,酸性最强的是___________________,呈两性的是___________________(填化学式)。
23.如表列出了A~R9种元素在周期表中的位置:
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 E F
3 A C D G R
4 B H
请回答下列问题。
(1)写出下列元素的元素符号:B___,G___。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是___。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为___(用元素符号表示)。
(4)F元素最简单氢化物的化学式是___,该氢化物在常温下与B的单质发生反应的化学方程式是___,所得溶液的pH___(填“>”、“<”或“=”)7。
(5)H元素与A元素形成的化合物的化学式是___,高温灼烧该化合物时,火焰呈___色。
24.已知单质碘受热易升华(固体变为气体)。可用于分离或提纯物质的方法有:
A.过滤B.加热升华C.加热分解D.洗气法
下列各组混合物的分离或提纯应选用上述哪种方法最合适(填对应字母)?
(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒:___________。
(2)除去O2中少量的水蒸气:___________。
(3)除去固体碘中混有的少量NaI:___________。
(4)除去氧化钙中的CaCO3:___________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【分析】W在大气中有两种同素异形体且均能支持燃烧,W为O元素;X的原子半径是所有短周期主族元素中最大的,X为Na元素;短周期主族元素 W、X、Y、Z的原子序数依次增大,非金属元素Y的原子序数是Z的最外层电子数的 2 倍,则Y为Si、Z为Cl元素。
【详解】根据分析可知,W为O,X为Na,Y为Si,Z为Cl元素。
A.非金属性Si<Cl,则Y、Z的氢化物的稳定性Si(Y)<Cl(Z),故A错误;
B.ClO2、Na2O2都能使品红溶液褪色,因为两种物质都具有强氧化性,褪色原理相同,故B正确;
C.X(Na)、W(O)、Z(Cl)形成的化合物NaClO具有强氧化性,故C正确;
D.Na2SiO3属于强碱弱酸盐,水解后水溶液显碱性,故D正确;
故选A。
【点睛】本题考查原子结构与元素周期律的应用,推断元素为解答关键,注意掌握元素周期律内容及常见元素化合物性质,试题侧重考查学生的分析能力及灵活应用基础知识的能力,难点B,ClO2、Na2O2都能使品红溶液褪色,因为两种物质都具有强氧化性。
2.B
【详解】A、CO2、SO2、SiO2、Cl2O7都能与碱反应生成盐和水,为酸性氧化物,A项正确;
B、非电解质属于化合物,氯气为单质,不属于非电解质,B项错误;
C、石墨与金刚石、单斜硫与斜方硫,都是由同种元素形成的不同单质,为同素异形体,C项正确;
D、铝热剂、纯净矿泉水、水玻璃、焦炉气都含有多种成分,为混合物,D项正确;
本题答案选B。
3.D
【详解】A.同主族元素从上到下,原子的最外层电子数相同,故A错误;
B.原子半径逐渐增大,原子核对最外层电子的吸引力逐渐减弱,因此原子的得电子能力逐渐减弱,失电子能力逐渐增强,故B错误;
C.单质的密度逐渐增大,但有特例,而熔沸点变化不一致,如碱金属单质的熔沸点逐渐降低,卤素单质的熔沸点逐渐升高,故C错误;
D.从上到下,金属性逐渐增强,最高价氧化物的水化物的碱性逐渐增强,从上到下,非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,故D正确。
综上所述,答案为D。
4.C
【详解】A.Cl、Br为同一主族的元素,原子核外电子层越多,元素的非金属性越弱,单质的氧化性就越弱,由于元素的非金属性Cl>Br,所以Cl2的氧化性比Br2强,A错误;
B.B、Al同一主族且电子层增多,元素的金属性B<Al,则硼原子失电子能力比铝弱,B错误;
C.P、As同一主族且电子层增多,元素的非金属性P>As,则磷酸的酸性比砷酸强,C正确;
D.Ca、Sr同一主族且电子层增多,元素的金属性Sr>Ca,则氢氧化锶的碱性比氢氧化钙弱强,D错误;
故合理选项是C。
5.D
【详解】试题分析:A.二氧化硅能与氢氟酸反应与可用于制光导纤维没有关系,A错误;B.浓硫酸具有吸水性,可用于干燥氯气,B错误;C.漂白粉具有强氧化性,可用于漂白纸张,C错误;D.氧化铝熔点很高,可用于制耐火材料,D正确,答案选D。
考点:考查物质性质应用的有关判断
6.B
【详解】A.青蒿素(C15H22O5)中含有O元素,则青蒿素属于烃的衍生物,A错误;
B.重油裂解的催化剂可以获得乙烯等很多重要的化工原料,B正确;
C. 凯库勒研究了苯环的结构,苯环不是碳碳单键和碳碳双键交替的结构,苯环的六个碳碳键完全相同,是介于单键和双键之间的特殊共价键,6个碳原子还共同形成一个大键,C错误;
D. 门捷列夫提出元素周期律,元素周期律指元素的性质随原子序数的递增而呈周期性的变化,D错误;
答案为B
7.C
【详解】A.氯化银、碳酸银等都是沉淀,向某溶液中滴加溶液,产生白色沉淀,该溶液中可能含、CO等,故A错误;
B.向水玻璃中通入少量,生成白色胶状硅酸沉淀,说明盐酸的酸性大于硅酸,盐酸是无氧酸,不能证明的非金属性比的强,故B错误;
C.用坩埚钳夹持铝箔在火焰上加热,铝表面被氧化,氧化铝的熔点比铝的熔点高,所以铝箔熔化,外边有膜兜住而不滴落,故C正确;
D.向蔗糖中加入适量浓硫酸,搅拌,产生黑色“面包”现象,浓硫酸具有脱水性,故D错误;
选C。
8.A
【分析】由价-类图可推知,a为H2S,b为SO2,c为SO3,d为H2SO4。
【详解】A.S的非金属性比O弱,所以a(H2S)的稳定性弱于水,A正确;
B.S在氧气中燃烧只能生成SO2,不能生成SO3,B错误;
C.a为H2S,具有较强的还原性,不能用浓硫酸干燥,C错误;
D.常温下,浓硫酸能使Fe发生钝化,不生成H2,D错误;
答案选A。
9.B
【详解】A.硫化钠由钠离子和硫离子构成,硫离子带2个单位负电荷,并且外围达到8电子结构,其电子式为 ,A错误;
B.Cl-的核电荷数为17,核外电子总数为18,其离子结构示意图为:,B正确;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为,C错误;
D.中子数为18的氯原子的质量数为18+17=35,所以符号为,D错误;
综上所述答案为B。
10.A
【详解】A.金属材料包括纯金属、合金、特种金属材料等,锂铝合金属于合金,为金属材料,故A正确;
B.硅酸盐材料传统无机非金属材料,高温结构陶瓷主要有氧化铝陶瓷、氮化硅陶瓷、氮化硼陶瓷,故B错误;
C.光纤的主要成分是二氧化硅,故C错误;
D.太阳能电池帆板的材料是单晶硅,不是二氧化硅,故D错误;
综上所述答案为A。
11.C
【详解】A.同一周期,从左到右金属性减弱,Na、Mg、Al金属性减弱,还原性依次减弱,A正确;
B.同一主族,从下到上,非金属性增强, I2、Br2、Cl2非金属增强,其单质的氧化性依次增强,B正确;
C.C、N、O同属于周期元素,核电荷数增大,原子半径依次减小,C错误;
D.P、S、Cl最高正价依次为+5、+6、+7,依次升高,D正确;
故选C。
12.D
【分析】短周期元素原子的最外层电子数是其电子层数的3倍,X是氧元素;、在同一主族,Z是硫元素;原子序数依次增大,、均与相邻,Y是磷元素。综上,、、元素分别是O、P、S。
【详解】A.非金属性:O>S>P,即X>Z>Y, A错误;
B.元素最高价氧化物对应水化物H3PO4属于弱酸,B错误;
C.单氢化物的稳定性:H2S
故选D。
13.B
【详解】A、34S原子核内中子数为:34—16=18,错误;
B、16O2比18O2相对分子质量小,所以16O2比18O2范德华力小,故16O2比18O2沸点更低,正确;
C、2H+的酸性与1H+的酸性相同,错误;
D、13C原子核内的质子数为6,15N原子核内的质子数为7,相差1,错误。
14.C
【分析】YZ2分子的总电子数为奇数,常温下为气体,该气体应为NO2;Y为N元素,Z为O元素;在化合物(YW4X5Z8·4W2Z )中W2Z应为结晶水,则W为H元素;W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21,则X的核电外电子总数为21-1-7-8=5,则X为B元素。
【详解】A.根据分析,W、Y、Z分别为H、N、O,常温下H2、N2、O2均为气体,A正确;
B.同一周期从左到右非金属性依次增强,因此非金属性B<N,非金属性越强,最高价氧化物的水化物酸性越强,因此酸性H3BO3<HNO3,B正确;
C.化合物(YW4X5Z8·4W2Z )为NH4B5O8·4H2O,已知该200℃以下热分解时无刺激性气体逸出,说明失去的是结晶水,若100 ~ 200℃阶段热分解失去4个H2O,该化合物的化学式变为NH4B5O8,此时的质量保留百分数为,与图示曲线数据( 80.2% )不一致,说明100~200℃阶段不是失去4个H2O,C错误;
D.假设化合物NH4B5O8·4H2O在500℃热分解后生成固体化合物B2O3,根据硼元素守恒,则得到关系式2NH4B5O8·4H2O~5B2O3,则固体化合物B2O3质量分数为≈64.1%,与图象中的数据相符,说明假设正确,D正确;
故选C。
15.(1)D
(2)
(3)
(4)H-O-Cl
(5)A-X-n
【解析】(1)
合金是指一种金属中加热熔合其他金属或非金属而形成的具有金属特性的物质。不锈钢是铁的合金,生铁是含碳量为2%~4.3%的铁碳合金,碳素钢是含碳量低于2%,并有少量硅、锰以及磷、硫等杂质的铁碳合金,故A、B、C选项不符合题意;氧化铁是氧化物,属于纯净物,故D符合题意;
故选D。
(2)
铁屑溶于过量稀硫酸,反应生成硫酸亚铁,硫酸亚铁与过量氨水反应生成氢氧化亚铁白色沉淀,在空气中氢氧化亚铁容易被空气中的氧气氧化为氢氧化铁,氢氧化铁为红褐色沉淀,受热分解生成红棕色三氧化二铁,即上述沉淀和残渣分别是、,故答案为:;。
(3)
与盐酸反应生成氯化钠和氢气,与盐酸反应生成氯化钠、水和氧气,和盐酸反应生成氯化钠、水和二氧化碳,均有气体产生,和盐酸反应生成氯化钠和水,没有气体产生,则不产生气体的是,故答案为:。
(4)
HClO为共价化合物,O原子分别和H原子、Cl原子各共用一对电子,其结构式为H-O-Cl,故答案为:H-O-Cl。
(5)
阳离子Rn+,质量数为A,核外有X个电子,所以其质子数Z=X+n,由于中子数=质量数-质子数,故中子数=A-(X+n)= A-X-n,故答案为:A-X-n。
16.(1)三
(2)小
(3)O
(4)Na2O
【详解】(1)根据元素周期表的结构可知,Na元素位于第三周期第IA族;
故答案为:三;
(2)Na原子电子层数为3,H原子电子层数为1,因此H原子半径小于Na原子;
故答案为:小;
(3)NaOH中含两种非金属元素H、O,其中非金属性较强的是O;
故答案为:O;
(4)Na的最高价氧化物为Na2O;
故答案为:Na2O。
17. HF>HCl>HBr NaOH>Mg(OH)2>Al(OH)3
【详解】物质的非金属性越强,对应的氢化物稳定性越强,非金属性F>Cl>Br,气态氢化物的热稳定性由强至弱的顺序依次为HF>HCl>HBr;与Cl元素同周期的所有金属元素为Na、Mg、Al,同周期从左到右,元素的金属性逐渐减弱,对应的最高价氧化物对应的水化物的碱性逐渐减弱,则碱性由强至弱的顺序依次为NaOH>Mg(OH)2>Al(OH)3。
18. Fe3O4 K2O · 3Al2O3 · 6SiO2 · 2H2O 生成白色沉淀,迅速变成灰绿色,最终变成红褐色 B 纯碱 石英 硅 Na2O2或HClO、氯水、O3
【分析】(2)硅酸盐改写为氧化物形式,按照活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水的顺序书写,注意氧化物形式与盐中原子数目关系对应;
(3)FeSO4溶液中滴加NaOH溶液,FeSO4和NaOH发生复分解反应生成氢Fe(OH)2,Fe(OH)2不稳定,易被氧气氧化生成Fe(OH)3;
(4)根据高温分解碳酸钙生成氧化钙和二氧化碳,根据坩埚本身不能参与反应选择;
(7)氯水、H2O2、O3、HClO均具有强氧化性,能使有色物质褪色。
【详解】(1)磁铁矿的主要成分是Fe3O4,故答案为:Fe3O4;
(2)K2H4Al6Si6O24改用氧化物的形式表示其组成为K2O · 3Al2O3 · 6SiO2 · 2H2O,故答案为:K2O · 3Al2O3 · 6SiO2 · 2H2O;
(3)FeSO4溶液中滴加NaOH溶液立即生成氢氧化亚铁白色沉淀,后被空气中氧气氧化为红褐色沉淀,所以实验现象是生成白色沉淀,迅速变成灰绿色,最终变成红褐色,故答案为:
生成白色沉淀,迅速变成灰绿色,最终变成红褐色;
(4)CaCO3CaO+CO2,瓷坩埚的主要成分是二氧化硅与氧化钙反应,不能选,氧化铝与氧化钙反应,不能选,故答案为:B;
(5)生产玻璃的原料有纯碱、石英、石灰石,故答案为:纯碱;石英;
(6)用作半导体材料的是单质硅,故答案为:硅;
(7)氯水是利用强氧化性漂白,原理相同的有Na2O2、HClO、氯水、O3等,故答案为:Na2O2或HClO、氯水、O3。
19. Al2O3·2SiO2·2H2O NaHCO3 SiO2+4HF=SiF4↑+2H2O 2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2NaCl+2H2O
【详解】(1)复杂硅酸盐书写成氧化物,金属氧化物在前,非金属氧化物在后,因此黏土的氧化物:Al2O3·2SiO2·2H2O,故答案为:Al2O3·2SiO2·2H2O;
(2)治疗胃酸过多,常有Al(OH)3和NaHCO3,如果患有胃溃疡,不能服用NaHCO3,因此产生的CO2是酸性氧化物,加速胃溃疡,因此应服用氢氧化铝,故答案为:NaHCO3;
(3)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅,反应的化学方程式为SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;
(4)NaClO3作氧化剂,Cl转化成ClO2,HCl作还原剂,Cl→Cl2,根据化合价的升降法进行配平,因此反应方程式2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2NaCl+2H2O,故答案为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2NaCl+2H2O。
20.(1) -3价 氮气 碳
(2)11.7g
【解析】(1)
中,氮化硅中氮元素的电负性大于硅元素,所以氮元素显负价,硅元素显正价,硅元素的化合价是+4价,化合物中各元素的化合价代数和为,所以氮元素的化合价是-3价,二氧化硅中各元素的化合价不变,碳的化合价升高,氮元素的化合价降低,反应中的氧化剂是氮气和还原剂是碳,故答案为:-3价;氮气;碳;
(2)
11.2L一氧化碳(标准状况)的物质的量为0.5mol,由方程式可知关系式:,解得n=,则生成氮化硅的质量=,故答案为:11.7g。
21.(1) 39 钇元素的相对原子质量
(2)5
(3)Y2O3
【分析】根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;元素名称(汉字)下面的数字表示相对原子质量;当质子数=核外电子数,为原子;原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层。若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子、通常,其氧化物中元素化合价呈+3、化合价数值=最外层电子数。
【详解】(1)据分析,钇原子核内有39个质子,左图中89.91表示的是表示钇元素的相对原子质量;
(2)由原子结构示意图可知,Y的核外电子其占据5个电子层;
(3)钇原子最外层有3个电子,则钇元素形成氧化物的化学式是Y2O3。
22. F Si NaOH HClO4 Al(OH)3
【详解】根据元素A~J在周期表中的位置判断它们分别是H、Na、Al、C、N、P、F、Cl、Ar、Si。则
(1)表中元素,只有负价而无正价的是活泼性最强的非金属元素F,可用于制半导体材料的元素是Si。
(2)所给元素中金属性最强的是Na,则最高价氧化物的水化物碱性最强的是NaOH。F没有含氧酸,则酸性最强的是HClO4,呈两性的是Al(OH)3。
23. K Cl Al(OH)3+OH-=AlO+2H2O K>Na>Mg H2O 2K+2H2O=2KOH+H2↑ > NaBr 黄
【分析】根据9中元素所在周期中的位置,推出A为Na,B为K,C为Mg,D为Al,E为C,F为O,G为Cl、H为Br,R为Ar;
【详解】(1)B位于第四周期ⅠA族,即B为K,G位于第三周期ⅦA族,推出F为Cl;故答案为K;Cl;
(2)根据D所在周期位置,D为Al,其最高价氧化物对应水化物为Al(OH)3,Al(OH)3为两性氢氧化物,能与氢氧化钠发生反应,即离子方程式为Al(OH)3+OH-=AlO+2H2O;故答案为Al(OH)3+OH-=AlO+2H2O;
(3)根据所在周期位置,A为Na,B为K,C为Mg,同周期从左向右原子半径依次减小,同主族从上到下原子半径依次增大,因此原子半径大小顺序是K>Na>Mg;故答案为K>Na>Mg;
(4)根据元素周期表,F为O,其最简单氢化物的化学式为H2O;K为活泼的金属,能与H2O反应,其反应方程式为2K+2H2O=2KOH+H2↑;所得溶液为KOH,溶液显碱性,即pH>7;故答案为H2O;2K+2H2O=2KOH+H2↑;>;
(5)H元素为Br,A为Na,形成的化合物为NaBr;高温灼烧该化合物,因为含有钠元素,则火焰呈黄色;故答案为NaBr;黄。
24.(1)A
(2)D
(3)B
(4)C
【解析】(1)
除去Ca(OH)2溶液中悬浮的CaCO3颗粒,属于固液分离,用过滤法,选A;
(2)
浓硫酸可以干燥氧气,O2中的水蒸气可通过装有浓H2SO4的洗气瓶,用洗气法,选D;
(3)
碘易升华,加热升华可除去固体碘中混有的少量NaI,选B;
(4)
碳酸钙高温分解为氧化钙和二氧化碳,加热分解可除去氧化钙中的CaCO3,选C。
答案第1页,共2页
答案第1页,共2页
