浙教版八年级科学2022-2023第二学期“期末冲刺”分类题型训练(十八):化学计算(1)(含答案)
文档属性
| 名称 | 浙教版八年级科学2022-2023第二学期“期末冲刺”分类题型训练(十八):化学计算(1)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 187.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-10 19:09:20 | ||
图片预览


文档简介
1.木糖醇和普通的白糖相比,具有热量低的特点,常用于减肥食品。已知该有机物由碳、氢、氧三种元素组成,其中氢元素质量分数约为7.9%,氧元素质量分数约为52.6%,且每个分子中含有5个氧原子。试回答:
(1)该有机物的相对分子质量为多少?(取整数);
(2)该有机物的化学式。
2.完成下列研究性学习的有关内容:探究氯酸钾和二氧化锰混合物中氯酸钾的质量分数。
【研究方案】先称取一定质量的氯酸钾和二氧化锰混合物、放入大试管中加热至质量不再变化为止。根据质量守恒定律,固体物质减轻的质量即为产生氧气的质量,从而求出氯酸钾的质量。
【解决问题】实验测得固体混合物质量随加热时间变化的相关数据如右图所示。请你计算:
(1)反应中产生氧气的质量
(2)原混合物中氯酸钾的质量分数
【继续研究】为了分离回收二氧化锰和氯化钾,他们在反应后的固体混合物中加入80克水使其中的氯化钾完全溶解,然后通过过滤使二氧化锰与液体分离。请你计算他们得到的溶液中氯化钾的质量分数。(过滤中水的损失不计)
3.冬季是流感高发季,用于抗流感病毒的奥司他韦成为“抢手货”。它的主要成分是磷酸奥司他韦,化学式为:C16H28O4 H3PO4,请根据化学式,借助相对原子质量进行计算(精确到0.1%):
(1)磷酸奥司他韦中氢、氧元素的质量比________;
(2)磷酸奥司他韦中氧元素的质量分数__________;
(3)4.1克磷酸奥司他韦中氧元素的质量与多少克水中氧元素的质量相同?
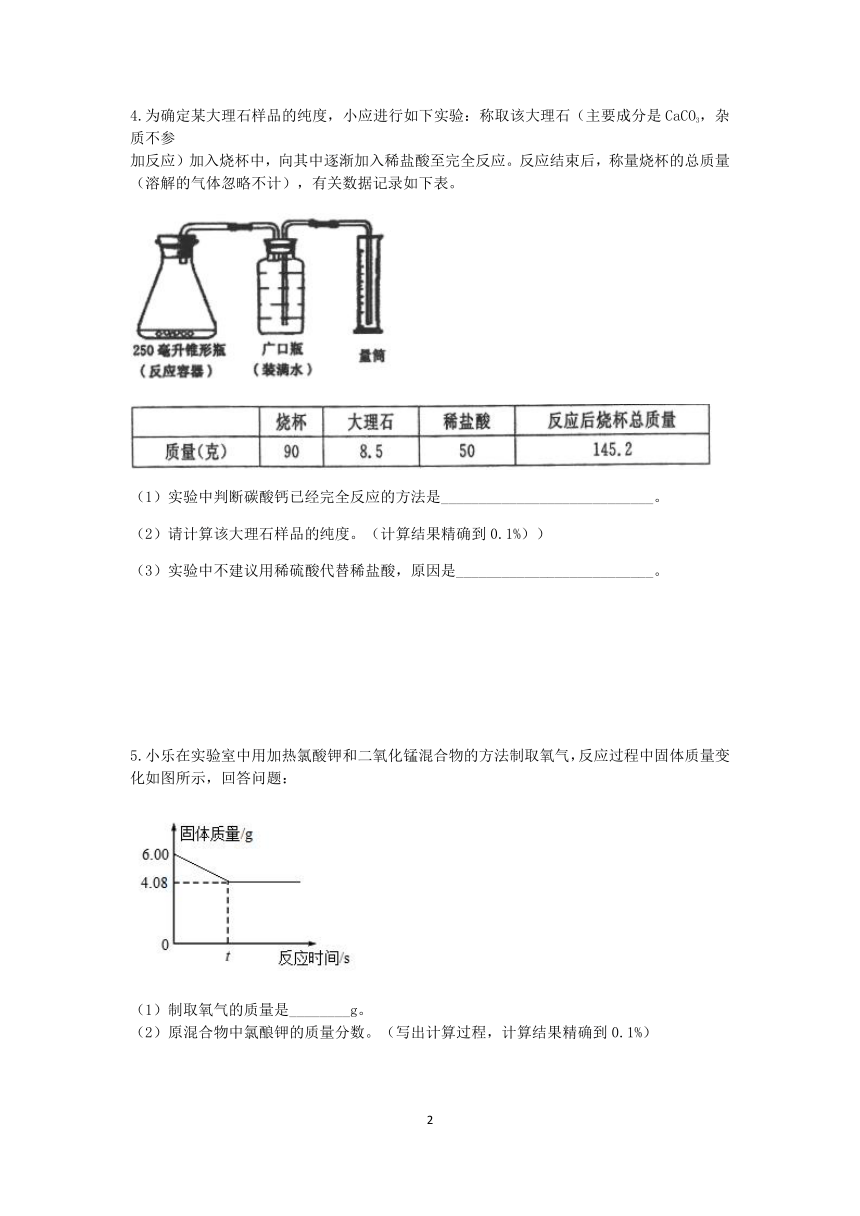
4.为确定某大理石样品的纯度,小应进行如下实验:称取该大理石(主要成分是CaCO3,杂质不参
加反应)加入烧杯中,向其中逐渐加入稀盐酸至完全反应。反应结束后,称量烧杯的总质量(溶解的气体忽略不计),有关数据记录如下表。
(1)实验中判断碳酸钙已经完全反应的方法是____________________________。
(2)请计算该大理石样品的纯度。(计算结果精确到0.1%))
(3)实验中不建议用稀硫酸代替稀盐酸,原因是__________________________。
5.小乐在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量变化如图所示,回答问题:
(1)制取氧气的质量是________g。
(2)原混合物中氯酿钾的质量分数。(写出计算过程,计算结果精确到0.1%)
6.硝酸铵(NH4N03)是常用的一种氮肥,对促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量等有作用:回答问题:
(1)NH4N03中含有NH4+,则NH4+中氮元素的化合价为_______________。
(2)使用硝酸铵时要注意不能与某些物质一起施用,比如硝酸铵能与熟石灰发生反应而失效。在化学方程式2NH4NO3+Ca(OH)2=Ca(NO3)2+2↑+2H2O中,“”的化学式为___________。
(3)与80克硝酸铵具有相同肥效的尿素[CO(NH2)2]的质量为多少克?(写出计算过程)
7.科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C3H5ON)。请根据丙烯酰胺(C3H5ON)的化学式计算 后填写:
(1)丙烯酰胺(C3H5ON)中碳、氢、氮元素的质量比是________;
(2)氢元素的质量分数为________。(结果保留到0.01%)
(3)已知亚硝酸钠(NaNO2)也是一种有毒的致癌物质,请计算13.8g亚硝酸钠与多少克丙烯酰胺中含的氮元素质量相等。(列式计算)
参考答案:(1)36:5:14(2)7.04% (7%)(3)解:13.8g×1469=m×1471m=14.2g
8.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下。
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束?________________。
(2)结合表格分析,影响化学反应快慢的因素是________________。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
9.为测出鸡蛋壳(主要成分是碳酸钙)中钙元素的质量分数,小乐称取已洗净、晾干、研成粉末的鸡蛋壳10克置于烧杯中,将烧杯放在电子天平上,往烧杯中加入稀盐酸100克(足量),每0.5分钟记录一次电子天平的示数,据此计算出产生气体的质量,具体数据如表:
(1)若产生的气体全部是鸡蛋壳中的碳酸钙与稀盐酸反应生成的CO2,根据实验结果计算出该鸡蛋壳中碳酸钙的质量分数(假定鸡蛋壳中其它成分不含钙元素,写出具体计算过程)。
(2)下列哪些情况会导致实验中钙元素质量分数测量结果偏大 _______(选填字母)。
A. 盐酸溶质质量分数过大 B.鸡蛋壳未晾干 C.鸡蛋壳未充分研碎
10.如图所示为一瓶医用葡萄糖(C6H12O6)注射液标签的部分内容。回答问题:
(1)葡萄糖中碳、氢、氛元素的质量比是 ;
(2)葡萄糖中碳元素的质量分数是 ;
(3)葡萄糖是人体的供能物质,在酶的催化下与氧气反应生成二氧化碳和水,此反应的化学方程式为 。
11.长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和其它杂质(其它杂质与盐酸反应不产生气体)。为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生气体的质量情况如图所示。
(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是 g。
(2)水垢中碳酸钙的质量分数是多少?(列式计算)
12.小乐在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量变化如图所示,回答问题:
(1)制取氧气的质量是__________g。
(2)原混合物中氯酸钾的质量分数。(写出计算过程,计算结果精确到0.1%)
13.硝酸铵(NH4NO3)是常用的一种氮肥,对促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量等有作用。回答问题:
(1)NH4NO3中含有NH4+,则NH4+中氮元素的化合价为___________。
(2)使用硝酸铵时要注意不能与某些物质一起施用,比如硝酸铵能与熟石灰发生反应而失效。在化学方程式 2NH4NO3+Ca(OH)2== Ca(NO3)2+ 2■↑+2H2O中,“■”的化学式为____________。
(3)与80克硝酸铵具有相同肥效的尿素[CO(NH2)2]的质量为多少克?(写出计算过程)
参考答案
1.(1)152 (2)C5H12O5
2.(1)4.8克 (2)76.6% 8.5%
3.(1)31:128 (2)31.2% (3)1.44g
4.(1)继续滴入稀盐酸,观察到不再产生气泡(2)CO2:3.3
解:设8.5克大理石样品中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3克
100/x=44/3.3克 x=7.5克
大理石样品的纯度=7.5克8.5克×100%=88.2%
答:该大理石样品的纯度为 88.2%。
(3)稀硫酸与碳酸钙反应会生成微溶的硫酸钙,覆盖在碳酸钙表面,阻止反应进一步发生。
5.解:(1)1.92 (2)设原混合物中KClO3的质量为x
2KClO3=2KCl+3O2↑
245 96
x 1.92g
245/96=x/1.92g
x=4.90g
原混合物中KClO3的质量分数是:4.90g6.00g×100%≈81.7%
答:原混合物中KClO3的质量分数是81.7%。
6.(1)-3价(2)NH3(3)所需尿素[CO(NH2)2]的质量为80kg×2×1414×2+1×4+16×3×100%÷(14×212+16+(14+1×2)×2×100%)=60kg
7.(1)36:5:14(2)7.04% (7%)(3)解:13.8g×1469=m×1471m=14.2g
8.(1)容器内不再产生气泡(或电子天平示数不再改变)(2)反应物之间的接触面积
(3)解:设块状大理石中有x克碳酸钙与稀盐酸发生了反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2
比例式:100:44=x: 2.2 克x=5 克
9.(1)设:10克鸡蛋壳中含有CaCO3的质量是x。根据:100/x=44/3.96g 可得:x=9gCaCO3%=9g/10g=0.9=90%(2)A。
10.
11.
12.解:(1)1.92 (2)设原混合物中KClO3的质量为x
2KClO3=2KCl+3O2↑
245 96
x 1.92 g
245/96=x/1.92g x=4.90g 原混合物中KClO3的质量分数是:4.90g6.00g×100%≈81.7%
答:原混合物中KClO3的质量分数是81.7%。
13.(1)-3价(2)NH3(3)60克
化学计算(1)
(1)该有机物的相对分子质量为多少?(取整数);
(2)该有机物的化学式。
2.完成下列研究性学习的有关内容:探究氯酸钾和二氧化锰混合物中氯酸钾的质量分数。
【研究方案】先称取一定质量的氯酸钾和二氧化锰混合物、放入大试管中加热至质量不再变化为止。根据质量守恒定律,固体物质减轻的质量即为产生氧气的质量,从而求出氯酸钾的质量。
【解决问题】实验测得固体混合物质量随加热时间变化的相关数据如右图所示。请你计算:
(1)反应中产生氧气的质量
(2)原混合物中氯酸钾的质量分数
【继续研究】为了分离回收二氧化锰和氯化钾,他们在反应后的固体混合物中加入80克水使其中的氯化钾完全溶解,然后通过过滤使二氧化锰与液体分离。请你计算他们得到的溶液中氯化钾的质量分数。(过滤中水的损失不计)
3.冬季是流感高发季,用于抗流感病毒的奥司他韦成为“抢手货”。它的主要成分是磷酸奥司他韦,化学式为:C16H28O4 H3PO4,请根据化学式,借助相对原子质量进行计算(精确到0.1%):
(1)磷酸奥司他韦中氢、氧元素的质量比________;
(2)磷酸奥司他韦中氧元素的质量分数__________;
(3)4.1克磷酸奥司他韦中氧元素的质量与多少克水中氧元素的质量相同?
4.为确定某大理石样品的纯度,小应进行如下实验:称取该大理石(主要成分是CaCO3,杂质不参
加反应)加入烧杯中,向其中逐渐加入稀盐酸至完全反应。反应结束后,称量烧杯的总质量(溶解的气体忽略不计),有关数据记录如下表。
(1)实验中判断碳酸钙已经完全反应的方法是____________________________。
(2)请计算该大理石样品的纯度。(计算结果精确到0.1%))
(3)实验中不建议用稀硫酸代替稀盐酸,原因是__________________________。
5.小乐在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量变化如图所示,回答问题:
(1)制取氧气的质量是________g。
(2)原混合物中氯酿钾的质量分数。(写出计算过程,计算结果精确到0.1%)
6.硝酸铵(NH4N03)是常用的一种氮肥,对促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量等有作用:回答问题:
(1)NH4N03中含有NH4+,则NH4+中氮元素的化合价为_______________。
(2)使用硝酸铵时要注意不能与某些物质一起施用,比如硝酸铵能与熟石灰发生反应而失效。在化学方程式2NH4NO3+Ca(OH)2=Ca(NO3)2+2↑+2H2O中,“”的化学式为___________。
(3)与80克硝酸铵具有相同肥效的尿素[CO(NH2)2]的质量为多少克?(写出计算过程)
7.科学家经过多年研究证明,有一些同学爱吃的小包装零食中,含一定量的有毒、有害、致病的化学物质,如某些油炸食品中含有致癌物质丙烯酰胺(C3H5ON)。请根据丙烯酰胺(C3H5ON)的化学式计算 后填写:
(1)丙烯酰胺(C3H5ON)中碳、氢、氮元素的质量比是________;
(2)氢元素的质量分数为________。(结果保留到0.01%)
(3)已知亚硝酸钠(NaNO2)也是一种有毒的致癌物质,请计算13.8g亚硝酸钠与多少克丙烯酰胺中含的氮元素质量相等。(列式计算)
参考答案:(1)36:5:14(2)7.04% (7%)(3)解:13.8g×1469=m×1471m=14.2g
8.为研究影响化学反应快慢的因素,小明选取成分相同的大理石碎屑、块状大理石两种样品各6克,分别与足量的、溶质质量分数相同的稀盐酸反应(样品中杂质不与稀盐酸反应),实验装置如图。每2分钟读取一次电子天平的示数,据此计算生成的二氧化碳的质量,并记录前18分钟数据如下。
(1)实验过程中,通过观察如图装置中的哪一现象可判断反应结束?________________。
(2)结合表格分析,影响化学反应快慢的因素是________________。
(3)当反应进行到18分钟时,块状大理石中有多少克碳酸钙与稀盐酸发生了反应?(写出计算过程)
9.为测出鸡蛋壳(主要成分是碳酸钙)中钙元素的质量分数,小乐称取已洗净、晾干、研成粉末的鸡蛋壳10克置于烧杯中,将烧杯放在电子天平上,往烧杯中加入稀盐酸100克(足量),每0.5分钟记录一次电子天平的示数,据此计算出产生气体的质量,具体数据如表:
(1)若产生的气体全部是鸡蛋壳中的碳酸钙与稀盐酸反应生成的CO2,根据实验结果计算出该鸡蛋壳中碳酸钙的质量分数(假定鸡蛋壳中其它成分不含钙元素,写出具体计算过程)。
(2)下列哪些情况会导致实验中钙元素质量分数测量结果偏大 _______(选填字母)。
A. 盐酸溶质质量分数过大 B.鸡蛋壳未晾干 C.鸡蛋壳未充分研碎
10.如图所示为一瓶医用葡萄糖(C6H12O6)注射液标签的部分内容。回答问题:
(1)葡萄糖中碳、氢、氛元素的质量比是 ;
(2)葡萄糖中碳元素的质量分数是 ;
(3)葡萄糖是人体的供能物质,在酶的催化下与氧气反应生成二氧化碳和水,此反应的化学方程式为 。
11.长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和其它杂质(其它杂质与盐酸反应不产生气体)。为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生气体的质量情况如图所示。
(1)从图中可以看出,12.5g水垢与盐酸反应后生成的二氧化碳最多是 g。
(2)水垢中碳酸钙的质量分数是多少?(列式计算)
12.小乐在实验室中用加热氯酸钾和二氧化锰混合物的方法制取氧气,反应过程中固体质量变化如图所示,回答问题:
(1)制取氧气的质量是__________g。
(2)原混合物中氯酸钾的质量分数。(写出计算过程,计算结果精确到0.1%)
13.硝酸铵(NH4NO3)是常用的一种氮肥,对促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量等有作用。回答问题:
(1)NH4NO3中含有NH4+,则NH4+中氮元素的化合价为___________。
(2)使用硝酸铵时要注意不能与某些物质一起施用,比如硝酸铵能与熟石灰发生反应而失效。在化学方程式 2NH4NO3+Ca(OH)2== Ca(NO3)2+ 2■↑+2H2O中,“■”的化学式为____________。
(3)与80克硝酸铵具有相同肥效的尿素[CO(NH2)2]的质量为多少克?(写出计算过程)
参考答案
1.(1)152 (2)C5H12O5
2.(1)4.8克 (2)76.6% 8.5%
3.(1)31:128 (2)31.2% (3)1.44g
4.(1)继续滴入稀盐酸,观察到不再产生气泡(2)CO2:3.3
解:设8.5克大理石样品中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 3.3克
100/x=44/3.3克 x=7.5克
大理石样品的纯度=7.5克8.5克×100%=88.2%
答:该大理石样品的纯度为 88.2%。
(3)稀硫酸与碳酸钙反应会生成微溶的硫酸钙,覆盖在碳酸钙表面,阻止反应进一步发生。
5.解:(1)1.92 (2)设原混合物中KClO3的质量为x
2KClO3=2KCl+3O2↑
245 96
x 1.92g
245/96=x/1.92g
x=4.90g
原混合物中KClO3的质量分数是:4.90g6.00g×100%≈81.7%
答:原混合物中KClO3的质量分数是81.7%。
6.(1)-3价(2)NH3(3)所需尿素[CO(NH2)2]的质量为80kg×2×1414×2+1×4+16×3×100%÷(14×212+16+(14+1×2)×2×100%)=60kg
7.(1)36:5:14(2)7.04% (7%)(3)解:13.8g×1469=m×1471m=14.2g
8.(1)容器内不再产生气泡(或电子天平示数不再改变)(2)反应物之间的接触面积
(3)解:设块状大理石中有x克碳酸钙与稀盐酸发生了反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2
比例式:100:44=x: 2.2 克x=5 克
9.(1)设:10克鸡蛋壳中含有CaCO3的质量是x。根据:100/x=44/3.96g 可得:x=9gCaCO3%=9g/10g=0.9=90%(2)A。
10.
11.
12.解:(1)1.92 (2)设原混合物中KClO3的质量为x
2KClO3=2KCl+3O2↑
245 96
x 1.92 g
245/96=x/1.92g x=4.90g 原混合物中KClO3的质量分数是:4.90g6.00g×100%≈81.7%
答:原混合物中KClO3的质量分数是81.7%。
13.(1)-3价(2)NH3(3)60克
化学计算(1)
同课章节目录
