浙教版八年级科学2022-2023第二学期“期末冲刺”分类题型训练(十九):化学计算(2)(含解析)
文档属性
| 名称 | 浙教版八年级科学2022-2023第二学期“期末冲刺”分类题型训练(十九):化学计算(2)(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 390.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-10 19:13:35 | ||
图片预览



文档简介
1.尿素[CO(NH2)2] 在工农业生产中有着重要的用途。
(1)人工合成尿素的化学方程式为:2■+CO2=催化剂CO(NH2)2+H2O,其中“■”为某种物质的化学式,则“■”是_____________。
(2)尿素中C、H、O、N四种元素的质量比为__________。
(3)_________克尿素中氮元素的质量是56克。
2.本学期我们学习了从分子、原子层面上认识和创造物质的部分知识。
(1)物质是由分子、原子、离子等微粒构成的。在铁、干冰、水、氯化钠四种物质中,由分子构成的是______________。(写化学式)
(2)氯化钠中钠元素和氯元素的质量比为________________。
3.实验室有一瓶含杂质的氯酸钾。取氯酸钾样品16.45g和一定质量二氧化锰混和加热(杂质不参加反应,不含氧元素),充分反应后测得剩余固体质量为16g,生成氧气4.8g。
(1)二氧化锰为该反应的催化剂,反应前后二氧化锰的__________和__________均没有发生改变;
(2)求样品中氯酸钾的质量:
(3)求剩余固体中氧元素的质量。
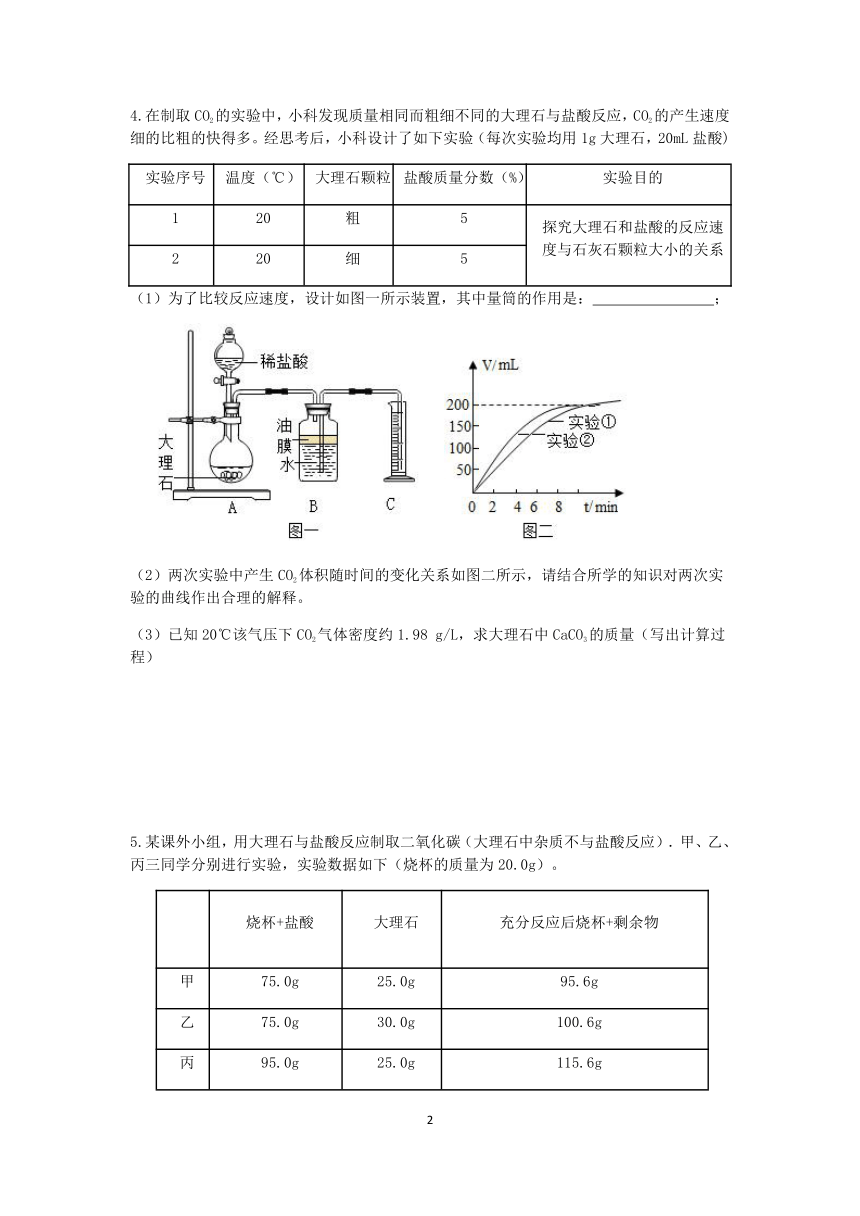
4.在制取CO2的实验中,小科发现质量相同而粗细不同的大理石与盐酸反应,CO2的产生速度细的比粗的快得多。经思考后,小科设计了如下实验(每次实验均用1g大理石,20mL盐酸)
实验序号 温度(℃) 大理石颗粒 盐酸质量分数(%) 实验目的
1 20 粗 5 探究大理石和盐酸的反应速度与石灰石颗粒大小的关系
2 20 细 5
(1)为了比较反应速度,设计如图一所示装置,其中量筒的作用是: ;
(2)两次实验中产生CO2体积随时间的变化关系如图二所示,请结合所学的知识对两次实验的曲线作出合理的解释。
(3)已知20℃该气压下CO2气体密度约1.98 g/L,求大理石中CaCO3的质量(写出计算过程)
5.某课外小组,用大理石与盐酸反应制取二氧化碳(大理石中杂质不与盐酸反应).甲、乙、丙三同学分别进行实验,实验数据如下(烧杯的质量为20.0g)。
烧杯+盐酸 大理石 充分反应后烧杯+剩余物
甲 75.0g 25.0g 95.6g
乙 75.0g 30.0g 100.6g
丙 95.0g 25.0g 115.6g
若甲、乙、丙三同学中有一名同学所取的大理石和盐酸恰好完全反应,请回答下列问题.
(1) 同学所取的盐酸与大理石恰好完全反应.
(2)计算大理石中碳酸钙的质量分数.
6.科学兴趣小组的同学们对蛋壳成分开展了有关探究。同学们的实验过程如下:
①将一定量的蛋壳放人容器中;②往其中加入适量的稀盐酸,观察到有较多的气泡产生;③……;④得出结论:蛋壳的主要成分是碳酸盐(如:碳酸钙)。
(1)请补全第③步的实验内容与现象
(2)为了测定蛋壳中碳酸钙的质量分数,同学们用蛋壳与足量的稀盐酸充分反应,得到有关数据如下表:(CO2的密度为2克/升)
蛋壳的质量/克 加入稀盐酸质量/克 收集到CO2气体体积/升
7.5 100 1.1
假设二氧化碳全部是由蛋壳中的碳酸钙与盐酸反应产生,小明计算这些蛋壳中碳酸钙的质量分数的过程如下:
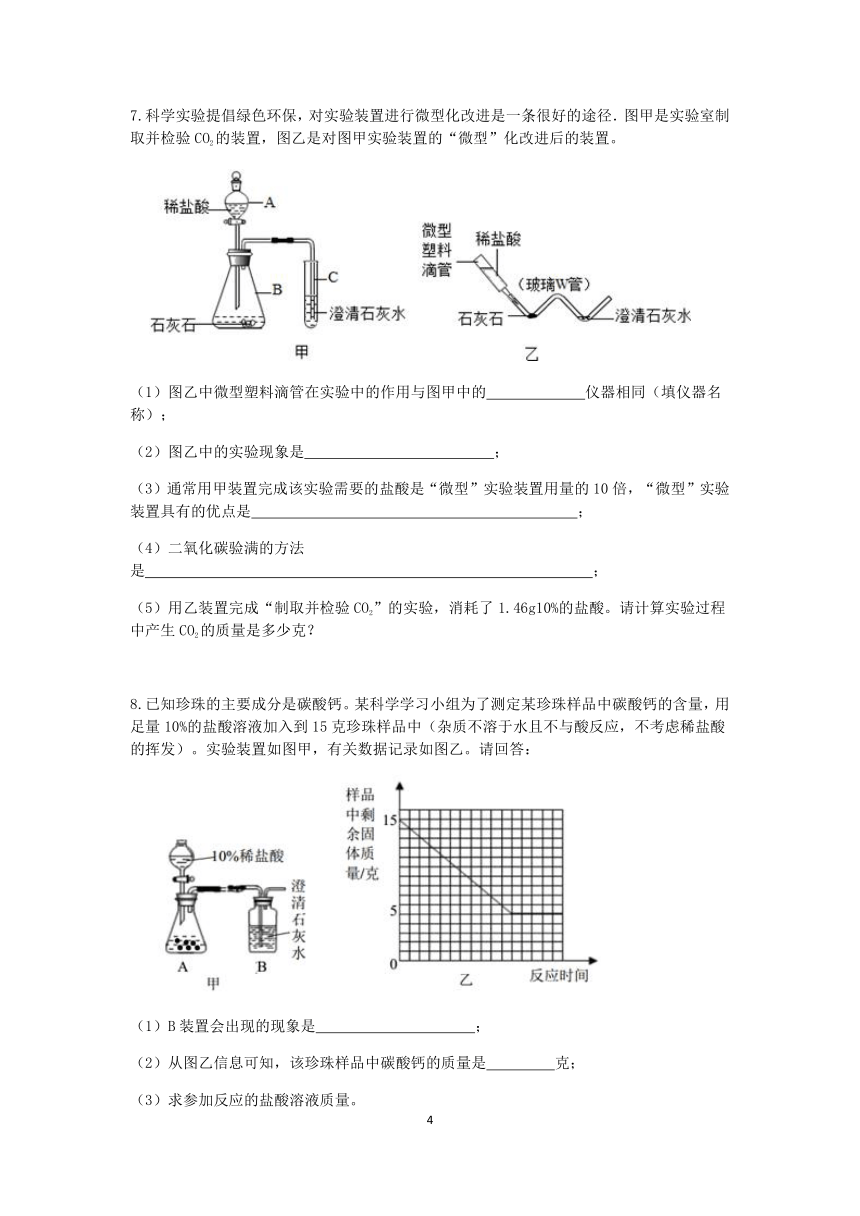
7.科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径.图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。
(1)图乙中微型塑料滴管在实验中的作用与图甲中的 仪器相同(填仪器名称);
(2)图乙中的实验现象是 ;
(3)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,“微型”实验装置具有的优点是 ;
(4)二氧化碳验满的方法是 ;
(5)用乙装置完成“制取并检验CO2”的实验,消耗了1.46g10%的盐酸。请计算实验过程中产生CO2的质量是多少克?
8.已知珍珠的主要成分是碳酸钙。某科学学习小组为了测定某珍珠样品中碳酸钙的含量,用足量10%的盐酸溶液加入到15克珍珠样品中(杂质不溶于水且不与酸反应,不考虑稀盐酸的挥发)。实验装置如图甲,有关数据记录如图乙。请回答:
(1)B装置会出现的现象是 ;
(2)从图乙信息可知,该珍珠样品中碳酸钙的质量是 克;
(3)求参加反应的盐酸溶液质量。
9.杨梅是时下最受市民欢迎的水果之一,市场上有一种带有杨梅味的果香型食品添加剂,它是以草莓醛(化学式:C12H14O3)为主体与一些酯类香料混合而成。
(1)草莓醛的相对分子质量为_________;
(2)草莓醛中氧元素的质量分数为_________;(结果保留到(0.1%)
(3)103克草莓醛与多少克碳酸钙所含的碳元素的质量相等?写出计算过程。
10.某同学向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:
反应前物质的质量/克 充分反应后物质的质量/克
过氧化氢溶液 二氧化锰 固体与液体混合物质量
68.0 0.1 66.5
请计算:
(1)该同学制得氧气的质量为________。
(2)该同学所用过氧化氢溶液中过氧化氢的质量。
11.过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如图所示.
(1)完全反应后生成氧气的质量为________g
(2)计算该过氧化氢溶液中溶质的质量分数.
12.在实验室里加热 60g 氯酸钾(KClO3)和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为 40.8g。请计算:
(1)生成氧气的质量为________g;
(2)原混合物中氯酸钾的质量。
(3)剩余固体中氧元素的质量分数(精确到 0.1%)
13.小晨同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作。她的具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:
反应过程 反应前 反应后
质量变化(不含容器质量) 34.3g 32.7g
若反应后,双氧水分解完全且氧气全部逸出,不计水分的蒸发,请完成下列问题:
(1)随着反应的进行,小晨会发现反应的反应速度再逐渐减慢,原因是________;
(2)反应得到氧气的质量是________g;
(3)二氧化锰在反应后的质量是________g;
(4)反应最后容器中水的质量是多少?
14.为了测定实验室中氯酸钾样品的纯度,某学习小组取2.5g该样品与0.8g二氧化锰混合.加热该混合物t1时间后(假设杂质不参加反应)。冷却,称量剩余固体质量,重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体的质量,记录数据如下表请仔细分析实验数据,回答下列问题:
加热时间 t1 t2 t3 t4
剩余固体质量/g 2.48 2.41 2.34 2.34
(1)在 时间后,该样品中的氯酸钾已经反应完全;
(2)求完全反应后产生氧气的质量;
(3)求该样品中氯酸钾的质量分数。
15.小金欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品5g,把60g稀盐酸分四次加入,实验过程所得数据如表(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应)。根据实验数据计算:
(1)表中x=______。
(2)第________次加入稀盐酸时,碳酸钙已经反应完全。
(3)求原60g稀盐酸中溶质质量分数(写出计算过程,计算结果精确到0.1%)
16.称取12.5克石灰石(主要成分是 CaCO3,杂质不参加反应)放入烧杯中,向其中加入50克稀盐酸,两者恰好完全反应。反应结束后称量烧杯中剩余物员的总崩量为58.1克(不包括烧杯的质量,且气体的溶解忽略不计)。 计算石灰石中CaCO3的质量分数和反应后所得溶液中的溶质质量。
参考答案
1.(1)NH3(2)3:1:4:7(3)120
2.(1)CO2;H2O (2)Na:Cl=46:71
3.(1)化学性质;质量(2)12.25g(3)1.6g
4.(1)测CO2的体积
(2)反应物接触面积较大,反应速率较快,相比之下,反应需要时间短
(3)生成二氧化碳的质量:m=ρV=1.98g/L×0.2L=0.396g;
设参加反应的碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
x 0.396g;
; 解得;x=0.9g;
那么难大理石中碳酸钙的含量为:。
【解析】(1)实验前,B中装满水。当产生的二氧化碳进入B中时,对里面的水产生压强,水沿着导管进入量筒,当水不流动时,量筒内水的体积就是生成二氧化碳的体积。
(2)在化学反应中,反应物的颗粒越小,接触面积越大,同时参加反应的物质越多,即反应速度越快,据此分析解得;
(3)首先根据m=ρV计算出生成二氧化碳的质量,然后写出碳酸钙与稀盐酸反应的方程式,利用比例关系计算出参加反应的碳酸钙的质量,最后与大理石的质量作比得到它的含量。
【解答】(1)了比较反应速度,设计如图一所示装置,其中量筒的作用是:测CO2的体积;
(2)对两次实验的曲线的解释:反应物接触面积较大,反应速率较快,相比之下,反应需要时间短。
(3)生成二氧化碳的质量:m=ρV=1.98g/L×0.2L=0.396g;
设参加反应的碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
x 0.396g;
; 解得;x=0.9g;
那么难大理石中碳酸钙的含量为:。
5.(1)甲
(2)解:设参加反应的大理石的质量为x
生成二氧化碳的质量=75.0g+25.0g﹣95.6g=4.4g
CaCO3+2HCl═CaCl2+H2O+ CO2↑
100 44
x 4.4g
= x=10g
CaCO3%=40%
【解析】(1)将甲和乙,甲和丙的实验数据进行比较即可;
(2)根据甲的数据可知,反应前后总质量之差就是生成二氧化碳的质量,写出碳酸钙和稀盐酸反应的方程式,利用二氧化碳的质量计算出参加反应的碳酸钙的质量,最后根据计算即可。
【解答】(1)甲和乙中,稀盐酸的质量相同,而大理石多加入了:30g-25g=5g,反应后总质量也增加了:100.6g-95.6g=5g,那么多加入的5g大理石没有反应。甲和丙中,大理石的质量相等,而多加入稀盐酸:95g-75g=20g,反应后总质量也增加了:115.6g-95.6g=20g,可见多加入的20g稀盐酸根本没有反应。二者对比可知,在甲中,稀盐酸和大理石刚好完全反应。
(2)生成二氧化碳的质量=75.0g+25.0g﹣95.6g=4.4g;
设参加反应的大理石的质量为x,
CaCO3+2HCl═CaCl2+H2O+ CO2↑
100 44
x 4.4g
;
解得:x=10g;
那么大理石中碳酸钙的质量分数为:。
6.设该蛋壳中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+ 2CO2↑
100 28
x 1.1升
100:28=x:1.1升
x=3.93,
蛋壳中碳酸钙的质量分数 =0.524
小明的计算过程中存在明显错误,请你通过列式进行计算(保留1位小数)。
【答案】(1)将生成的气体通入澄清的石灰水,发现变浑浊
(2)反应生成二氧化碳的质量m=ρV=2g/L×1.1L=2.2g;
设该蛋壳中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
x 2.2g
100:44=x:2.2g;
解得:x=5g;
蛋壳中碳酸钙的质量分数:。
【解析】(1)二氧化碳能够使澄清的石灰水变浑浊,通常用这个方法检验二氧化碳气体的存在;
(2)通过化学方程式能够得到的数量关系是反应物和生成物之间的质量关系,而不是体积关系,应该根据公式m=ρV计算出二氧化碳的质量,再利用方程式计算出参加反应的碳酸钙的质量,最后计算碳酸钙在蛋壳中的质量分数。同时还要注意化学方程式是否配平,据此判断并解答即可。
【解答】(1)第③步的实验内容与现象是:将生成的气体通入澄清的石灰水,发现变浑浊;
(2)反应生成二氧化碳的质量m=ρV=2g/L×1.1L=2.2g;
设该蛋壳中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
x 2.2g
100:44=x:2.2g;
解得:x=5g;
蛋壳中碳酸钙的质量分数:。
7.(1)分液漏斗
(2)石灰石表面有气泡产生
(3)药品用量少,产生的废弃物也少,操作方便
(4)将燃着的木条放在集气瓶口,木条熄灭,证明二氧化碳已集满
(5)解:设实验过程中产生CO2的质量为x
CaCO3+ 2HCl=CaCl2+H2O+ CO2↑
73 44
1.46g×10% x
73/44=(1.46g×10%)/x
x=0.088g
答:实验过程中产生CO2的质量为0.088g.
【解析】(1)图乙中微型塑料滴管在实验中的作用与图甲中的分液漏斗相同;
(2)图乙中石灰石与盐酸的反应,实验现象是石灰石表面有气泡产生;
(3)“微型”实验装置具有的优点是药品用量少,产生的废弃物也少,操作方便;
(4)二氧化碳验满的方法是将燃着的木条放在集气瓶口,木条熄灭,证明二氧化碳已集满;
8.(1)澄清石灰水变浑浊
(2)10
(3)设参加反应的HCl的质量为x
CaCO3+ 2HCl=CaCl2+H2O+ CO2↑
100 73
10克 x
100:10克=73:x
解得x=7.3克
m稀盐酸= =73克
【解析】(1)珍珠中的碳酸钙与稀盐酸反应,生成二氧化碳气体。二氧化碳被澄清的石灰水吸收,生成白色的碳酸钙沉淀,因此石灰水会变浑浊。
(2)根据质量守恒定律可知,反应前后固体质量的变化量就是其中碳酸钙的质量;
(3)写出碳酸钙与稀盐酸反应的方程式,根据碳酸钙的质量计算出参加反应的HCl的质量,最后根据计算消耗的稀盐酸的质量。
【解答】(1)B装置会出现的现象是:澄清石灰水变浑浊;
(2)从图乙信息可知,该珍珠样品中碳酸钙的质量是:15g-5g=10g;
(3)设参加反应的HCl的质量为x
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 73
10g x
100:10g=73:x
解得:x=7.3g;
。
9.(1)206(2)23.3%(3)600g
10.(1)1.6克
(2)解:设参加反应的H2O2的质量为x。
2H2O2 2H2O+ O2↑
68 32
x 1.6克
x=3.4克
答:该同学所用过氧化氢溶液中过氧化氢的质量为3.4克。
【解析】(1)根据质量守恒定律可知,生成氧气的质量为68.0g+0.1g-66.5g=1.6g;
(2)根据方程戒过氧化氢与氧气的质量比,利用氧气的质量计算出过氧化氢的质量。
11.(1)0.48g
(2)设过氧化氢溶液溶质质量分数为x
2H2O22H2O+O2↑
68 32
51gx 0.48g
68:32=51gx :0.48g
x=2%
【解析】根据方程式计算方法分析,利用氧气的质量代入方程式中根据物质间质量关系,计算出过氧化氢的质量,再利用溶质质量分数=溶质质量/溶液质量计算。
【解答】(1)由图像可知, 完全反应后生成氧气的质量为 0.48克;
(2)设过氧化氢溶液溶质质量分数为x
2H2O22H2O+O2↑
68 32
51gx 0.48g
68:32=51gx :0.48g
x=2%。
12.(1)19.2g
(2)解:设原混合物中氯酸钾的质量为x 克
2KClO3 2KCl+ 3O2↑
245 96
x 19.2g
∴x=49g
答:原混合物中氯酸钾的质量为 49 克
(3)二氧化锰的质量:60g-49g=11g
二氧化锰中氧元素的质量分数: ≈36.78%
固体中的氧元素: ≈9.9%
【解析】(1)根据质量守恒定律,参加化学反应的各物质的质量总和,等于反应后生成物质的质量总和据此可得出生成氧气的质量。
(2)根据化学反应方程式即可计算;
(3) 剩余固体中的氧元素质量分数= ╳ 100%
【解答】(1)根据质量守恒定律得生成氧气的质量为:60g-40.8g=19.2g
13.(1)随着反应的进行,过氧化氢的浓度会逐渐降低,所以反应速度会减慢
(2)1.6
(3)0.3
(4)32.4g
【解析】(1)反应物的浓度会影响化学反应的速度,即浓度越大,反应越快;
(2)根据质量守恒定律可知,反应前后总质量的差就是生成氧气的质量;
(3)根据过氧化氢分解的方程式,利用氧气的质量计算出参加反应的过氧化氢溶质的质量,再根据溶质质量÷质量分数计算出参加反应的过氧化氢溶液的质量,最后根据反应前总质量减去溶液质量计算二氧化锰的质量即可;
(4)反应后水的质量等于反应后物质的总质量和二氧化锰质量的差。
【解答】(1)随着反应的进行,小晨会发现反应的反应速度在逐渐减慢,原因是随着反应进行,过氧化氢浓度减小。
(2)反应得到氧气的质量是:34.3g-32.7g=1.6g,
(3)设过氧化氢质量为x,反应生成水的质量为y,
68 36 32
x y 1.6g
; 解得:x=3.4g;,
过氧化氢溶液质量:3.4g÷10%=34g,
二氧化锰在反应后的质量是:34.3g-34g=0.3g。
(4)反应最后容器中水的质量是:32.7g-0.3g=32.4g.
14.(1)t3
(2)根据质量守恒定律可知,反应生成氧气的质量为:2.5g+0.8g-2.34g=0.96g;
(3)设参加反应的氯酸钾的质量为x,
2KClO 2KCl+3O2 ↑
245 96
x 0.96g
; 解得:x=2.45g;
则氯酸钾的质量分数为:。
【解析】(1)当氯酸钾完全反应后,不再有氧气生成,则剩余固体的质量保持不变;
(2)根据质量守恒定律计算出生成氧气的质量;
(3)首先根据氯酸钾分解的方程式,利用氧气的质量计算出参加反应的氯酸钾的质量,然后根据氯酸钾的质量分数=计算即可。
15.(1)2.00。(2)3。(3)设第一次参加反应的HCl的质量为x10073=1.50x,x=1.095g稀盐酸中溶质质量分数为:1.095g15g×100%=7.3%答:原60g稀盐酸中溶质质量分数为7.3%。
16.
化学计算(2)
(1)人工合成尿素的化学方程式为:2■+CO2=催化剂CO(NH2)2+H2O,其中“■”为某种物质的化学式,则“■”是_____________。
(2)尿素中C、H、O、N四种元素的质量比为__________。
(3)_________克尿素中氮元素的质量是56克。
2.本学期我们学习了从分子、原子层面上认识和创造物质的部分知识。
(1)物质是由分子、原子、离子等微粒构成的。在铁、干冰、水、氯化钠四种物质中,由分子构成的是______________。(写化学式)
(2)氯化钠中钠元素和氯元素的质量比为________________。
3.实验室有一瓶含杂质的氯酸钾。取氯酸钾样品16.45g和一定质量二氧化锰混和加热(杂质不参加反应,不含氧元素),充分反应后测得剩余固体质量为16g,生成氧气4.8g。
(1)二氧化锰为该反应的催化剂,反应前后二氧化锰的__________和__________均没有发生改变;
(2)求样品中氯酸钾的质量:
(3)求剩余固体中氧元素的质量。
4.在制取CO2的实验中,小科发现质量相同而粗细不同的大理石与盐酸反应,CO2的产生速度细的比粗的快得多。经思考后,小科设计了如下实验(每次实验均用1g大理石,20mL盐酸)
实验序号 温度(℃) 大理石颗粒 盐酸质量分数(%) 实验目的
1 20 粗 5 探究大理石和盐酸的反应速度与石灰石颗粒大小的关系
2 20 细 5
(1)为了比较反应速度,设计如图一所示装置,其中量筒的作用是: ;
(2)两次实验中产生CO2体积随时间的变化关系如图二所示,请结合所学的知识对两次实验的曲线作出合理的解释。
(3)已知20℃该气压下CO2气体密度约1.98 g/L,求大理石中CaCO3的质量(写出计算过程)
5.某课外小组,用大理石与盐酸反应制取二氧化碳(大理石中杂质不与盐酸反应).甲、乙、丙三同学分别进行实验,实验数据如下(烧杯的质量为20.0g)。
烧杯+盐酸 大理石 充分反应后烧杯+剩余物
甲 75.0g 25.0g 95.6g
乙 75.0g 30.0g 100.6g
丙 95.0g 25.0g 115.6g
若甲、乙、丙三同学中有一名同学所取的大理石和盐酸恰好完全反应,请回答下列问题.
(1) 同学所取的盐酸与大理石恰好完全反应.
(2)计算大理石中碳酸钙的质量分数.
6.科学兴趣小组的同学们对蛋壳成分开展了有关探究。同学们的实验过程如下:
①将一定量的蛋壳放人容器中;②往其中加入适量的稀盐酸,观察到有较多的气泡产生;③……;④得出结论:蛋壳的主要成分是碳酸盐(如:碳酸钙)。
(1)请补全第③步的实验内容与现象
(2)为了测定蛋壳中碳酸钙的质量分数,同学们用蛋壳与足量的稀盐酸充分反应,得到有关数据如下表:(CO2的密度为2克/升)
蛋壳的质量/克 加入稀盐酸质量/克 收集到CO2气体体积/升
7.5 100 1.1
假设二氧化碳全部是由蛋壳中的碳酸钙与盐酸反应产生,小明计算这些蛋壳中碳酸钙的质量分数的过程如下:
7.科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径.图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。
(1)图乙中微型塑料滴管在实验中的作用与图甲中的 仪器相同(填仪器名称);
(2)图乙中的实验现象是 ;
(3)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,“微型”实验装置具有的优点是 ;
(4)二氧化碳验满的方法是 ;
(5)用乙装置完成“制取并检验CO2”的实验,消耗了1.46g10%的盐酸。请计算实验过程中产生CO2的质量是多少克?
8.已知珍珠的主要成分是碳酸钙。某科学学习小组为了测定某珍珠样品中碳酸钙的含量,用足量10%的盐酸溶液加入到15克珍珠样品中(杂质不溶于水且不与酸反应,不考虑稀盐酸的挥发)。实验装置如图甲,有关数据记录如图乙。请回答:
(1)B装置会出现的现象是 ;
(2)从图乙信息可知,该珍珠样品中碳酸钙的质量是 克;
(3)求参加反应的盐酸溶液质量。
9.杨梅是时下最受市民欢迎的水果之一,市场上有一种带有杨梅味的果香型食品添加剂,它是以草莓醛(化学式:C12H14O3)为主体与一些酯类香料混合而成。
(1)草莓醛的相对分子质量为_________;
(2)草莓醛中氧元素的质量分数为_________;(结果保留到(0.1%)
(3)103克草莓醛与多少克碳酸钙所含的碳元素的质量相等?写出计算过程。
10.某同学向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:
反应前物质的质量/克 充分反应后物质的质量/克
过氧化氢溶液 二氧化锰 固体与液体混合物质量
68.0 0.1 66.5
请计算:
(1)该同学制得氧气的质量为________。
(2)该同学所用过氧化氢溶液中过氧化氢的质量。
11.过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小.小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数.他们取出该溶液51g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如图所示.
(1)完全反应后生成氧气的质量为________g
(2)计算该过氧化氢溶液中溶质的质量分数.
12.在实验室里加热 60g 氯酸钾(KClO3)和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为 40.8g。请计算:
(1)生成氧气的质量为________g;
(2)原混合物中氯酸钾的质量。
(3)剩余固体中氧元素的质量分数(精确到 0.1%)
13.小晨同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作。她的具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:
反应过程 反应前 反应后
质量变化(不含容器质量) 34.3g 32.7g
若反应后,双氧水分解完全且氧气全部逸出,不计水分的蒸发,请完成下列问题:
(1)随着反应的进行,小晨会发现反应的反应速度再逐渐减慢,原因是________;
(2)反应得到氧气的质量是________g;
(3)二氧化锰在反应后的质量是________g;
(4)反应最后容器中水的质量是多少?
14.为了测定实验室中氯酸钾样品的纯度,某学习小组取2.5g该样品与0.8g二氧化锰混合.加热该混合物t1时间后(假设杂质不参加反应)。冷却,称量剩余固体质量,重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体的质量,记录数据如下表请仔细分析实验数据,回答下列问题:
加热时间 t1 t2 t3 t4
剩余固体质量/g 2.48 2.41 2.34 2.34
(1)在 时间后,该样品中的氯酸钾已经反应完全;
(2)求完全反应后产生氧气的质量;
(3)求该样品中氯酸钾的质量分数。
15.小金欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品5g,把60g稀盐酸分四次加入,实验过程所得数据如表(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应)。根据实验数据计算:
(1)表中x=______。
(2)第________次加入稀盐酸时,碳酸钙已经反应完全。
(3)求原60g稀盐酸中溶质质量分数(写出计算过程,计算结果精确到0.1%)
16.称取12.5克石灰石(主要成分是 CaCO3,杂质不参加反应)放入烧杯中,向其中加入50克稀盐酸,两者恰好完全反应。反应结束后称量烧杯中剩余物员的总崩量为58.1克(不包括烧杯的质量,且气体的溶解忽略不计)。 计算石灰石中CaCO3的质量分数和反应后所得溶液中的溶质质量。
参考答案
1.(1)NH3(2)3:1:4:7(3)120
2.(1)CO2;H2O (2)Na:Cl=46:71
3.(1)化学性质;质量(2)12.25g(3)1.6g
4.(1)测CO2的体积
(2)反应物接触面积较大,反应速率较快,相比之下,反应需要时间短
(3)生成二氧化碳的质量:m=ρV=1.98g/L×0.2L=0.396g;
设参加反应的碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
x 0.396g;
; 解得;x=0.9g;
那么难大理石中碳酸钙的含量为:。
【解析】(1)实验前,B中装满水。当产生的二氧化碳进入B中时,对里面的水产生压强,水沿着导管进入量筒,当水不流动时,量筒内水的体积就是生成二氧化碳的体积。
(2)在化学反应中,反应物的颗粒越小,接触面积越大,同时参加反应的物质越多,即反应速度越快,据此分析解得;
(3)首先根据m=ρV计算出生成二氧化碳的质量,然后写出碳酸钙与稀盐酸反应的方程式,利用比例关系计算出参加反应的碳酸钙的质量,最后与大理石的质量作比得到它的含量。
【解答】(1)了比较反应速度,设计如图一所示装置,其中量筒的作用是:测CO2的体积;
(2)对两次实验的曲线的解释:反应物接触面积较大,反应速率较快,相比之下,反应需要时间短。
(3)生成二氧化碳的质量:m=ρV=1.98g/L×0.2L=0.396g;
设参加反应的碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
x 0.396g;
; 解得;x=0.9g;
那么难大理石中碳酸钙的含量为:。
5.(1)甲
(2)解:设参加反应的大理石的质量为x
生成二氧化碳的质量=75.0g+25.0g﹣95.6g=4.4g
CaCO3+2HCl═CaCl2+H2O+ CO2↑
100 44
x 4.4g
= x=10g
CaCO3%=40%
【解析】(1)将甲和乙,甲和丙的实验数据进行比较即可;
(2)根据甲的数据可知,反应前后总质量之差就是生成二氧化碳的质量,写出碳酸钙和稀盐酸反应的方程式,利用二氧化碳的质量计算出参加反应的碳酸钙的质量,最后根据计算即可。
【解答】(1)甲和乙中,稀盐酸的质量相同,而大理石多加入了:30g-25g=5g,反应后总质量也增加了:100.6g-95.6g=5g,那么多加入的5g大理石没有反应。甲和丙中,大理石的质量相等,而多加入稀盐酸:95g-75g=20g,反应后总质量也增加了:115.6g-95.6g=20g,可见多加入的20g稀盐酸根本没有反应。二者对比可知,在甲中,稀盐酸和大理石刚好完全反应。
(2)生成二氧化碳的质量=75.0g+25.0g﹣95.6g=4.4g;
设参加反应的大理石的质量为x,
CaCO3+2HCl═CaCl2+H2O+ CO2↑
100 44
x 4.4g
;
解得:x=10g;
那么大理石中碳酸钙的质量分数为:。
6.设该蛋壳中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+ 2CO2↑
100 28
x 1.1升
100:28=x:1.1升
x=3.93,
蛋壳中碳酸钙的质量分数 =0.524
小明的计算过程中存在明显错误,请你通过列式进行计算(保留1位小数)。
【答案】(1)将生成的气体通入澄清的石灰水,发现变浑浊
(2)反应生成二氧化碳的质量m=ρV=2g/L×1.1L=2.2g;
设该蛋壳中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
x 2.2g
100:44=x:2.2g;
解得:x=5g;
蛋壳中碳酸钙的质量分数:。
【解析】(1)二氧化碳能够使澄清的石灰水变浑浊,通常用这个方法检验二氧化碳气体的存在;
(2)通过化学方程式能够得到的数量关系是反应物和生成物之间的质量关系,而不是体积关系,应该根据公式m=ρV计算出二氧化碳的质量,再利用方程式计算出参加反应的碳酸钙的质量,最后计算碳酸钙在蛋壳中的质量分数。同时还要注意化学方程式是否配平,据此判断并解答即可。
【解答】(1)第③步的实验内容与现象是:将生成的气体通入澄清的石灰水,发现变浑浊;
(2)反应生成二氧化碳的质量m=ρV=2g/L×1.1L=2.2g;
设该蛋壳中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 44
x 2.2g
100:44=x:2.2g;
解得:x=5g;
蛋壳中碳酸钙的质量分数:。
7.(1)分液漏斗
(2)石灰石表面有气泡产生
(3)药品用量少,产生的废弃物也少,操作方便
(4)将燃着的木条放在集气瓶口,木条熄灭,证明二氧化碳已集满
(5)解:设实验过程中产生CO2的质量为x
CaCO3+ 2HCl=CaCl2+H2O+ CO2↑
73 44
1.46g×10% x
73/44=(1.46g×10%)/x
x=0.088g
答:实验过程中产生CO2的质量为0.088g.
【解析】(1)图乙中微型塑料滴管在实验中的作用与图甲中的分液漏斗相同;
(2)图乙中石灰石与盐酸的反应,实验现象是石灰石表面有气泡产生;
(3)“微型”实验装置具有的优点是药品用量少,产生的废弃物也少,操作方便;
(4)二氧化碳验满的方法是将燃着的木条放在集气瓶口,木条熄灭,证明二氧化碳已集满;
8.(1)澄清石灰水变浑浊
(2)10
(3)设参加反应的HCl的质量为x
CaCO3+ 2HCl=CaCl2+H2O+ CO2↑
100 73
10克 x
100:10克=73:x
解得x=7.3克
m稀盐酸= =73克
【解析】(1)珍珠中的碳酸钙与稀盐酸反应,生成二氧化碳气体。二氧化碳被澄清的石灰水吸收,生成白色的碳酸钙沉淀,因此石灰水会变浑浊。
(2)根据质量守恒定律可知,反应前后固体质量的变化量就是其中碳酸钙的质量;
(3)写出碳酸钙与稀盐酸反应的方程式,根据碳酸钙的质量计算出参加反应的HCl的质量,最后根据计算消耗的稀盐酸的质量。
【解答】(1)B装置会出现的现象是:澄清石灰水变浑浊;
(2)从图乙信息可知,该珍珠样品中碳酸钙的质量是:15g-5g=10g;
(3)设参加反应的HCl的质量为x
CaCO3+2HCl=CaCl2+H2O+ CO2↑
100 73
10g x
100:10g=73:x
解得:x=7.3g;
。
9.(1)206(2)23.3%(3)600g
10.(1)1.6克
(2)解:设参加反应的H2O2的质量为x。
2H2O2 2H2O+ O2↑
68 32
x 1.6克
x=3.4克
答:该同学所用过氧化氢溶液中过氧化氢的质量为3.4克。
【解析】(1)根据质量守恒定律可知,生成氧气的质量为68.0g+0.1g-66.5g=1.6g;
(2)根据方程戒过氧化氢与氧气的质量比,利用氧气的质量计算出过氧化氢的质量。
11.(1)0.48g
(2)设过氧化氢溶液溶质质量分数为x
2H2O22H2O+O2↑
68 32
51gx 0.48g
68:32=51gx :0.48g
x=2%
【解析】根据方程式计算方法分析,利用氧气的质量代入方程式中根据物质间质量关系,计算出过氧化氢的质量,再利用溶质质量分数=溶质质量/溶液质量计算。
【解答】(1)由图像可知, 完全反应后生成氧气的质量为 0.48克;
(2)设过氧化氢溶液溶质质量分数为x
2H2O22H2O+O2↑
68 32
51gx 0.48g
68:32=51gx :0.48g
x=2%。
12.(1)19.2g
(2)解:设原混合物中氯酸钾的质量为x 克
2KClO3 2KCl+ 3O2↑
245 96
x 19.2g
∴x=49g
答:原混合物中氯酸钾的质量为 49 克
(3)二氧化锰的质量:60g-49g=11g
二氧化锰中氧元素的质量分数: ≈36.78%
固体中的氧元素: ≈9.9%
【解析】(1)根据质量守恒定律,参加化学反应的各物质的质量总和,等于反应后生成物质的质量总和据此可得出生成氧气的质量。
(2)根据化学反应方程式即可计算;
(3) 剩余固体中的氧元素质量分数= ╳ 100%
【解答】(1)根据质量守恒定律得生成氧气的质量为:60g-40.8g=19.2g
13.(1)随着反应的进行,过氧化氢的浓度会逐渐降低,所以反应速度会减慢
(2)1.6
(3)0.3
(4)32.4g
【解析】(1)反应物的浓度会影响化学反应的速度,即浓度越大,反应越快;
(2)根据质量守恒定律可知,反应前后总质量的差就是生成氧气的质量;
(3)根据过氧化氢分解的方程式,利用氧气的质量计算出参加反应的过氧化氢溶质的质量,再根据溶质质量÷质量分数计算出参加反应的过氧化氢溶液的质量,最后根据反应前总质量减去溶液质量计算二氧化锰的质量即可;
(4)反应后水的质量等于反应后物质的总质量和二氧化锰质量的差。
【解答】(1)随着反应的进行,小晨会发现反应的反应速度在逐渐减慢,原因是随着反应进行,过氧化氢浓度减小。
(2)反应得到氧气的质量是:34.3g-32.7g=1.6g,
(3)设过氧化氢质量为x,反应生成水的质量为y,
68 36 32
x y 1.6g
; 解得:x=3.4g;,
过氧化氢溶液质量:3.4g÷10%=34g,
二氧化锰在反应后的质量是:34.3g-34g=0.3g。
(4)反应最后容器中水的质量是:32.7g-0.3g=32.4g.
14.(1)t3
(2)根据质量守恒定律可知,反应生成氧气的质量为:2.5g+0.8g-2.34g=0.96g;
(3)设参加反应的氯酸钾的质量为x,
2KClO 2KCl+3O2 ↑
245 96
x 0.96g
; 解得:x=2.45g;
则氯酸钾的质量分数为:。
【解析】(1)当氯酸钾完全反应后,不再有氧气生成,则剩余固体的质量保持不变;
(2)根据质量守恒定律计算出生成氧气的质量;
(3)首先根据氯酸钾分解的方程式,利用氧气的质量计算出参加反应的氯酸钾的质量,然后根据氯酸钾的质量分数=计算即可。
15.(1)2.00。(2)3。(3)设第一次参加反应的HCl的质量为x10073=1.50x,x=1.095g稀盐酸中溶质质量分数为:1.095g15g×100%=7.3%答:原60g稀盐酸中溶质质量分数为7.3%。
16.
化学计算(2)
同课章节目录
