浙教版八年级科学2022-2023第二学期“期末冲刺”分类题型训练(二十):化学计算(3)(含答案)
文档属性
| 名称 | 浙教版八年级科学2022-2023第二学期“期末冲刺”分类题型训练(二十):化学计算(3)(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 188.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-10 19:31:09 | ||
图片预览


文档简介
1.2021年3月15日,央视曝光了“瘦肉精”事件。“瘦肉精”是一类药物的统称,其中较常见的是盐酸克仑特罗,其化学式为C12H19Cl3N2O。请回答:
(1) 一个盐酸克仑特罗分子由_________个原子构成。
(2)盐酸克仑特罗中氯、氮元素的质量比为_________(写最简整数比)。
(3) 627g盐酸克仑特罗中含有氧元素多少g?
2.在2.0g的大理石中加入足量的盐酸(假设杂质不与酸反应),用数字检测仪分别测得产生的二氧化碳体积随时间的变化曲线如图所示。甲曲线表示粉末状大理石与10%的盐酸反应过程,乙曲线表示块状大理石与10%的盐酸反应过程。已知:①该条件下,二氧化碳密度为1.98g/L。②一般来说,其他条件相同,增大反应物浓度,化学反应速率加快。
(1)根据图中信息,反应速率快的是_________(选填“甲”或“乙”)。
(2)求大理石中碳酸钙的百分含量。(写出计算过程,结果保留1位小数)
(3)请你在图中画出:用块状大理石与6%的盐酸反应的大致曲线。
3.为了测定实验室中高锰酸钾样品的纯度(假设杂质不参加反应),称取4.0g该样品中试管中加热。高锰酸钾完全分解,用排水法得到0.2升冷却到室温的氧气(常温下氧气的密度约为1.6克/升)。请回答下列问题:
(1)高锰酸钾完全分解得到氧气的质量约为__________;
(2)该样品中高锰酸钾的质量分数是多少?
4.某同学采用如图装置,用一些植物的器官来代替Mn02作催化剂,分解H202制取氧气,记录数据如下表。
请依据上述信息分析:
(1)要使胡萝卜能够更快地促进过氧化氢的分解,可采用的方法是__________________。
(2)当量筒内的水达到80毫升时,打开广口瓶的橡皮塞,立即将带火星的木条伸入瓶内,却发现木条不能复燃。请你解释木条不能复燃的原因是______________________________。
(3)计算:34克15%的H202溶液中的溶质完全分解,能制得氧气多少克?
5.在一种新催化剂作用下可实现二氧化碳与氢气反应,高效地转化为甲醇(CH3OH)和另一种不含碳的常见化合物。
(1)CH3OH中H、O原子的个数比为_________;
(2)CH3OH中C元素的质量分数为多少?
(3)理论上转化44吨二氧化碳可制得多少吨甲醇?
6.抗击新冠肺炎疫情中,一种名为瑞德西韦(分子式为C27H35N6O8P)的新药曾被寄予厚望。请回答:
(1)瑞德西韦由_________种元素组成,其中碳、氧元素的质量比为_________(最简整数比)。
(2)该药品中氧元素的质量分数是_________(精确到0.1%)。301mg瑞德西韦中含有氢元素的质量为_________mg。
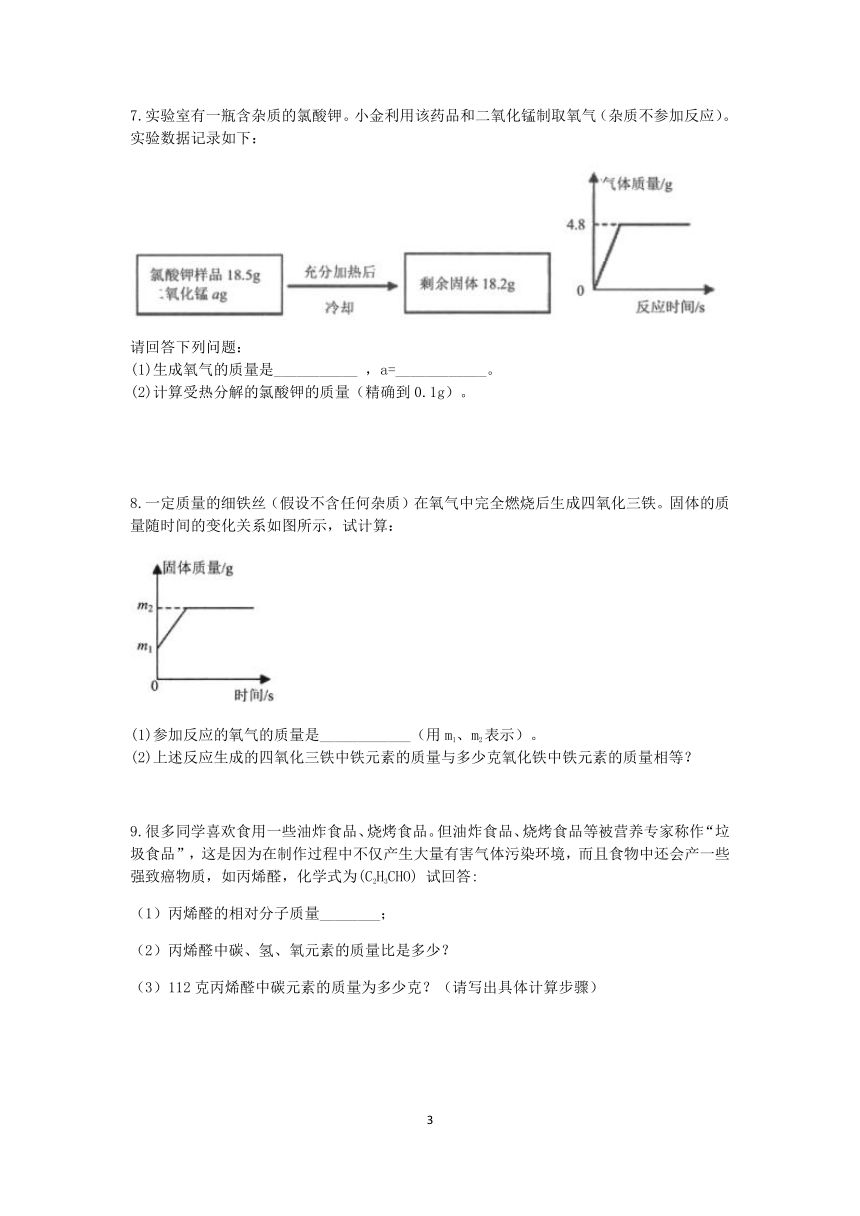
7.实验室有一瓶含杂质的氯酸钾。小金利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如下:
请回答下列问题:
(1)生成氧气的质量是___________ ,a=____________。
(2)计算受热分解的氯酸钾的质量(精确到0.1g)。
8.一定质量的细铁丝(假设不含任何杂质)在氧气中完全燃烧后生成四氧化三铁。固体的质量随时间的变化关系如图所示,试计算:
(1)参加反应的氧气的质量是____________(用m1、m2表示)。
(2)上述反应生成的四氧化三铁中铁元素的质量与多少克氧化铁中铁元素的质量相等?
9.很多同学喜欢食用一些油炸食品、烧烤食品。但油炸食品、烧烤食品等被营养专家称作“垃圾食品”,这是因为在制作过程中不仅产生大量有害气体污染环境,而且食物中还会产一些强致癌物质,如丙烯醛,化学式为(C2H3CHO) 试回答:
(1)丙烯醛的相对分子质量________;
(2)丙烯醛中碳、氢、氧元素的质量比是多少?
(3)112克丙烯醛中碳元素的质量为多少克?(请写出具体计算步骤)
10.取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:
(1)生成氧气的质量是________克;
(2)参加反应的氯酸钾的质量是多少克?(写出具体计算步骤)
(3)氯化钾溶液的质量是多少克?(写出具体计算步骤)
11.复方冬青软膏具有强力迅速镇痛作用,其有效成分A的分子模型如图所示:
(1)A物质的化学式为___________;
(2)A物质中碳元素的质量分数为__________ (结果精确到0.1%)
(3)76克A物质中所含氧元素的质量为?
12.超市卖的纯碱产品中往往会含有少量的氯化钠,化学兴趣小组的同学要通过实验来测定某品牌的纯碱样品中Na2CO3的质量分数。他们取了6g纯碱样品放入烧杯中,再将80g一定溶质质量分数的稀盐酸分4次加入该烧杯中,充分反应后测得实验数据如下表(不考虑CO2溶解于水)。(计算结果精确到0.1%)
(1)表格中m的值为__________。
(2)样品中Na2CO3的质量分数是多少?
(3)第四次实验后所得溶液中NaCl的质量分数是多少?
13.小乐利用图示实验装置测定某大理石样品的纯度(所含杂质不与盐酸反应,且不溶于水)。她取了该大理石样品12.5g,并加入足量稀盐酸进行实验。实验数据记录如下表:
(1)反应共生成CO2的质量为_______g。
(2)计算该大理石样品中CaCO3的质量分数。(写出计算过程)
14.为测定某钙片中碳酸钙的质量分数(钙片中其他成分不参与反应),小乐取10g钙片研磨后,进行了如图所示的实验(忽略水分蒸发)。回答下列问题:
(1)研磨钙片的目的是_____________。该实验中,装置的气密性对测定结果__________(选填“有”或“无”)影响。
(2)计算该钙片中碳酸钙的质量分数。(写出计算过程)
参考答案
1.(1)甲 (2)设2.0g大理石中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 400×10﹣3L×1.98g/L
100/44=x/400×10 3L×1.98g/Lx=1.8g
则大理石中碳酸钙的百分含量为1.8g/2.0g×100%=90%
答:大理石中碳酸钙的百分含量为90%。
(3)依据题意可知,一般来说,其他条件相同,增大反应物浓度,化学反应速率加快,则:
3.(1)0.32(2)79%
4.(1)将胡萝卜切成更小的颗粒(或“将胡萝卜磨成浆”等均可);(2)此时广口瓶内的气体主要为空气
(3)解:设产生氧气的质量为m
2H2O2=2H2O+O2↑
68 32
34克×15% m
68/34克×15%=32/m m=2.4g
5.(1)4:1 (2)C%=C/CH3OH=1232=37.5%(3)设可制得甲醇质量为x,根据C元素质量守恒,可得:44吨×12/44=x×12/32 解得:x=32吨
6.(1)5;81:32 (2)21.3%;17.5
7.(1)4.8g,4.5g(2)由于是充分反应,所以是氯酸钾完全分解,设原固体混合物中氯酸钾的质量为x。
2KClO3===2KCl+3O2↑
245 96
x 4.8g
245/96=x/4.8g x≈12.3g
答:(2)受热分解的氯酸钾的质量12.3g。
8.(1)(m2-m1)g (2)设:上述反应生成的四氧化三铁与X克氧化铁的含铁量相等∵ 化合物中某元素的质量=该化合物的质量×该化合物中该元素的质量分数m2×3×563×56+4×16×100%=X×2×562×56+3×16×100%计算得:X=30m229(克)
9.(1)56 (2)9:1:4(3)112g丙烯醛中碳元素的质量为112g×12×356×100%=72g
10.(1)4.8 (2)设氯酸钾的质量为x,生成氯化钾的质量为y,
2KClO3 = 2KCl + 3O2↑
245 149 96
x y 4.8
245/x=96/4.8 149/y=96/4.8解得:x=12.25g,y=7.45g
(3)解:氯化钾溶液的质量:7.45g10%=74.5g
11.(1)C8H8O3 (2)63.2% (3)24g
12.(1)44.4 (2)88.3% (3)7.8%
13.(1)4.4(2)解:设CaCO3的质量为x。
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 4.4g
100/44=x/4.4g x=100×4.4g/44=10g
大理石样品中CaCO3的质量分数=10g12.5g×100%=80%
答:大理石样品中CaCO3的质量分数为80%。
14.(1)增大接触面积,使反应更充分。无。
(2)二氧化碳质量为340g-336.7g=3.3g
设碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 3.3g
x=7.5g
碳酸钙的质量分数为=7.5g/10g×100%=75%
化学计算(3)
(1) 一个盐酸克仑特罗分子由_________个原子构成。
(2)盐酸克仑特罗中氯、氮元素的质量比为_________(写最简整数比)。
(3) 627g盐酸克仑特罗中含有氧元素多少g?
2.在2.0g的大理石中加入足量的盐酸(假设杂质不与酸反应),用数字检测仪分别测得产生的二氧化碳体积随时间的变化曲线如图所示。甲曲线表示粉末状大理石与10%的盐酸反应过程,乙曲线表示块状大理石与10%的盐酸反应过程。已知:①该条件下,二氧化碳密度为1.98g/L。②一般来说,其他条件相同,增大反应物浓度,化学反应速率加快。
(1)根据图中信息,反应速率快的是_________(选填“甲”或“乙”)。
(2)求大理石中碳酸钙的百分含量。(写出计算过程,结果保留1位小数)
(3)请你在图中画出:用块状大理石与6%的盐酸反应的大致曲线。
3.为了测定实验室中高锰酸钾样品的纯度(假设杂质不参加反应),称取4.0g该样品中试管中加热。高锰酸钾完全分解,用排水法得到0.2升冷却到室温的氧气(常温下氧气的密度约为1.6克/升)。请回答下列问题:
(1)高锰酸钾完全分解得到氧气的质量约为__________;
(2)该样品中高锰酸钾的质量分数是多少?
4.某同学采用如图装置,用一些植物的器官来代替Mn02作催化剂,分解H202制取氧气,记录数据如下表。
请依据上述信息分析:
(1)要使胡萝卜能够更快地促进过氧化氢的分解,可采用的方法是__________________。
(2)当量筒内的水达到80毫升时,打开广口瓶的橡皮塞,立即将带火星的木条伸入瓶内,却发现木条不能复燃。请你解释木条不能复燃的原因是______________________________。
(3)计算:34克15%的H202溶液中的溶质完全分解,能制得氧气多少克?
5.在一种新催化剂作用下可实现二氧化碳与氢气反应,高效地转化为甲醇(CH3OH)和另一种不含碳的常见化合物。
(1)CH3OH中H、O原子的个数比为_________;
(2)CH3OH中C元素的质量分数为多少?
(3)理论上转化44吨二氧化碳可制得多少吨甲醇?
6.抗击新冠肺炎疫情中,一种名为瑞德西韦(分子式为C27H35N6O8P)的新药曾被寄予厚望。请回答:
(1)瑞德西韦由_________种元素组成,其中碳、氧元素的质量比为_________(最简整数比)。
(2)该药品中氧元素的质量分数是_________(精确到0.1%)。301mg瑞德西韦中含有氢元素的质量为_________mg。
7.实验室有一瓶含杂质的氯酸钾。小金利用该药品和二氧化锰制取氧气(杂质不参加反应)。实验数据记录如下:
请回答下列问题:
(1)生成氧气的质量是___________ ,a=____________。
(2)计算受热分解的氯酸钾的质量(精确到0.1g)。
8.一定质量的细铁丝(假设不含任何杂质)在氧气中完全燃烧后生成四氧化三铁。固体的质量随时间的变化关系如图所示,试计算:
(1)参加反应的氧气的质量是____________(用m1、m2表示)。
(2)上述反应生成的四氧化三铁中铁元素的质量与多少克氧化铁中铁元素的质量相等?
9.很多同学喜欢食用一些油炸食品、烧烤食品。但油炸食品、烧烤食品等被营养专家称作“垃圾食品”,这是因为在制作过程中不仅产生大量有害气体污染环境,而且食物中还会产一些强致癌物质,如丙烯醛,化学式为(C2H3CHO) 试回答:
(1)丙烯醛的相对分子质量________;
(2)丙烯醛中碳、氢、氧元素的质量比是多少?
(3)112克丙烯醛中碳元素的质量为多少克?(请写出具体计算步骤)
10.取氯酸钾和二氧化锰的混合物13g,加热至混合物固体质量不再减少为止,冷却后称得固体质量为8.2g,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假设溶液无损失),计算:
(1)生成氧气的质量是________克;
(2)参加反应的氯酸钾的质量是多少克?(写出具体计算步骤)
(3)氯化钾溶液的质量是多少克?(写出具体计算步骤)
11.复方冬青软膏具有强力迅速镇痛作用,其有效成分A的分子模型如图所示:
(1)A物质的化学式为___________;
(2)A物质中碳元素的质量分数为__________ (结果精确到0.1%)
(3)76克A物质中所含氧元素的质量为?
12.超市卖的纯碱产品中往往会含有少量的氯化钠,化学兴趣小组的同学要通过实验来测定某品牌的纯碱样品中Na2CO3的质量分数。他们取了6g纯碱样品放入烧杯中,再将80g一定溶质质量分数的稀盐酸分4次加入该烧杯中,充分反应后测得实验数据如下表(不考虑CO2溶解于水)。(计算结果精确到0.1%)
(1)表格中m的值为__________。
(2)样品中Na2CO3的质量分数是多少?
(3)第四次实验后所得溶液中NaCl的质量分数是多少?
13.小乐利用图示实验装置测定某大理石样品的纯度(所含杂质不与盐酸反应,且不溶于水)。她取了该大理石样品12.5g,并加入足量稀盐酸进行实验。实验数据记录如下表:
(1)反应共生成CO2的质量为_______g。
(2)计算该大理石样品中CaCO3的质量分数。(写出计算过程)
14.为测定某钙片中碳酸钙的质量分数(钙片中其他成分不参与反应),小乐取10g钙片研磨后,进行了如图所示的实验(忽略水分蒸发)。回答下列问题:
(1)研磨钙片的目的是_____________。该实验中,装置的气密性对测定结果__________(选填“有”或“无”)影响。
(2)计算该钙片中碳酸钙的质量分数。(写出计算过程)
参考答案
1.(1)甲 (2)设2.0g大理石中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 400×10﹣3L×1.98g/L
100/44=x/400×10 3L×1.98g/Lx=1.8g
则大理石中碳酸钙的百分含量为1.8g/2.0g×100%=90%
答:大理石中碳酸钙的百分含量为90%。
(3)依据题意可知,一般来说,其他条件相同,增大反应物浓度,化学反应速率加快,则:
3.(1)0.32(2)79%
4.(1)将胡萝卜切成更小的颗粒(或“将胡萝卜磨成浆”等均可);(2)此时广口瓶内的气体主要为空气
(3)解:设产生氧气的质量为m
2H2O2=2H2O+O2↑
68 32
34克×15% m
68/34克×15%=32/m m=2.4g
5.(1)4:1 (2)C%=C/CH3OH=1232=37.5%(3)设可制得甲醇质量为x,根据C元素质量守恒,可得:44吨×12/44=x×12/32 解得:x=32吨
6.(1)5;81:32 (2)21.3%;17.5
7.(1)4.8g,4.5g(2)由于是充分反应,所以是氯酸钾完全分解,设原固体混合物中氯酸钾的质量为x。
2KClO3===2KCl+3O2↑
245 96
x 4.8g
245/96=x/4.8g x≈12.3g
答:(2)受热分解的氯酸钾的质量12.3g。
8.(1)(m2-m1)g (2)设:上述反应生成的四氧化三铁与X克氧化铁的含铁量相等∵ 化合物中某元素的质量=该化合物的质量×该化合物中该元素的质量分数m2×3×563×56+4×16×100%=X×2×562×56+3×16×100%计算得:X=30m229(克)
9.(1)56 (2)9:1:4(3)112g丙烯醛中碳元素的质量为112g×12×356×100%=72g
10.(1)4.8 (2)设氯酸钾的质量为x,生成氯化钾的质量为y,
2KClO3 = 2KCl + 3O2↑
245 149 96
x y 4.8
245/x=96/4.8 149/y=96/4.8解得:x=12.25g,y=7.45g
(3)解:氯化钾溶液的质量:7.45g10%=74.5g
11.(1)C8H8O3 (2)63.2% (3)24g
12.(1)44.4 (2)88.3% (3)7.8%
13.(1)4.4(2)解:设CaCO3的质量为x。
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 4.4g
100/44=x/4.4g x=100×4.4g/44=10g
大理石样品中CaCO3的质量分数=10g12.5g×100%=80%
答:大理石样品中CaCO3的质量分数为80%。
14.(1)增大接触面积,使反应更充分。无。
(2)二氧化碳质量为340g-336.7g=3.3g
设碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 3.3g
x=7.5g
碳酸钙的质量分数为=7.5g/10g×100%=75%
化学计算(3)
同课章节目录
