1.1原子结构与性质(共14张PPT)2022-2023学年高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 1.1原子结构与性质(共14张PPT)2022-2023学年高一下学期化学鲁科版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-11 15:33:50 | ||
图片预览


文档简介
(共14张PPT)
原子结构与元素性质
01
原子结构
02
元素得失电子能力
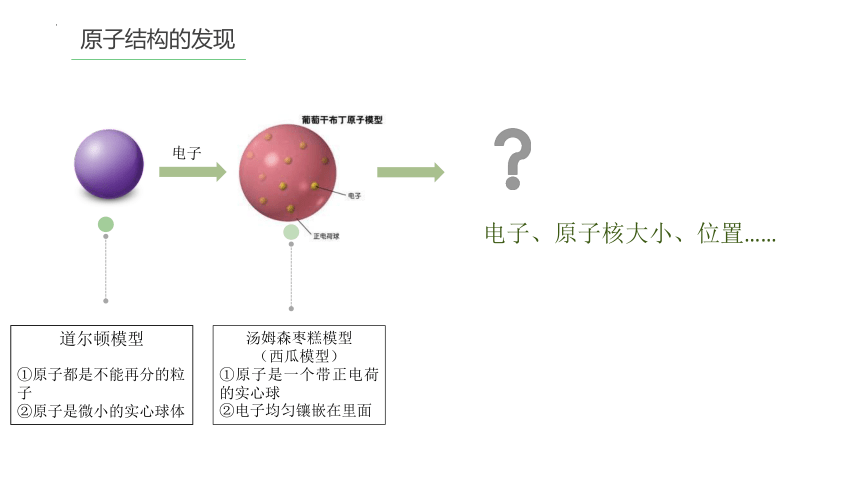
原子结构的发现
道尔顿模型
①原子都是不能再分的粒子
②原子是微小的实心球体
汤姆森枣糕模型
(西瓜模型)
①原子是一个带正电荷的实心球
②电子均匀镶嵌在里面
电子
电子、原子核大小、位置……
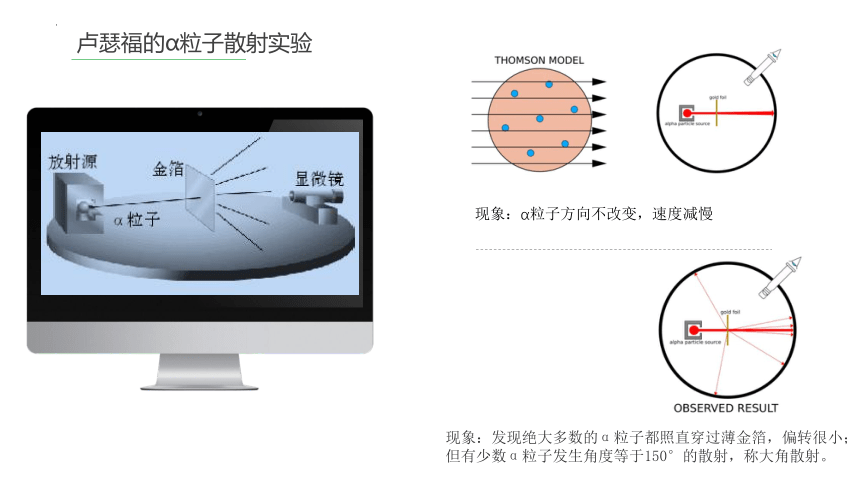
卢瑟福的α粒子散射实验
现象:α粒子方向不改变,速度减慢
现象:发现绝大多数的α粒子都照直穿过薄金箔,偏转很小;
但有少数α粒子发生角度等于150°的散射,称大角散射。
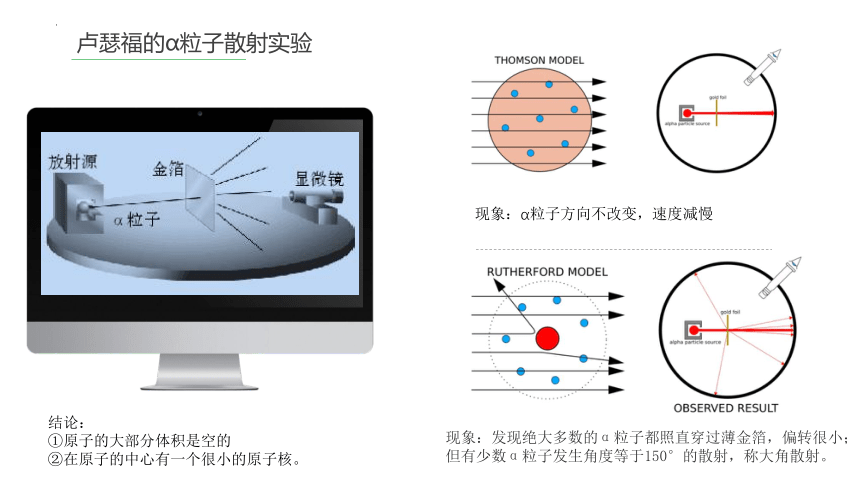
卢瑟福的α粒子散射实验
结论:
①原子的大部分体积是空的
②在原子的中心有一个很小的原子核。
现象:α粒子方向不改变,速度减慢
现象:发现绝大多数的α粒子都照直穿过薄金箔,偏转很小;
但有少数α粒子发生角度等于150°的散射,称大角散射。
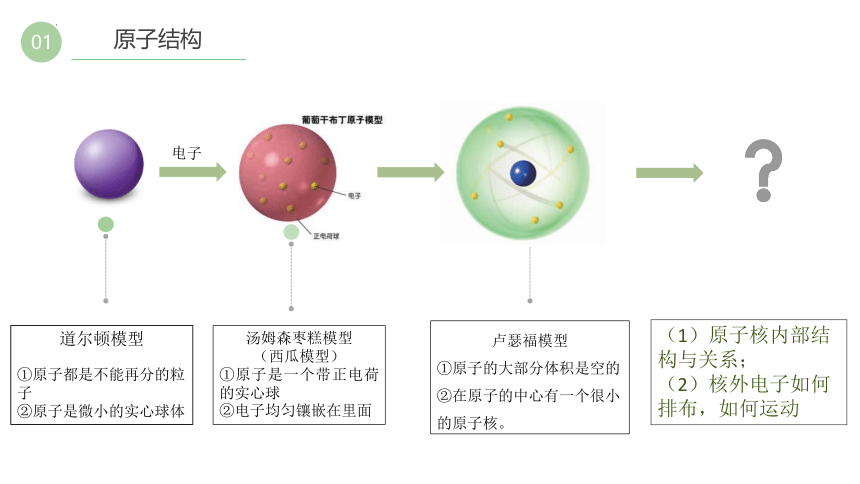
01
原子结构
道尔顿模型
①原子都是不能再分的粒子
②原子是微小的实心球体
卢瑟福模型
①原子的大部分体积是空的
②在原子的中心有一个很小的原子核。
汤姆森枣糕模型
(西瓜模型)
①原子是一个带正电荷的实心球
②电子均匀镶嵌在里面
电子
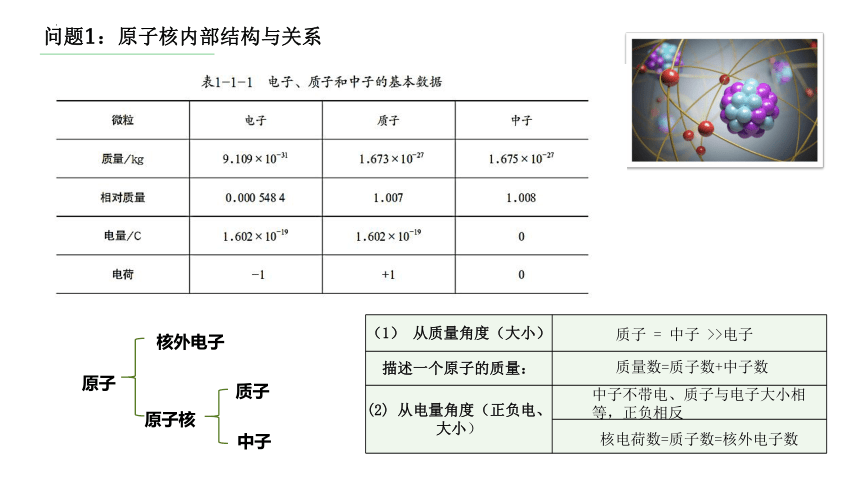
(1)原子核内部结构与关系;
(2)核外电子如何排布,如何运动
问题1:原子核内部结构与关系
质子
中子
核外电子
原子核
原子
(1) 从质量角度(大小)
描述一个原子的质量:
(2) 从电量角度(正负电、大小)
质子 = 中子 >>电子
质量数=质子数+中子数
中子不带电、质子与电子大小相等,正负相反
核电荷数=质子数=核外电子数
01
原子结构
练习:
说出下列元素的质量数、质子数、中子数、核外电子数
质量数(A)= 质子数(Z) + 中子数(N)
(1) 从质量角度(大小) 质子 = 中子 >>电子
描述一个原子的质量: 质量数=质子数+中子数
(2) 从电量角度(正负电、大小) 中子不带电、质子与电子大小相等,正负相反
核电荷数=质子数=核外电子数
质子 Z个
中子 (A-Z)/N个
核外电子 Z个
原子核
原子
01
原子结构
质子数 1 1 1
中子数 0 1 2
质量数 1 2 3
同位素:质子数相同而中子数不同的同一元素的不同核素互为同位素
元素:质子数相同的一类原子。
核素:具有相同质子数和相同中子数的一类原子
相对原子质量:
各核素的相对原子质量分别与各核素在自然界的丰度乘积之和。
(氕丰度:99.98%、氘丰度0.02%、氚自然界中存在极微,从核反应制得)
“国之光荣”的秦山核电站
问题2:核外电子运动关系
道尔顿模型
①原子都是不能再分的粒子
②原子是微小的实心球体
卢瑟福模型
①原子的大部分体积是空的
②在原子的中心有一个很小的原子核。
汤姆森枣糕模型
(西瓜模型)
①原子是一个带正电荷的实心球
②电子均匀镶嵌在里面
电子
玻尔原子模型
电子在一些特定的可能轨道上绕核作圆周运动,离核愈远能量愈高
核外电子排布
02
由低到高
书写规则:每层可容纳电子数2n2(n是电子层数),
每层依次是2、8、18、32
(1)先确定该原子的核外电子数
(即原子序数、质子数、核电荷数)
(2)电子先填充内层,再填充外层
(3)最内层最多两个电子,次外层最多八个电子,最外层最多八个电子。
尝试写出Na的原子排布:
11号元素,原子序数=质子数=核电荷数
K层2,L层8,M层1
核外电子排布规律
02
金属元素:
最外层电子数一般小于4(H除外),容易失去电子生成阳离子
非金属元素:
最外层电子数一般等于或大于4(H除外),易得到电子生成阴离子。
稀有气体(惰性气体):
最外层电子数一般等于8(He除外),稳定
Na、Mg、K哪个容易失去电子?
问题三:Na、Mg、K哪个容易失去电子?
02
03
04
微观预测 宏观实验现象 结论
钠镁的失电子能力 (更容易失去)
钠钾的失电子能力 (更容易失去)
预测:
(1)最外层电子数越多
(2) 能层越多
实验验证:
(1) 金属元素:还原性
(2)与氧气、与水、与酸反应。
氧化还原反应的实质:
电子的得失
微观
宏观
多数情况下可以通过比较元素的单质与水或酸的反应置换出氢气的难易程度来判断元素原子失电子能力的强弱。
(越外层能量越高,受原子核束缚越弱)
2Na + 2H2O = 2NaOH +H2
问题3:Na、Mg、K哪个容易失去电子?
02
03
04
能层个数
最外层电子数
钠和镁
与水反应快慢
核外电子排布
氧化还原反应
微观
宏观
钠和钾
与酸反应快慢
预测 实验现象 结论
钠镁的失电子能力 (更容易失去) 钠
钠钾的失电子能力 (更容易失去) 钾
结论:
(1) 原子的电子层数相同,最外层电子数越大,原子越容易得电子。
(2) 最外层电子数相同,电子层数越多,越容易失电子。
总结
质子 Z个
中子 (A-Z)个
核外电子 Z个
原子核
原子
卢瑟福的α粒子散射实验
(1)原子结构
微观推测
宏观验证
得失电子能力
书写规则
(2)核外电子排布
原子结构与元素性质
01
原子结构
02
元素得失电子能力
原子结构的发现
道尔顿模型
①原子都是不能再分的粒子
②原子是微小的实心球体
汤姆森枣糕模型
(西瓜模型)
①原子是一个带正电荷的实心球
②电子均匀镶嵌在里面
电子
电子、原子核大小、位置……
卢瑟福的α粒子散射实验
现象:α粒子方向不改变,速度减慢
现象:发现绝大多数的α粒子都照直穿过薄金箔,偏转很小;
但有少数α粒子发生角度等于150°的散射,称大角散射。
卢瑟福的α粒子散射实验
结论:
①原子的大部分体积是空的
②在原子的中心有一个很小的原子核。
现象:α粒子方向不改变,速度减慢
现象:发现绝大多数的α粒子都照直穿过薄金箔,偏转很小;
但有少数α粒子发生角度等于150°的散射,称大角散射。
01
原子结构
道尔顿模型
①原子都是不能再分的粒子
②原子是微小的实心球体
卢瑟福模型
①原子的大部分体积是空的
②在原子的中心有一个很小的原子核。
汤姆森枣糕模型
(西瓜模型)
①原子是一个带正电荷的实心球
②电子均匀镶嵌在里面
电子
(1)原子核内部结构与关系;
(2)核外电子如何排布,如何运动
问题1:原子核内部结构与关系
质子
中子
核外电子
原子核
原子
(1) 从质量角度(大小)
描述一个原子的质量:
(2) 从电量角度(正负电、大小)
质子 = 中子 >>电子
质量数=质子数+中子数
中子不带电、质子与电子大小相等,正负相反
核电荷数=质子数=核外电子数
01
原子结构
练习:
说出下列元素的质量数、质子数、中子数、核外电子数
质量数(A)= 质子数(Z) + 中子数(N)
(1) 从质量角度(大小) 质子 = 中子 >>电子
描述一个原子的质量: 质量数=质子数+中子数
(2) 从电量角度(正负电、大小) 中子不带电、质子与电子大小相等,正负相反
核电荷数=质子数=核外电子数
质子 Z个
中子 (A-Z)/N个
核外电子 Z个
原子核
原子
01
原子结构
质子数 1 1 1
中子数 0 1 2
质量数 1 2 3
同位素:质子数相同而中子数不同的同一元素的不同核素互为同位素
元素:质子数相同的一类原子。
核素:具有相同质子数和相同中子数的一类原子
相对原子质量:
各核素的相对原子质量分别与各核素在自然界的丰度乘积之和。
(氕丰度:99.98%、氘丰度0.02%、氚自然界中存在极微,从核反应制得)
“国之光荣”的秦山核电站
问题2:核外电子运动关系
道尔顿模型
①原子都是不能再分的粒子
②原子是微小的实心球体
卢瑟福模型
①原子的大部分体积是空的
②在原子的中心有一个很小的原子核。
汤姆森枣糕模型
(西瓜模型)
①原子是一个带正电荷的实心球
②电子均匀镶嵌在里面
电子
玻尔原子模型
电子在一些特定的可能轨道上绕核作圆周运动,离核愈远能量愈高
核外电子排布
02
由低到高
书写规则:每层可容纳电子数2n2(n是电子层数),
每层依次是2、8、18、32
(1)先确定该原子的核外电子数
(即原子序数、质子数、核电荷数)
(2)电子先填充内层,再填充外层
(3)最内层最多两个电子,次外层最多八个电子,最外层最多八个电子。
尝试写出Na的原子排布:
11号元素,原子序数=质子数=核电荷数
K层2,L层8,M层1
核外电子排布规律
02
金属元素:
最外层电子数一般小于4(H除外),容易失去电子生成阳离子
非金属元素:
最外层电子数一般等于或大于4(H除外),易得到电子生成阴离子。
稀有气体(惰性气体):
最外层电子数一般等于8(He除外),稳定
Na、Mg、K哪个容易失去电子?
问题三:Na、Mg、K哪个容易失去电子?
02
03
04
微观预测 宏观实验现象 结论
钠镁的失电子能力 (更容易失去)
钠钾的失电子能力 (更容易失去)
预测:
(1)最外层电子数越多
(2) 能层越多
实验验证:
(1) 金属元素:还原性
(2)与氧气、与水、与酸反应。
氧化还原反应的实质:
电子的得失
微观
宏观
多数情况下可以通过比较元素的单质与水或酸的反应置换出氢气的难易程度来判断元素原子失电子能力的强弱。
(越外层能量越高,受原子核束缚越弱)
2Na + 2H2O = 2NaOH +H2
问题3:Na、Mg、K哪个容易失去电子?
02
03
04
能层个数
最外层电子数
钠和镁
与水反应快慢
核外电子排布
氧化还原反应
微观
宏观
钠和钾
与酸反应快慢
预测 实验现象 结论
钠镁的失电子能力 (更容易失去) 钠
钠钾的失电子能力 (更容易失去) 钾
结论:
(1) 原子的电子层数相同,最外层电子数越大,原子越容易得电子。
(2) 最外层电子数相同,电子层数越多,越容易失电子。
总结
质子 Z个
中子 (A-Z)个
核外电子 Z个
原子核
原子
卢瑟福的α粒子散射实验
(1)原子结构
微观推测
宏观验证
得失电子能力
书写规则
(2)核外电子排布
