8.1.2海水资源的开发利用(精品课件)(共24张PPT)-2022-2023学年高一化学同步精品课堂(人教版2019必修第二册)
文档属性
| 名称 | 8.1.2海水资源的开发利用(精品课件)(共24张PPT)-2022-2023学年高一化学同步精品课堂(人教版2019必修第二册) |  | |
| 格式 | pptx | ||
| 文件大小 | 29.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-12 08:26:54 | ||
图片预览




文档简介
(共24张PPT)
走进奇妙的化学世界
2022-2023
必修第二册
第八章
化学与可持续发展
第一节
自然资源的开发利用
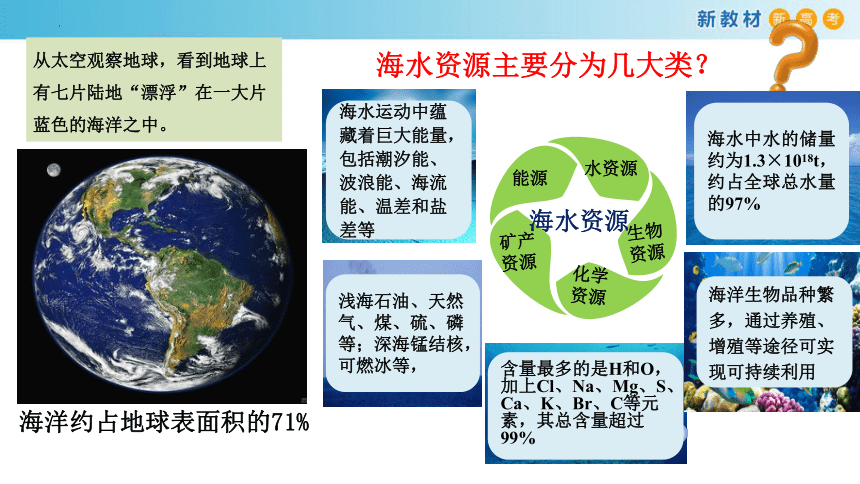
海洋中蕴含着丰富的资源,21世纪人类将重点开发海洋资源
从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中。
海洋约占地球表面积的71%
水资源
生物资源
化学资源
矿产资源
能源
氯
钠
溴
碘
镁
钾
钴
锰
锌
锡
钛
铀
金
海水中水的储量约为1.3×1018t,约占全球总水量的97%
海洋生物品种繁多,通过养殖、增殖等途径可实现可持续利用
含量最多的是H和O,加上Cl、Na、Mg、S、Ca、K、Br、C等元素,其总含量超过99%
浅海石油、天然气、煤、硫、磷等;深海锰结核,可燃冰等,
海水运动中蕴藏着巨大能量,包括潮汐能、波浪能、海流能、温差和盐差等
海水资源
海水资源主要分为几大类?
学习
目标
第2课时
海水资源的开发利用
PART
01
PART
02
了解海水资源及其利用。
掌握海水化学资源的开发和利用,即海水制盐,海水提镁、提溴、提碘
科学探究:认识海水资源的多样性和分散性;不断创新海水资源开发利用的途径和方法
社会责任:通过海水资源保护意识和合理开发,建立可持续发展意识和绿色化学观念,并能对与此有关的社会热点问题做出正确的价值判断
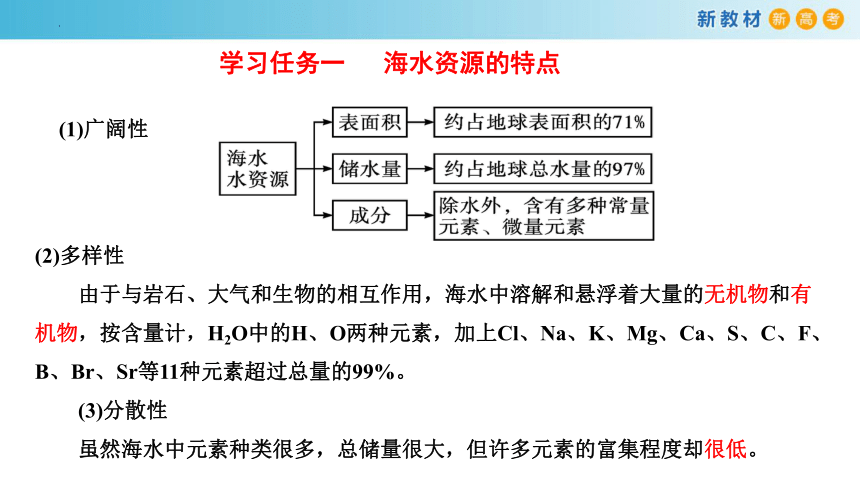
学习任务一 海水资源的特点
(1)广阔性
(2)多样性
由于与岩石、大气和生物的相互作用,海水中溶解和悬浮着大量的无机物和有机物,按含量计,H2O中的H、O两种元素,加上Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr等11种元素超过总量的99%。
(3)分散性
虽然海水中元素种类很多,总储量很大,但许多元素的富集程度却很低。
含80多种元素,以氢、氧、氯、钠、镁、硫、钙、钾等较多。被称为“元素的故乡”。
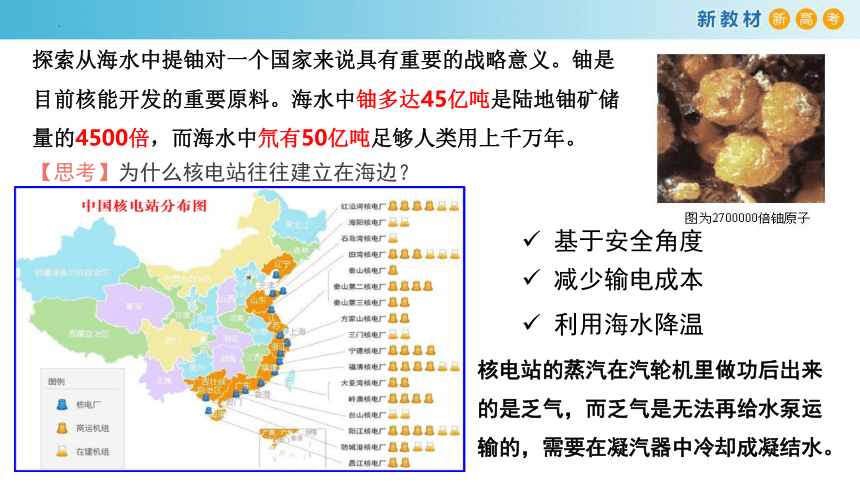
海水中铀多达45亿吨是已知陆地铀矿储量的4500倍。氘有50亿吨足够人类用上千万年
海水中的化学资源
海洋中的矿产资源
探索从海水中提铀对一个国家来说具有重要的战略意义。铀是目前核能开发的重要原料。海水中铀多达45亿吨是陆地铀矿储量的4500倍,而海水中氘有50亿吨足够人类用上千万年。
【思考】为什么核电站往往建立在海边?
基于安全角度
减少输电成本
利用海水降温
核电站的蒸汽在汽轮机里做功后出来的是乏气,而乏气是无法再给水泵运输的,需要在凝汽器中冷却成凝结水。
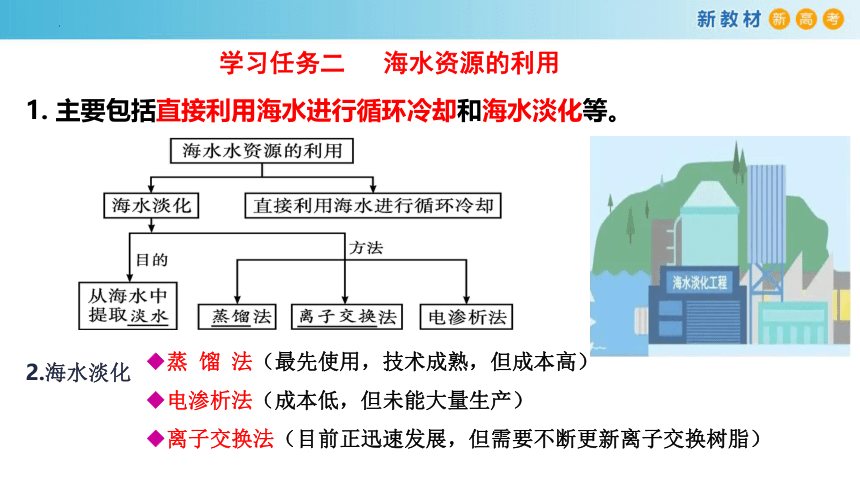
学习任务二 海水资源的利用
◆蒸 馏 法(最先使用,技术成熟,但成本高)
◆电渗析法(成本低,但未能大量生产)
◆离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)
1. 主要包括直接利用海水进行循环冷却和海水淡化等。
2.海水淡化
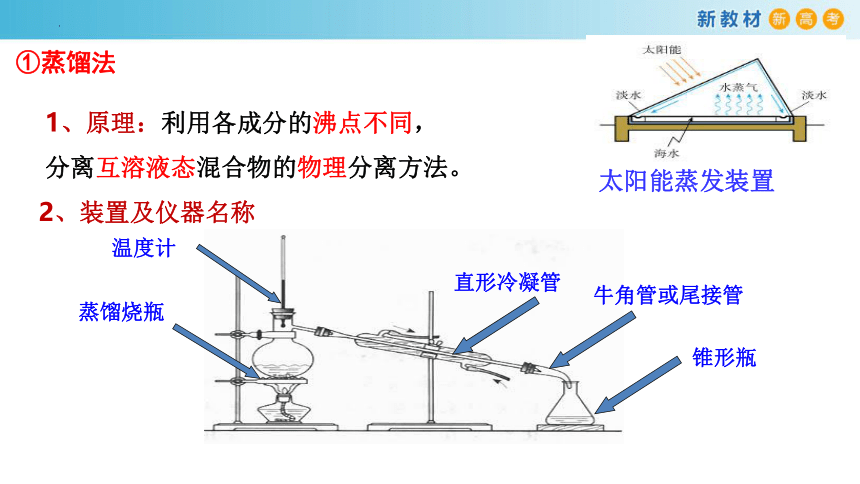
太阳能蒸发装置
①蒸馏法
1、原理:利用各成分的沸点不同,分离互溶液态混合物的物理分离方法。
2、装置及仪器名称
蒸馏烧瓶
温度计
直形冷凝管
牛角管或尾接管
锥形瓶
3、海水蒸馏实验的操作步骤。
连接装置→检查装置气密性→向烧瓶中加入海水和碎瓷片→接通冷却水→给烧瓶加热→收集蒸馏水→停止对烧瓶加热→待冷却至室温后停止通入冷却水→整理仪器。
4、注意事项
加热装置 冷凝装置 接收装置
石棉网
加入沸石/碎瓷片,防暴沸
液体体积不应该超过容积的2/3,不应少于1/3
温度计水银球处于支管口处
冷凝水:下进上出
牛角管伸入锥形瓶内
[典例1]海水淡化可使用蒸馏法。如图所示为以自来水为原料制取蒸馏水的实验装置,请回答下列问题。
(1)图中的两处明显错误
① ;
② 。
(2)仪器A的名称是 ,
仪器B的名称是 。
(3)实验时A中除加入自来水外,为防止
液体暴沸还需加入少量 。
温度计的水银球插入液体中
冷却水进出口方向反了
蒸馏烧瓶
碎瓷片(或沸石)
冷凝管
思考:实验过程中发现忘加沸石了,怎么办?
②电渗析法
+
-
(电渗析法是利用电场的作用,强行将离子向电极处吸引,致使电极中间部位的离子浓度大为下降,从而制得淡水的。)
成本低,但未能大量生产
③离子交换法
离子交换树脂可以把阴阳离子分别交换出来,使水得到纯化。
HR + Na+ = NaR + H+
ROH + Cl— = RCl +OH—
H++OH- =H2O
目前正迅速发展,需要不断更新离子交换树脂
2.海水化学资源的开发利用。
此流程的目的是什么?这种方法叫什么法?
流程中涉及哪些步骤?每一步的作用是什么?
2、从海水中提取溴——吹出法
【思考与讨论1】海水提溴的原理是什么?请结合教材中的流程图用一句话简述。
以海水中的含溴物质为原料,通过化学和物理方法分离提纯,得到溴单质。
【思考与讨论2】该流程中是Br-如何转化成Br2?
溴元素由化合物变为单质,化合价升高,发生了氧化反应,所以用氧化剂把Br-氧化为Br2
【思考与讨论3】为何选择氧化剂氯气来氧化Br-?
①氯气的氧化性大于溴②氯气的成本③生成物对环境无污染
【思考与讨论4】工业上常用的一种海水提溴技术叫做“吹出法”。根据资料思考:用热空气吹出的物质是什么?利用该物质的什么性质呢?
溴,有挥发性
药品 价格(万元/吨)
Cl2 0.155
KMnO4 3.4
H2O2 1.4
【思考与讨论5】根据教材中海水提溴的工艺流程图,思考和讨论每一环节的作用,写出氧化和吸收环节主要反应的离子方程式。
11 五月 2023
新人教版2019
“吹出法”海水提溴
环节 作用 化学方程式(或离子方程式)
氧化
吹出
吸收
蒸馏
用氯气氧化海水中的溴离子
用空气将生成的溴 吹出
用SO2作还原剂使溴转化为氢溴酸,以使其与空气分离
再用氯气将氢溴酸氧化为溴
后蒸馏分离
冷凝
将气态溴转化为液态溴
2Br-+Cl2=2Cl-+Br2
Br2+SO2+2H2O=H2SO4+2HBr
Br2+SO2+2H2O=4H++SO42-+2Br-
2Br-+Cl2=2Cl-+Br2
2HBr+Cl2=2HCl+Br2
【思考与讨论6】请绘制出运用“吹出法”从海水中制备溴的工业流程图?
海水
富集
(浓缩)
氧化室
酸和Cl2
吹出塔
空气
吸收塔
SO2和H2O
蒸馏塔
Cl2和H2O
冷凝器
工业原料
富集
物质转化、分离提纯
Br2
目标产品
建立方法模型 ——自然界提取物质的一般工业流程和思维方法
工业原料
中间产物1
中间产物2
目标产品
富集
转化
①酸碱性
②氧化性
①除去杂质②提纯产物
分离提纯
任 务
核心问题
原料
产品
如何分离出产品?
物料是否能够循环使用?
原料预处理
物质转化
产品分离
如何选取原料?
如何处理原料?
1、从资源、成本角度考虑;
2、从反应速率、提高效率角度。
1、从元素价态的角度分析是否需要选取氧化剂或还原剂?
2、从成本、环保的角度选取最合适的试剂。
根据目标产物的性质及含量,选取合适的分离提纯方法。
如何控制反应条件?
如何选取氧化剂?还原剂?
知识、方法
思考1:通入二氧化硫将溴单质还原后再通入氯气生成溴单质,是不是多此一举?
将溴浓缩(富集溴元素),提高Br2的提取率
思考2:涉及的主要反应有哪些?
请总结由工业原料到具体产品的一般思路和方法流程和思维方法
Cl2+2Br-===Br2+2Cl-(氧化)
Br2+SO2+2H2O===2HBr+H2SO4(富集)
Cl2+2Br-===Br2+2Cl-(提取)
[典例2]海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
(1)步骤①反应的离子方程式是
。
(2)步骤③反应的化学方程式是
。
从理论上考虑,下列也能吸收Br2的是 。
A.NaOH B.FeCl2
C.Na2SO3 D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因 。
(4)为什么不直接用“溴水混合物Ⅰ”而要用“溴水混合物Ⅱ”进行蒸馏得到液溴 。
2Br-+Cl2==Br2+2Cl-
SO2+Br2+2H2O==H2SO4+2HBr
ABC
若温度过高,大量水蒸气随溴排出,所得气体中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低
溴水混合物Ⅰ”中虽然含有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高。而“溴水混合物Ⅱ”实际上将溴水浓缩了
[典例3]从海带中提取碘的实验过程中涉及下列操作,其中正确的是( )。
解析:灼烧海带应用坩埚,A选项错误;过滤时应用玻璃棒引流, B选项错误;苯的密度比水的小,萃取I2的苯层在上层,应从分液漏斗上口倒出,C选项错误。
D
海水资源
海水化学资源的开发利用
海水提镁
海水提溴
海带提碘
海水制盐
海水淡化
蒸馏法、电渗析法、
离子交换法
海水冷却循环
淡水
浓缩海水
海水水资源的利用
课堂小结
走进奇妙的化学世界
2022-2023
必修第二册
第八章
化学与可持续发展
第一节
自然资源的开发利用
海洋中蕴含着丰富的资源,21世纪人类将重点开发海洋资源
从太空观察地球,看到地球上有七片陆地“漂浮”在一大片蓝色的海洋之中。
海洋约占地球表面积的71%
水资源
生物资源
化学资源
矿产资源
能源
氯
钠
溴
碘
镁
钾
钴
锰
锌
锡
钛
铀
金
海水中水的储量约为1.3×1018t,约占全球总水量的97%
海洋生物品种繁多,通过养殖、增殖等途径可实现可持续利用
含量最多的是H和O,加上Cl、Na、Mg、S、Ca、K、Br、C等元素,其总含量超过99%
浅海石油、天然气、煤、硫、磷等;深海锰结核,可燃冰等,
海水运动中蕴藏着巨大能量,包括潮汐能、波浪能、海流能、温差和盐差等
海水资源
海水资源主要分为几大类?
学习
目标
第2课时
海水资源的开发利用
PART
01
PART
02
了解海水资源及其利用。
掌握海水化学资源的开发和利用,即海水制盐,海水提镁、提溴、提碘
科学探究:认识海水资源的多样性和分散性;不断创新海水资源开发利用的途径和方法
社会责任:通过海水资源保护意识和合理开发,建立可持续发展意识和绿色化学观念,并能对与此有关的社会热点问题做出正确的价值判断
学习任务一 海水资源的特点
(1)广阔性
(2)多样性
由于与岩石、大气和生物的相互作用,海水中溶解和悬浮着大量的无机物和有机物,按含量计,H2O中的H、O两种元素,加上Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr等11种元素超过总量的99%。
(3)分散性
虽然海水中元素种类很多,总储量很大,但许多元素的富集程度却很低。
含80多种元素,以氢、氧、氯、钠、镁、硫、钙、钾等较多。被称为“元素的故乡”。
海水中铀多达45亿吨是已知陆地铀矿储量的4500倍。氘有50亿吨足够人类用上千万年
海水中的化学资源
海洋中的矿产资源
探索从海水中提铀对一个国家来说具有重要的战略意义。铀是目前核能开发的重要原料。海水中铀多达45亿吨是陆地铀矿储量的4500倍,而海水中氘有50亿吨足够人类用上千万年。
【思考】为什么核电站往往建立在海边?
基于安全角度
减少输电成本
利用海水降温
核电站的蒸汽在汽轮机里做功后出来的是乏气,而乏气是无法再给水泵运输的,需要在凝汽器中冷却成凝结水。
学习任务二 海水资源的利用
◆蒸 馏 法(最先使用,技术成熟,但成本高)
◆电渗析法(成本低,但未能大量生产)
◆离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)
1. 主要包括直接利用海水进行循环冷却和海水淡化等。
2.海水淡化
太阳能蒸发装置
①蒸馏法
1、原理:利用各成分的沸点不同,分离互溶液态混合物的物理分离方法。
2、装置及仪器名称
蒸馏烧瓶
温度计
直形冷凝管
牛角管或尾接管
锥形瓶
3、海水蒸馏实验的操作步骤。
连接装置→检查装置气密性→向烧瓶中加入海水和碎瓷片→接通冷却水→给烧瓶加热→收集蒸馏水→停止对烧瓶加热→待冷却至室温后停止通入冷却水→整理仪器。
4、注意事项
加热装置 冷凝装置 接收装置
石棉网
加入沸石/碎瓷片,防暴沸
液体体积不应该超过容积的2/3,不应少于1/3
温度计水银球处于支管口处
冷凝水:下进上出
牛角管伸入锥形瓶内
[典例1]海水淡化可使用蒸馏法。如图所示为以自来水为原料制取蒸馏水的实验装置,请回答下列问题。
(1)图中的两处明显错误
① ;
② 。
(2)仪器A的名称是 ,
仪器B的名称是 。
(3)实验时A中除加入自来水外,为防止
液体暴沸还需加入少量 。
温度计的水银球插入液体中
冷却水进出口方向反了
蒸馏烧瓶
碎瓷片(或沸石)
冷凝管
思考:实验过程中发现忘加沸石了,怎么办?
②电渗析法
+
-
(电渗析法是利用电场的作用,强行将离子向电极处吸引,致使电极中间部位的离子浓度大为下降,从而制得淡水的。)
成本低,但未能大量生产
③离子交换法
离子交换树脂可以把阴阳离子分别交换出来,使水得到纯化。
HR + Na+ = NaR + H+
ROH + Cl— = RCl +OH—
H++OH- =H2O
目前正迅速发展,需要不断更新离子交换树脂
2.海水化学资源的开发利用。
此流程的目的是什么?这种方法叫什么法?
流程中涉及哪些步骤?每一步的作用是什么?
2、从海水中提取溴——吹出法
【思考与讨论1】海水提溴的原理是什么?请结合教材中的流程图用一句话简述。
以海水中的含溴物质为原料,通过化学和物理方法分离提纯,得到溴单质。
【思考与讨论2】该流程中是Br-如何转化成Br2?
溴元素由化合物变为单质,化合价升高,发生了氧化反应,所以用氧化剂把Br-氧化为Br2
【思考与讨论3】为何选择氧化剂氯气来氧化Br-?
①氯气的氧化性大于溴②氯气的成本③生成物对环境无污染
【思考与讨论4】工业上常用的一种海水提溴技术叫做“吹出法”。根据资料思考:用热空气吹出的物质是什么?利用该物质的什么性质呢?
溴,有挥发性
药品 价格(万元/吨)
Cl2 0.155
KMnO4 3.4
H2O2 1.4
【思考与讨论5】根据教材中海水提溴的工艺流程图,思考和讨论每一环节的作用,写出氧化和吸收环节主要反应的离子方程式。
11 五月 2023
新人教版2019
“吹出法”海水提溴
环节 作用 化学方程式(或离子方程式)
氧化
吹出
吸收
蒸馏
用氯气氧化海水中的溴离子
用空气将生成的溴 吹出
用SO2作还原剂使溴转化为氢溴酸,以使其与空气分离
再用氯气将氢溴酸氧化为溴
后蒸馏分离
冷凝
将气态溴转化为液态溴
2Br-+Cl2=2Cl-+Br2
Br2+SO2+2H2O=H2SO4+2HBr
Br2+SO2+2H2O=4H++SO42-+2Br-
2Br-+Cl2=2Cl-+Br2
2HBr+Cl2=2HCl+Br2
【思考与讨论6】请绘制出运用“吹出法”从海水中制备溴的工业流程图?
海水
富集
(浓缩)
氧化室
酸和Cl2
吹出塔
空气
吸收塔
SO2和H2O
蒸馏塔
Cl2和H2O
冷凝器
工业原料
富集
物质转化、分离提纯
Br2
目标产品
建立方法模型 ——自然界提取物质的一般工业流程和思维方法
工业原料
中间产物1
中间产物2
目标产品
富集
转化
①酸碱性
②氧化性
①除去杂质②提纯产物
分离提纯
任 务
核心问题
原料
产品
如何分离出产品?
物料是否能够循环使用?
原料预处理
物质转化
产品分离
如何选取原料?
如何处理原料?
1、从资源、成本角度考虑;
2、从反应速率、提高效率角度。
1、从元素价态的角度分析是否需要选取氧化剂或还原剂?
2、从成本、环保的角度选取最合适的试剂。
根据目标产物的性质及含量,选取合适的分离提纯方法。
如何控制反应条件?
如何选取氧化剂?还原剂?
知识、方法
思考1:通入二氧化硫将溴单质还原后再通入氯气生成溴单质,是不是多此一举?
将溴浓缩(富集溴元素),提高Br2的提取率
思考2:涉及的主要反应有哪些?
请总结由工业原料到具体产品的一般思路和方法流程和思维方法
Cl2+2Br-===Br2+2Cl-(氧化)
Br2+SO2+2H2O===2HBr+H2SO4(富集)
Cl2+2Br-===Br2+2Cl-(提取)
[典例2]海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
(1)步骤①反应的离子方程式是
。
(2)步骤③反应的化学方程式是
。
从理论上考虑,下列也能吸收Br2的是 。
A.NaOH B.FeCl2
C.Na2SO3 D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因 。
(4)为什么不直接用“溴水混合物Ⅰ”而要用“溴水混合物Ⅱ”进行蒸馏得到液溴 。
2Br-+Cl2==Br2+2Cl-
SO2+Br2+2H2O==H2SO4+2HBr
ABC
若温度过高,大量水蒸气随溴排出,所得气体中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低
溴水混合物Ⅰ”中虽然含有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高。而“溴水混合物Ⅱ”实际上将溴水浓缩了
[典例3]从海带中提取碘的实验过程中涉及下列操作,其中正确的是( )。
解析:灼烧海带应用坩埚,A选项错误;过滤时应用玻璃棒引流, B选项错误;苯的密度比水的小,萃取I2的苯层在上层,应从分液漏斗上口倒出,C选项错误。
D
海水资源
海水化学资源的开发利用
海水提镁
海水提溴
海带提碘
海水制盐
海水淡化
蒸馏法、电渗析法、
离子交换法
海水冷却循环
淡水
浓缩海水
海水水资源的利用
课堂小结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
