第六章第一节化学反应与能量变化同步练习 (含解析)2022——2023学年高中化学人教版(2019)必修2
文档属性
| 名称 | 第六章第一节化学反应与能量变化同步练习 (含解析)2022——2023学年高中化学人教版(2019)必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 588.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-13 15:57:31 | ||
图片预览



文档简介
第六章第一节化学反应与能量变化同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
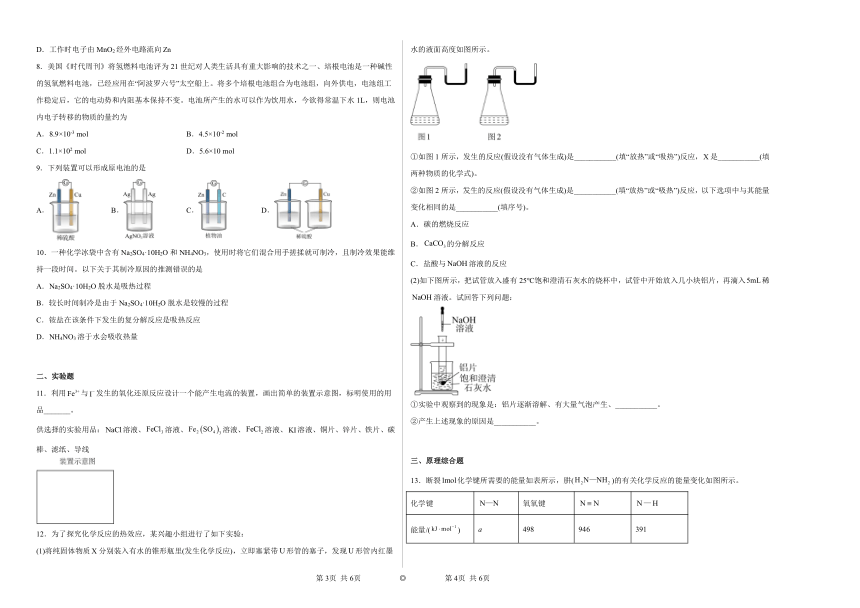
1.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼胶)研究电化学原理。下列叙述正确的是
A.银片为负极,发生的反应为:Ag++e-=Ag
B.用稀硫酸代替AgNO3溶液,也可形成原电池
C.进行实验时,琼胶中K+移向Mg(NO3)2溶液
D.取出盐桥,电流表指针依然偏转
2.有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。如图所示。在此构想的物质循环中太阳能最终转化为
A.化学能 B.热能 C.生物质能 D.电能
3.下列电池不属于二次电池的是
A B C D
手机用锂电池 电动汽车用电池 铅酸蓄电池 锌锰干电池
A.A B.B C.C D.D
4.白磷与氧气可发生反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:ckJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算1 mol白磷反应放出的热量,其中正确的是
A.(6a+5d-4c-12b) kJ B.(4c+12b-6a-5d) kJ
C.(4c+12b-4a-5d) kJ D.(4a+5d-4c-12b) kJ
5.下列有关能量转化的说法中正确的是
A.Na与H2O的反应属于吸热反应
B.“H—Cl→H+Cl”过程中放出热量
C.干冰升华过程放出热量
D.反应“C+H2O(g)CO+H2”中的能量变化可以用如图表示
6.下列说法正确的是
①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③浓硫酸溶于水放出热量属于放热反应 ④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有④ B.只有①② C.①②③④ D.②③④
7.碱性锌锰电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。下列说法正确的是
A.Zn为正极,MnO2为负极
B.该电池为二次电池
C.负极的电极反应式为:Zn+2OH--2e-=Zn(OH)2
D.工作时电子由MnO2经外电路流向
8.美国《时代周刊》将氢燃料电池评为21世纪对人类生活具有重大影响的技术之一、培根电池是一种碱性的氢氧燃料电池,已经应用在“阿波罗六号”太空船上。将多个培根电池组合为电池组,向外供电,电池组工作稳定后,它的电动势和内阻基本保持不变。电池所产生的水可以作为饮用水,今欲得常温下水1L,则电池内电子转移的物质的量约为
A.8.9×10-3 mol B.4.5×10-2 mol
C.1.1×102 mol D.5.6×10 mol
9.下列装置可以形成原电池的是
A. B. C. D.
10.一种化学冰袋中含有Na2SO4·10H2O和NH4NO3,使用时将它们混合用手搓揉就可制冷,且制冷效果能维持一段时间。以下关于其制冷原因的推测错误的是
A.Na2SO4·10H2O脱水是吸热过程
B.较长时间制冷是由于Na2SO4·10H2O脱水是较慢的过程
C.铵盐在该条件下发生的复分解反应是吸热反应
D.NH4NO3溶于水会吸收热量
二、实验题
11.利用与发生的氧化还原反应设计一个能产生电流的装置,画出简单的装置示意图,标明使用的用品_______。
供选择的实验用品:溶液、溶液、溶液、溶液、溶液、铜片、锌片、铁片、碳棒、滤纸、导线
12.为了探究化学反应的热效应,某兴趣小组进行了如下实验:
(1)将纯固体物质分别装入有水的锥形瓶里(发生化学反应),立即塞紧带形管的塞子,发现形管内红墨水的液面高度如图所示。
①如图1所示,发生的反应(假设没有气体生成)是___________(填“放热”或“吸热”)反应,是___________(填两种物质的化学式)。
②如图2所示,发生的反应(假设没有气体生成)是___________(填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是___________(填序号)。
A.碳的燃烧反应
B.的分解反应
C.盐酸与溶液的反应
(2)如下图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块铝片,再滴入稀溶液。试回答下列问题:
①实验中观察到的现象是:铝片逐渐溶解、有大量气泡产生、___________。
②产生上述现象的原因是___________。
三、原理综合题
13.断裂化学键所需要的能量如表所示,肼()的有关化学反应的能量变化如图所示。
化学键 氧氧键
能量/() a 498 946 391
回答下列问题:
(1)与反应生成和放出的能量为____________________。
(2)与断键吸收的能量为____________。
(3)________________________。
(4)当有(1)生成时,放出的能量__________________________(填“>”“<”或“=”)。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.该装置为MgAg原电池,镁的活泼性大于银,镁作负极,失电子形成镁离子,故A错误;
B.若把硝酸银换成稀硫酸,H+同样在银电极处得到电子析出氢气,可以构成原电池,故B正确;
C.MgAg原电池,镁的活泼性大于银,镁作负极、银为正极,原电池中阳离子移向正极,所以盐桥中的阳离子往右侧硝酸银溶液迁移,故C错误;
D.取出盐桥,由于无法构成闭合回路,不能形成原电池,所以电流表不发生偏转,D错误;
选B。
2.B
【分析】图中关键信息是利用太阳能使H2O、CO2、N2等重新组合,组合成可燃物,而可燃物燃烧后转化为燃烧产物并放出热量,产物又结合太阳能转化为燃料,如此循环,可知太阳能最终转化为热能。
【详解】A.太阳能转化为化学能,燃烧后转化为热能,A错误;
B.太阳能转化为化学能,燃烧后转化为热能,B正确;
C.生物质能是指自然界有生命的物质提供的能量,此构想未涉及到生物质能,C错误;
D.此构想未涉及电能,D错误;
故答案为:B。
3.D
【详解】A.手机用锂电池,可充电,属于二次电池,故A不选;
B.电动汽车用电池,可充电,属于二次电池,故B不选;
C.铅酸蓄电池,可充电,属于二次电池,故C不选;
D.锌锰干电池不可充电,属于一次电池,故D选;
故选D。
4.B
【详解】该反应为放热反应,反应中放出热量=形成生成物中化学键的总能量-断开反应物中化学键的总能量。由图可以看出:P4中有6mol的P-P,5mol的O2中含有5molO=O,1mol的P4O10中含有4mol的P=O,12mol的P-O,故该反应中放出能量=(4c+12b)kJ-(6a+5d)kJ=(4c+12b-6a-5d) kJ。
故选B。
5.D
【分析】由图可知,生成物能量大于反应物能量,图示表示的为吸热反应;
【详解】A.Na与H2O的反应放出大量热,属于放热反应,A不符合题意;
B.“H—Cl―→H+Cl”断键吸收能量,B不符合题意;
C.干冰升华过程吸收能量,反应为物理变化不是化学变化,C不符合题意;
D.碳与水反应是吸热反应,生成物的总能量大于反应物的总能量,D符合题意。
故选D。
6.A
【详解】①放热反应有的需加热,有的不需加热,如Na的燃烧是一个放热反应,但需要加热,①错误;
②放热的反应在常温下不一定很容易发生,如铝热反应(2Al+Fe2O32Fe+Al2O3)是放热反应,但需在高温条件下才能引发氧化铁和铝粉反应,②错误;
③浓硫酸溶于水放出热量属于放热过程,不是放热反应,③错误;
④放热反应在反应中会放出热量,所以有的反应在停止加热后可以利用放出的热量继续进行,④正确;
故选A。
7.C
【详解】A.碱性锌锰电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,Zn的化合价升高,失去电子,被氧化,则Zn为负极,Mn元素的化合价降低,得到电子,被还原,MnO2为正极,故A错误;
B.碱性锌锰电池为一次电池,故B错误;
C.Zn为负极,Zn失去电子转化为Zn(OH)2,负极的电极反应式为:Zn+2OH--2e-=Zn(OH)2,故C正确;
D.Zn为负极,MnO2为正极,原电池中电子从负极经导线流向正极,则工作时电子由经外电路流向MnO2,故D错误;
故选C。
8.C
【详解】负极:2H2-4e-+4OH-=4H2O 正极:O2+4e-+2H2O=4OH-。所以产生2 mol水,转移4 mol电子。制得1 L水转移电子数为×2=1.1×102 mol。故C正确;
故选:C。
9.A
【详解】A.该装置中,两个电极材料Zn、Cu的金属活动性不同,用导线相连接,与电解质溶液稀硫酸相接触,能形成原电池,A符合题意;
B.两个电极材料都为Ag,活动性相同,不能产生电势差,不能形成电流,B不符合题意;
C.虽然具有两个活动性不同的电极,但植物油为非电解质,不能传导电流,C不符合题意;
D.具有两个活动性不同的电极,且稀硫酸为电解质溶液,但不能形成闭合回路,D不符合题意;
故选A。
10.C
【详解】A. Na2SO4 10H2O脱水是吸热过程,A正确;
B. 因为十水硫酸钠脱水较慢,它一点点地脱水,水遇上硝酸铵吸热,因此制冷效果可以维持较长,B正确;
C. 铵盐不会自身发生复分解反应,Na2SO4 10H2O和NH4NO3也不能发生复分解反应,C错误;
D. 硝酸铵夺取硫酸钠结晶水,是一个吸热反应,同时溶解吸热,D正确;
故选C。
11.
【详解】依据原电池反应原理分析,氧化还原反应中铁离子在正极得到电子发生还原反应,碘离子在负极失电子发生氧化反应,负极所在电解质溶液为KI溶液,正极所在电解质溶液为FeCl3溶液,画出原电池装置;
故答案为:
12. 放热 、 吸热 B 饱和澄清石灰水中出现白色浑浊 铝和溶液反应生成,且该反应是放热反应,的溶解度随温度的升高而降低
【分析】(1)利用气体的热胀冷缩原理以及根据U形管两端红墨水液面的相对高度可判断出图1为放热反应,图2为吸热反应;
(2)铝与强碱反应属于放热反应,然后根据氢氧化钙的溶解度随温度的升高而减小,可判断出观察到的现象除铝片逐渐溶解、有大量气泡产生外,还有饱和澄清石灰水中出现白色浑浊;据此分析解答。
【详解】(1)①若如图1所示,体系内压强大于外界大气压,说明体系内气体膨胀,反应放热,遇水放热的物质X可以是、等,故答案为:放热;、;
②若如图2所示,体系内压强小于外界大气压,说明体系内气体体积缩小,反应吸热;故答案为:吸热;
A.碳的燃烧反应为放热反应,故A不选;
B.的分解反应为吸热反应,故选B;
C.盐酸与溶液反应为放热反应,故C不选;
答案选B。
(2)把试管放入盛有饱和澄清石灰水的烧杯中,向试管中放入几小块铝片,再滴入稀溶液,铝和溶液反应生成,且该反应是放热反应,的溶解度随温度的升高而降低,烧杯中的饱和澄清石灰水中会出现白色浑浊,故答案为:饱和澄清石灰水中出现白色浑浊;铝和溶液反应生成,且该反应是放热反应,的溶解度随温度的升高而降低。
13. 523 2255 193 >
【详解】(1)由题图可知,与反应生成和放出的能量为,故答案为:523;
(2)与断键吸收的能量为,故答案为:2255;
(3)化学键断裂吸收能量,化学键生成释放能量,断裂键所需的能量为,则化学键断裂吸收的能量为,解得,故答案为:193;
(4)据图可知,与反应生成和放出的能量。(1)放出能量,因此当有(1)生成时,放出的能量大于,故答案为:>。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼胶)研究电化学原理。下列叙述正确的是
A.银片为负极,发生的反应为:Ag++e-=Ag
B.用稀硫酸代替AgNO3溶液,也可形成原电池
C.进行实验时,琼胶中K+移向Mg(NO3)2溶液
D.取出盐桥,电流表指针依然偏转
2.有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。如图所示。在此构想的物质循环中太阳能最终转化为
A.化学能 B.热能 C.生物质能 D.电能
3.下列电池不属于二次电池的是
A B C D
手机用锂电池 电动汽车用电池 铅酸蓄电池 锌锰干电池
A.A B.B C.C D.D
4.白磷与氧气可发生反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:ckJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算1 mol白磷反应放出的热量,其中正确的是
A.(6a+5d-4c-12b) kJ B.(4c+12b-6a-5d) kJ
C.(4c+12b-4a-5d) kJ D.(4a+5d-4c-12b) kJ
5.下列有关能量转化的说法中正确的是
A.Na与H2O的反应属于吸热反应
B.“H—Cl→H+Cl”过程中放出热量
C.干冰升华过程放出热量
D.反应“C+H2O(g)CO+H2”中的能量变化可以用如图表示
6.下列说法正确的是
①需要加热才能发生的反应一定是吸热反应 ②放热反应在常温下一定很容易发生 ③浓硫酸溶于水放出热量属于放热反应 ④有的放热反应加热到一定温度引发后,停止加热反应也能继续进行
A.只有④ B.只有①② C.①②③④ D.②③④
7.碱性锌锰电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。下列说法正确的是
A.Zn为正极,MnO2为负极
B.该电池为二次电池
C.负极的电极反应式为:Zn+2OH--2e-=Zn(OH)2
D.工作时电子由MnO2经外电路流向
8.美国《时代周刊》将氢燃料电池评为21世纪对人类生活具有重大影响的技术之一、培根电池是一种碱性的氢氧燃料电池,已经应用在“阿波罗六号”太空船上。将多个培根电池组合为电池组,向外供电,电池组工作稳定后,它的电动势和内阻基本保持不变。电池所产生的水可以作为饮用水,今欲得常温下水1L,则电池内电子转移的物质的量约为
A.8.9×10-3 mol B.4.5×10-2 mol
C.1.1×102 mol D.5.6×10 mol
9.下列装置可以形成原电池的是
A. B. C. D.
10.一种化学冰袋中含有Na2SO4·10H2O和NH4NO3,使用时将它们混合用手搓揉就可制冷,且制冷效果能维持一段时间。以下关于其制冷原因的推测错误的是
A.Na2SO4·10H2O脱水是吸热过程
B.较长时间制冷是由于Na2SO4·10H2O脱水是较慢的过程
C.铵盐在该条件下发生的复分解反应是吸热反应
D.NH4NO3溶于水会吸收热量
二、实验题
11.利用与发生的氧化还原反应设计一个能产生电流的装置,画出简单的装置示意图,标明使用的用品_______。
供选择的实验用品:溶液、溶液、溶液、溶液、溶液、铜片、锌片、铁片、碳棒、滤纸、导线
12.为了探究化学反应的热效应,某兴趣小组进行了如下实验:
(1)将纯固体物质分别装入有水的锥形瓶里(发生化学反应),立即塞紧带形管的塞子,发现形管内红墨水的液面高度如图所示。
①如图1所示,发生的反应(假设没有气体生成)是___________(填“放热”或“吸热”)反应,是___________(填两种物质的化学式)。
②如图2所示,发生的反应(假设没有气体生成)是___________(填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是___________(填序号)。
A.碳的燃烧反应
B.的分解反应
C.盐酸与溶液的反应
(2)如下图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块铝片,再滴入稀溶液。试回答下列问题:
①实验中观察到的现象是:铝片逐渐溶解、有大量气泡产生、___________。
②产生上述现象的原因是___________。
三、原理综合题
13.断裂化学键所需要的能量如表所示,肼()的有关化学反应的能量变化如图所示。
化学键 氧氧键
能量/() a 498 946 391
回答下列问题:
(1)与反应生成和放出的能量为____________________。
(2)与断键吸收的能量为____________。
(3)________________________。
(4)当有(1)生成时,放出的能量__________________________(填“>”“<”或“=”)。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.该装置为MgAg原电池,镁的活泼性大于银,镁作负极,失电子形成镁离子,故A错误;
B.若把硝酸银换成稀硫酸,H+同样在银电极处得到电子析出氢气,可以构成原电池,故B正确;
C.MgAg原电池,镁的活泼性大于银,镁作负极、银为正极,原电池中阳离子移向正极,所以盐桥中的阳离子往右侧硝酸银溶液迁移,故C错误;
D.取出盐桥,由于无法构成闭合回路,不能形成原电池,所以电流表不发生偏转,D错误;
选B。
2.B
【分析】图中关键信息是利用太阳能使H2O、CO2、N2等重新组合,组合成可燃物,而可燃物燃烧后转化为燃烧产物并放出热量,产物又结合太阳能转化为燃料,如此循环,可知太阳能最终转化为热能。
【详解】A.太阳能转化为化学能,燃烧后转化为热能,A错误;
B.太阳能转化为化学能,燃烧后转化为热能,B正确;
C.生物质能是指自然界有生命的物质提供的能量,此构想未涉及到生物质能,C错误;
D.此构想未涉及电能,D错误;
故答案为:B。
3.D
【详解】A.手机用锂电池,可充电,属于二次电池,故A不选;
B.电动汽车用电池,可充电,属于二次电池,故B不选;
C.铅酸蓄电池,可充电,属于二次电池,故C不选;
D.锌锰干电池不可充电,属于一次电池,故D选;
故选D。
4.B
【详解】该反应为放热反应,反应中放出热量=形成生成物中化学键的总能量-断开反应物中化学键的总能量。由图可以看出:P4中有6mol的P-P,5mol的O2中含有5molO=O,1mol的P4O10中含有4mol的P=O,12mol的P-O,故该反应中放出能量=(4c+12b)kJ-(6a+5d)kJ=(4c+12b-6a-5d) kJ。
故选B。
5.D
【分析】由图可知,生成物能量大于反应物能量,图示表示的为吸热反应;
【详解】A.Na与H2O的反应放出大量热,属于放热反应,A不符合题意;
B.“H—Cl―→H+Cl”断键吸收能量,B不符合题意;
C.干冰升华过程吸收能量,反应为物理变化不是化学变化,C不符合题意;
D.碳与水反应是吸热反应,生成物的总能量大于反应物的总能量,D符合题意。
故选D。
6.A
【详解】①放热反应有的需加热,有的不需加热,如Na的燃烧是一个放热反应,但需要加热,①错误;
②放热的反应在常温下不一定很容易发生,如铝热反应(2Al+Fe2O32Fe+Al2O3)是放热反应,但需在高温条件下才能引发氧化铁和铝粉反应,②错误;
③浓硫酸溶于水放出热量属于放热过程,不是放热反应,③错误;
④放热反应在反应中会放出热量,所以有的反应在停止加热后可以利用放出的热量继续进行,④正确;
故选A。
7.C
【详解】A.碱性锌锰电池的总反应为:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,Zn的化合价升高,失去电子,被氧化,则Zn为负极,Mn元素的化合价降低,得到电子,被还原,MnO2为正极,故A错误;
B.碱性锌锰电池为一次电池,故B错误;
C.Zn为负极,Zn失去电子转化为Zn(OH)2,负极的电极反应式为:Zn+2OH--2e-=Zn(OH)2,故C正确;
D.Zn为负极,MnO2为正极,原电池中电子从负极经导线流向正极,则工作时电子由经外电路流向MnO2,故D错误;
故选C。
8.C
【详解】负极:2H2-4e-+4OH-=4H2O 正极:O2+4e-+2H2O=4OH-。所以产生2 mol水,转移4 mol电子。制得1 L水转移电子数为×2=1.1×102 mol。故C正确;
故选:C。
9.A
【详解】A.该装置中,两个电极材料Zn、Cu的金属活动性不同,用导线相连接,与电解质溶液稀硫酸相接触,能形成原电池,A符合题意;
B.两个电极材料都为Ag,活动性相同,不能产生电势差,不能形成电流,B不符合题意;
C.虽然具有两个活动性不同的电极,但植物油为非电解质,不能传导电流,C不符合题意;
D.具有两个活动性不同的电极,且稀硫酸为电解质溶液,但不能形成闭合回路,D不符合题意;
故选A。
10.C
【详解】A. Na2SO4 10H2O脱水是吸热过程,A正确;
B. 因为十水硫酸钠脱水较慢,它一点点地脱水,水遇上硝酸铵吸热,因此制冷效果可以维持较长,B正确;
C. 铵盐不会自身发生复分解反应,Na2SO4 10H2O和NH4NO3也不能发生复分解反应,C错误;
D. 硝酸铵夺取硫酸钠结晶水,是一个吸热反应,同时溶解吸热,D正确;
故选C。
11.
【详解】依据原电池反应原理分析,氧化还原反应中铁离子在正极得到电子发生还原反应,碘离子在负极失电子发生氧化反应,负极所在电解质溶液为KI溶液,正极所在电解质溶液为FeCl3溶液,画出原电池装置;
故答案为:
12. 放热 、 吸热 B 饱和澄清石灰水中出现白色浑浊 铝和溶液反应生成,且该反应是放热反应,的溶解度随温度的升高而降低
【分析】(1)利用气体的热胀冷缩原理以及根据U形管两端红墨水液面的相对高度可判断出图1为放热反应,图2为吸热反应;
(2)铝与强碱反应属于放热反应,然后根据氢氧化钙的溶解度随温度的升高而减小,可判断出观察到的现象除铝片逐渐溶解、有大量气泡产生外,还有饱和澄清石灰水中出现白色浑浊;据此分析解答。
【详解】(1)①若如图1所示,体系内压强大于外界大气压,说明体系内气体膨胀,反应放热,遇水放热的物质X可以是、等,故答案为:放热;、;
②若如图2所示,体系内压强小于外界大气压,说明体系内气体体积缩小,反应吸热;故答案为:吸热;
A.碳的燃烧反应为放热反应,故A不选;
B.的分解反应为吸热反应,故选B;
C.盐酸与溶液反应为放热反应,故C不选;
答案选B。
(2)把试管放入盛有饱和澄清石灰水的烧杯中,向试管中放入几小块铝片,再滴入稀溶液,铝和溶液反应生成,且该反应是放热反应,的溶解度随温度的升高而降低,烧杯中的饱和澄清石灰水中会出现白色浑浊,故答案为:饱和澄清石灰水中出现白色浑浊;铝和溶液反应生成,且该反应是放热反应,的溶解度随温度的升高而降低。
13. 523 2255 193 >
【详解】(1)由题图可知,与反应生成和放出的能量为,故答案为:523;
(2)与断键吸收的能量为,故答案为:2255;
(3)化学键断裂吸收能量,化学键生成释放能量,断裂键所需的能量为,则化学键断裂吸收的能量为,解得,故答案为:193;
(4)据图可知,与反应生成和放出的能量。(1)放出能量,因此当有(1)生成时,放出的能量大于,故答案为:>。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
