第五章第三节无机非金属材料同步练习 (含解析)2022——2023学年高中化学人教版(2019)必修2
文档属性
| 名称 | 第五章第三节无机非金属材料同步练习 (含解析)2022——2023学年高中化学人教版(2019)必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 134.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-13 16:11:57 | ||
图片预览



文档简介
第五章第三节无机非金属材料同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.陶瓷是一种常见硅酸盐材料,可以用陶瓷坩埚熔融纯碱
B.在自然界以游离态存在
C.溶液可与反应
D.属于酸性氧化物,不与任何酸反应
2.近年来,具有特殊性质的新型无机非金属材料迅速发展,下列有关新型无机非金属材料的叙述不正确的是
A.新型无机非金属材料克服了传统无机非金属材料的许多缺点
B.碳化硅的硬度大、熔点高,可用于制作高温结构陶瓷和轴承
C.氮化硅陶瓷是一种新型无机非金属材料,可用于制造发动机,其化学式为Si3N4
D.合成纤维和光导纤维都是新型无机非金属材料
3.关于二氧化硅,下列叙述不正确的是
A.水晶的主要成分是二氧化硅
B.二氧化硅和二氧化碳在物理性质上有很大差别
C.二氧化硅不溶于水,也不能跟水起反应生成酸
D.二氧化硅是一种酸性氧化物,它不跟任何酸起反应
4.“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是
A.玻璃的主要成分为Na2CO3、CaCO3和SiO2
B.生产陶瓷、玻璃、水泥都用到黏土
C.硅酸盐制品的性质稳定、熔点较高
D.沙子和黏土的主要成分均为硅酸盐
5.“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品,玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是
A.玻璃是人类最早使用的硅酸盐制品 B.制水泥的原料为纯碱、石灰石和石英砂
C.硅酸盐制品的性质稳定、熔点较高 D.沙子和黏土的主要成分均为硅酸盐
6.化学与生产、生活、科研密切相关。下列说法错误的是
A.氮化硅陶瓷、光导纤维、硅酸盐水泥均属于新型无机非金属材料
B.火箭发射时使用液氢和液氧作推进剂,是利用燃烧反应提供能量
C.月球探测器使用的太阳能电池板,其主要成分是单质硅
D.制造月球探测器中的瞄准镜时使用的光导纤维,其主要成分是二氧化硅
7.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是硅,下列有关硅及其化合物叙述正确的是
A.水玻璃可做防火材料 B.水晶、玛瑙的主要成分是晶体硅
C.可用石英坩埚加热熔融氢氧化钠固体 D.二氧化硅不和任何酸反应
8.由粗制备纯的流程如图所示,下列说法不正确的是
A.X可用作木材防火剂
B.步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3↓+Na2SO4
C.步骤Ⅱ中的稀硫酸可用替代
D.若在实验室完成步骤Ⅲ,一般在蒸皿中进行
9.单晶硅是制作电子集成电路的基础材料。用化学方法可制得高纯度硅,其化学方程式为:
①SiO2+2CSi+2CO↑
②Si+3HClSiHCl3+H2
③SiHCl3+H2Si(纯)+3HCl
下列对上述三个反应的叙述中,正确的是
A.仅①③为置换反应
B.②为化合反应
C.①②③均为氧化还原反应
D.三个反应的反应物中硅元素均被还原
10.纳米材料被誉为21世纪最有发展前景的新型材料。纳米碳管是一种由碳原子构成的直径为几纳米的空心管。下列说法错误的是
A.纳米碳管是一种新型的有机化合物
B.纳米碳管在常温下化学性质稳定
C.纳米碳管材料如果完全燃烧,生成物是二氧化碳
D.纳米碳管材料管道多,表面积大,吸附能力强
二、实验题
11.晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅的过程如下:
I.高温下用过量的碳还原二氧化硅制得粗硅;
II.粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HClSiHCl3+H2);
III.SiHCl3与过量的H2在1100~1200℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应。
(1)第一步用焦炭与石英砂制取粗硅,其反应的化学方程式为_______;上述反应中的氧化剂是_______,还原剂是_______。
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为_______。
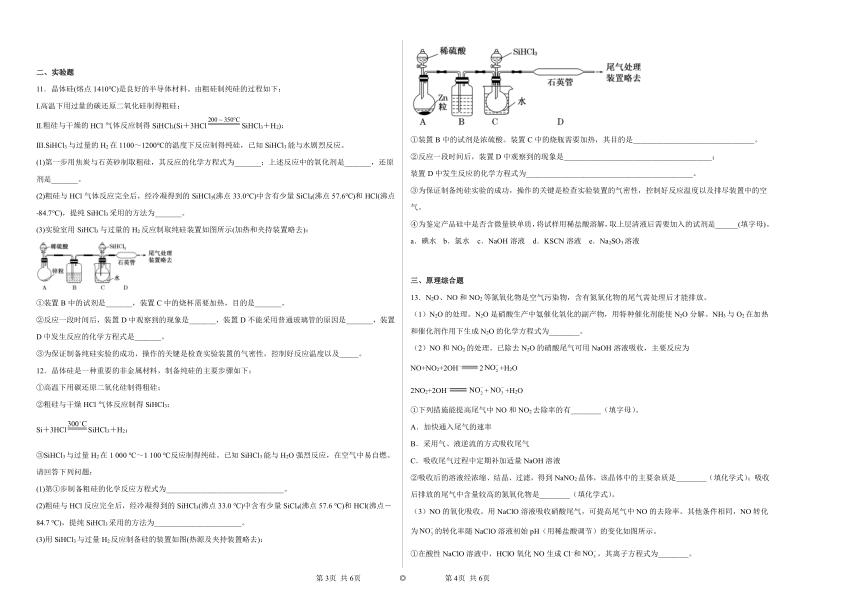
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):
①装置B中的试剂是_______,装置C中的烧杯需要加热,目的是_______。
②反应一段时间后,装置D中观察到的现象是_______,装置D不能采用普通玻璃管的原因是_______,装置D中发生反应的化学方程式是_______。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_____。
12.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HClSiHCl3+H2;
③SiHCl3与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为_______________________。
(3)用SiHCl3与过量H2反应制备硅的装置如图(热源及夹持装置略去):
①装置B中的试剂是浓硫酸。装置C中的烧瓶需要加热,其目的是________________________________。
②反应一段时间后,装置D中观察到的现象是_______________________________________;
装置D中发生反应的化学方程式为____________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置中的空气。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂是______(填字母)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
三、原理综合题
13.N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH 2+H2O
2NO2+2OH ++H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl 和,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.陶瓷是一种常见硅酸盐材料,二氧化硅能和碱反应,不能用陶瓷坩埚熔融纯碱,故A错误;
B.自然界中没用游离态Si,故B错误;
C.溶液可与反应生成碳酸钠和硅酸,故C正确;
D.与氢氟酸反应生成SiF4气体和水,故D错误;
选C。
2.D
【详解】A.传统的无机非金属材料,缺点为质地较脆,经不起热冲击,新型无机非金属材料克服了传统无机非金属材料的缺点,能承受高温,强度较高,具有电学特性、光学特性等,A项正确;
B.碳化硅的硬度大,熔点高,可用于制作高温结构陶瓷和轴承,B项正确;
C.氮化硅陶瓷是一种新型无机非金属材料,可用于制造发动机,其化学式为Si3N4,C项正确;
D.光导纤维属于新型无机非金属材料,但合成纤维属于有机高分子材料,D项错误;
故选D。
3.D
【详解】A.水晶的主要成分为SiO2,A项正确;
B.CO2是由分子构成的,而SiO2是Si和O按1∶2组成的空间立体网状结构的晶体,二者物理性质差别较大,B项正确;
C.SiO2不溶于水,也不与水反应,C项正确;
D.SiO2可以与氢氟酸反应,D项错误;
故选D。
4.C
【详解】A.陶瓷是人类最早使用的硅酸盐材料,不是玻璃,故A错误;
B.水泥的原料是黏土和石灰石,纯碱、石灰石、石英是制造玻璃的原料,生成玻璃不需要黏土,故B错误;
C.硅酸盐性质稳定,熔点较高,所以硅酸盐制品一般具有性质稳定、熔点较高特点,故C正确;
D.沙子主要成分为二氧化硅,为氧化物,不是硅酸盐,故D错误;
故选:C。
5.C
【详解】A.陶瓷是人类最早使用的硅酸盐材料,不是玻璃,A错误;
B.水泥的原料是黏土和石灰石,纯碱、石灰石、石英是制造玻璃的原料,生成玻璃不需要黏土,B错误;
C.硅酸盐性质稳定,熔点较高,所以硅酸盐制品一般具有性质稳定、熔点较高的特点,C正确;
D.沙子主要成分是二氧化硅,为氧化物,不是硅酸盐,D错误;
故答案选C。
6.A
【详解】A.氮化硅、光导纤维属于新型无机非金属材料,硅酸盐水泥属于传统无机非金属材料,A错误;
B.火箭发射时使用液氢和液氧作推进剂,二者化合生成水,同时放出大量热,因此是利用燃烧反应提供能量,B正确;
C.硅是半导体,可以导电,月球探测器使用的太阳能电池板,其主要成分是单质硅,C正确;
D.二氧化硅可以传递光信号,制造月球探测器中的瞄准镜时使用的光导纤维,其主要成分是二氧化硅,D正确;
答案选A。
7.A
【详解】A.硅酸钠水溶液俗称水玻璃,不易燃烧,具有阻燃性,可做防火材料,故A正确;
B.水晶、玛瑙主要成分为二氧化硅,不是晶体硅,故B错误;
C.石英成分为二氧化硅,与氢氧化钠反应,所以不能用石英坩埚加热熔融氢氧化钠固体,故C错误;
D.常温下,二氧化硅与氢氟酸反应生成四氟化硅和水,故D错误;
故选A。
8.D
【分析】由流程可知,加入足量NaOH溶液可溶解SiO2,过滤分离出不溶杂质,X含硅酸钠,加过量硫酸,过滤分离出硅酸,灼烧生成SiO2。
【详解】A. X含硅酸钠溶液,可用作木材防火剂,故A正确;
B. X中主要含硅酸钠,则步骤Ⅱ中的主要反应是Na2SiO3+H2SO4═H2SiO3↓+Na2SO4,故B正确;
C. 二氧化碳与硅酸钠反应生成硅酸得到Y,则步骤Ⅱ中的稀硫酸能用CO2代替,故C正确;
D. 硅酸灼烧生成SiO2,则在实验室中完成步骤Ⅲ,一般在坩埚中进行,故D错误;
故选D。
9.C
【详解】A.置换反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的化学反应,反应①②③均为置换反应,A错误;
B.化合反应是多种物质反应生成一种物质,反应②不是化合反应,为置换反应,B错误;
C.反应①②③均有元素发生了化合价的改变,均为氧化还原反应,C正确;
D.反应①③中硅元素化合价降低,被还原,反应②中硅元素化合价升高,被氧化,D错误;
故选C。
10.A
【详解】A.纳米碳管是一种新型的无机物,属于单质,A错误;
B.纳米碳管在常温下化学性质稳定,B正确;
C.纳米碳管材料为碳的同素异形体,如果完全燃烧,生成物是二氧化碳,C正确;
D.纳米碳管材料管道多,直径为纳米级别,表面积大,吸附能力强,D正确;
故选A。
11.(1) SiO2+2CSi+2CO↑ SiO2 C
(2)分馏(或蒸馏)
(3) 浓硫酸 使滴入烧瓶中的SiHCl3汽化 有固体生成 在此反应温度下,普通玻璃会软化 SiHCl3 +H2Si+3HCl 排尽装置内的空气
【详解】(1)焦炭与石英砂制取粗硅:SiO2+2CSi+2CO↑,SiO2得电子,价态降低,为氧化剂,C失电子,价态升高,为还原剂。
(2)SiHCl3的沸点和所含杂质的沸点相差较大,故可以采用分馏(或蒸馏)的方法。
(3)①SiHCl3能与水剧烈反应,应将制得的H2中的水蒸气除去,故装置B中的试剂是浓硫酸;常温下SiHCl3为液体,反应时应使其汽化后再在D处与H2反应,故装置C的烧瓶需加热;
②H2和汽化后的SiHCl3在装置D中发生反应:SiHCl3 +H2Si+3HCl,故D中观察到的现象是有固体生成,在此反应温度下,普通玻璃会软化,故不能采用普通玻璃管。
③制备流程包含高温下加热氢气,氢气和氧气混合在高温条件下易发生爆炸,因此必须排尽装置内的空气。
12. SiO2+2CSi+2CO↑ 分馏(或蒸馏) 使滴入烧瓶中的SiHCl3汽化 有固体物质生成 SiHCl3+H2Si+3HCl b、d
【详解】(1)根据题给信息,粗硅可以用碳还原二氧化硅的办法来制得,故反应方程式为SiO2+2CSi+2CO↑;
(2)因HCl易溶于水,而SiHCl3与H2O强烈反应,故提纯SiHCl3的方法只能在无水的条件下利用它们的沸点不同,采用分馏的方法进行;
(3)①C中烧瓶需加热,其目的是使SiHCl3汽化,加快与H2的反应;
②根据题给信息石英管中产生的物质应为硅,故D中现象为有固体产生;SiHCl3和H2反应生成Si和HCl,Si元素化合价由+2价下降到0价,H元素由0价上升到+1价,根据得失电子守恒和原子守恒配平方程式为:SiHCl3+H2Si+3HCl;
④铁与盐酸反应产生Fe2+,常常采用先将Fe2+氧化为Fe3+,然后再加入KSCN溶液看是否变红来检验,故答案为:b、d。
13. 2NH3+2O2N2O+3H2O BC NaNO3 NO 3HClO+2NO+H2O=3Cl +2+5H+ 溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强
【详解】(1)NH3与O2在加热和催化剂作用下发生氧化还原反应生成N2O,根据得失电子守恒和原子守恒可知反应有水生成,配平化学方程式为:2NH3+2O2N2O+3H2O,
故答案为2NH3+2O2N2O+3H2O;
(2)①A.加快通入尾气的速率,不能提高尾气中NO和NO2的去除率,不选A;
B.采用气、液逆流的方式吸收尾气,可使气液充分接触,能提高尾气中NO和NO2的去除率,选B;
C.定期补充适量的NaOH溶液可增大反应物浓度,能提高尾气中NO和NO2的去除率,选C。
故答案为BC;
②由吸收反应:NO+NO2+2OH-=2NO2-+H2O,2NO2+2OH-=NO2-+ NO3-+H2O可知,反应后得到NaNO2和NaNO3混合溶液,经浓缩、结晶、过滤得到NaNO2和NaNO3晶体,因此得到的NaNO2混有NaNO3;由吸收反应可知,若NO和NO2的物质的量之比大于1:1,NO不能被吸收,因此,吸收后排放的尾气中含量较高的氮氧化物是NO,
故答案为NaNO3;NO;
(3)①在酸性的NaClO溶液中,次氯酸根离子和氢离子结合生成HClO,HClO和NO发生氧化还原反应生成NO3-和Cl-,根据得失电子守恒及电荷守恒、原子守恒,配平离子方程式为2NO+3HClO+H2O=2 NO3-+3 Cl-+5H+,
故答案为2NO+3HClO+H2O=2 NO3-+3 Cl-+5H+;
②在相同条件下,氧化剂的浓度越大,氧化能力越强,由反应2NO+3HClO+H2O=2NO3-+3 Cl-+5H+可知,溶液pH越小,溶液中HClO浓度越大,氧化NO的能力越强,
故答案为溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.陶瓷是一种常见硅酸盐材料,可以用陶瓷坩埚熔融纯碱
B.在自然界以游离态存在
C.溶液可与反应
D.属于酸性氧化物,不与任何酸反应
2.近年来,具有特殊性质的新型无机非金属材料迅速发展,下列有关新型无机非金属材料的叙述不正确的是
A.新型无机非金属材料克服了传统无机非金属材料的许多缺点
B.碳化硅的硬度大、熔点高,可用于制作高温结构陶瓷和轴承
C.氮化硅陶瓷是一种新型无机非金属材料,可用于制造发动机,其化学式为Si3N4
D.合成纤维和光导纤维都是新型无机非金属材料
3.关于二氧化硅,下列叙述不正确的是
A.水晶的主要成分是二氧化硅
B.二氧化硅和二氧化碳在物理性质上有很大差别
C.二氧化硅不溶于水,也不能跟水起反应生成酸
D.二氧化硅是一种酸性氧化物,它不跟任何酸起反应
4.“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是
A.玻璃的主要成分为Na2CO3、CaCO3和SiO2
B.生产陶瓷、玻璃、水泥都用到黏土
C.硅酸盐制品的性质稳定、熔点较高
D.沙子和黏土的主要成分均为硅酸盐
5.“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品,玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是
A.玻璃是人类最早使用的硅酸盐制品 B.制水泥的原料为纯碱、石灰石和石英砂
C.硅酸盐制品的性质稳定、熔点较高 D.沙子和黏土的主要成分均为硅酸盐
6.化学与生产、生活、科研密切相关。下列说法错误的是
A.氮化硅陶瓷、光导纤维、硅酸盐水泥均属于新型无机非金属材料
B.火箭发射时使用液氢和液氧作推进剂,是利用燃烧反应提供能量
C.月球探测器使用的太阳能电池板,其主要成分是单质硅
D.制造月球探测器中的瞄准镜时使用的光导纤维,其主要成分是二氧化硅
7.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是硅,下列有关硅及其化合物叙述正确的是
A.水玻璃可做防火材料 B.水晶、玛瑙的主要成分是晶体硅
C.可用石英坩埚加热熔融氢氧化钠固体 D.二氧化硅不和任何酸反应
8.由粗制备纯的流程如图所示,下列说法不正确的是
A.X可用作木材防火剂
B.步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3↓+Na2SO4
C.步骤Ⅱ中的稀硫酸可用替代
D.若在实验室完成步骤Ⅲ,一般在蒸皿中进行
9.单晶硅是制作电子集成电路的基础材料。用化学方法可制得高纯度硅,其化学方程式为:
①SiO2+2CSi+2CO↑
②Si+3HClSiHCl3+H2
③SiHCl3+H2Si(纯)+3HCl
下列对上述三个反应的叙述中,正确的是
A.仅①③为置换反应
B.②为化合反应
C.①②③均为氧化还原反应
D.三个反应的反应物中硅元素均被还原
10.纳米材料被誉为21世纪最有发展前景的新型材料。纳米碳管是一种由碳原子构成的直径为几纳米的空心管。下列说法错误的是
A.纳米碳管是一种新型的有机化合物
B.纳米碳管在常温下化学性质稳定
C.纳米碳管材料如果完全燃烧,生成物是二氧化碳
D.纳米碳管材料管道多,表面积大,吸附能力强
二、实验题
11.晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅的过程如下:
I.高温下用过量的碳还原二氧化硅制得粗硅;
II.粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HClSiHCl3+H2);
III.SiHCl3与过量的H2在1100~1200℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应。
(1)第一步用焦炭与石英砂制取粗硅,其反应的化学方程式为_______;上述反应中的氧化剂是_______,还原剂是_______。
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为_______。
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):
①装置B中的试剂是_______,装置C中的烧杯需要加热,目的是_______。
②反应一段时间后,装置D中观察到的现象是_______,装置D不能采用普通玻璃管的原因是_______,装置D中发生反应的化学方程式是_______。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_____。
12.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HClSiHCl3+H2;
③SiHCl3与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为_______________________。
(3)用SiHCl3与过量H2反应制备硅的装置如图(热源及夹持装置略去):
①装置B中的试剂是浓硫酸。装置C中的烧瓶需要加热,其目的是________________________________。
②反应一段时间后,装置D中观察到的现象是_______________________________________;
装置D中发生反应的化学方程式为____________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置中的空气。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂是______(填字母)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
三、原理综合题
13.N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH 2+H2O
2NO2+2OH ++H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl 和,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.陶瓷是一种常见硅酸盐材料,二氧化硅能和碱反应,不能用陶瓷坩埚熔融纯碱,故A错误;
B.自然界中没用游离态Si,故B错误;
C.溶液可与反应生成碳酸钠和硅酸,故C正确;
D.与氢氟酸反应生成SiF4气体和水,故D错误;
选C。
2.D
【详解】A.传统的无机非金属材料,缺点为质地较脆,经不起热冲击,新型无机非金属材料克服了传统无机非金属材料的缺点,能承受高温,强度较高,具有电学特性、光学特性等,A项正确;
B.碳化硅的硬度大,熔点高,可用于制作高温结构陶瓷和轴承,B项正确;
C.氮化硅陶瓷是一种新型无机非金属材料,可用于制造发动机,其化学式为Si3N4,C项正确;
D.光导纤维属于新型无机非金属材料,但合成纤维属于有机高分子材料,D项错误;
故选D。
3.D
【详解】A.水晶的主要成分为SiO2,A项正确;
B.CO2是由分子构成的,而SiO2是Si和O按1∶2组成的空间立体网状结构的晶体,二者物理性质差别较大,B项正确;
C.SiO2不溶于水,也不与水反应,C项正确;
D.SiO2可以与氢氟酸反应,D项错误;
故选D。
4.C
【详解】A.陶瓷是人类最早使用的硅酸盐材料,不是玻璃,故A错误;
B.水泥的原料是黏土和石灰石,纯碱、石灰石、石英是制造玻璃的原料,生成玻璃不需要黏土,故B错误;
C.硅酸盐性质稳定,熔点较高,所以硅酸盐制品一般具有性质稳定、熔点较高特点,故C正确;
D.沙子主要成分为二氧化硅,为氧化物,不是硅酸盐,故D错误;
故选:C。
5.C
【详解】A.陶瓷是人类最早使用的硅酸盐材料,不是玻璃,A错误;
B.水泥的原料是黏土和石灰石,纯碱、石灰石、石英是制造玻璃的原料,生成玻璃不需要黏土,B错误;
C.硅酸盐性质稳定,熔点较高,所以硅酸盐制品一般具有性质稳定、熔点较高的特点,C正确;
D.沙子主要成分是二氧化硅,为氧化物,不是硅酸盐,D错误;
故答案选C。
6.A
【详解】A.氮化硅、光导纤维属于新型无机非金属材料,硅酸盐水泥属于传统无机非金属材料,A错误;
B.火箭发射时使用液氢和液氧作推进剂,二者化合生成水,同时放出大量热,因此是利用燃烧反应提供能量,B正确;
C.硅是半导体,可以导电,月球探测器使用的太阳能电池板,其主要成分是单质硅,C正确;
D.二氧化硅可以传递光信号,制造月球探测器中的瞄准镜时使用的光导纤维,其主要成分是二氧化硅,D正确;
答案选A。
7.A
【详解】A.硅酸钠水溶液俗称水玻璃,不易燃烧,具有阻燃性,可做防火材料,故A正确;
B.水晶、玛瑙主要成分为二氧化硅,不是晶体硅,故B错误;
C.石英成分为二氧化硅,与氢氧化钠反应,所以不能用石英坩埚加热熔融氢氧化钠固体,故C错误;
D.常温下,二氧化硅与氢氟酸反应生成四氟化硅和水,故D错误;
故选A。
8.D
【分析】由流程可知,加入足量NaOH溶液可溶解SiO2,过滤分离出不溶杂质,X含硅酸钠,加过量硫酸,过滤分离出硅酸,灼烧生成SiO2。
【详解】A. X含硅酸钠溶液,可用作木材防火剂,故A正确;
B. X中主要含硅酸钠,则步骤Ⅱ中的主要反应是Na2SiO3+H2SO4═H2SiO3↓+Na2SO4,故B正确;
C. 二氧化碳与硅酸钠反应生成硅酸得到Y,则步骤Ⅱ中的稀硫酸能用CO2代替,故C正确;
D. 硅酸灼烧生成SiO2,则在实验室中完成步骤Ⅲ,一般在坩埚中进行,故D错误;
故选D。
9.C
【详解】A.置换反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的化学反应,反应①②③均为置换反应,A错误;
B.化合反应是多种物质反应生成一种物质,反应②不是化合反应,为置换反应,B错误;
C.反应①②③均有元素发生了化合价的改变,均为氧化还原反应,C正确;
D.反应①③中硅元素化合价降低,被还原,反应②中硅元素化合价升高,被氧化,D错误;
故选C。
10.A
【详解】A.纳米碳管是一种新型的无机物,属于单质,A错误;
B.纳米碳管在常温下化学性质稳定,B正确;
C.纳米碳管材料为碳的同素异形体,如果完全燃烧,生成物是二氧化碳,C正确;
D.纳米碳管材料管道多,直径为纳米级别,表面积大,吸附能力强,D正确;
故选A。
11.(1) SiO2+2CSi+2CO↑ SiO2 C
(2)分馏(或蒸馏)
(3) 浓硫酸 使滴入烧瓶中的SiHCl3汽化 有固体生成 在此反应温度下,普通玻璃会软化 SiHCl3 +H2Si+3HCl 排尽装置内的空气
【详解】(1)焦炭与石英砂制取粗硅:SiO2+2CSi+2CO↑,SiO2得电子,价态降低,为氧化剂,C失电子,价态升高,为还原剂。
(2)SiHCl3的沸点和所含杂质的沸点相差较大,故可以采用分馏(或蒸馏)的方法。
(3)①SiHCl3能与水剧烈反应,应将制得的H2中的水蒸气除去,故装置B中的试剂是浓硫酸;常温下SiHCl3为液体,反应时应使其汽化后再在D处与H2反应,故装置C的烧瓶需加热;
②H2和汽化后的SiHCl3在装置D中发生反应:SiHCl3 +H2Si+3HCl,故D中观察到的现象是有固体生成,在此反应温度下,普通玻璃会软化,故不能采用普通玻璃管。
③制备流程包含高温下加热氢气,氢气和氧气混合在高温条件下易发生爆炸,因此必须排尽装置内的空气。
12. SiO2+2CSi+2CO↑ 分馏(或蒸馏) 使滴入烧瓶中的SiHCl3汽化 有固体物质生成 SiHCl3+H2Si+3HCl b、d
【详解】(1)根据题给信息,粗硅可以用碳还原二氧化硅的办法来制得,故反应方程式为SiO2+2CSi+2CO↑;
(2)因HCl易溶于水,而SiHCl3与H2O强烈反应,故提纯SiHCl3的方法只能在无水的条件下利用它们的沸点不同,采用分馏的方法进行;
(3)①C中烧瓶需加热,其目的是使SiHCl3汽化,加快与H2的反应;
②根据题给信息石英管中产生的物质应为硅,故D中现象为有固体产生;SiHCl3和H2反应生成Si和HCl,Si元素化合价由+2价下降到0价,H元素由0价上升到+1价,根据得失电子守恒和原子守恒配平方程式为:SiHCl3+H2Si+3HCl;
④铁与盐酸反应产生Fe2+,常常采用先将Fe2+氧化为Fe3+,然后再加入KSCN溶液看是否变红来检验,故答案为:b、d。
13. 2NH3+2O2N2O+3H2O BC NaNO3 NO 3HClO+2NO+H2O=3Cl +2+5H+ 溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强
【详解】(1)NH3与O2在加热和催化剂作用下发生氧化还原反应生成N2O,根据得失电子守恒和原子守恒可知反应有水生成,配平化学方程式为:2NH3+2O2N2O+3H2O,
故答案为2NH3+2O2N2O+3H2O;
(2)①A.加快通入尾气的速率,不能提高尾气中NO和NO2的去除率,不选A;
B.采用气、液逆流的方式吸收尾气,可使气液充分接触,能提高尾气中NO和NO2的去除率,选B;
C.定期补充适量的NaOH溶液可增大反应物浓度,能提高尾气中NO和NO2的去除率,选C。
故答案为BC;
②由吸收反应:NO+NO2+2OH-=2NO2-+H2O,2NO2+2OH-=NO2-+ NO3-+H2O可知,反应后得到NaNO2和NaNO3混合溶液,经浓缩、结晶、过滤得到NaNO2和NaNO3晶体,因此得到的NaNO2混有NaNO3;由吸收反应可知,若NO和NO2的物质的量之比大于1:1,NO不能被吸收,因此,吸收后排放的尾气中含量较高的氮氧化物是NO,
故答案为NaNO3;NO;
(3)①在酸性的NaClO溶液中,次氯酸根离子和氢离子结合生成HClO,HClO和NO发生氧化还原反应生成NO3-和Cl-,根据得失电子守恒及电荷守恒、原子守恒,配平离子方程式为2NO+3HClO+H2O=2 NO3-+3 Cl-+5H+,
故答案为2NO+3HClO+H2O=2 NO3-+3 Cl-+5H+;
②在相同条件下,氧化剂的浓度越大,氧化能力越强,由反应2NO+3HClO+H2O=2NO3-+3 Cl-+5H+可知,溶液pH越小,溶液中HClO浓度越大,氧化NO的能力越强,
故答案为溶液pH越小,溶液中HClO的浓度越大,氧化NO的能力越强。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
