【备考2023】浙教版科学“冲刺重高”压轴训练(三):化学综合计算【word,含答案】
文档属性
| 名称 | 【备考2023】浙教版科学“冲刺重高”压轴训练(三):化学综合计算【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 306.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-05-12 22:01:04 | ||
图片预览




文档简介
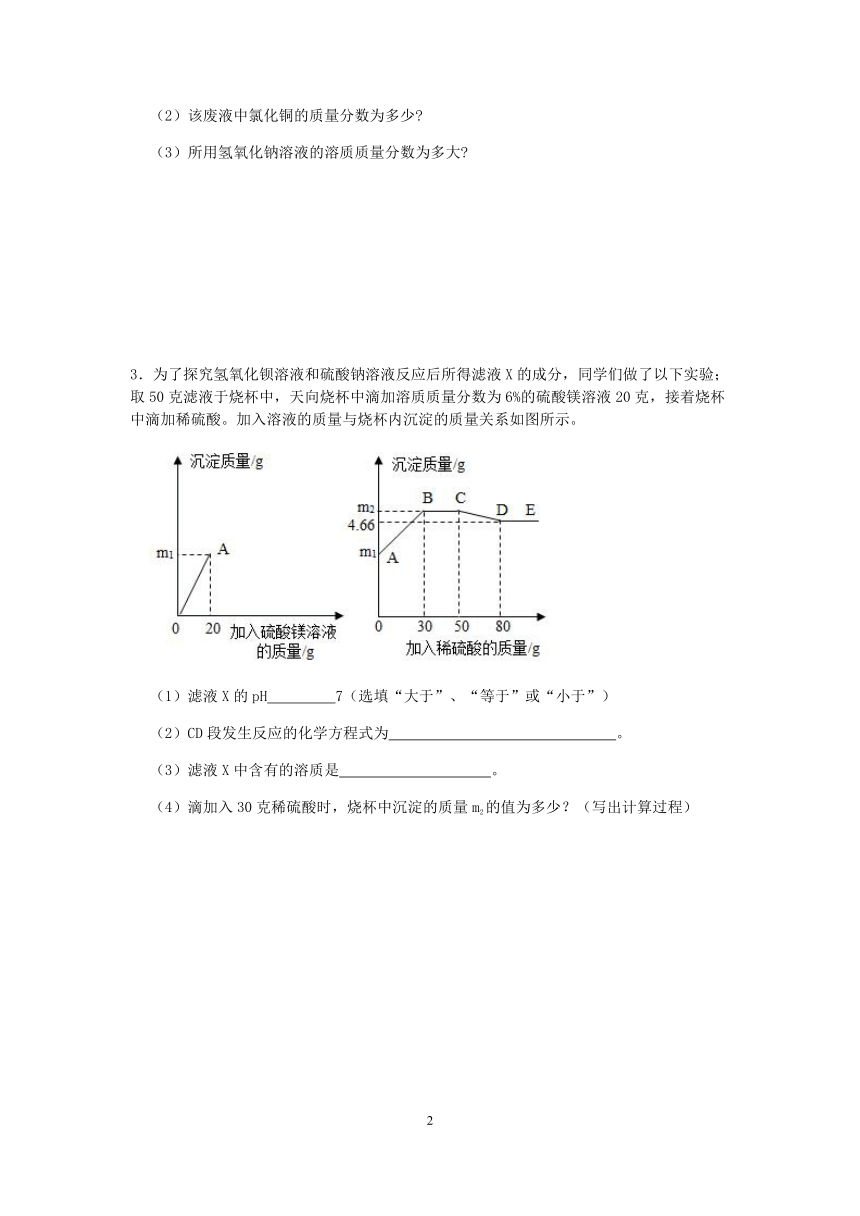
1.实验室有一份在空气中潮解变质的氢氧化钠样品,质量为1.5g。某实验小组将这份样品完全溶解,配成50g溶液,然后缓慢滴入7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据如下表所示:
测量次数 第1次 第6次 第16次 第21次 第26次
滴加的盐酸总质量/g 0 5 15 20 25
溶液总质量/g 50 55 m 69.78 74.78
溶液pH 12.4 12.1 7.0 2.2 2.1
请分析计算:
(1)第 次测量时,溶液中只有一种溶质。
(2)表中m= 。
(3)样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(4)1.5g样品中氢氧化钠固体的质量。
2.某次实验后,得到了一杯可能还含有少量盐酸的氯化铜废液,某同学想知道该废液中否还含有盐酸以及氯化铜的质量分数,他取了109.8g废液于烧杯中,然后向废液中逐滴加入一定溶质质量分数的氢氧化钠溶液,所加氢氧化钠溶液与生成沉淀的质量关系如图所示。试分析计算:
(1)该废液中是否还含有盐酸
(2)该废液中氯化铜的质量分数为多少
(3)所用氢氧化钠溶液的溶质质量分数为多大
3.为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验;取50克滤液于烧杯中,天向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
(1)滤液X的pH 7(选填“大于”、“等于”或“小于”)
(2)CD段发生反应的化学方程式为 。
(3)滤液X中含有的溶质是 。
(4)滴加入30克稀硫酸时,烧杯中沉淀的质量m2的值为多少?(写出计算过程)
4.有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末。工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通。小柯利用如图装置测定疏通剂中铝的质量分数。
Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1。
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2。
Ⅲ.实验数据如下表:
反应前总质量m1 反应后总质量m2
371.84g 371.24g
回答下列问题:
(1)配平化学方程式:2Al+2NaOH+2H2O NaAlO2+3H2↑
(2)根据化学方程式计算样品中铝的质量分数。
(3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有__________。
A.向锥形瓶中倒入样品时,撒出了部分粉末
B.在反应过程中有水蒸气逸出
C.没有等装置中氢气全部排尽就称量
5.某兴趣小组在实验室发现一瓶敞口久置且不干燥的氢氧化钠和一瓶浓度为 14.6%的稀盐酸。为测定氢氧化钠的变质情况,他们取 9.5 g 变质的氢氧化钠样品于锥形瓶中,加入50 g 水,充分溶解,再向锥形瓶中滴加稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示。(计算结果 均保留一位小数)求:
(1)反应中共产生二氧化碳的质量是
(2)9.5g样品中碳酸钠的质量。
(3)9.5g样品中氢氧化钠的质量分数。
(4)反应刚结束时溶液的溶质质量分数。
6.用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氯化钠)加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如下表:
实验次数 第1次 第2次 第3次 第4次 第5次 第6次
反应前溶液的质量/g 20.0 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 M 191.0 211.0
请根据实验数据分析解答下列问题:(已知:CaCl2+Na2CO3=CaCO3↓+2NaCl)
(1)实验前,向食用碱样品溶液中滴入紫色石荔试液,溶液呈 色。
(2)表中数据M的值为 。
(3)计算该食用碱样品中碳酸钠的质量分数。(结果保留到0.1%)
7.家庭食用碱的主要成分是Na2CO3,为测定该食用碱中Na2CO3的质量分数,小姚进行了以下实验。取48g食用碱,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表(假设该食用碱中不含难溶性杂质且杂质均不与CaCl2溶液产生沉淀)。请分析表中数据回答并计算。
实验一 实验二 实验三 实验四
食用碱的质量/g 12 12 12 12
加入CaCl2溶液的质量/g 20 40 60 80
生成沉淀的质量/g 4 m 10 10
(1)m= g。
(2)该食用碱中Na2CO3的质量分数是多少 (写出计算过程,答案精确到0.1%)
(3)根据表中实验数据以及适当的计算,请画出实验四中生成沉淀的质量和加入CaCl2溶液的质量的坐标关系图,请标出拐点数据。
8.某食用碱的主要成分是Na2CO3,其中含有少量的NaCl,小明同学为测定该食用碱中Na2CO3的质量分数,他进行了以下实验,取40g食用碱,加水配成400g的溶液,把溶液平均分为四份,然后分别加入一定质量分数的CaCl2浴液,实验数据见表:
实验一 实验二 实验三 实验四
食用碱溶液的质量 100g 100g 100g 100g
加入CaCl2溶液的质量 20g 40g 60g 80g
生成沉淀的质量 2.5g 5g m 8g
请分析表中数据并计算回答:
(1)m= ;
(2)40g该食用碱配成的溶液与足量CaCl2溶液反应,最多生成沉淀质量为 g;
(3)该食用碱中Na2CO3的质量分数是多少?
(4)请根据实验四的数据画图并标上合适的坐标数据。
9.实验室现有一瓶水垢样品,其成分为氢氧化镁和碳酸钙。已知:氢氧化镁受热易分解,反应的化学方程式为:Mg(OH)2MgO+H2O;碳酸钙高温下分解,某兴趣小组为测定其中各成分的质量分数,取12.9g水垢样品加热,加热过程中剩余固体的质量随加热时间的变化如图所示。请据图分析并计算:
(1)Mg(OH)2受热分解生成的水的质量为 g。
(2)水垢样品中Mg(OH)2的质量分数为多少?(结果精确到0.1%)
(3)x的值为多少?
(4)当剩余固体中钙元素的质量分数为36.0%,此时剩余固体处于图中的 段。(填“ab”、“bc”、“cd”或“de”)
10.为探究铜及其化合物的性质,进行如下实验:称取一定质量已部分被H2还原的氧化铜粉末(含Cu和CuO)置于烧杯中,向其中加入50g稀硫酸,充分反应后,再向烧杯中加入溶质质量分数为20%的NaOH溶液,烧杯内固体物质的质量与加入NaOH溶液的质量关系如图所示。请分析计算:
(1)加完50克稀硫酸后溶液中的溶质为 (写出化学式);
(2)Cu和CuO的混合物中,Cu元素和O元素的质量比为 。
(3)a的值。
参考答案
1.解:
根据第16次实验时pH=7,表示恰好完全反应,根据前两组数据,而第四组数据应该是总质量不变,所以m=69.78g﹣5g=64.78g,即m=64.78。
生成二氧化碳的质量为50g+15g﹣64.78g=0.22g
设碳酸钠的质量为x,与碳酸钠反应的稀盐酸的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x 7.3%y 0.22g
x=0.53g
y=5g
样品中碳酸钠的质量分数为100%≈35.3%
则与氢氧化钠反应的盐酸的质量为15g﹣5g=10g。设氢氧化钠的质量为z
NaOH+HCl=NaCl+H2O
40 36.5
z 10g×7.3%
z=0.8g
故答案为:(1)16。(2)64.78。(3)35.3%,(4)0.8g。
2.(1)是(有)
(2) 解: 设生成氯化铜的质量为x
CuCl2+2NaOH= Cu(OH)2↓+2NaCl
135 98
x 9.8g
x=13.5g
CuCl2%=13.5g/109.8g=12.3% (12%)
答:氯化铜的质量分数为 12.3%
(3)解:生成氢氧化钠的质量为 y
CuCl2+ 2NaOH= Cu(OH)2↓+2NaCl
80 98
y 9.8g
y=8g
答:氢氧化钠的质量分数为 16%
3.(1)大于(2)Mg(OH)2+H2SO4=MgSO4+2H2O(3)Ba(OH)2和NaOH
(4)解:设加入20克硫酸镁溶液时,生成Mg(OH)2沉淀的质量为x。
Ba(OH)2+ MgSO4=BaSO4↓+ Mg(OH)2↓
120 58
20克×6% x
120:58=1.2克:x
解得x=0.58克
M2=4.66克+0.58克=5.24克
【解答】(1)加入稀硫酸沉淀增加,说明氢氧化钡有剩余,且氢氧化钡与硫酸钠反应生成氢氧化钠,则滤液XpH大于7;
(2) CD段沉淀减少,为氢氧化镁与硫酸的反应,发生反应的化学方程式为 Mg(OH)2+H2SO4=MgSO4+2H2O ;
(3) 滤液X中含有的溶质是Ba(OH)2和NaOH ;
故答案为:(2) Mg(OH)2+H2SO4=MgSO4+2H2O;(3) Ba(OH)2和NaOH ;(4) 5.24克 。
4.(1)2
(2)反应产生的氢气质量为371.84g-371.24g=0.6g
设参加反应的铝质量为x
2Al+2NaOH+H2O===2NaAlO2+3H2↑
2Al+2NaOH+H2O=2NaAlO2+ 3H2↑
54 6
x 0.6g
解得x=5.4g
Al%=
答:该样品中铝的质量分数为27%。
(3)B;C
【解答】(1)根据质量守恒定律可知是2;(3)导致样品中铝的质量分数测量结果偏高的原因可能有,A选项撒出了部分粉末铝的质量分数将减小;B选项由于反应过程中有水蒸气逸出,我们在计算时误将水蒸气当作氢,而增大由此计算得到的铝的质量从则铝的质量分数增大。C选项没有等装置中氢气全部排尽就称量,氢气质量比等体积的空气质量要小称量结果将始反应后的总质量偏小,而使反应前后的质量差增大也就是计算时的氢气质量增大了,由此得到的铝质量增大故质量分数也偏大,答案B、C
故答案为:1、2;2、;3、B、C
5.(1)2.2g
(2)设9.5g样品中碳酸钠的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑;
106 44
x 2.2g
;
解得:x=5.3g。
(3)9.5g样品中氢氧化钠的质量分数为:。
(4)碳酸钠和稀盐酸反应生成氯化钠,氢氧化钠和稀盐酸反应也生成氯化钠;
HCl ~ NaCl
36.5 58.5
50g×14.6%=7.3g y
;
解得:y=11.7g;
则反应结束后溶液的溶质质量分数为:。
【解答】(1)根据质量守恒定律可知,反应产生二氧化碳的质量:9.5g+50g+50g-107.3g=2.2g。
6.(1)蓝
(2)172
(3)碳酸钙的质量m=100g+20g-211g=9g
解:设该食用碱样品中碳酸钠的质量为x
CaCl3+ Na2CO3= CaCO3↓+2NaCl
106 100
x 9g
x=9.54g
×100%≈86.7%
答:该食用贼样品中碳酸钠的质量分数是86.7%
【解答】(1)食用碱的主要成分为碳酸钠,它的水溶液呈碱性,则:向食用碱样品溶液中滴入紫色石荔试液,溶液呈蓝色。
(2)根据第1组和第2组数据可知,没加入20g氯化钙,溶液的总质量增加:136g-118g=18g,那么第4次加入20g氯化钙时,溶液总质量比第3次增加18g,即M=154g+18g=172g。
7.(1)8
(2)解:设碳酸钠质量为×
Na2CO3+CaCl= CaCO3↓+2NaCl
106 100
x 10g
×=10.6g
该食用碱中Na2CO3的质量分数是 × 100%≈88.3%
答:该食用碱中Na2CO3的质量分数是88.3%
(3)如图所示:
8.(1)7.5
(2)32
(3)解:10g该食用碱中Na2CO3的质量为x
Na2CO3+CaCl2= CaCO3↓+NaCl
106 100
x 8g
解得:x=8.48g
该食用碱中Na2CO3的质量分数分数=(8.48g/10g)×100%=84.8%
(4)每消耗20gCaCl2溶液生成沉淀的质量为2.5g;所以当生成8g沉淀消耗的CaCl2溶液为8g× =64g,所以图像如图
【解答】(1)由表中数据可知,氯化钙溶液20克完全反应产生沉淀2.5克,则m=7.5;
(2)由题意可知,10克食用碱完全反应 生成8克碳酸钙沉淀,则40克完全反应时生成沉淀质量为32克;
故答案为:(1)7.5;(2)32;(3) 84.8% ;(4)。
9.解:(1)由题意可知,碳酸钙高温下分解放出了二氧化碳气体,固体的质量要减少,完全反应后,固体的质量不再减少。由此可知:ab段是氢氧化镁分解,cd段是碳酸钙分解;氢氧化镁受热易分解生成了水蒸气,固体的质量要减少,ab段减少的质量即为水的质量,故Mg(OH)2受热分解生成的水的质量为12.9g﹣12.0g=0.9g;故填:0.9g;
(2)设氢氧化镁的质量为y,生成氧化镁为m
Mg(OH)2MgO+H2O
58 40 18
y m 0.9g
解得:y=2.9g m=2g
水垢样品中Mg(OH)2的质量分数为100%≈22.5%
答:水垢样品中Mg(OH)2的质量分数为22.5%;
(3)碳酸钙高温下分解放出了二氧化碳气体,固体的质量要减少,完全反应后,固体的质量不再减少,x即为生成的氧化钙和氧化镁的质量,由上述计算可知,碳酸钙的质量为:12.9g﹣2.9g=10g
设生成氧化钙的质量为n
CaCO3CaO+CO2↑
100 56
10g n
n=5.6g
因此x=5.6+2g=7.6g;
答:x=7.6g;
(4)由上述计算可知,碳酸钙的质量为:12.9g﹣2.9g=10g
在碳酸钙和氧化镁的混合物中钙元素的质量分数是:100%≈33.3%;
若碳酸钙完全分解,则剩余固体中钙元素的质量分数是100%≈52.6%;
由于剩余固体中钙元素的质量分数为36.0%,52.6>36.0%>33.3%,说明了氢氧化镁已完全分解,碳酸钙没有完全分解,则剩余固体的成分为CaCO3、MgO、CaO,即当剩余固体中钙元素的质量分数为36.0%,此时剩余固体处于图中的cd段;故填:cd;
10.解:(1)加入10g氢氧化钠溶液时,固体质量不变,说明氢氧化钠和稀硫酸反应生成硫酸钠和水,进一步说明稀硫酸过量,加完50g稀硫酸后溶液中的溶质为过量的硫酸和反应生成的硫酸铜。
故填:H2SO4、CuSO4。
(2)设氧化铜质量为x,生成氢氧化铜质量为y,
由CuO+H2SO4═CuSO4+H2O、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4可知,CuO﹣2NaOH﹣Cu(OH)2,
CuO﹣2NaOH﹣Cu(OH)2,
80 80 98
x 20g×20% y
,
x=4g,y=4.9g,
由图中数据可知,铜质量是3.2g,4g氧化铜中铜元素质量:4g3.2g,氧元素质量:4g﹣3.2g=0.8g,
Cu和CuO的混合物中,Cu元素和O元素的质量比为:(3.2g+3.2g):0.8g=8:1。
故填:8:1。
(3)a=3.2+4.9=8.1.
故答案为:8.1。
化学综合计算
测量次数 第1次 第6次 第16次 第21次 第26次
滴加的盐酸总质量/g 0 5 15 20 25
溶液总质量/g 50 55 m 69.78 74.78
溶液pH 12.4 12.1 7.0 2.2 2.1
请分析计算:
(1)第 次测量时,溶液中只有一种溶质。
(2)表中m= 。
(3)样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(4)1.5g样品中氢氧化钠固体的质量。
2.某次实验后,得到了一杯可能还含有少量盐酸的氯化铜废液,某同学想知道该废液中否还含有盐酸以及氯化铜的质量分数,他取了109.8g废液于烧杯中,然后向废液中逐滴加入一定溶质质量分数的氢氧化钠溶液,所加氢氧化钠溶液与生成沉淀的质量关系如图所示。试分析计算:
(1)该废液中是否还含有盐酸
(2)该废液中氯化铜的质量分数为多少
(3)所用氢氧化钠溶液的溶质质量分数为多大
3.为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验;取50克滤液于烧杯中,天向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
(1)滤液X的pH 7(选填“大于”、“等于”或“小于”)
(2)CD段发生反应的化学方程式为 。
(3)滤液X中含有的溶质是 。
(4)滴加入30克稀硫酸时,烧杯中沉淀的质量m2的值为多少?(写出计算过程)
4.有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末。工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通。小柯利用如图装置测定疏通剂中铝的质量分数。
Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1。
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2。
Ⅲ.实验数据如下表:
反应前总质量m1 反应后总质量m2
371.84g 371.24g
回答下列问题:
(1)配平化学方程式:2Al+2NaOH+2H2O NaAlO2+3H2↑
(2)根据化学方程式计算样品中铝的质量分数。
(3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有__________。
A.向锥形瓶中倒入样品时,撒出了部分粉末
B.在反应过程中有水蒸气逸出
C.没有等装置中氢气全部排尽就称量
5.某兴趣小组在实验室发现一瓶敞口久置且不干燥的氢氧化钠和一瓶浓度为 14.6%的稀盐酸。为测定氢氧化钠的变质情况,他们取 9.5 g 变质的氢氧化钠样品于锥形瓶中,加入50 g 水,充分溶解,再向锥形瓶中滴加稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示。(计算结果 均保留一位小数)求:
(1)反应中共产生二氧化碳的质量是
(2)9.5g样品中碳酸钠的质量。
(3)9.5g样品中氢氧化钠的质量分数。
(4)反应刚结束时溶液的溶质质量分数。
6.用沉淀法可测定食用碱样品中碳酸钠的质量分数。取11g食用碱样品(有少量的杂质氯化钠)加水完全溶解制成100g溶液,逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如下表:
实验次数 第1次 第2次 第3次 第4次 第5次 第6次
反应前溶液的质量/g 20.0 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 M 191.0 211.0
请根据实验数据分析解答下列问题:(已知:CaCl2+Na2CO3=CaCO3↓+2NaCl)
(1)实验前,向食用碱样品溶液中滴入紫色石荔试液,溶液呈 色。
(2)表中数据M的值为 。
(3)计算该食用碱样品中碳酸钠的质量分数。(结果保留到0.1%)
7.家庭食用碱的主要成分是Na2CO3,为测定该食用碱中Na2CO3的质量分数,小姚进行了以下实验。取48g食用碱,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表(假设该食用碱中不含难溶性杂质且杂质均不与CaCl2溶液产生沉淀)。请分析表中数据回答并计算。
实验一 实验二 实验三 实验四
食用碱的质量/g 12 12 12 12
加入CaCl2溶液的质量/g 20 40 60 80
生成沉淀的质量/g 4 m 10 10
(1)m= g。
(2)该食用碱中Na2CO3的质量分数是多少 (写出计算过程,答案精确到0.1%)
(3)根据表中实验数据以及适当的计算,请画出实验四中生成沉淀的质量和加入CaCl2溶液的质量的坐标关系图,请标出拐点数据。
8.某食用碱的主要成分是Na2CO3,其中含有少量的NaCl,小明同学为测定该食用碱中Na2CO3的质量分数,他进行了以下实验,取40g食用碱,加水配成400g的溶液,把溶液平均分为四份,然后分别加入一定质量分数的CaCl2浴液,实验数据见表:
实验一 实验二 实验三 实验四
食用碱溶液的质量 100g 100g 100g 100g
加入CaCl2溶液的质量 20g 40g 60g 80g
生成沉淀的质量 2.5g 5g m 8g
请分析表中数据并计算回答:
(1)m= ;
(2)40g该食用碱配成的溶液与足量CaCl2溶液反应,最多生成沉淀质量为 g;
(3)该食用碱中Na2CO3的质量分数是多少?
(4)请根据实验四的数据画图并标上合适的坐标数据。
9.实验室现有一瓶水垢样品,其成分为氢氧化镁和碳酸钙。已知:氢氧化镁受热易分解,反应的化学方程式为:Mg(OH)2MgO+H2O;碳酸钙高温下分解,某兴趣小组为测定其中各成分的质量分数,取12.9g水垢样品加热,加热过程中剩余固体的质量随加热时间的变化如图所示。请据图分析并计算:
(1)Mg(OH)2受热分解生成的水的质量为 g。
(2)水垢样品中Mg(OH)2的质量分数为多少?(结果精确到0.1%)
(3)x的值为多少?
(4)当剩余固体中钙元素的质量分数为36.0%,此时剩余固体处于图中的 段。(填“ab”、“bc”、“cd”或“de”)
10.为探究铜及其化合物的性质,进行如下实验:称取一定质量已部分被H2还原的氧化铜粉末(含Cu和CuO)置于烧杯中,向其中加入50g稀硫酸,充分反应后,再向烧杯中加入溶质质量分数为20%的NaOH溶液,烧杯内固体物质的质量与加入NaOH溶液的质量关系如图所示。请分析计算:
(1)加完50克稀硫酸后溶液中的溶质为 (写出化学式);
(2)Cu和CuO的混合物中,Cu元素和O元素的质量比为 。
(3)a的值。
参考答案
1.解:
根据第16次实验时pH=7,表示恰好完全反应,根据前两组数据,而第四组数据应该是总质量不变,所以m=69.78g﹣5g=64.78g,即m=64.78。
生成二氧化碳的质量为50g+15g﹣64.78g=0.22g
设碳酸钠的质量为x,与碳酸钠反应的稀盐酸的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x 7.3%y 0.22g
x=0.53g
y=5g
样品中碳酸钠的质量分数为100%≈35.3%
则与氢氧化钠反应的盐酸的质量为15g﹣5g=10g。设氢氧化钠的质量为z
NaOH+HCl=NaCl+H2O
40 36.5
z 10g×7.3%
z=0.8g
故答案为:(1)16。(2)64.78。(3)35.3%,(4)0.8g。
2.(1)是(有)
(2) 解: 设生成氯化铜的质量为x
CuCl2+2NaOH= Cu(OH)2↓+2NaCl
135 98
x 9.8g
x=13.5g
CuCl2%=13.5g/109.8g=12.3% (12%)
答:氯化铜的质量分数为 12.3%
(3)解:生成氢氧化钠的质量为 y
CuCl2+ 2NaOH= Cu(OH)2↓+2NaCl
80 98
y 9.8g
y=8g
答:氢氧化钠的质量分数为 16%
3.(1)大于(2)Mg(OH)2+H2SO4=MgSO4+2H2O(3)Ba(OH)2和NaOH
(4)解:设加入20克硫酸镁溶液时,生成Mg(OH)2沉淀的质量为x。
Ba(OH)2+ MgSO4=BaSO4↓+ Mg(OH)2↓
120 58
20克×6% x
120:58=1.2克:x
解得x=0.58克
M2=4.66克+0.58克=5.24克
【解答】(1)加入稀硫酸沉淀增加,说明氢氧化钡有剩余,且氢氧化钡与硫酸钠反应生成氢氧化钠,则滤液XpH大于7;
(2) CD段沉淀减少,为氢氧化镁与硫酸的反应,发生反应的化学方程式为 Mg(OH)2+H2SO4=MgSO4+2H2O ;
(3) 滤液X中含有的溶质是Ba(OH)2和NaOH ;
故答案为:(2) Mg(OH)2+H2SO4=MgSO4+2H2O;(3) Ba(OH)2和NaOH ;(4) 5.24克 。
4.(1)2
(2)反应产生的氢气质量为371.84g-371.24g=0.6g
设参加反应的铝质量为x
2Al+2NaOH+H2O===2NaAlO2+3H2↑
2Al+2NaOH+H2O=2NaAlO2+ 3H2↑
54 6
x 0.6g
解得x=5.4g
Al%=
答:该样品中铝的质量分数为27%。
(3)B;C
【解答】(1)根据质量守恒定律可知是2;(3)导致样品中铝的质量分数测量结果偏高的原因可能有,A选项撒出了部分粉末铝的质量分数将减小;B选项由于反应过程中有水蒸气逸出,我们在计算时误将水蒸气当作氢,而增大由此计算得到的铝的质量从则铝的质量分数增大。C选项没有等装置中氢气全部排尽就称量,氢气质量比等体积的空气质量要小称量结果将始反应后的总质量偏小,而使反应前后的质量差增大也就是计算时的氢气质量增大了,由此得到的铝质量增大故质量分数也偏大,答案B、C
故答案为:1、2;2、;3、B、C
5.(1)2.2g
(2)设9.5g样品中碳酸钠的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑;
106 44
x 2.2g
;
解得:x=5.3g。
(3)9.5g样品中氢氧化钠的质量分数为:。
(4)碳酸钠和稀盐酸反应生成氯化钠,氢氧化钠和稀盐酸反应也生成氯化钠;
HCl ~ NaCl
36.5 58.5
50g×14.6%=7.3g y
;
解得:y=11.7g;
则反应结束后溶液的溶质质量分数为:。
【解答】(1)根据质量守恒定律可知,反应产生二氧化碳的质量:9.5g+50g+50g-107.3g=2.2g。
6.(1)蓝
(2)172
(3)碳酸钙的质量m=100g+20g-211g=9g
解:设该食用碱样品中碳酸钠的质量为x
CaCl3+ Na2CO3= CaCO3↓+2NaCl
106 100
x 9g
x=9.54g
×100%≈86.7%
答:该食用贼样品中碳酸钠的质量分数是86.7%
【解答】(1)食用碱的主要成分为碳酸钠,它的水溶液呈碱性,则:向食用碱样品溶液中滴入紫色石荔试液,溶液呈蓝色。
(2)根据第1组和第2组数据可知,没加入20g氯化钙,溶液的总质量增加:136g-118g=18g,那么第4次加入20g氯化钙时,溶液总质量比第3次增加18g,即M=154g+18g=172g。
7.(1)8
(2)解:设碳酸钠质量为×
Na2CO3+CaCl= CaCO3↓+2NaCl
106 100
x 10g
×=10.6g
该食用碱中Na2CO3的质量分数是 × 100%≈88.3%
答:该食用碱中Na2CO3的质量分数是88.3%
(3)如图所示:
8.(1)7.5
(2)32
(3)解:10g该食用碱中Na2CO3的质量为x
Na2CO3+CaCl2= CaCO3↓+NaCl
106 100
x 8g
解得:x=8.48g
该食用碱中Na2CO3的质量分数分数=(8.48g/10g)×100%=84.8%
(4)每消耗20gCaCl2溶液生成沉淀的质量为2.5g;所以当生成8g沉淀消耗的CaCl2溶液为8g× =64g,所以图像如图
【解答】(1)由表中数据可知,氯化钙溶液20克完全反应产生沉淀2.5克,则m=7.5;
(2)由题意可知,10克食用碱完全反应 生成8克碳酸钙沉淀,则40克完全反应时生成沉淀质量为32克;
故答案为:(1)7.5;(2)32;(3) 84.8% ;(4)。
9.解:(1)由题意可知,碳酸钙高温下分解放出了二氧化碳气体,固体的质量要减少,完全反应后,固体的质量不再减少。由此可知:ab段是氢氧化镁分解,cd段是碳酸钙分解;氢氧化镁受热易分解生成了水蒸气,固体的质量要减少,ab段减少的质量即为水的质量,故Mg(OH)2受热分解生成的水的质量为12.9g﹣12.0g=0.9g;故填:0.9g;
(2)设氢氧化镁的质量为y,生成氧化镁为m
Mg(OH)2MgO+H2O
58 40 18
y m 0.9g
解得:y=2.9g m=2g
水垢样品中Mg(OH)2的质量分数为100%≈22.5%
答:水垢样品中Mg(OH)2的质量分数为22.5%;
(3)碳酸钙高温下分解放出了二氧化碳气体,固体的质量要减少,完全反应后,固体的质量不再减少,x即为生成的氧化钙和氧化镁的质量,由上述计算可知,碳酸钙的质量为:12.9g﹣2.9g=10g
设生成氧化钙的质量为n
CaCO3CaO+CO2↑
100 56
10g n
n=5.6g
因此x=5.6+2g=7.6g;
答:x=7.6g;
(4)由上述计算可知,碳酸钙的质量为:12.9g﹣2.9g=10g
在碳酸钙和氧化镁的混合物中钙元素的质量分数是:100%≈33.3%;
若碳酸钙完全分解,则剩余固体中钙元素的质量分数是100%≈52.6%;
由于剩余固体中钙元素的质量分数为36.0%,52.6>36.0%>33.3%,说明了氢氧化镁已完全分解,碳酸钙没有完全分解,则剩余固体的成分为CaCO3、MgO、CaO,即当剩余固体中钙元素的质量分数为36.0%,此时剩余固体处于图中的cd段;故填:cd;
10.解:(1)加入10g氢氧化钠溶液时,固体质量不变,说明氢氧化钠和稀硫酸反应生成硫酸钠和水,进一步说明稀硫酸过量,加完50g稀硫酸后溶液中的溶质为过量的硫酸和反应生成的硫酸铜。
故填:H2SO4、CuSO4。
(2)设氧化铜质量为x,生成氢氧化铜质量为y,
由CuO+H2SO4═CuSO4+H2O、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4可知,CuO﹣2NaOH﹣Cu(OH)2,
CuO﹣2NaOH﹣Cu(OH)2,
80 80 98
x 20g×20% y
,
x=4g,y=4.9g,
由图中数据可知,铜质量是3.2g,4g氧化铜中铜元素质量:4g3.2g,氧元素质量:4g﹣3.2g=0.8g,
Cu和CuO的混合物中,Cu元素和O元素的质量比为:(3.2g+3.2g):0.8g=8:1。
故填:8:1。
(3)a=3.2+4.9=8.1.
故答案为:8.1。
化学综合计算
同课章节目录
