第二节 物质组成的表示课件(共58张PPT)
文档属性
| 名称 | 第二节 物质组成的表示课件(共58张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-12 14:31:18 | ||
图片预览









文档简介
(共58张PPT)
POWERPOINT
化 学
学习目标
1.了解化学式的涵义,知道化学式周围数字所示的含义。
2.能正确书写常见单质和化合物的化学式,掌握化学式的读法。
3.会根据化合价书写化学式以及会根据化学式判断化合价。
PART ONE
知识精讲
元素---用元素符号表示纯净物可以用什么来表示??NaCl
食盐
Cu
金属铜
H2O
水
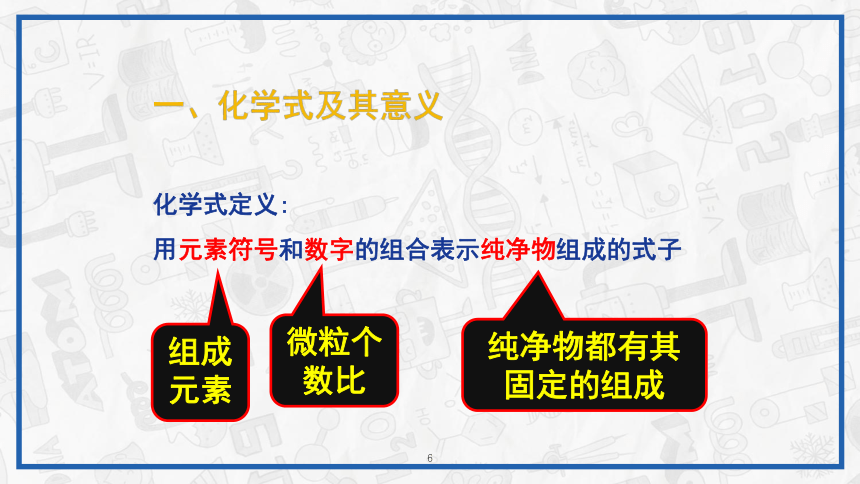
一、化学式及其意义化学式定义:用元素符号和数字的组合表示纯净物组成的式子组成元素微粒个数比纯净物都有其固定的组成只有纯净物才能用化学式表示其组成
化学式的书写必须依据实验的结果
①任何物质都有化学式吗?
②同种物质可以有不同的化学式吗?
一种物质只能用一个化学式来表示
③化学式可以任意的书写吗?
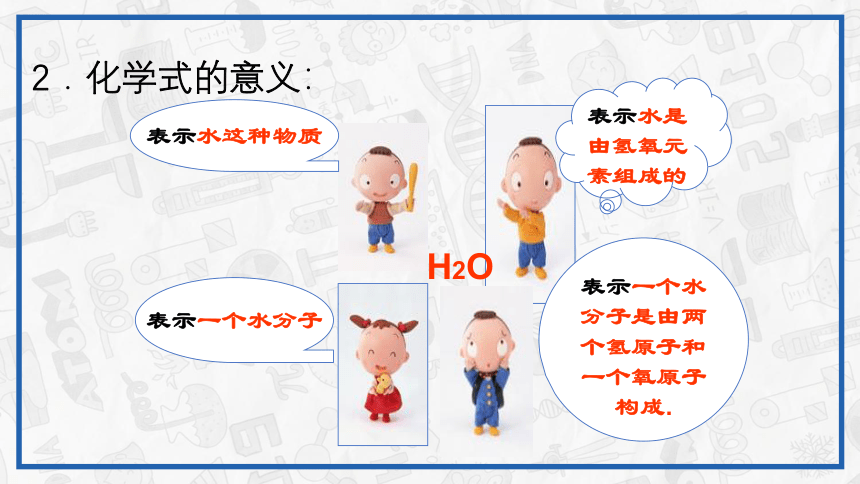
2.化学式的意义:
表示水是由氢氧元素组成的
表示一个水分子是由两个氢原子和一个氧原子构成.
表示水这种物质
表示一个水分子
H2O
化学式的意义
宏观:1、表示一种物质;
2、表示组成物质的各种元素。
微观:1、表示这种物质的一个分子;
2、表示构成这种分子的原子个数。
CO2
表示物质二氧化碳
表示二氧化碳是由氧元素和碳元素组成的
表示一个二氧化碳分子
表示一个二氧化碳分子是由两个氧原子和一个 碳原子构成
3CO2
表示三个二氧化碳分子
① H
③ H2
④ 2H2
符号H、2H、H2、2H2各具有什么意义?
② 2H
表示氢元素或一个氢原子
表示2个氢原子
表示氢气这种物质;氢气是由氢元素组成;
一个氢分子;每个氢分子由2个氢原子构成。
表示两个氢分子
Ca2+表示钙离子;一个钙离子带2个单位的正电荷。2Ca2+表示2个钙离子;一个钙离子带2个单位的正电荷。注意:书写离子符号时“1”应该省略不写。真题训练BC甜蜜素[C6H12NSNa]是一种甜味添加剂。下列有关说法正确的是( )A、它是混合物B、它是化合物C、它由五种元素组成D、它的一个分子中含有20个原子真题训练B海洛因(C21H23NO5)和吗啡(C17H19NO3)都是毒品。下列关于它们的叙述错误的是( )A.海洛因和吗啡的组成元素相同,都是化合物B.吗啡中各元素的个数比为17:19:1:3C.1个海洛因分子和1个吗啡分子中,碳原子的个数比为21:17D.海洛因分子中质子数与电子数相等单质由原子构成由分子构成:金属单质:Cu Fe Hg Mg非金属固态单质:C Si稀有气体单质:He Ne Ar用元素符号及其右下角的数字表示直接用元素符号表示化学式单质化学式的写法与读法H2O2N2F2Cl2读元素符号的名称读“某气”二、化合价(第二课时)学习目标1、记忆常见元素的化合价2、能根据化合价写出常见物质的化学式3、能根据化学式推求某元素的化合价物质中各元素的原子间有一定的比值,这个比值与元素的化合价有关
原子个数比:
水 氨气 甲烷
H2O NH3 CH4
2:1 1:3 1:4
元素化合价实质上是指元素的一个原子在与其它原子化合时得、
失电子的数目或形成共用电子对的数目。
什么是化合价?
NaCl
+1
-1
化合价的数值和符号是由什么决定的?
Cl
Mg
Cl
2+
-
-
MgCl2
+2
-1
化合价的数值和符号是由什么决定的?
小结:化合价的数值由该元素的一个原子得失电子的数目决定的,得电子元素显负价,失电子元素显正价。
离子化合物中,失电子显____价,得电子显____价,化
合价数值就是___________ __ __ 的数值.
+13 2 8 3
如右图所示为铝原子结构示意图,则在化学反应中铝原子易 __电子,形成的离子带 __个单位_ _电荷,在化合物中铝元素的化合价为_ _
正
负
该原子得到或失去的电子
失
3
正
+3
Cl
H
-
HCl
+1
-1
共用电子对
氯化氢的形成过程
元素 元素符号 常见化合价 元素 元素符号 常见化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 氯 Cl -1、+1、+5、+7
钙 Ca +2 溴 Br -1、+1、+5、+7
镁 Mg +2 氧 O -2
钡 Ba +2 硫 S -2、+4、+6
铜 Cu +1、+2 碳 C +2、+4
铁 Fe +2、+3 硅 Si +4
铝 Al +3 氮 N -3、+2、+4、+5
锰 Mn +2、+4、+6、+7 磷 P -3、+3、+5
锌 Zn +2
原子团是在化合物中和在化学反应中常作为一个整体的原子集团,又叫根。
根的名称 根的符号 对应离子 常见化合价
硝酸根 NO3 NO3- -1
氢氧根 OH OH- -1
硫酸根 SO4 SO42- -2
碳酸根 CO3 CO32- -2
铵根 NH4 NH4+ +1
二、化合价的规律
(1)化合价有正价和负价。(化合物:前正后负)
①氧元素通常显-2价,氢元素通常显+1价
②金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价。
非金属元素和氧元素化合时,非金属元素显正价。
(2)在化合物里正负化合价的代数和为0。
NaCl Al2O3
+1 -1 +3 -2
(+1)×1
(-1)×1
(+1) +(-1) =0
(+3)×2
(-2)×3
(+6) +(-6) =0
(3)一些元素在不同的物质中可显示不同的化合价
CO
一氧化碳
CO2
二氧化碳
+2
+4
FeO
氧化亚铁
+2
Fe2O3
氧化铁
+3
Cu2O
氧化亚铜
CuO
氧化铜
+1
+2
(4)在同一物质中,同一元素也可显不同价态。
NH4NO3
-3
+5
(5)在单质分子里,元素的化合价为0。
NH4
(6)原子团的化合价等于化合物中各元素化合价的代数和.
+1
SO4
-2
OH
-1
在化合物里,正负化合价的代数和为零;
在单质里元素的化合价为零;
在原子团里,正负化合价的代数和为原子团化合价。
Na+ Mg2+ Al3+ F- O2-
Na Mg Al F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法不同:
离子:数字在前,“+”“—”号在后;写在元素符号右上角。
化合价:“+”“—”号在前;数字在后,写在元素符号正上方。
化合价与离子所带电荷有关:数字相同
比较并找规律
离子符号和化合价的比较:
化合价与离子符号表示意义的区别与联系
Mg
2+
整体:
“2”:
表示(一个)镁离子
表示每个镁离子带两个单位
的正电荷
MgO
+ 2
表示在氧化镁中镁元素的化合价为+2价
例题:已知O为-2价,求Fe2O3中铁元素的化合价.
解:设Fe2O3中铁元素的化合价为X
2X+(-2)× 3=0
练习:已知SO4为-2价,求FeSO4中铁元素的化合价.
(依据:化合物里正负化合价代数和为0)
可变价元素的化合价必须根据计算才能确定。
X=+3
三、化合价的应用
(1)根据化学式,确定元素或原子团的化合价
1.标出下列化合物或单质中氯元素的化合价
HCl Cl2 HClO KClO3 KClO4
元素在不同的化合物中元素的化合价不同
2.标出下列化合物中图上氮元素的化合价
NH3 N2
-1 0 +1 +5 +7
-3 0
练习:
例:求NH4NO3中带横线元素的化合价
设原子团NH4中氮元素的化合价为X
思路:
设原子团NO3中氮元素的化合价为Y
NH4
X +(+1)×4 = +1
X= -3
NO3
Y + (-2)×3 = -1
Y = +5
NH4NO3
-3
+5
在原子团里,正负化合价的代数和
为原子团化合价。
(2)根据化合价,写出化合物的化学式。
方法:“一排 二标 三叉 四约 五查”
排列元素
正价在前
负价在后
标出元素的化合价
交叉价数
检查代数和是否为零
依据:化合物中各元素的正负化合价代数和为零
化学式右下角的数字要为最简整数比
S
+4
O
-2
2
4
例.已知硫为+4价,氧为-2价,写出硫的这种
化合物的化学式
一排序 二标价 三交叉 四约简
S
O
2
4
例.已知硫为+4价,氧为-2价,写出硫的这种
化合物的化学式
2
二氧化硫
一排序 二标价 三交叉 四约简
例.已知铁为+3价,硫酸根为-2价,写出铁的
这种化合物的化学式
Fe
+3
SO4
2
3
-2
一排序 二标价 三交叉 四约简
例.已知铁为+3价,硫酸根为-2价,写出铁的
这种化合物的化学式
Fe
SO4
2
3
(
)
硫酸铁
一排序 二标价 三交叉 四约简
(3)根据元素的化合价判断所写的化学式是否正确
判断依据:化合物中各元素(或原子团)的正负
化合价代数和为零
步骤方法:标出化合价→验证正负化合价代数和是否为零→判断正误
练习2:
判断下列化学式是否正确,错则更正。
MgO2、NaO、Ba2O2、K(OH)2、
NaCO3、CaCl、 AgCl2
谈收获……本节课你的最大收获……你还有哪些疑惑?水由什么构成的?水有质量吗?水分子有质量吗?三、物质组成的定量表示问题探究??原子的质量很小,分子的质量也很小,原子可以用相对原子质量来表示它的质量,那么分子呢?如何理解化学式量1、是化学式中各原子的相对原子质量的总和2、是分子的相对质量3、它的单位也是11、化学式量 (相对分子质量)概念:化学式中各原子的相对原子质量的总和,就是相对分子质量O2的化学式量= 16×2=32(NH4)2CO3的化学式量=96H2O的化学式量=1×2 + 16=18例题1:计算O2、H2O、(NH4)2CO3的化学式量=(14+1×4)×2 + 12 + 16 ×3练习:已知化合物R2O3的相对分子质量(化学式量)是160,求R的相对原子质量。设R的相对原子质量为XX×2+16×3=160X=56解:答: R的相对原子质量为56例题2:计算硝酸铵中各元素的质量比m(N) : m(H) : m( O) = 14×2: 1×4: 16×3在NH4NO3中= 28 : 4 : 48= 7 : 1 : 12元素质量比=(相对原子质量×原子个数)之比例如:二氧化碳(CO2) 中碳元素质量︰氧元素质量= 12 ︰(16×2)= 3 ︰8解:2、计算物质组成元素的质量比3.燃烧爆竹产生一种污染物,其元素的质量比为1:1,该污染物是( )A. H2O B. CO C. SO2D. NO2C2.碳酸钠中各元素的质量比1.水中各元素的质量比m(Na) :m(C) : m(O)= 23×2 : 12 : 16×3= 46 : 12: 48= 23 : 6 : 24m(H) : m(O)=1×2 : 16=2 : 16=1 : 8解:在Na2CO3中解:在H2O中物质的化学式量该元素的相对原子质量×该元素的原子个数元素的质量分数3、计算物质中某一元素的质量分数=×100%注意事项:①质量分数——用百分数来表示②意义每100克物质中含有某元素的质量例题3:计算硝酸铵中氮元素的质量分数。解:在NH4NO3中N的质量分数=氮的相对原子质量×氮原子个数硝酸铵的化学式量×100%14×214×2 + 1×4 + 16×3×100%==2880×100%=35%答:硝酸铵中氮元素的质量分数为35%(意义:每100克硝酸铵中氮元素的质量为35克。)150千克的硝酸铵中有多少氮元素?解:在NH4NO3中=14×214×2 + 1×4 + 16×3×100%=2880×100%= 35%∴150千克的硝酸铵中含有的N元素的质量为150千克×35% = 52.5千克答:150千克的硝酸铵中有52.5千克氮元素。拓展应用:N的质量分数=Ar(N)×2Mr(NH4NO3)×100%在NH4NO3中=14×214×2 + 1×4 + 16×3×100%=2880×100%= 35%∴X × 35% = 100吨X=285.7吨答:285.7吨的硝酸铵中有100吨氮元素。应用:多少吨的硝酸铵中含有100吨的氮元素?解:设质量为X的硝酸铵中含有100吨的氮元素.N的质量分数=Ar(N)×2Mr(NH4NO3)×100%1、最近,科学家研究发现,某些食品中使用的苏丹红I号可能致癌。苏丹红I号的化学式为C10H12N2O,它的一个分子中共含有_____个原子,它是由____种元素组成的,其中氮、氧元素的质量比为________。练习:25四7︰42、油炸食品,烧烤食品等被营养专家称作“垃圾食品”,这是因为在制作过程中不仅产生大量有害气体污染环境,而且食物中还会产生一些强致癌物质,故此类食品不易多吃、常吃。如在食物煎炸过程中会产生一种有害物质-----丙烯醛,化学式为C2H3CHO。试回答:(1)丙烯醛的相对分子质量是____。(2)丙烯醛中氧元素的质量分数为________(结果保留一位小数)。5628.6%3、已知某氮氧元素组成的氧化物中,氮与氧的质量比是7:16,该化合物的化学式为。解:设化学式为NXOY,14X16Y=716XY=12∴该化合物的化学式是NO2NO24、相同质量的SO2和SO3中氧元素的质量比是( )A、2:3 B、3:2 C、5:6 D、6:5解析:设SO2和SO3的质量均为m,则:拓展:——化学式计算的应用C16×264×100%SO2中O的质量=m×80×100%16×3SO3中O的质量=m×所以,SO2和SO3中的O的质量比是5:6掌握求相对分子质量(化学式量)的方法2、了解化合物中各元素质量比的计算方法3、了解物质中某元素的质量分数的计算方法5、注意规范有关计算的书写格式1、了解相对分子质量(化学式量)的含义学完本课你应该4、会做一些逆运算计算题或比较综合的计算题作业
谢谢聆听
POWERPOINT
化 学
学习目标
1.了解化学式的涵义,知道化学式周围数字所示的含义。
2.能正确书写常见单质和化合物的化学式,掌握化学式的读法。
3.会根据化合价书写化学式以及会根据化学式判断化合价。
PART ONE
知识精讲
元素---用元素符号表示纯净物可以用什么来表示??NaCl
食盐
Cu
金属铜
H2O
水
一、化学式及其意义化学式定义:用元素符号和数字的组合表示纯净物组成的式子组成元素微粒个数比纯净物都有其固定的组成只有纯净物才能用化学式表示其组成
化学式的书写必须依据实验的结果
①任何物质都有化学式吗?
②同种物质可以有不同的化学式吗?
一种物质只能用一个化学式来表示
③化学式可以任意的书写吗?
2.化学式的意义:
表示水是由氢氧元素组成的
表示一个水分子是由两个氢原子和一个氧原子构成.
表示水这种物质
表示一个水分子
H2O
化学式的意义
宏观:1、表示一种物质;
2、表示组成物质的各种元素。
微观:1、表示这种物质的一个分子;
2、表示构成这种分子的原子个数。
CO2
表示物质二氧化碳
表示二氧化碳是由氧元素和碳元素组成的
表示一个二氧化碳分子
表示一个二氧化碳分子是由两个氧原子和一个 碳原子构成
3CO2
表示三个二氧化碳分子
① H
③ H2
④ 2H2
符号H、2H、H2、2H2各具有什么意义?
② 2H
表示氢元素或一个氢原子
表示2个氢原子
表示氢气这种物质;氢气是由氢元素组成;
一个氢分子;每个氢分子由2个氢原子构成。
表示两个氢分子
Ca2+表示钙离子;一个钙离子带2个单位的正电荷。2Ca2+表示2个钙离子;一个钙离子带2个单位的正电荷。注意:书写离子符号时“1”应该省略不写。真题训练BC甜蜜素[C6H12NSNa]是一种甜味添加剂。下列有关说法正确的是( )A、它是混合物B、它是化合物C、它由五种元素组成D、它的一个分子中含有20个原子真题训练B海洛因(C21H23NO5)和吗啡(C17H19NO3)都是毒品。下列关于它们的叙述错误的是( )A.海洛因和吗啡的组成元素相同,都是化合物B.吗啡中各元素的个数比为17:19:1:3C.1个海洛因分子和1个吗啡分子中,碳原子的个数比为21:17D.海洛因分子中质子数与电子数相等单质由原子构成由分子构成:金属单质:Cu Fe Hg Mg非金属固态单质:C Si稀有气体单质:He Ne Ar用元素符号及其右下角的数字表示直接用元素符号表示化学式单质化学式的写法与读法H2O2N2F2Cl2读元素符号的名称读“某气”二、化合价(第二课时)学习目标1、记忆常见元素的化合价2、能根据化合价写出常见物质的化学式3、能根据化学式推求某元素的化合价物质中各元素的原子间有一定的比值,这个比值与元素的化合价有关
原子个数比:
水 氨气 甲烷
H2O NH3 CH4
2:1 1:3 1:4
元素化合价实质上是指元素的一个原子在与其它原子化合时得、
失电子的数目或形成共用电子对的数目。
什么是化合价?
NaCl
+1
-1
化合价的数值和符号是由什么决定的?
Cl
Mg
Cl
2+
-
-
MgCl2
+2
-1
化合价的数值和符号是由什么决定的?
小结:化合价的数值由该元素的一个原子得失电子的数目决定的,得电子元素显负价,失电子元素显正价。
离子化合物中,失电子显____价,得电子显____价,化
合价数值就是___________ __ __ 的数值.
+13 2 8 3
如右图所示为铝原子结构示意图,则在化学反应中铝原子易 __电子,形成的离子带 __个单位_ _电荷,在化合物中铝元素的化合价为_ _
正
负
该原子得到或失去的电子
失
3
正
+3
Cl
H
-
HCl
+1
-1
共用电子对
氯化氢的形成过程
元素 元素符号 常见化合价 元素 元素符号 常见化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 氯 Cl -1、+1、+5、+7
钙 Ca +2 溴 Br -1、+1、+5、+7
镁 Mg +2 氧 O -2
钡 Ba +2 硫 S -2、+4、+6
铜 Cu +1、+2 碳 C +2、+4
铁 Fe +2、+3 硅 Si +4
铝 Al +3 氮 N -3、+2、+4、+5
锰 Mn +2、+4、+6、+7 磷 P -3、+3、+5
锌 Zn +2
原子团是在化合物中和在化学反应中常作为一个整体的原子集团,又叫根。
根的名称 根的符号 对应离子 常见化合价
硝酸根 NO3 NO3- -1
氢氧根 OH OH- -1
硫酸根 SO4 SO42- -2
碳酸根 CO3 CO32- -2
铵根 NH4 NH4+ +1
二、化合价的规律
(1)化合价有正价和负价。(化合物:前正后负)
①氧元素通常显-2价,氢元素通常显+1价
②金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价。
非金属元素和氧元素化合时,非金属元素显正价。
(2)在化合物里正负化合价的代数和为0。
NaCl Al2O3
+1 -1 +3 -2
(+1)×1
(-1)×1
(+1) +(-1) =0
(+3)×2
(-2)×3
(+6) +(-6) =0
(3)一些元素在不同的物质中可显示不同的化合价
CO
一氧化碳
CO2
二氧化碳
+2
+4
FeO
氧化亚铁
+2
Fe2O3
氧化铁
+3
Cu2O
氧化亚铜
CuO
氧化铜
+1
+2
(4)在同一物质中,同一元素也可显不同价态。
NH4NO3
-3
+5
(5)在单质分子里,元素的化合价为0。
NH4
(6)原子团的化合价等于化合物中各元素化合价的代数和.
+1
SO4
-2
OH
-1
在化合物里,正负化合价的代数和为零;
在单质里元素的化合价为零;
在原子团里,正负化合价的代数和为原子团化合价。
Na+ Mg2+ Al3+ F- O2-
Na Mg Al F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法不同:
离子:数字在前,“+”“—”号在后;写在元素符号右上角。
化合价:“+”“—”号在前;数字在后,写在元素符号正上方。
化合价与离子所带电荷有关:数字相同
比较并找规律
离子符号和化合价的比较:
化合价与离子符号表示意义的区别与联系
Mg
2+
整体:
“2”:
表示(一个)镁离子
表示每个镁离子带两个单位
的正电荷
MgO
+ 2
表示在氧化镁中镁元素的化合价为+2价
例题:已知O为-2价,求Fe2O3中铁元素的化合价.
解:设Fe2O3中铁元素的化合价为X
2X+(-2)× 3=0
练习:已知SO4为-2价,求FeSO4中铁元素的化合价.
(依据:化合物里正负化合价代数和为0)
可变价元素的化合价必须根据计算才能确定。
X=+3
三、化合价的应用
(1)根据化学式,确定元素或原子团的化合价
1.标出下列化合物或单质中氯元素的化合价
HCl Cl2 HClO KClO3 KClO4
元素在不同的化合物中元素的化合价不同
2.标出下列化合物中图上氮元素的化合价
NH3 N2
-1 0 +1 +5 +7
-3 0
练习:
例:求NH4NO3中带横线元素的化合价
设原子团NH4中氮元素的化合价为X
思路:
设原子团NO3中氮元素的化合价为Y
NH4
X +(+1)×4 = +1
X= -3
NO3
Y + (-2)×3 = -1
Y = +5
NH4NO3
-3
+5
在原子团里,正负化合价的代数和
为原子团化合价。
(2)根据化合价,写出化合物的化学式。
方法:“一排 二标 三叉 四约 五查”
排列元素
正价在前
负价在后
标出元素的化合价
交叉价数
检查代数和是否为零
依据:化合物中各元素的正负化合价代数和为零
化学式右下角的数字要为最简整数比
S
+4
O
-2
2
4
例.已知硫为+4价,氧为-2价,写出硫的这种
化合物的化学式
一排序 二标价 三交叉 四约简
S
O
2
4
例.已知硫为+4价,氧为-2价,写出硫的这种
化合物的化学式
2
二氧化硫
一排序 二标价 三交叉 四约简
例.已知铁为+3价,硫酸根为-2价,写出铁的
这种化合物的化学式
Fe
+3
SO4
2
3
-2
一排序 二标价 三交叉 四约简
例.已知铁为+3价,硫酸根为-2价,写出铁的
这种化合物的化学式
Fe
SO4
2
3
(
)
硫酸铁
一排序 二标价 三交叉 四约简
(3)根据元素的化合价判断所写的化学式是否正确
判断依据:化合物中各元素(或原子团)的正负
化合价代数和为零
步骤方法:标出化合价→验证正负化合价代数和是否为零→判断正误
练习2:
判断下列化学式是否正确,错则更正。
MgO2、NaO、Ba2O2、K(OH)2、
NaCO3、CaCl、 AgCl2
谈收获……本节课你的最大收获……你还有哪些疑惑?水由什么构成的?水有质量吗?水分子有质量吗?三、物质组成的定量表示问题探究??原子的质量很小,分子的质量也很小,原子可以用相对原子质量来表示它的质量,那么分子呢?如何理解化学式量1、是化学式中各原子的相对原子质量的总和2、是分子的相对质量3、它的单位也是11、化学式量 (相对分子质量)概念:化学式中各原子的相对原子质量的总和,就是相对分子质量O2的化学式量= 16×2=32(NH4)2CO3的化学式量=96H2O的化学式量=1×2 + 16=18例题1:计算O2、H2O、(NH4)2CO3的化学式量=(14+1×4)×2 + 12 + 16 ×3练习:已知化合物R2O3的相对分子质量(化学式量)是160,求R的相对原子质量。设R的相对原子质量为XX×2+16×3=160X=56解:答: R的相对原子质量为56例题2:计算硝酸铵中各元素的质量比m(N) : m(H) : m( O) = 14×2: 1×4: 16×3在NH4NO3中= 28 : 4 : 48= 7 : 1 : 12元素质量比=(相对原子质量×原子个数)之比例如:二氧化碳(CO2) 中碳元素质量︰氧元素质量= 12 ︰(16×2)= 3 ︰8解:2、计算物质组成元素的质量比3.燃烧爆竹产生一种污染物,其元素的质量比为1:1,该污染物是( )A. H2O B. CO C. SO2D. NO2C2.碳酸钠中各元素的质量比1.水中各元素的质量比m(Na) :m(C) : m(O)= 23×2 : 12 : 16×3= 46 : 12: 48= 23 : 6 : 24m(H) : m(O)=1×2 : 16=2 : 16=1 : 8解:在Na2CO3中解:在H2O中物质的化学式量该元素的相对原子质量×该元素的原子个数元素的质量分数3、计算物质中某一元素的质量分数=×100%注意事项:①质量分数——用百分数来表示②意义每100克物质中含有某元素的质量例题3:计算硝酸铵中氮元素的质量分数。解:在NH4NO3中N的质量分数=氮的相对原子质量×氮原子个数硝酸铵的化学式量×100%14×214×2 + 1×4 + 16×3×100%==2880×100%=35%答:硝酸铵中氮元素的质量分数为35%(意义:每100克硝酸铵中氮元素的质量为35克。)150千克的硝酸铵中有多少氮元素?解:在NH4NO3中=14×214×2 + 1×4 + 16×3×100%=2880×100%= 35%∴150千克的硝酸铵中含有的N元素的质量为150千克×35% = 52.5千克答:150千克的硝酸铵中有52.5千克氮元素。拓展应用:N的质量分数=Ar(N)×2Mr(NH4NO3)×100%在NH4NO3中=14×214×2 + 1×4 + 16×3×100%=2880×100%= 35%∴X × 35% = 100吨X=285.7吨答:285.7吨的硝酸铵中有100吨氮元素。应用:多少吨的硝酸铵中含有100吨的氮元素?解:设质量为X的硝酸铵中含有100吨的氮元素.N的质量分数=Ar(N)×2Mr(NH4NO3)×100%1、最近,科学家研究发现,某些食品中使用的苏丹红I号可能致癌。苏丹红I号的化学式为C10H12N2O,它的一个分子中共含有_____个原子,它是由____种元素组成的,其中氮、氧元素的质量比为________。练习:25四7︰42、油炸食品,烧烤食品等被营养专家称作“垃圾食品”,这是因为在制作过程中不仅产生大量有害气体污染环境,而且食物中还会产生一些强致癌物质,故此类食品不易多吃、常吃。如在食物煎炸过程中会产生一种有害物质-----丙烯醛,化学式为C2H3CHO。试回答:(1)丙烯醛的相对分子质量是____。(2)丙烯醛中氧元素的质量分数为________(结果保留一位小数)。5628.6%3、已知某氮氧元素组成的氧化物中,氮与氧的质量比是7:16,该化合物的化学式为。解:设化学式为NXOY,14X16Y=716XY=12∴该化合物的化学式是NO2NO24、相同质量的SO2和SO3中氧元素的质量比是( )A、2:3 B、3:2 C、5:6 D、6:5解析:设SO2和SO3的质量均为m,则:拓展:——化学式计算的应用C16×264×100%SO2中O的质量=m×80×100%16×3SO3中O的质量=m×所以,SO2和SO3中的O的质量比是5:6掌握求相对分子质量(化学式量)的方法2、了解化合物中各元素质量比的计算方法3、了解物质中某元素的质量分数的计算方法5、注意规范有关计算的书写格式1、了解相对分子质量(化学式量)的含义学完本课你应该4、会做一些逆运算计算题或比较综合的计算题作业
谢谢聆听
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
