专题3第1单元金属键金属晶体同步练习(含解析)2022——2023学年高中化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题3第1单元金属键金属晶体同步练习(含解析)2022——2023学年高中化学苏教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 902.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-15 09:11:20 | ||
图片预览



文档简介
专题3第1单元金属键 金属晶体同步练习
2022——2023学年下学期高二化学苏教版(2019)选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于金属键或金属的性质说法正确的是
①金属的导电性是由金属阳离子和自由电子的定向移动实现的
②金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
③、、的沸点依次升高
④金属键没有方向性和饱和性,金属中的电子在整个三维空间运动,属于整个金属
A.①② B.②③ C.③④ D.①④
2.金属材料具有良好的延展性的原因是
A.金属原子半径都较大,价电子数较少
B.金属受外力作用变形时,金属中各原子层会发生相对滑动
C.金属中大量自由电子受外力作用时,运动速率加快
D.自由电子受外力作用时能迅速传递能量
3.金属键的实质是
A.金属阳离子和自由电子之间的相互排斥
B.阴、阳离子之间的相互作用
C.金属阳离子和自由电子之间的相互吸引
D.金属阳离子和自由电子之间的相互作用
4.下图是金属晶体内部的电子气理论示意图。电子气理论可以用来解释金属的性质,其中正确的是
A.金属能导电是因为金属阳离子在外加电场作用下定向移动
B.金属能导热是因为自由电子在热的作用下相互碰撞,从而发生热的传导
C.金属具有延展性是因为在外力的作用下,金属中各原子层间会出现相对滑动,但自由电子可以起到润滑剂的作用,使金属不会断裂
D.合金与纯金属相比,由于增加了不同的金属或非金属,使电子数目增多,所以合金的延展性比纯金属强,硬度比纯金属小
5.有四种不同堆积方式的金属晶体的晶胞如图所示,下列叙述错误的是
A.晶体中原子的配位数分别为:①6,②8,③12,④12
B.③为六方堆积
C.晶胞中含有的原子数分别为:③2,④4
D.金属晶体是一种“巨分子”,可能存在分子间作用力
6.金属材料具有良好的延展性的原因是
A.金属原子半径都较大,价电子数较少
B.金属受外力作用变形时,金属中各原子层会发生相对滑动,但仍保持金属键作用
C.金属中大量自由电子受外力作用时,运动速率加快
D.自由电子受外力作用时能迅速传递能量
7.下列有关金属键的叙述错误的是
A.金属键没有饱和性和方向性
B.金属键中的自由电子属于整块金属
C.金属的性质和金属固体的形成都与金属键有关
D.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
8.对图中某金属晶体结构的模型进行分析,判断下列有关说法正确的是
A.该种堆积方式称为六方堆积 B.该种堆积方式称为体心立方堆积
C.该种堆积方式称为面心立方堆积 D.金属就属于此种堆积方式
9.金属晶体的堆积方式和配位数关系正确的是
A.简单立方堆积 B.体心立方堆积
C.六方堆积 D.面心立方堆积-12
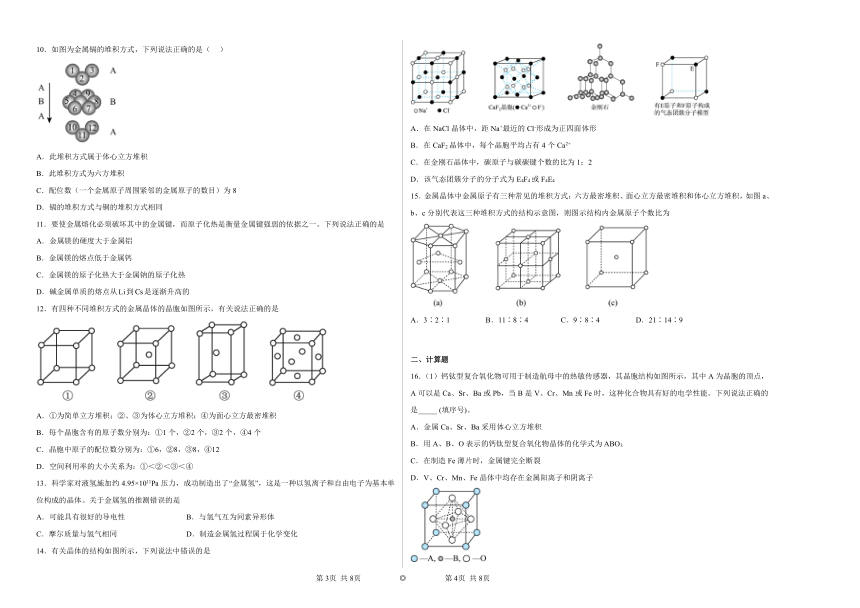
10.如图为金属镉的堆积方式,下列说法正确的是( )
A.此堆积方式属于体心立方堆积
B.此堆积方式为六方堆积
C.配位数(一个金属原子周围紧邻的金属原子的数目)为8
D.镉的堆积方式与铜的堆积方式相同
11.要使金属熔化必须破坏其中的金属键,而原子化热是衡量金属键强弱的依据之一。下列说法正确的是
A.金属镁的硬度大于金属铝
B.金属镁的熔点低于金属钙
C.金属镁的原子化热大于金属钠的原子化热
D.碱金属单质的熔点从到是逐渐升高的
12.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
A.①为简单立方堆积;②、③为体心立方堆积;④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③8,④12
D.空间利用率的大小关系为:①<②<③<④
13.科学家对液氢施加约4.95×1011Pa压力,成功制造出了“金属氢”,这是一种以氢离子和自由电子为基本单位构成的晶体。关于金属氢的推测错误的是
A.可能具有很好的导电性 B.与氢气互为同素异形体
C.摩尔质量与氢气相同 D.制造金属氢过程属于化学变化
14.有关晶体的结构如图所示,下列说法中错误的是
A.在NaCl晶体中,距Na+最近的Cl-形成为正四面体形
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D.该气态团簇分子的分子式为E4F4或F4E4
15.金属晶体中金属原子有三种常见的堆积方式:六方最密堆积、面心立方最密堆积和体心立方堆积,如图a、b、c分别代表这三种堆积方式的结构示意图,则图示结构内金属原子个数比为
A.3∶2∶1 B.11∶8∶4 C.9∶8∶4 D.21∶14∶9
二、计算题
16.(1)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有好的电学性能。下列说法正确的是_____ (填序号)。
A.金属Ca、Sr、Ba采用体心立方堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子
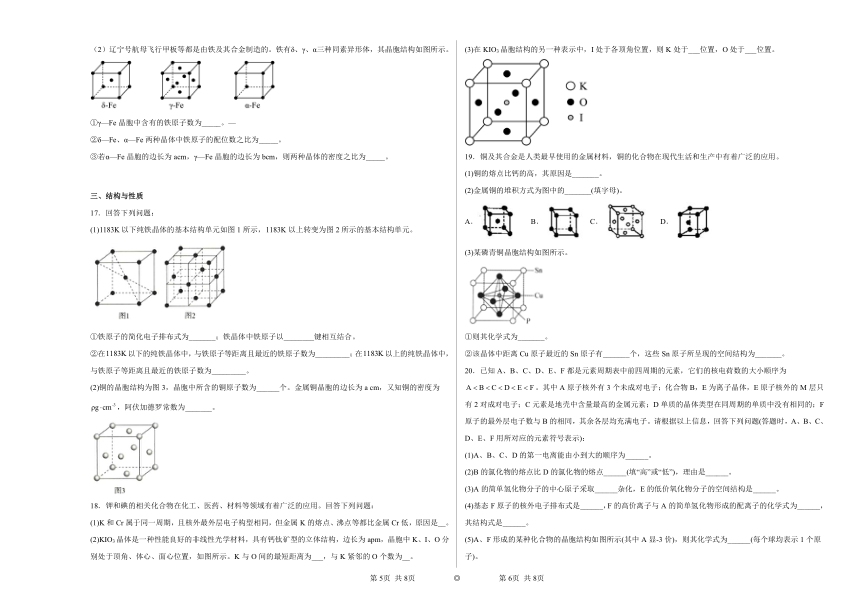
(2)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有δ、γ、α三种同素异形体,其晶胞结构如图所示。
①γ—Fe晶胞中含有的铁原子数为_____。—
②δ—Fe、α—Fe两种晶体中铁原子的配位数之比为_____。
③若α—Fe晶胞的边长为acm,γ—Fe晶胞的边长为bcm,则两种晶体的密度之比为_____。
三、结构与性质
17.回答下列问题:
(1)以下纯铁晶体的基本结构单元如图1所示,以上转变为图2所示的基本结构单元。
①铁原子的简化电子排布式为_______;铁晶体中铁原子以________键相互结合。
②在以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为_________;在以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为_________。
(2)铜的晶胞结构为图3,晶胞中所含的铜原子数为______个。金属铜晶胞的边长为a cm,又知铜的密度为,阿伏加德罗常数为_______。
18.钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是__。
(2)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为apm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为___,与K紧邻的O个数为__。
(3)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于___位置,O处于___位置。
19.铜及其合金是人类最早使用的金属材料,铜的化合物在现代生活和生产中有着广泛的应用。
(1)铜的熔点比钙的高,其原因是_______。
(2)金属铜的堆积方式为图中的_______(填字母)。
A. B. C. D.
(3)某磷青铜晶胞结构如图所示。
①则其化学式为_______。
②该晶体中距离Cu原子最近的Sn原子有_______个,这些Sn原子所呈现的空间结构为_______。
20.已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数的大小顺序为。其中A原子核外有3个未成对电子;化合物B,E为离子晶体,E原子核外的M层只有2对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子的最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为______。
(2)B的氯化物的熔点比D的氯化物的熔点______(填“高”或“低”),理由是______。
(3)A的简单氢化物分子的中心原子采取______杂化,E的低价氧化物分子的空间结构是______。
(4)基态F原子的核外电子排布式是______,F的高价离子与A的简单氢化物形成的配离子的化学式为______,其结构式是______。
(5)A、F形成的某种化合物的晶胞结构如图所示(其中A显-3价),则其化学式为______(每个球均表示1个原子)。
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为______,其晶体中所含的化学键类型为______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】①金属的导电性是在外加电场的作用下,自由电子发生定向移动实现的,而金属阳离子并没有移动,因此①错误;
②金属键是金属阳离子和自由电子之间存在的强烈的相互作用,并非仅存在静电吸引作用,因此②错误;
③一般情况下,金属阳离子所带电荷数越多,半径越小,金属键越强,金属单质的熔、沸点越高,硬度越大,、、三种离子的半径依次减小、离子所带电荷数依次增多,金属键越来越强,因此③正确;
④金属键没有方向性和饱和性,所有电子在三维空间运动,属于整个金属,因此④正确;
故选:C。
2.B
【详解】A.金属原子价电子数较少,容易失去电子,不能说明金属有延展性,A错误;
B.金属受外力作用时,金属原子层之间会发生相对滑动,但不会改变原来的排列方式,故金属有良好的延展性,B正确;
C.金属的延展性与原子层的相对滑动有关,与电子的运动无关,C错误;
D.自由电子传递能量与金属延展性无关,可以影响金属的导热性,D错误。
答案选B。
3.D
【详解】金属晶体中存在金属阳离子和自由电子之间的吸引作用,金属阳离子之间的排斥作用、自由电子之间的排斥作用,故选:D。
4.C
【详解】A.金属能导电是因为自由电子在外加电场作用下定向移动,故A错误;
B.金属能导热是因为自由电子在热的作用下与金属阳离子发生碰撞,从而发生热的传导,故B错误;
C.金属具有延展性是因为在外力的作用下,金属中各原子层间会出现相对滑动,而自由电子起到润滑剂的作用,使得金属不会断裂,故C正确;
D.合金与纯金属相比,由于增加了不同的金属或非金属,相当于填补了金属阳离子之间的空隙,所以一般情况下合金的延展性比纯金属弱,硬度比纯金属大,故D错误;
综上所述,答案为C。
5.D
【分析】由金属晶体的晶胞结构图可知,①为简单立方堆积,②为体心立方堆积,③为六方堆积,④为面心立方堆积。
【详解】A.根据晶胞结构可知,晶体中原子的配位数分别为:①6,②8,③12,④12,A项正确;
B.依据上述分析可知,③为六方堆积,B项正确;
C.晶胞中含有的原子数分别为:③为2,④为,C项正确;
D.金属晶体是一种“巨分子”,存在金属阳离子和自由电子之间的相互作用,不存在分子间作用力,D项错误。
答案选D。
6.B
【详解】A.金属原子价电子数较少,容易失去电子,不能说明金属有延展性,A错误;
B.金属受外力作用时,金属原子层之间会发生相对滑动,但不会改变原来的排列方式,故金属有良好的延展性,B正确;
C.金属的延展性与原子层的相对滑动有关,与电子的运动无关,C错误;
D.自由电子传递能量与金属延展性无关,可以影响金属的导热性,D错误。
答案选B。
7.D
【详解】A.金属键是金属阳离子和自由电子之间的强烈相互作用,自由电子为整个金属的所有阳离子所共有,所以金属键没有方向性和饱和性,故A正确;
B.自由电子在金属中自由运动,为整个金属的所有阳离子所共有,属于整块金属,故B正确;
C.金属的性质和金属固体的形成都与金属键有关,故C正确;
D. 金属键是金属阳离子和自由电子之间的强烈相互作用,既包括金属阳离子与自由电子之间的静电吸引作用,也包括金属阳离子之间及自由电子之间的静电排斥作用,故D错误;
故答案选D。
8.C
【详解】A.由题图知该堆积方式为面心立方堆积,A错误;
B.由题图知该堆积方式为面心立方堆积,B错误;
C.由题图知该堆积方式为面心立方堆积,C正确;
D.的堆积模型为六方堆积,D错误;
故选C。
9.D
【详解】A.简单立方堆积(如)配位数为6,A错误;
B.体心立方堆积,如钾、钠和铁,配位数为8,B错误;
C.六方堆积,如镁、锌、钛,配位数为12,C错误;
D.为面心立方堆积,配位数为12,D正确;
故选D。
10.B
【详解】A.据题图可看出,镉的堆积方式为六方堆积,A项错误;
B.据题图可看出,镉的堆积方式为六方堆积,B项正确;
C.一个金属原子周围紧邻的金属原子数目为12个,故配位数为12,C项错误;
D.铜的堆积方式为面心立方堆积,镉的堆积方式与铜的堆积方式不相同,D项错误;
答案选B。
11.C
【详解】A.镁离子比铝离子的半径大而所带的电荷数少,所以金属镁比金属铝的金属键弱,硬度小,A错误;
B.因镁离子的半径小而所带电荷数与钙离子相同,使金属镁比金属钙的金属键强,所以金属镁比金属钙的熔点高,B错误;
C.因镁离子的半径小而所带电荷数多,使金属镁比金属钠的金属键强,原子化热比钠大,C正确;
D.碱金属单质从到,其离子的半径是逐渐增大的,所带电荷数相同,金属键逐渐减弱,熔点逐渐降低,D错误;
故选C。
12.B
【详解】A.由金属晶体的晶胞结构图可知:①为简单立方堆积;②为体心立方堆积;③为六方最密堆积;④为面心立方最密堆积,A错误;
B.顶点为8个晶胞共用;面为2个晶胞共用;晶胞体内原子为1个晶胞单独占有。晶胞①中原子个数=8×=1;晶胞②中原子个数=1+8×=2;晶胞③中原子个数=1+8×=2,晶胞④中原子个数=8×+6×=4,B正确;
C.①为简单立方堆积,配位数为6;②为体心立方堆积,配位数为8;③为六方最密堆积,配位数为12;④为面心立方最密堆积,配位数为12,C错误;
D.六方最密堆积与面心立方最密堆积的空间利用率相等,简单立方堆积、体心立方堆积不是最密堆积,空间利用率比六方最密堆积和面心立方最密堆积的小;体心立方堆积空间利用率比简单立方堆积的高,故空间利用率的大小关系为:①<②<③=④,D错误;
故合理选项是B。
13.C
【详解】A.由题干信息可知,金属氢中含有氢离子和自由电子,类似于金属晶体,则可能具有很好的导电性,A正确;
B.金属氢与氢气是由氢元素形成的性质不同的两种单质,故互为同素异形体,B正确;
C.金属氢是一种以氢离子和自由电子为基本单元构成的晶体,是原子构成的单质,与氢气分子不同的单质,则摩尔质量不相同,C错误;
D.制造金属氢过程,单质结构发生变化,有旧化学键的断裂和新的化学键的形成,则属于化学变化,D正确;
故答案为:C。
14.A
【详解】A.据图可知距Na+最近的Cl-位于棱心和体心,共6个,形成正八面体,A错误;
B.Ca2+位于晶胞的顶点和面心,根据均摊法,个数为=4,B正确;
C.金刚石中每个C原子形成4个共价键,每个共价键被两个碳原子共用,所以每个碳原子具有2个共价键,即碳原子与碳碳键个数的比为1:2,C正确;
D.该物质由分子构成,据图可知每个分子含有4个F原子,4个E原子,所以分子式为E4F4或F4E4,D正确;
综上所述答案为A。
15.A
【详解】a中原子个数=12×+2×+3=6,b中原子个数=8×+6×=4,c中原子个数=1+8×=2,所以其原子个数比是6∶4∶2=3∶2∶1,故选A。
16. B 4 4:3
【分析】根据晶胞结构,用均摊法时行分析。
【详解】(1)A.由晶胞结构可知,A位于晶胞的8个顶点,故金属Ca、Sr、Ba采用的是简单立方堆积,A不正确;
B.由晶胞结构可知,晶胞中含有A的数目为,含有B的数目为,含有O的数目为,故用A、B、O表示的钙钛型复合氧化物晶体的化学式为ABO3,B正确;
C.金属键没有方向性,故金属在发生形变后,金属键仍存在。在制造Fe薄片时,金属键没有完全断裂,C不正确;
D.V、Cr、Mn、Fe晶体均为金属晶体,其中均存在金属阳离子和自由电子,无阴离子存在,D不正确。
综上所述,说法正确的是B。
(2)①γ—Fe晶胞中,Fe位于晶胞的8个顶点和6个面心,故其含有的铁原子数为。
②δ—Fe中,铁原子的配位数为8;α—Fe中,铁原子的配位数为6,故两种晶体中铁原子的配位数之比为8:6=4:3。
③若α—Fe晶胞的边长为acm,其晶胞中只含1个Fe原子,则晶体的密度为;若γ—Fe晶胞的边长为bcm,其晶胞中含4个Fe原子,则晶体的密度为 。故两种晶体的密度之比为。
【点睛】求晶体的密度时,先求出一个晶胞的体积,再求出一个晶胞的质量,最后代入密度的计算公式即可求得。
17.(1) [Ar] 3d64s2 金属 8 12
(2) 4
【详解】(1)①Fe是26号元素,根据构造原理可知基态Fe元素核外电子排布式是1s22s22p63s23p63d64s2,则其简化的电子排布式是[Ar] 3d64s2;
在Fe晶体中晶体中铁原子以金属键相互结合;
②在以下的纯铁晶体中,与体心铁原子等距离且最近的铁原子是8个顶点的铁原子;在以上的纯铁晶体中,与面心铁原子等距离且最近的铁原子有12个。
(2)铜晶胞为面心立方晶胞,1个晶胞平均有铜原子数目是8×+6×=4个;由于晶胞参数是a cm,则1个晶胞的体积为a3 cm3;由于晶胞密度是ρ g/cm3,则一个晶胞的质量m= a3ρg,根据晶体密度定义式可知: ,整理可得到。
18. K原子半径较大且价电子数较少,金属键较弱 pm 12 体心 棱心
【详解】(1)K和Cr属于同一周期,且核外最外层电子构型相同,但K的价电子排布为4s1,而Cr的价电子排布为3d54s1,则K的原子半径比Cr大,形成金属键比Cr弱,所以金属K的熔点、沸点等都比金属Cr低,原因是K原子半径较大且价电子数较少,金属键较弱。答案为:K原子半径较大且价电子数较少,金属键较弱。
(2)分析KIO3晶体的晶胞结构可知,K与O间的最短距离为pm,与K紧邻的O原子分别在各个面的面心,所以个数为。答案为:pm;12;
(3)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,因为K原子与I原子间的距离为pm,所以K处于体心位置;而O原子与I原子间的距离为pm,所以 O处于棱心位置。答案为:体心;棱心。
【点睛】在分析KIO3晶胞结构的另一种表示时,可先定位I原子,然后根据K、O原子与I原子间的距离,对原晶胞中的原子进行替换,从而得出另一种结构的晶胞图。
19. 铜的金属键强度大于钙 C 4 平面正方形
【详解】(1)铜的原子半径比钙小,金属键比钙强,因此铜的熔点比钙的高。答案为:铜的金属键强度大于钙;
(2)金属铜的晶胞为最密堆积,铜原子分布在顶点和面心上,故选C。答案为:C;
(3)①根据磷青铜晶胞结构知,晶体中P原子位于中心,含有一个磷原子,立方体每个面心含一个Cu,每个Cu分摊给一个晶胞的原子占,立方体顶角Sn分摊给每个晶胞的原子为,所以一个晶胞中含有Cu原子的数目为,含Sn原子的数为,含P原子的数目为1,化学式为。
②根据晶胞结构知,距离Cu原子最近的Sn原子有4个,这些原子呈平面正方形。答案为:;4;平面正方形。
20. 高 为离子晶体,而为分子晶体 角形 或 共价键
【分析】A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数的大小顺序为,A原子核外有3个未成对电子,则A是N;C元素是地壳中含量最高的金属元素,则C是;E原子核外的M层只有2对成对电子,则E是S;再结合题意分析可知,B是;在第3周期的单质晶体中,硅的晶体类型与其他均不相同,则D是;F原子的最外层电子数与B的相同,其余各层均充满电子,故F是。
【详解】(1)N、、、四种元素中,非金属性最强的是N,其他三种元素均位于第3周期,同一周期,第一电离能呈增大的趋势,则第一电离能由小到大的顺序是;
(2)是离子晶体,是分子晶体,前者的熔点高于后者;
(3)的中心原子的价电子对数,则N采取杂化;的中心原子的价电子对数,则其分子的空间结构为角形;
(4)的核外电子数是29,则其核外电子排布式是或;与形成的配离子的化学式是,其结构式是;
(5)原子半径,题给晶胞结构中,○表示N,●表示,该晶胞中的N原子数是,原子数是,则二者形成的化合物的化学式是;
(6) N、形成的化合物的化学式是,根据该化合物具有高沸点和高硬度的特点可知,晶体属于原子晶体,其晶体中的化学键是共价键。
答案第1页,共2页
答案第1页,共2页
2022——2023学年下学期高二化学苏教版(2019)选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于金属键或金属的性质说法正确的是
①金属的导电性是由金属阳离子和自由电子的定向移动实现的
②金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
③、、的沸点依次升高
④金属键没有方向性和饱和性,金属中的电子在整个三维空间运动,属于整个金属
A.①② B.②③ C.③④ D.①④
2.金属材料具有良好的延展性的原因是
A.金属原子半径都较大,价电子数较少
B.金属受外力作用变形时,金属中各原子层会发生相对滑动
C.金属中大量自由电子受外力作用时,运动速率加快
D.自由电子受外力作用时能迅速传递能量
3.金属键的实质是
A.金属阳离子和自由电子之间的相互排斥
B.阴、阳离子之间的相互作用
C.金属阳离子和自由电子之间的相互吸引
D.金属阳离子和自由电子之间的相互作用
4.下图是金属晶体内部的电子气理论示意图。电子气理论可以用来解释金属的性质,其中正确的是
A.金属能导电是因为金属阳离子在外加电场作用下定向移动
B.金属能导热是因为自由电子在热的作用下相互碰撞,从而发生热的传导
C.金属具有延展性是因为在外力的作用下,金属中各原子层间会出现相对滑动,但自由电子可以起到润滑剂的作用,使金属不会断裂
D.合金与纯金属相比,由于增加了不同的金属或非金属,使电子数目增多,所以合金的延展性比纯金属强,硬度比纯金属小
5.有四种不同堆积方式的金属晶体的晶胞如图所示,下列叙述错误的是
A.晶体中原子的配位数分别为:①6,②8,③12,④12
B.③为六方堆积
C.晶胞中含有的原子数分别为:③2,④4
D.金属晶体是一种“巨分子”,可能存在分子间作用力
6.金属材料具有良好的延展性的原因是
A.金属原子半径都较大,价电子数较少
B.金属受外力作用变形时,金属中各原子层会发生相对滑动,但仍保持金属键作用
C.金属中大量自由电子受外力作用时,运动速率加快
D.自由电子受外力作用时能迅速传递能量
7.下列有关金属键的叙述错误的是
A.金属键没有饱和性和方向性
B.金属键中的自由电子属于整块金属
C.金属的性质和金属固体的形成都与金属键有关
D.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
8.对图中某金属晶体结构的模型进行分析,判断下列有关说法正确的是
A.该种堆积方式称为六方堆积 B.该种堆积方式称为体心立方堆积
C.该种堆积方式称为面心立方堆积 D.金属就属于此种堆积方式
9.金属晶体的堆积方式和配位数关系正确的是
A.简单立方堆积 B.体心立方堆积
C.六方堆积 D.面心立方堆积-12
10.如图为金属镉的堆积方式,下列说法正确的是( )
A.此堆积方式属于体心立方堆积
B.此堆积方式为六方堆积
C.配位数(一个金属原子周围紧邻的金属原子的数目)为8
D.镉的堆积方式与铜的堆积方式相同
11.要使金属熔化必须破坏其中的金属键,而原子化热是衡量金属键强弱的依据之一。下列说法正确的是
A.金属镁的硬度大于金属铝
B.金属镁的熔点低于金属钙
C.金属镁的原子化热大于金属钠的原子化热
D.碱金属单质的熔点从到是逐渐升高的
12.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
A.①为简单立方堆积;②、③为体心立方堆积;④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③8,④12
D.空间利用率的大小关系为:①<②<③<④
13.科学家对液氢施加约4.95×1011Pa压力,成功制造出了“金属氢”,这是一种以氢离子和自由电子为基本单位构成的晶体。关于金属氢的推测错误的是
A.可能具有很好的导电性 B.与氢气互为同素异形体
C.摩尔质量与氢气相同 D.制造金属氢过程属于化学变化
14.有关晶体的结构如图所示,下列说法中错误的是
A.在NaCl晶体中,距Na+最近的Cl-形成为正四面体形
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D.该气态团簇分子的分子式为E4F4或F4E4
15.金属晶体中金属原子有三种常见的堆积方式:六方最密堆积、面心立方最密堆积和体心立方堆积,如图a、b、c分别代表这三种堆积方式的结构示意图,则图示结构内金属原子个数比为
A.3∶2∶1 B.11∶8∶4 C.9∶8∶4 D.21∶14∶9
二、计算题
16.(1)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有好的电学性能。下列说法正确的是_____ (填序号)。
A.金属Ca、Sr、Ba采用体心立方堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子
(2)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有δ、γ、α三种同素异形体,其晶胞结构如图所示。
①γ—Fe晶胞中含有的铁原子数为_____。—
②δ—Fe、α—Fe两种晶体中铁原子的配位数之比为_____。
③若α—Fe晶胞的边长为acm,γ—Fe晶胞的边长为bcm,则两种晶体的密度之比为_____。
三、结构与性质
17.回答下列问题:
(1)以下纯铁晶体的基本结构单元如图1所示,以上转变为图2所示的基本结构单元。
①铁原子的简化电子排布式为_______;铁晶体中铁原子以________键相互结合。
②在以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为_________;在以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为_________。
(2)铜的晶胞结构为图3,晶胞中所含的铜原子数为______个。金属铜晶胞的边长为a cm,又知铜的密度为,阿伏加德罗常数为_______。
18.钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是__。
(2)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为apm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为___,与K紧邻的O个数为__。
(3)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于___位置,O处于___位置。
19.铜及其合金是人类最早使用的金属材料,铜的化合物在现代生活和生产中有着广泛的应用。
(1)铜的熔点比钙的高,其原因是_______。
(2)金属铜的堆积方式为图中的_______(填字母)。
A. B. C. D.
(3)某磷青铜晶胞结构如图所示。
①则其化学式为_______。
②该晶体中距离Cu原子最近的Sn原子有_______个,这些Sn原子所呈现的空间结构为_______。
20.已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数的大小顺序为。其中A原子核外有3个未成对电子;化合物B,E为离子晶体,E原子核外的M层只有2对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子的最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为______。
(2)B的氯化物的熔点比D的氯化物的熔点______(填“高”或“低”),理由是______。
(3)A的简单氢化物分子的中心原子采取______杂化,E的低价氧化物分子的空间结构是______。
(4)基态F原子的核外电子排布式是______,F的高价离子与A的简单氢化物形成的配离子的化学式为______,其结构式是______。
(5)A、F形成的某种化合物的晶胞结构如图所示(其中A显-3价),则其化学式为______(每个球均表示1个原子)。
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为______,其晶体中所含的化学键类型为______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】①金属的导电性是在外加电场的作用下,自由电子发生定向移动实现的,而金属阳离子并没有移动,因此①错误;
②金属键是金属阳离子和自由电子之间存在的强烈的相互作用,并非仅存在静电吸引作用,因此②错误;
③一般情况下,金属阳离子所带电荷数越多,半径越小,金属键越强,金属单质的熔、沸点越高,硬度越大,、、三种离子的半径依次减小、离子所带电荷数依次增多,金属键越来越强,因此③正确;
④金属键没有方向性和饱和性,所有电子在三维空间运动,属于整个金属,因此④正确;
故选:C。
2.B
【详解】A.金属原子价电子数较少,容易失去电子,不能说明金属有延展性,A错误;
B.金属受外力作用时,金属原子层之间会发生相对滑动,但不会改变原来的排列方式,故金属有良好的延展性,B正确;
C.金属的延展性与原子层的相对滑动有关,与电子的运动无关,C错误;
D.自由电子传递能量与金属延展性无关,可以影响金属的导热性,D错误。
答案选B。
3.D
【详解】金属晶体中存在金属阳离子和自由电子之间的吸引作用,金属阳离子之间的排斥作用、自由电子之间的排斥作用,故选:D。
4.C
【详解】A.金属能导电是因为自由电子在外加电场作用下定向移动,故A错误;
B.金属能导热是因为自由电子在热的作用下与金属阳离子发生碰撞,从而发生热的传导,故B错误;
C.金属具有延展性是因为在外力的作用下,金属中各原子层间会出现相对滑动,而自由电子起到润滑剂的作用,使得金属不会断裂,故C正确;
D.合金与纯金属相比,由于增加了不同的金属或非金属,相当于填补了金属阳离子之间的空隙,所以一般情况下合金的延展性比纯金属弱,硬度比纯金属大,故D错误;
综上所述,答案为C。
5.D
【分析】由金属晶体的晶胞结构图可知,①为简单立方堆积,②为体心立方堆积,③为六方堆积,④为面心立方堆积。
【详解】A.根据晶胞结构可知,晶体中原子的配位数分别为:①6,②8,③12,④12,A项正确;
B.依据上述分析可知,③为六方堆积,B项正确;
C.晶胞中含有的原子数分别为:③为2,④为,C项正确;
D.金属晶体是一种“巨分子”,存在金属阳离子和自由电子之间的相互作用,不存在分子间作用力,D项错误。
答案选D。
6.B
【详解】A.金属原子价电子数较少,容易失去电子,不能说明金属有延展性,A错误;
B.金属受外力作用时,金属原子层之间会发生相对滑动,但不会改变原来的排列方式,故金属有良好的延展性,B正确;
C.金属的延展性与原子层的相对滑动有关,与电子的运动无关,C错误;
D.自由电子传递能量与金属延展性无关,可以影响金属的导热性,D错误。
答案选B。
7.D
【详解】A.金属键是金属阳离子和自由电子之间的强烈相互作用,自由电子为整个金属的所有阳离子所共有,所以金属键没有方向性和饱和性,故A正确;
B.自由电子在金属中自由运动,为整个金属的所有阳离子所共有,属于整块金属,故B正确;
C.金属的性质和金属固体的形成都与金属键有关,故C正确;
D. 金属键是金属阳离子和自由电子之间的强烈相互作用,既包括金属阳离子与自由电子之间的静电吸引作用,也包括金属阳离子之间及自由电子之间的静电排斥作用,故D错误;
故答案选D。
8.C
【详解】A.由题图知该堆积方式为面心立方堆积,A错误;
B.由题图知该堆积方式为面心立方堆积,B错误;
C.由题图知该堆积方式为面心立方堆积,C正确;
D.的堆积模型为六方堆积,D错误;
故选C。
9.D
【详解】A.简单立方堆积(如)配位数为6,A错误;
B.体心立方堆积,如钾、钠和铁,配位数为8,B错误;
C.六方堆积,如镁、锌、钛,配位数为12,C错误;
D.为面心立方堆积,配位数为12,D正确;
故选D。
10.B
【详解】A.据题图可看出,镉的堆积方式为六方堆积,A项错误;
B.据题图可看出,镉的堆积方式为六方堆积,B项正确;
C.一个金属原子周围紧邻的金属原子数目为12个,故配位数为12,C项错误;
D.铜的堆积方式为面心立方堆积,镉的堆积方式与铜的堆积方式不相同,D项错误;
答案选B。
11.C
【详解】A.镁离子比铝离子的半径大而所带的电荷数少,所以金属镁比金属铝的金属键弱,硬度小,A错误;
B.因镁离子的半径小而所带电荷数与钙离子相同,使金属镁比金属钙的金属键强,所以金属镁比金属钙的熔点高,B错误;
C.因镁离子的半径小而所带电荷数多,使金属镁比金属钠的金属键强,原子化热比钠大,C正确;
D.碱金属单质从到,其离子的半径是逐渐增大的,所带电荷数相同,金属键逐渐减弱,熔点逐渐降低,D错误;
故选C。
12.B
【详解】A.由金属晶体的晶胞结构图可知:①为简单立方堆积;②为体心立方堆积;③为六方最密堆积;④为面心立方最密堆积,A错误;
B.顶点为8个晶胞共用;面为2个晶胞共用;晶胞体内原子为1个晶胞单独占有。晶胞①中原子个数=8×=1;晶胞②中原子个数=1+8×=2;晶胞③中原子个数=1+8×=2,晶胞④中原子个数=8×+6×=4,B正确;
C.①为简单立方堆积,配位数为6;②为体心立方堆积,配位数为8;③为六方最密堆积,配位数为12;④为面心立方最密堆积,配位数为12,C错误;
D.六方最密堆积与面心立方最密堆积的空间利用率相等,简单立方堆积、体心立方堆积不是最密堆积,空间利用率比六方最密堆积和面心立方最密堆积的小;体心立方堆积空间利用率比简单立方堆积的高,故空间利用率的大小关系为:①<②<③=④,D错误;
故合理选项是B。
13.C
【详解】A.由题干信息可知,金属氢中含有氢离子和自由电子,类似于金属晶体,则可能具有很好的导电性,A正确;
B.金属氢与氢气是由氢元素形成的性质不同的两种单质,故互为同素异形体,B正确;
C.金属氢是一种以氢离子和自由电子为基本单元构成的晶体,是原子构成的单质,与氢气分子不同的单质,则摩尔质量不相同,C错误;
D.制造金属氢过程,单质结构发生变化,有旧化学键的断裂和新的化学键的形成,则属于化学变化,D正确;
故答案为:C。
14.A
【详解】A.据图可知距Na+最近的Cl-位于棱心和体心,共6个,形成正八面体,A错误;
B.Ca2+位于晶胞的顶点和面心,根据均摊法,个数为=4,B正确;
C.金刚石中每个C原子形成4个共价键,每个共价键被两个碳原子共用,所以每个碳原子具有2个共价键,即碳原子与碳碳键个数的比为1:2,C正确;
D.该物质由分子构成,据图可知每个分子含有4个F原子,4个E原子,所以分子式为E4F4或F4E4,D正确;
综上所述答案为A。
15.A
【详解】a中原子个数=12×+2×+3=6,b中原子个数=8×+6×=4,c中原子个数=1+8×=2,所以其原子个数比是6∶4∶2=3∶2∶1,故选A。
16. B 4 4:3
【分析】根据晶胞结构,用均摊法时行分析。
【详解】(1)A.由晶胞结构可知,A位于晶胞的8个顶点,故金属Ca、Sr、Ba采用的是简单立方堆积,A不正确;
B.由晶胞结构可知,晶胞中含有A的数目为,含有B的数目为,含有O的数目为,故用A、B、O表示的钙钛型复合氧化物晶体的化学式为ABO3,B正确;
C.金属键没有方向性,故金属在发生形变后,金属键仍存在。在制造Fe薄片时,金属键没有完全断裂,C不正确;
D.V、Cr、Mn、Fe晶体均为金属晶体,其中均存在金属阳离子和自由电子,无阴离子存在,D不正确。
综上所述,说法正确的是B。
(2)①γ—Fe晶胞中,Fe位于晶胞的8个顶点和6个面心,故其含有的铁原子数为。
②δ—Fe中,铁原子的配位数为8;α—Fe中,铁原子的配位数为6,故两种晶体中铁原子的配位数之比为8:6=4:3。
③若α—Fe晶胞的边长为acm,其晶胞中只含1个Fe原子,则晶体的密度为;若γ—Fe晶胞的边长为bcm,其晶胞中含4个Fe原子,则晶体的密度为 。故两种晶体的密度之比为。
【点睛】求晶体的密度时,先求出一个晶胞的体积,再求出一个晶胞的质量,最后代入密度的计算公式即可求得。
17.(1) [Ar] 3d64s2 金属 8 12
(2) 4
【详解】(1)①Fe是26号元素,根据构造原理可知基态Fe元素核外电子排布式是1s22s22p63s23p63d64s2,则其简化的电子排布式是[Ar] 3d64s2;
在Fe晶体中晶体中铁原子以金属键相互结合;
②在以下的纯铁晶体中,与体心铁原子等距离且最近的铁原子是8个顶点的铁原子;在以上的纯铁晶体中,与面心铁原子等距离且最近的铁原子有12个。
(2)铜晶胞为面心立方晶胞,1个晶胞平均有铜原子数目是8×+6×=4个;由于晶胞参数是a cm,则1个晶胞的体积为a3 cm3;由于晶胞密度是ρ g/cm3,则一个晶胞的质量m= a3ρg,根据晶体密度定义式可知: ,整理可得到。
18. K原子半径较大且价电子数较少,金属键较弱 pm 12 体心 棱心
【详解】(1)K和Cr属于同一周期,且核外最外层电子构型相同,但K的价电子排布为4s1,而Cr的价电子排布为3d54s1,则K的原子半径比Cr大,形成金属键比Cr弱,所以金属K的熔点、沸点等都比金属Cr低,原因是K原子半径较大且价电子数较少,金属键较弱。答案为:K原子半径较大且价电子数较少,金属键较弱。
(2)分析KIO3晶体的晶胞结构可知,K与O间的最短距离为pm,与K紧邻的O原子分别在各个面的面心,所以个数为。答案为:pm;12;
(3)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,因为K原子与I原子间的距离为pm,所以K处于体心位置;而O原子与I原子间的距离为pm,所以 O处于棱心位置。答案为:体心;棱心。
【点睛】在分析KIO3晶胞结构的另一种表示时,可先定位I原子,然后根据K、O原子与I原子间的距离,对原晶胞中的原子进行替换,从而得出另一种结构的晶胞图。
19. 铜的金属键强度大于钙 C 4 平面正方形
【详解】(1)铜的原子半径比钙小,金属键比钙强,因此铜的熔点比钙的高。答案为:铜的金属键强度大于钙;
(2)金属铜的晶胞为最密堆积,铜原子分布在顶点和面心上,故选C。答案为:C;
(3)①根据磷青铜晶胞结构知,晶体中P原子位于中心,含有一个磷原子,立方体每个面心含一个Cu,每个Cu分摊给一个晶胞的原子占,立方体顶角Sn分摊给每个晶胞的原子为,所以一个晶胞中含有Cu原子的数目为,含Sn原子的数为,含P原子的数目为1,化学式为。
②根据晶胞结构知,距离Cu原子最近的Sn原子有4个,这些原子呈平面正方形。答案为:;4;平面正方形。
20. 高 为离子晶体,而为分子晶体 角形 或 共价键
【分析】A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数的大小顺序为,A原子核外有3个未成对电子,则A是N;C元素是地壳中含量最高的金属元素,则C是;E原子核外的M层只有2对成对电子,则E是S;再结合题意分析可知,B是;在第3周期的单质晶体中,硅的晶体类型与其他均不相同,则D是;F原子的最外层电子数与B的相同,其余各层均充满电子,故F是。
【详解】(1)N、、、四种元素中,非金属性最强的是N,其他三种元素均位于第3周期,同一周期,第一电离能呈增大的趋势,则第一电离能由小到大的顺序是;
(2)是离子晶体,是分子晶体,前者的熔点高于后者;
(3)的中心原子的价电子对数,则N采取杂化;的中心原子的价电子对数,则其分子的空间结构为角形;
(4)的核外电子数是29,则其核外电子排布式是或;与形成的配离子的化学式是,其结构式是;
(5)原子半径,题给晶胞结构中,○表示N,●表示,该晶胞中的N原子数是,原子数是,则二者形成的化合物的化学式是;
(6) N、形成的化合物的化学式是,根据该化合物具有高沸点和高硬度的特点可知,晶体属于原子晶体,其晶体中的化学键是共价键。
答案第1页,共2页
答案第1页,共2页
