4.2.电解池 第一课时课件(共24张PPT)2022-2023学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2.电解池 第一课时课件(共24张PPT)2022-2023学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-15 09:22:59 | ||
图片预览






文档简介
(共24张PPT)
电解池基本原理
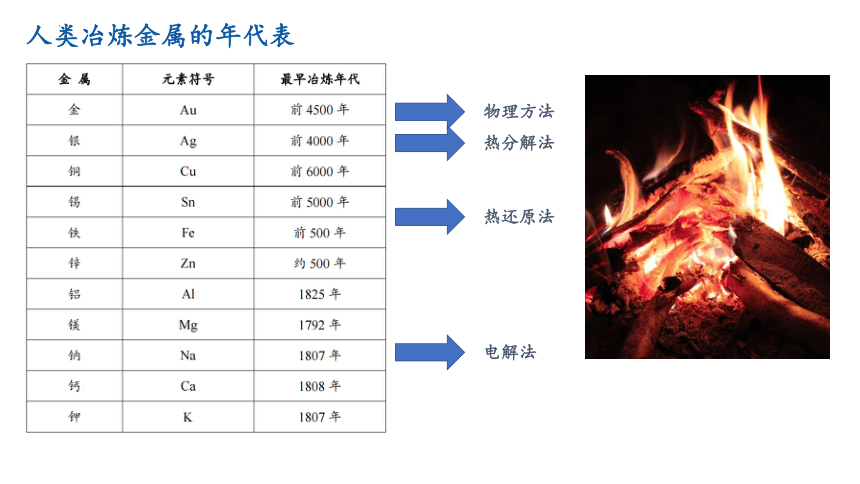
人类冶炼金属的年代表
物理方法
热分解法
热还原法
电解法
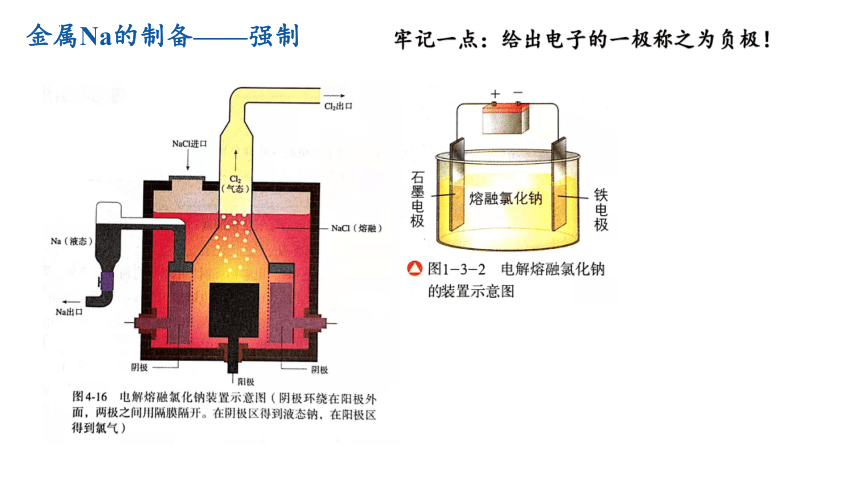
金属Na的制备——强制
牢记一点:给出电子的一极称之为负极!
有关电解
金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年电解氯化钠制钠的工业方法实现了。由于金属钠在现代技术上得到重要应用,它的产量显著地增加。目前,世界上钠的工业生产多数是用电解氯化钠的方法,少数仍沿用电解氢氧化钠的方法。
电解是将电能转化为化学能的一种重要方法。
电解 VS 原电池
自发
强制
使不愿意得失电子的离子得失电子——强制(强制需要一定的能力)
如果本身就容易得失电子呢?还可以强制吗?
【思考】电离和电解有何区别?
电离无需通电而电解需要,电解质先电离后电解
①电流应是直流电
②电解质溶液的导电过程,就是电解质溶液的电解过程。
③电解是最强的氧化还原反应手段。
一、电解
使电流通过电解质溶液(或熔融电解质)而在阴、阳两极引起氧化还原
反应的过程叫做电解
注意:
二、电解池(电解槽)
1、定义:借助于外界电流引起________________的装置,也就是把
转变为 的装置,叫做电解池或电解槽。
氧化还原反应
电能
化学能
2、构成电解池(电解槽)的条件
(1)直流电源
阴极:与电源负极相连
阳极:与电源正极相连
(2)阴、阳电极
(3)电解质溶液或熔融的电解质
(4)形成闭合回路
(5)强制氧化还原反应
两极一液一电源一回路一反应
两极可相同也可不同
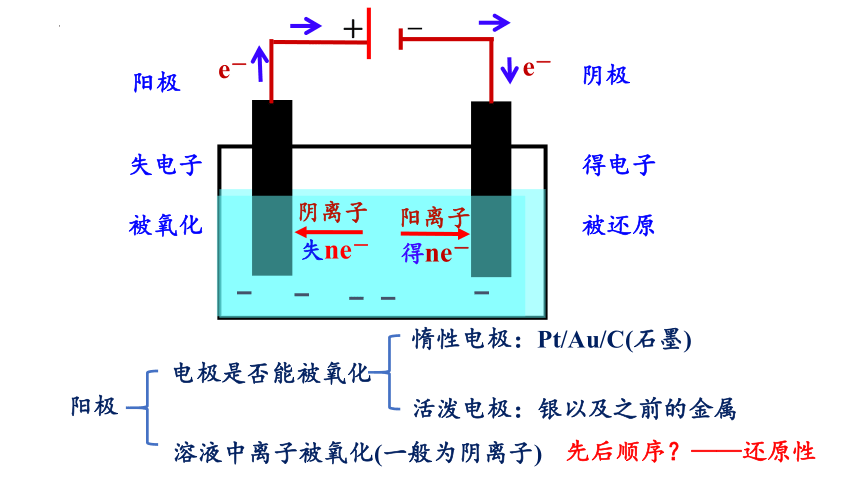
e-
阴离子
得ne-
–
+
阳离子
e-
失ne-
阳极
失电子
被氧化
阴极
得电子
被还原
阳极
电极是否能被氧化
溶液中离子被氧化(一般为阴离子)
惰性电极:Pt/Au/C(石墨)
活泼电极:银以及之前的金属
先后顺序?——还原性
三、离子放电顺序:
阴离子失去电子,阳离子得到电子的过程叫放电
①活性材料作电极:电极放电
②惰性电极(Pt、Au、石墨) :溶液中阴离子的放电
阳极:看电极材料是否参与反应
笔记
顺序是:
M > S2->I ->Br ->Cl ->OH ->最高价含氧酸根(SO42-、NO3 -)>F-
水溶液中
e-
阴离子
得ne-
–
+
阳离子
e-
失ne-
阳极
失电子
被氧化
阴极
得电子
被还原
阴极
电极被还原(一般不被还原)
溶液中离子被还原(一般为阳离子)
先后顺序?—氧化性比较
阳离子在阴极上放电顺序是:
Ag+>Hg2+>Fe3+>Cu2+>H(酸)+>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>
Al3+>Mg2+>Na+>Ca2+>K+
活性电极、惰性电极都不参与电极反应
阴极:
注:当离子浓度相差不大时,放电顺序按H+(酸),
当Pb2+、Sn2+、Fe2+、Zn2+浓度(电解质)远大于H+ 时,按H+(水)
只在熔融状态放电
笔记
发生氧化反应
阴离子移向
电源正极
(阳极)
电源、电极、电极反应关系
电源负极
(阴极)
发生还原反应
阳离子移向
离子放电:
离子失电子或者得电子的过程。
1、下列有关电解的说法正确的是( )
①电解是把电能转变成化学能
②电解是把化学能转变成电能
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理可以实现
⑤任何溶液被电解时,必将导致氧化还原反应的发生
A.①②③④ B.②③⑤
C.③④ D.①③④⑤
D
C
C
CuCl2溶液
问题:如果把两根石墨棒作电极插入CuCl2溶液中,外接直流电源,会发生怎样的现象呢?
向氯化铜溶液中通入直流电
思考1:氯化铜溶液中含有哪些微粒
阳离子:Cu2+ 、H+ 阴离子:Cl- 、OH-
Cu2+ 、H+向阴极区移动; Cl- 、OH-向阳极区移动
Cl-→Cl2↑ OH-→O2↑
H2O H+ + OH-
CuCl2= Cu2++2Cl-
阴极区:
Cu2+→Cu H+→H2↑
阳极区:
思考3:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
思考2:在通电时这些微粒各向什么区移动?
微观探索
有气泡,刺激性气味,并能使湿润的 KI—淀粉试纸变蓝
碳棒上有一层红色物质析出
阳极
阴极
氯
气
铜
阳极:
阴极:
宏观现象
CuCl2水溶液
Cu2+ + 2e- = Cu
2Cl- - 2e- = Cl2↑
四、电极方程式的书写
看电极材料(活泼金属作阳极失电子)
判断放电顺序
分析溶液中的阴阳离子
先确定电解池的阴阳极
书写电极方程式(阳失氧、阴得还)
3、电解后溶液的复原规律
(1)电解H2O型
电解质 H2SO4 NaOH Na2SO4
阳极反应式
阴极反应式
浓度
pH变化
复原加入物质 减小
增大
不变
加入H2O
4H++4e-=2H2↑
4OH--4e-=O2↑+2H2O
2H2O–4e-=4H++O2↑
2H2O +2e-=H2↑+2OH-
2H2O–4e-=4H++O2↑
2H2O +2e-=H2↑+2OH-
2H2O 2H2 ↑ + O2 ↑
电解
增大
增大
增大
(2)电解电解质型
电解质 HCl CuCl2
阳极反应式 阴极反应式
pH变化
复原加入物质
2Cl--2e-= Cl2↑
2H++2e- = H2↑
Cu2++2e- = Cu
增大
加入HCl
加入CuCl2
(3)电解质和水都发生电解型
电解质 NaCl CuSO4
阳极反应式
阴极反应式
pH变化
复原加入物质
2Cl--2e-===Cl2↑
2H2O-4e-===O2↑+4H+
2H2O+2e-==H2↑+2OH-
2Cu2++4e-===2Cu
增大
减小
加入HCl
加入CuO或CuCO3
放氢生碱
放氧生酸
电解后溶液的复原,遵循“少什么加什么,少多少加多少”的原则
特别提醒
电解池 原电池
原理
构成
电极反应
反应类型
电解池与原电池的比较
电能转化为化学能
化学能转化为电能
阴极、阳极、电解质、直流电源
正极、负极、电解质、盐桥
阳极发生氧化反应
阴极发生还原反应
负极发生氧化反应
正极发生还原反应
强制氧化还原反应
自发的氧化还原反应
1、关于下图所示①②两个装置的叙述正确的是( )
A.装置名称:①是原电池,②是电解池
B.硫酸浓度变化:①增大,②减小
C.电极反应式:①中阳极:4OH--4e-===2H2O+O2↑,
②中正极:Zn-2e-===Zn2+
D.离子移动方向:①中H+向阴极方向移动,
②中H+向负极方向移动
B
2、某同学按如图所示的装置进行电解实验,下列说法不正确的是( ) A.电解过程中,铜电极上有 H2 产生
B.电解初期,总反应方程式为 Cu+H2SO4===CuSO4+H2↑
C.电解一段时间后,石墨电极上有铜析出
D.电解过程中,H+的浓度减小
电解
A
3、按下图装置进行实验,并回答下列问题。
(1)判断装置的名称:
A 池为_________
B 池为_________
(2)铜极为________极,
电极反应式为__________________
(3)B 装置中,C1 不 C2 均为石墨棒,
石墨棒 C1 为________极,电极反应式为___________________,
石墨棒 C2 附近发生的实验现象为_________________________________________________。
原电池
电解池
正
Cu2++2e-==Cu
阳
2Cl--2e-= Cl2↑
有无色气体产生,附近溶液出现红色
电解池基本原理
人类冶炼金属的年代表
物理方法
热分解法
热还原法
电解法
金属Na的制备——强制
牢记一点:给出电子的一极称之为负极!
有关电解
金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年电解氯化钠制钠的工业方法实现了。由于金属钠在现代技术上得到重要应用,它的产量显著地增加。目前,世界上钠的工业生产多数是用电解氯化钠的方法,少数仍沿用电解氢氧化钠的方法。
电解是将电能转化为化学能的一种重要方法。
电解 VS 原电池
自发
强制
使不愿意得失电子的离子得失电子——强制(强制需要一定的能力)
如果本身就容易得失电子呢?还可以强制吗?
【思考】电离和电解有何区别?
电离无需通电而电解需要,电解质先电离后电解
①电流应是直流电
②电解质溶液的导电过程,就是电解质溶液的电解过程。
③电解是最强的氧化还原反应手段。
一、电解
使电流通过电解质溶液(或熔融电解质)而在阴、阳两极引起氧化还原
反应的过程叫做电解
注意:
二、电解池(电解槽)
1、定义:借助于外界电流引起________________的装置,也就是把
转变为 的装置,叫做电解池或电解槽。
氧化还原反应
电能
化学能
2、构成电解池(电解槽)的条件
(1)直流电源
阴极:与电源负极相连
阳极:与电源正极相连
(2)阴、阳电极
(3)电解质溶液或熔融的电解质
(4)形成闭合回路
(5)强制氧化还原反应
两极一液一电源一回路一反应
两极可相同也可不同
e-
阴离子
得ne-
–
+
阳离子
e-
失ne-
阳极
失电子
被氧化
阴极
得电子
被还原
阳极
电极是否能被氧化
溶液中离子被氧化(一般为阴离子)
惰性电极:Pt/Au/C(石墨)
活泼电极:银以及之前的金属
先后顺序?——还原性
三、离子放电顺序:
阴离子失去电子,阳离子得到电子的过程叫放电
①活性材料作电极:电极放电
②惰性电极(Pt、Au、石墨) :溶液中阴离子的放电
阳极:看电极材料是否参与反应
笔记
顺序是:
M > S2->I ->Br ->Cl ->OH ->最高价含氧酸根(SO42-、NO3 -)>F-
水溶液中
e-
阴离子
得ne-
–
+
阳离子
e-
失ne-
阳极
失电子
被氧化
阴极
得电子
被还原
阴极
电极被还原(一般不被还原)
溶液中离子被还原(一般为阳离子)
先后顺序?—氧化性比较
阳离子在阴极上放电顺序是:
Ag+>Hg2+>Fe3+>Cu2+>H(酸)+>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>
Al3+>Mg2+>Na+>Ca2+>K+
活性电极、惰性电极都不参与电极反应
阴极:
注:当离子浓度相差不大时,放电顺序按H+(酸),
当Pb2+、Sn2+、Fe2+、Zn2+浓度(电解质)远大于H+ 时,按H+(水)
只在熔融状态放电
笔记
发生氧化反应
阴离子移向
电源正极
(阳极)
电源、电极、电极反应关系
电源负极
(阴极)
发生还原反应
阳离子移向
离子放电:
离子失电子或者得电子的过程。
1、下列有关电解的说法正确的是( )
①电解是把电能转变成化学能
②电解是把化学能转变成电能
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理可以实现
⑤任何溶液被电解时,必将导致氧化还原反应的发生
A.①②③④ B.②③⑤
C.③④ D.①③④⑤
D
C
C
CuCl2溶液
问题:如果把两根石墨棒作电极插入CuCl2溶液中,外接直流电源,会发生怎样的现象呢?
向氯化铜溶液中通入直流电
思考1:氯化铜溶液中含有哪些微粒
阳离子:Cu2+ 、H+ 阴离子:Cl- 、OH-
Cu2+ 、H+向阴极区移动; Cl- 、OH-向阳极区移动
Cl-→Cl2↑ OH-→O2↑
H2O H+ + OH-
CuCl2= Cu2++2Cl-
阴极区:
Cu2+→Cu H+→H2↑
阳极区:
思考3:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
思考2:在通电时这些微粒各向什么区移动?
微观探索
有气泡,刺激性气味,并能使湿润的 KI—淀粉试纸变蓝
碳棒上有一层红色物质析出
阳极
阴极
氯
气
铜
阳极:
阴极:
宏观现象
CuCl2水溶液
Cu2+ + 2e- = Cu
2Cl- - 2e- = Cl2↑
四、电极方程式的书写
看电极材料(活泼金属作阳极失电子)
判断放电顺序
分析溶液中的阴阳离子
先确定电解池的阴阳极
书写电极方程式(阳失氧、阴得还)
3、电解后溶液的复原规律
(1)电解H2O型
电解质 H2SO4 NaOH Na2SO4
阳极反应式
阴极反应式
浓度
pH变化
复原加入物质 减小
增大
不变
加入H2O
4H++4e-=2H2↑
4OH--4e-=O2↑+2H2O
2H2O–4e-=4H++O2↑
2H2O +2e-=H2↑+2OH-
2H2O–4e-=4H++O2↑
2H2O +2e-=H2↑+2OH-
2H2O 2H2 ↑ + O2 ↑
电解
增大
增大
增大
(2)电解电解质型
电解质 HCl CuCl2
阳极反应式 阴极反应式
pH变化
复原加入物质
2Cl--2e-= Cl2↑
2H++2e- = H2↑
Cu2++2e- = Cu
增大
加入HCl
加入CuCl2
(3)电解质和水都发生电解型
电解质 NaCl CuSO4
阳极反应式
阴极反应式
pH变化
复原加入物质
2Cl--2e-===Cl2↑
2H2O-4e-===O2↑+4H+
2H2O+2e-==H2↑+2OH-
2Cu2++4e-===2Cu
增大
减小
加入HCl
加入CuO或CuCO3
放氢生碱
放氧生酸
电解后溶液的复原,遵循“少什么加什么,少多少加多少”的原则
特别提醒
电解池 原电池
原理
构成
电极反应
反应类型
电解池与原电池的比较
电能转化为化学能
化学能转化为电能
阴极、阳极、电解质、直流电源
正极、负极、电解质、盐桥
阳极发生氧化反应
阴极发生还原反应
负极发生氧化反应
正极发生还原反应
强制氧化还原反应
自发的氧化还原反应
1、关于下图所示①②两个装置的叙述正确的是( )
A.装置名称:①是原电池,②是电解池
B.硫酸浓度变化:①增大,②减小
C.电极反应式:①中阳极:4OH--4e-===2H2O+O2↑,
②中正极:Zn-2e-===Zn2+
D.离子移动方向:①中H+向阴极方向移动,
②中H+向负极方向移动
B
2、某同学按如图所示的装置进行电解实验,下列说法不正确的是( ) A.电解过程中,铜电极上有 H2 产生
B.电解初期,总反应方程式为 Cu+H2SO4===CuSO4+H2↑
C.电解一段时间后,石墨电极上有铜析出
D.电解过程中,H+的浓度减小
电解
A
3、按下图装置进行实验,并回答下列问题。
(1)判断装置的名称:
A 池为_________
B 池为_________
(2)铜极为________极,
电极反应式为__________________
(3)B 装置中,C1 不 C2 均为石墨棒,
石墨棒 C1 为________极,电极反应式为___________________,
石墨棒 C2 附近发生的实验现象为_________________________________________________。
原电池
电解池
正
Cu2++2e-==Cu
阳
2Cl--2e-= Cl2↑
有无色气体产生,附近溶液出现红色
