有机化合物的结构与性质_课件
图片预览










文档简介
课件48张PPT。第2节 有机化合物的结构与性质 1.通过前面的学习,我们知道德国化学家维勒打破了无机物和有机物的界限,他以无机物为原料合成出了尿素,使人们彻底摈弃了“生命力论”。此后许多化学家又以无机物为原料合成出了醋酸、苹果酸、甲烷、乙炔等有机物,这就使人们开始了对有机物组成的研究。
2.在人类衣食住行所需的物品中,有许多来源于天然有机物,如糖类、油脂、蛋白质、石油、天然气、天然橡胶等等。由于生产、生活的需要,人们学会了合成、分离、提纯有机物,而有机物的结构决定了它的化学性质,因此,研究有机物的结构是有机化学的重点。1.由于碳原子的最外层有四个电子,通常碳碳之间以共同电子对形成共价键,共价键可根据________分为单键、双键、叁键。
(1)单键:两个原子间共用________的共价键。
(2)双键:两个原子间共用________的共价键。
(3)饱和碳原子是碳原子与四个原子形成__________,而与其他原子成键数目少于__的碳原子,称为不饱和碳原子。
2.极性键和非极性键
(1)非极性键:成键的两原子相同,吸引共用电子对的________相同,共用电子对________任何一方的共价键叫做非极性键。不偏向成键方式1对电子2对电子4个共价键4能力(2)极性键:成键双方是________元素的原子,吸引电子能力不同,共用电子对偏向电负性________的一方,即吸引电子能力________的原子,这样的共价键叫极性键。
3.(1)同分异构现象:________的现象。
(2)同分异构体:________相同________不同的有机物之间互称同分异构体。
4.同分异构的异构方式(中学阶段)______、________、________。如1-丁烯,2-丁烯互为________异构;2-戊烯,环戊烷是由于前者为链状,后者为环状,互为________异构。(2)不同 大 强
3.(1)化合物具有相同的化学式,但具有不同的结构 (2)分子组成 结构
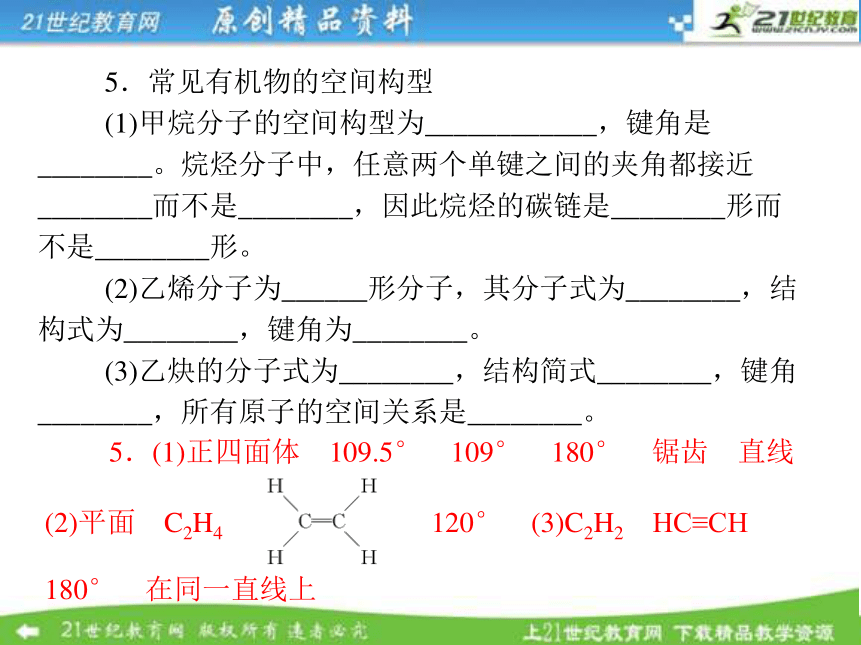
4.碳链异构 官能团位置异构 官能团类别异构 官能团位置 官能团类别5.常见有机物的空间构型
(1)甲烷分子的空间构型为____________,键角是________。烷烃分子中,任意两个单键之间的夹角都接近________而不是________,因此烷烃的碳链是________形而不是________形。
(2)乙烯分子为______形分子,其分子式为________,结构式为________,键角为________。
(3)乙炔的分子式为________,结构简式________,键角________,所有原子的空间关系是________。 5.(1)正四面体 109.5° 109° 180° 锯齿 直线
(2)平面 C2H4 120° (3)C2H2 HC≡CH
180° 在同一直线上(4)除了碳原子间能形成双键或叁键外,碳原子还能与氧、硫、氮等原子形成双键,能与氮原子形成叁键。而且,若一个碳原子周围是一个双键和两个单键,其双键和单键的夹角总是接近________;若是一个叁键和一个单键,则其夹角总是接近________。
6.官能团决定着一类有机物的化学特性,因为一方面,一些官能团含有________,易发生相关的化学反应。另一方面,一些官能团含有________。如________,由于碳原子的不饱和性,使得烯烃、炔烃的化学性质比烷烃________,如烯烃能使酸性高锰酸钾溶液________。(4)120° 180°
6.特性原子或原子团 活泼、易发生反应的价键 不饱和烃 活泼 褪色 1.有机物种类繁多的原因
(1)碳元素位于周期表中第2周期第ⅣA族,碳原子最外层有4个价电子,能与其他原子形成4个共价键。碳原子间可以形
成单键( )、双键( )、叁键(—C≡C—),
碳原子还可以形成碳氢单键、碳氧单键、碳氧双键,以及更加复杂的化学键形式。
(2)碳原子间可以单键结合成链状,碳链长度可以不同,也可以形成环状。
(3)普遍存在同分异构现象。碳原子的成键方式 2.单键、双键、叁键比较3.有机物空间结构比较 说明:(1)组成 和— C≡C—的碳原子称为不饱和碳原子。
(2) 和— C≡C—在一定条件下易断其中一个或两个C—C键生成新的化合物。
4.几种有机化合物的球棍模型及所能发生的主要反应 甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,下列可作为其理由的是( )?
A.CH3Cl不存在同分异构体
B.CH2Cl2不存在同分异构体?
C.CHCl3不存在同分异构体
D.CCl4是非极性分子? 解析:如果甲烷分子是正方形的平面结构,则CH2Cl2分子中的五个原子必在同一平面上,则 和 应是不同结构,而实际上CH2Cl2只有一种结构,从而证明甲烷分子为正四面体结构。?
答案:B点评:研究有机物要特别注意其分子的空间构型,甲烷分子是以一个碳原子为中心,四个氢原子位于四个顶点的正四面体结构,所以甲烷分子中的氢原子被一个氯原子、两个氯原子、三个氯原子或四个氯原子取代后的产物(即CH3Cl、CH2Cl2、CHCl3、CCl4)都只有一种。 描述CH3 — CH=CH — C ≡ C — CH3分子结构的下列叙述中,正确的是( )
A.6个碳原子有可能都在同一条直线上
B.6个碳原子不可能都在同一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上解析:已知乙烯分子结构中两个碳原子和4个氢原子在同一平面上而不在同一条直线上,若将甲基代替乙烯中的某个氢原子,则3个碳原子不在同一条直线上,故A错B对。若经上述替换后,其键角仍为120°,则CH3 — CH=CH — C ≡中4个碳原子在同一平面内。同时,根据乙炔中的两个碳原子和两个氢原子在同一条直线上,可认为=CH — C ≡ C — CH3中的4个碳原子在同一条直线上,故C对D错。
答案:BC点评:掌握典型的有机物分子的空间构型是解决此类问题的立足点,甲烷是以碳原子为中心的正四面体结构,其中碳原子位于正四面体的中心,4个氢原子位于正四面体的四个顶点上。乙烯分子中的2个碳原子及4个氢原子一定共平面,乙炔分子中的2个碳原子及2个氢原子一定共直线,苯分子中的6个碳原子和6个氢原子是共平面的,我们可以将复杂的分子拆解成我们熟悉的常见基本分子构型,并利用几何学原理加以重组。如该题即可拆解成类似乙烯、乙炔、甲烷等几个基本空间构型,然后重新组合、整理、求解。此种解题方法,充分体现了知识和能力的相互关系。极性键与非极性键的比较列表如下:极性键和非极性键 说明:(1)共价键的极性强弱与两个成键原子所属元素的电负性差值大小有关,电负性差值越大,键的极性越强。
(2)键的极性并不是一成不变的,受分子中邻近基团或外界环境的影响,键的极性及其强弱程度可能会发生变化。共价键是否具有极性及极性的强弱程度对有机化合物的性质有着重要的影响。 大多数有机物分子里的碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是( )
A.只有极性键 B.只有非极性键
C.有极性键和非极性键 D.只有离子键
解析:因碳原子有4个价电子,在有机物中,碳原子与碳原子之间或碳原子与其他原子之间相结合的均是共价键,其中碳原子与碳原子之间以非极性键相结合,碳原子与其他原子之间以极性键相结合。
答案:C 点评:极性和非极性一般针对共价键而言,由元素的电负性大小可判断键是否有极性,如Cl—Cl,H—Cl,ClCH3,其中键的极性可表述为 ,根据电负性的定义,也可由非金属性的强弱进行判断。1.基本概念
同分异构现象:化合物具有相同的化学式,但具有不同结构的现象叫同分异构现象。
同分异构体:分子组成相同而结构不同的有机化合物互为同分异构体。
(1)同分异构体因结构不同,故性质也不同,是不同的物质。
(2)同分异构体相对分子质量相同。但相对分子质量相同的化合物不一定是同分异构体。
例:C3H8和CO2,C2H4和N2、CO等。有机化合物的同分异构现象 (3)同分异构体研究对象并不专指有机物
例:CO(NH2)2和NH4CNO(无机物与无机物间),AgCNO和AgOCN(无机物间)都为同分异构体。
(4)同分异构体组成元素种类及各元素的原子个数一定相同,具有相同的最简式,因而各元素的质量分数相同。但最简式相同的化合物,不一定是同分异构体。HCHO和CH3COOH虽具有相同的最简式CH2O,但不是同分异构体。
(5)结构不同,即分子中原子的连接方式不同。同分异构体可以是同一类物质,也可以是不同类物质。 2.化学中“五同”比较 3.同分异构体的类型
(1)碳链异构,由碳原子排列顺序不同造成。例如:正丁烷与异丁烷。
(2)官能团位置异构,碳原子连接顺序未变而官能团位置不同形成的异构。例如:1-丙醇与2-丙醇。
(3)官能团类别异构,分子式相同,但官能团不同。例如:烯烃与环烷烃、醛与酮、羧酸和酯等。
常见的官能团异构:—(4)单官能团与多官能团,分子式相同,一种分子内为单官能团,另一种分子内有不止一个官能团。例如:CH3COOH与HO—CH2—CHO。
(5)立体异构。
4.判断两物质是否是同分异构体
判断依据是同分异构体的概念。其方法是:先看分子式相同,再看结构不同。注意从两个方面考虑:一是原子或原子团连接顺序;二是原子的空间排列形状。由此能辨认出不同结构,还应记住常见不同类的异构体,例如:相同碳原子数的二烯烃和炔,饱和一元醇和醚,羧酸和酯,氨基酸和硝基化合物等。①貌似不同,但由于分子呈空间四面体构型,实为同一物质,不是同分异构体。而②属于同分异构体。
5.有机物同分异构体种数的确定
一是已知有机物结构确定取代产物的同分异构体种数。其方法是分析有机物的结构特点,确定不同位置的氢原子种数,再确定取代产物同分异构体数目。例如:分析萘分子
( )的结构特点可知,分子中共有2种不同类型的
氢原子,故其一氯取代物的种类只有2种。
二是已知某物质某种取代物异构体种数来确定其另一种取代物的种数。此类题目重在分析结构,找清关系,其方法是:找出取代物氢原子数与取代基团关系,不必写出异构体即可得另一种异构体的种数。例如:若已知丁基有四种,则可推知分子中含5个碳原子的饱和一元醛。这是因为醛基只能在碳链的一端,丁基接上醛基后即构成含5个碳原子的饱和一元醛。再如:已知二甲苯有3种,则马上可推知四甲苯也有3种。因为二甲苯的苯环上有4个空位,若变换角度思考:就是苯环上有4个空位(另2个位被同一取代基占有)的物质有3种,故四甲苯有3种。 分子式为C5H11Cl的同分异构体共有(不考虑立体异构) ( )?
A.6种 B.7种?
C.8种 D.9种?点评:同分异构体种数的判断实质上就是同分异构体的书写。此类题往往是在限定范围内书写同分异构体,解题时一定要仔细分析,防止多写或漏写。 人们使用四百万只橡鼻虫和它们的215磅粪物,历经30多年时间弄清了棉籽橡鼻虫的四种信息素的组成,它们的结构可表示如下(括号内表示④的结构简式)以上四种信息素中互为同分异构体的是( )
A.①和② B.①和③
C.③和④ D.②和④
解析:由所给结构可知①中含有11个碳原子(一个C=C,一个六元环和一个C=O),②中含10个碳原子(一个C=C和一个六元环和一个C=O),③中含有11个碳原子,④中含有11个碳原子,可见①②,②④因碳原子数不同,不是同分异构体,①和③相比,①多一个C=O或少一个—OH即相差两个氢原子,故分子式也不相同,也不是同分异构体。
答案:C
点评:本题所给结构简式看似复杂,但从同分异构体的概念的内涵之一:分子式相同即可解决。但是本题要注意“键线式”结构中,拐点、转折点、端点都表示碳原子。 1.已知乙烯分子是平面结构,因此1,2-二氯乙烯可以形成
。两种不同的空间异构
体,下列各物质能形成类似上述两种空间异构体的是( )
A.1-丁烯 B.丙烯
C.2-甲基-2-丁烯 D.2-氯-2-丁烯解析:先写出各选项的有机物的结构简式:
A:CH2=CH—CH2—CH3
B:CH3—CH=CH2可以看出选项A、B、C中有机物分子中的C=C键上有一个双键碳原子连有相同的基团,因而没有题给条件的空间异构体,而选项D中的C=C键上每一个双键碳原子都连有不同的基团,应有题给条件的空间异构体。
答案:D2.下列物质分子中,属于正四面体结构的是( )
A.CCl4 B.CHCl3
C.CH2Cl2 D.CH3Cl解析:由甲烷分子的正四面体结构推知CCl4应该也是正四面体结构。
答案:A感谢您的使用,退出请按ESC键本小节结束
2.在人类衣食住行所需的物品中,有许多来源于天然有机物,如糖类、油脂、蛋白质、石油、天然气、天然橡胶等等。由于生产、生活的需要,人们学会了合成、分离、提纯有机物,而有机物的结构决定了它的化学性质,因此,研究有机物的结构是有机化学的重点。1.由于碳原子的最外层有四个电子,通常碳碳之间以共同电子对形成共价键,共价键可根据________分为单键、双键、叁键。
(1)单键:两个原子间共用________的共价键。
(2)双键:两个原子间共用________的共价键。
(3)饱和碳原子是碳原子与四个原子形成__________,而与其他原子成键数目少于__的碳原子,称为不饱和碳原子。
2.极性键和非极性键
(1)非极性键:成键的两原子相同,吸引共用电子对的________相同,共用电子对________任何一方的共价键叫做非极性键。不偏向成键方式1对电子2对电子4个共价键4能力(2)极性键:成键双方是________元素的原子,吸引电子能力不同,共用电子对偏向电负性________的一方,即吸引电子能力________的原子,这样的共价键叫极性键。
3.(1)同分异构现象:________的现象。
(2)同分异构体:________相同________不同的有机物之间互称同分异构体。
4.同分异构的异构方式(中学阶段)______、________、________。如1-丁烯,2-丁烯互为________异构;2-戊烯,环戊烷是由于前者为链状,后者为环状,互为________异构。(2)不同 大 强
3.(1)化合物具有相同的化学式,但具有不同的结构 (2)分子组成 结构
4.碳链异构 官能团位置异构 官能团类别异构 官能团位置 官能团类别5.常见有机物的空间构型
(1)甲烷分子的空间构型为____________,键角是________。烷烃分子中,任意两个单键之间的夹角都接近________而不是________,因此烷烃的碳链是________形而不是________形。
(2)乙烯分子为______形分子,其分子式为________,结构式为________,键角为________。
(3)乙炔的分子式为________,结构简式________,键角________,所有原子的空间关系是________。 5.(1)正四面体 109.5° 109° 180° 锯齿 直线
(2)平面 C2H4 120° (3)C2H2 HC≡CH
180° 在同一直线上(4)除了碳原子间能形成双键或叁键外,碳原子还能与氧、硫、氮等原子形成双键,能与氮原子形成叁键。而且,若一个碳原子周围是一个双键和两个单键,其双键和单键的夹角总是接近________;若是一个叁键和一个单键,则其夹角总是接近________。
6.官能团决定着一类有机物的化学特性,因为一方面,一些官能团含有________,易发生相关的化学反应。另一方面,一些官能团含有________。如________,由于碳原子的不饱和性,使得烯烃、炔烃的化学性质比烷烃________,如烯烃能使酸性高锰酸钾溶液________。(4)120° 180°
6.特性原子或原子团 活泼、易发生反应的价键 不饱和烃 活泼 褪色 1.有机物种类繁多的原因
(1)碳元素位于周期表中第2周期第ⅣA族,碳原子最外层有4个价电子,能与其他原子形成4个共价键。碳原子间可以形
成单键( )、双键( )、叁键(—C≡C—),
碳原子还可以形成碳氢单键、碳氧单键、碳氧双键,以及更加复杂的化学键形式。
(2)碳原子间可以单键结合成链状,碳链长度可以不同,也可以形成环状。
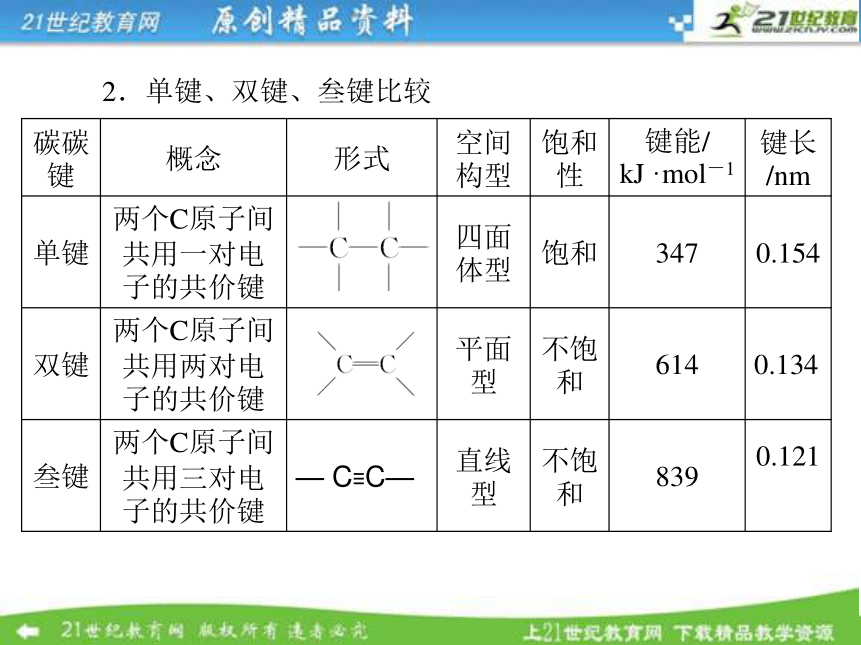
(3)普遍存在同分异构现象。碳原子的成键方式 2.单键、双键、叁键比较3.有机物空间结构比较 说明:(1)组成 和— C≡C—的碳原子称为不饱和碳原子。
(2) 和— C≡C—在一定条件下易断其中一个或两个C—C键生成新的化合物。
4.几种有机化合物的球棍模型及所能发生的主要反应 甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,下列可作为其理由的是( )?
A.CH3Cl不存在同分异构体
B.CH2Cl2不存在同分异构体?
C.CHCl3不存在同分异构体
D.CCl4是非极性分子? 解析:如果甲烷分子是正方形的平面结构,则CH2Cl2分子中的五个原子必在同一平面上,则 和 应是不同结构,而实际上CH2Cl2只有一种结构,从而证明甲烷分子为正四面体结构。?
答案:B点评:研究有机物要特别注意其分子的空间构型,甲烷分子是以一个碳原子为中心,四个氢原子位于四个顶点的正四面体结构,所以甲烷分子中的氢原子被一个氯原子、两个氯原子、三个氯原子或四个氯原子取代后的产物(即CH3Cl、CH2Cl2、CHCl3、CCl4)都只有一种。 描述CH3 — CH=CH — C ≡ C — CH3分子结构的下列叙述中,正确的是( )
A.6个碳原子有可能都在同一条直线上
B.6个碳原子不可能都在同一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上解析:已知乙烯分子结构中两个碳原子和4个氢原子在同一平面上而不在同一条直线上,若将甲基代替乙烯中的某个氢原子,则3个碳原子不在同一条直线上,故A错B对。若经上述替换后,其键角仍为120°,则CH3 — CH=CH — C ≡中4个碳原子在同一平面内。同时,根据乙炔中的两个碳原子和两个氢原子在同一条直线上,可认为=CH — C ≡ C — CH3中的4个碳原子在同一条直线上,故C对D错。
答案:BC点评:掌握典型的有机物分子的空间构型是解决此类问题的立足点,甲烷是以碳原子为中心的正四面体结构,其中碳原子位于正四面体的中心,4个氢原子位于正四面体的四个顶点上。乙烯分子中的2个碳原子及4个氢原子一定共平面,乙炔分子中的2个碳原子及2个氢原子一定共直线,苯分子中的6个碳原子和6个氢原子是共平面的,我们可以将复杂的分子拆解成我们熟悉的常见基本分子构型,并利用几何学原理加以重组。如该题即可拆解成类似乙烯、乙炔、甲烷等几个基本空间构型,然后重新组合、整理、求解。此种解题方法,充分体现了知识和能力的相互关系。极性键与非极性键的比较列表如下:极性键和非极性键 说明:(1)共价键的极性强弱与两个成键原子所属元素的电负性差值大小有关,电负性差值越大,键的极性越强。
(2)键的极性并不是一成不变的,受分子中邻近基团或外界环境的影响,键的极性及其强弱程度可能会发生变化。共价键是否具有极性及极性的强弱程度对有机化合物的性质有着重要的影响。 大多数有机物分子里的碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是( )
A.只有极性键 B.只有非极性键
C.有极性键和非极性键 D.只有离子键
解析:因碳原子有4个价电子,在有机物中,碳原子与碳原子之间或碳原子与其他原子之间相结合的均是共价键,其中碳原子与碳原子之间以非极性键相结合,碳原子与其他原子之间以极性键相结合。
答案:C 点评:极性和非极性一般针对共价键而言,由元素的电负性大小可判断键是否有极性,如Cl—Cl,H—Cl,ClCH3,其中键的极性可表述为 ,根据电负性的定义,也可由非金属性的强弱进行判断。1.基本概念
同分异构现象:化合物具有相同的化学式,但具有不同结构的现象叫同分异构现象。
同分异构体:分子组成相同而结构不同的有机化合物互为同分异构体。
(1)同分异构体因结构不同,故性质也不同,是不同的物质。
(2)同分异构体相对分子质量相同。但相对分子质量相同的化合物不一定是同分异构体。
例:C3H8和CO2,C2H4和N2、CO等。有机化合物的同分异构现象 (3)同分异构体研究对象并不专指有机物
例:CO(NH2)2和NH4CNO(无机物与无机物间),AgCNO和AgOCN(无机物间)都为同分异构体。
(4)同分异构体组成元素种类及各元素的原子个数一定相同,具有相同的最简式,因而各元素的质量分数相同。但最简式相同的化合物,不一定是同分异构体。HCHO和CH3COOH虽具有相同的最简式CH2O,但不是同分异构体。
(5)结构不同,即分子中原子的连接方式不同。同分异构体可以是同一类物质,也可以是不同类物质。 2.化学中“五同”比较 3.同分异构体的类型
(1)碳链异构,由碳原子排列顺序不同造成。例如:正丁烷与异丁烷。
(2)官能团位置异构,碳原子连接顺序未变而官能团位置不同形成的异构。例如:1-丙醇与2-丙醇。
(3)官能团类别异构,分子式相同,但官能团不同。例如:烯烃与环烷烃、醛与酮、羧酸和酯等。
常见的官能团异构:—(4)单官能团与多官能团,分子式相同,一种分子内为单官能团,另一种分子内有不止一个官能团。例如:CH3COOH与HO—CH2—CHO。
(5)立体异构。
4.判断两物质是否是同分异构体
判断依据是同分异构体的概念。其方法是:先看分子式相同,再看结构不同。注意从两个方面考虑:一是原子或原子团连接顺序;二是原子的空间排列形状。由此能辨认出不同结构,还应记住常见不同类的异构体,例如:相同碳原子数的二烯烃和炔,饱和一元醇和醚,羧酸和酯,氨基酸和硝基化合物等。①貌似不同,但由于分子呈空间四面体构型,实为同一物质,不是同分异构体。而②属于同分异构体。
5.有机物同分异构体种数的确定
一是已知有机物结构确定取代产物的同分异构体种数。其方法是分析有机物的结构特点,确定不同位置的氢原子种数,再确定取代产物同分异构体数目。例如:分析萘分子
( )的结构特点可知,分子中共有2种不同类型的
氢原子,故其一氯取代物的种类只有2种。
二是已知某物质某种取代物异构体种数来确定其另一种取代物的种数。此类题目重在分析结构,找清关系,其方法是:找出取代物氢原子数与取代基团关系,不必写出异构体即可得另一种异构体的种数。例如:若已知丁基有四种,则可推知分子中含5个碳原子的饱和一元醛。这是因为醛基只能在碳链的一端,丁基接上醛基后即构成含5个碳原子的饱和一元醛。再如:已知二甲苯有3种,则马上可推知四甲苯也有3种。因为二甲苯的苯环上有4个空位,若变换角度思考:就是苯环上有4个空位(另2个位被同一取代基占有)的物质有3种,故四甲苯有3种。 分子式为C5H11Cl的同分异构体共有(不考虑立体异构) ( )?
A.6种 B.7种?
C.8种 D.9种?点评:同分异构体种数的判断实质上就是同分异构体的书写。此类题往往是在限定范围内书写同分异构体,解题时一定要仔细分析,防止多写或漏写。 人们使用四百万只橡鼻虫和它们的215磅粪物,历经30多年时间弄清了棉籽橡鼻虫的四种信息素的组成,它们的结构可表示如下(括号内表示④的结构简式)以上四种信息素中互为同分异构体的是( )
A.①和② B.①和③
C.③和④ D.②和④
解析:由所给结构可知①中含有11个碳原子(一个C=C,一个六元环和一个C=O),②中含10个碳原子(一个C=C和一个六元环和一个C=O),③中含有11个碳原子,④中含有11个碳原子,可见①②,②④因碳原子数不同,不是同分异构体,①和③相比,①多一个C=O或少一个—OH即相差两个氢原子,故分子式也不相同,也不是同分异构体。
答案:C
点评:本题所给结构简式看似复杂,但从同分异构体的概念的内涵之一:分子式相同即可解决。但是本题要注意“键线式”结构中,拐点、转折点、端点都表示碳原子。 1.已知乙烯分子是平面结构,因此1,2-二氯乙烯可以形成
。两种不同的空间异构
体,下列各物质能形成类似上述两种空间异构体的是( )
A.1-丁烯 B.丙烯
C.2-甲基-2-丁烯 D.2-氯-2-丁烯解析:先写出各选项的有机物的结构简式:
A:CH2=CH—CH2—CH3
B:CH3—CH=CH2可以看出选项A、B、C中有机物分子中的C=C键上有一个双键碳原子连有相同的基团,因而没有题给条件的空间异构体,而选项D中的C=C键上每一个双键碳原子都连有不同的基团,应有题给条件的空间异构体。
答案:D2.下列物质分子中,属于正四面体结构的是( )
A.CCl4 B.CHCl3
C.CH2Cl2 D.CH3Cl解析:由甲烷分子的正四面体结构推知CCl4应该也是正四面体结构。
答案:A感谢您的使用,退出请按ESC键本小节结束
