原子的构成 课件
图片预览









文档简介
课件37张PPT。第二单元 自然界的水 第三节
原子的构成知 识 回 顾
1.分子:___________________________
2.原子:___________________________
3.分子与原子的区别:
——————————————————
4.用分子和原子知识解释化学变化的实质:
-------------------------------------------------------
保持物质化学性质的最小粒子化学变化中最小的粒子在化学变化中,分子可分,原子不可分在化学变化中,分子分成原子,然后原子重新组合成新的分子。学习目标(一)本节课我们要知道1、原子的内部结构
2、表示原子质量的方法 相对原子质量
自学指导(1)带着以下问题阅读课本P43-44 ,5分钟之后找同学来解答一下。用其他方法能否将原子继续分下去? 若能,它可以分为哪几部分?
原子是一个实心球体吗?相对于原子来说,原子核所占空间有多大?
原子核带电吗?带什么电?电子带电吗?带什么电?整个原子显电性吗?为什么?
原子核还能再分吗?如果能再分,它又是由什么粒子构成的呢?这些粒子有区别吗?
原子的质量主要集中在哪里?
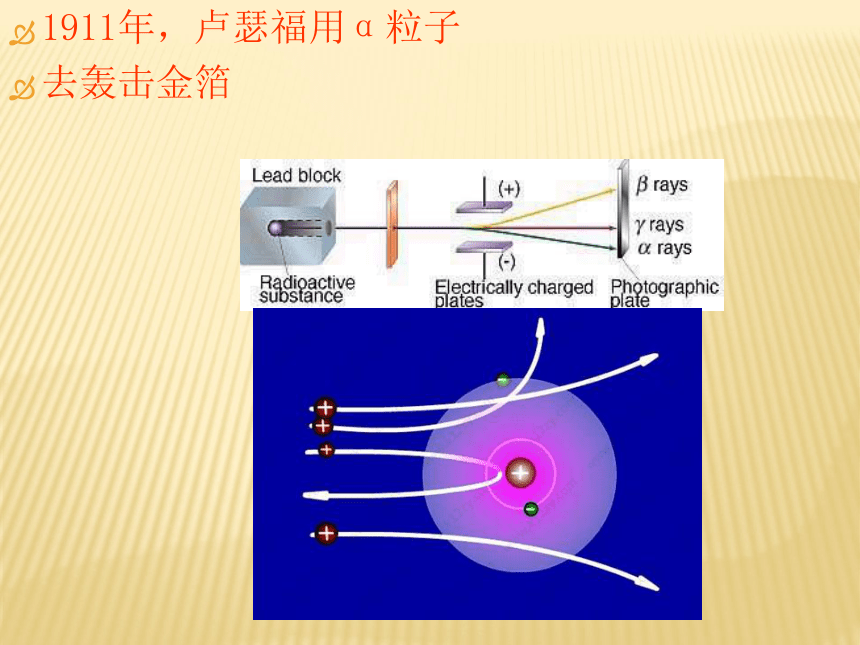
1911年,卢瑟福用α粒子
去轰击金箔 设计实验:1911年,英国科学家卢瑟福用一 束平行高速运动的α粒子轰击金箔。
观察现象:
(1)大多数α粒子不改变原有的运动方向。
(2)有一小部分α粒子改变了原有的运动路径。
(3)极少数的α粒子被反弹回来。解释原因:
(1)说明:
原子内部有很大部分是空的(2)说明:原子内部存在着带正电的组成部分, α粒子受到斥力而改变了原有的运动路径(3)说明:原子内部存在着质量很大,体积很小的微粒。原子的结构原子 原子核
(带正电)电子(带负电)
(核外)质子(带正电)中子(不带电)不显电性思考讨论题:1.原子核所带的正电荷从何而来
2.质子数与原子核所带的正电荷数有什么关系?
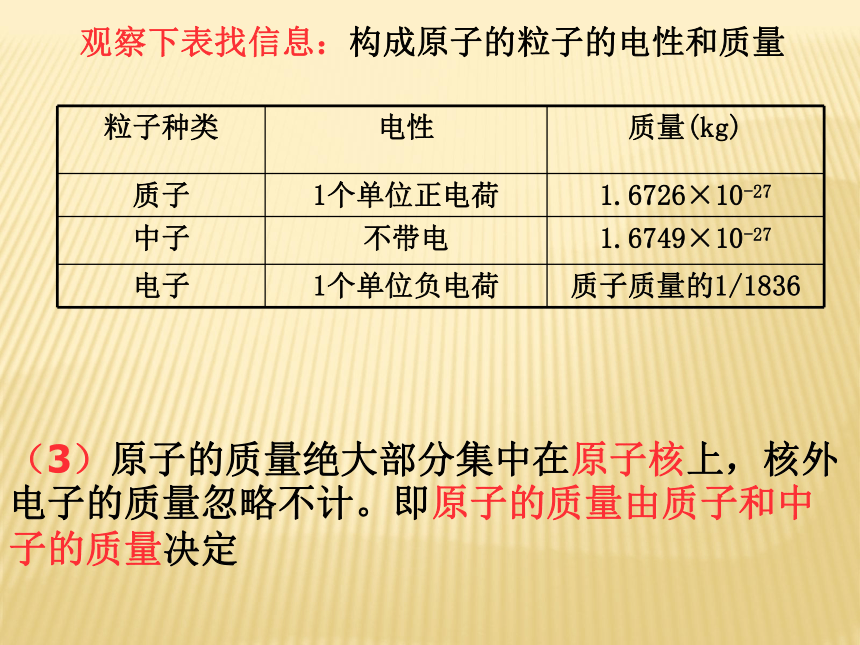
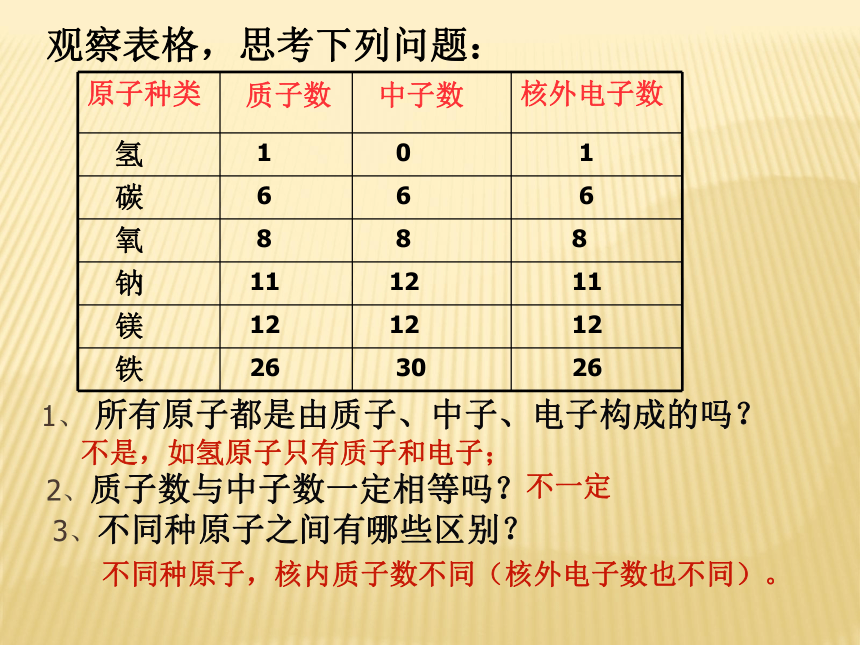
3.电子数与原子核所带正电荷有什么关系?核电荷数=核内质子数=核外电子数观察下表找信息:构成原子的粒子的电性和质量(3)原子的质量绝大部分集中在原子核上,核外电子的质量忽略不计。即原子的质量由质子和中子的质量决定观察表格,思考下列问题: 1、 所有原子都是由质子、中子、电子构成的吗?3、不同种原子之间有哪些区别?2、质子数与中子数一定相等吗?不是,如氢原子只有质子和电子;不一定不同种原子,核内质子数不同(核外电子数也不同)。你能得出的信息有:
1.不是所有的原子都有中子
2.质子数不一定等于中子数
3. 质子数等于核外电子数
4.质子数不同,原子种类也不同
总结:
不同种类的原子,核内质子数不同
1、在 原 子 的 组 成 中, 带 正 电,
带 负 电, 不 带 电, 绕 着 做 高 速 运 动。 占 据 原 子 的 绝 大 部 分 体 积, 集 中原 子 的 主 要 质 量 。
电 子 质 子 中 子 电 子 原 子 核 电 子 原 子 核练习题2、填写下表16811263、月球土壤含有大量氦-3原子在,它可能成为未来核能的重要原料。氦-3原子核内有2个质子和1个中子。氦-3原子中的电子数为( )
A、1 B、2 C、3 D、4 B在分子、原子、质子、中子、电子这些粒子中,选择合适的答案,填在空格上。
(1)能直接构成物质的粒子有:
(2)在化学变化中最小的粒子有:
(3)不显电性的粒子有:
(4)带正电的粒子有:
(5)带负电的粒子有:
(6)质量最小的粒子有:
(7)构成原子的微粒有:
(8)构成原子核的微粒有:
比一比速度、准确度分子 原子 原子分子 原子 中子质子电子电子质子 中子 电子质子 中子二、原子质量的表示——相对原子质量问题:1、原子的质量如此小,无论书写、记忆、还是使用都极不方便。原子的质量又该怎样衡量呢?
2、什么叫相对原子质量?它是如何来表示原子的质量的?自学指导(2)
阅读课本P472分钟回答下面的问题相对原子质量:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比
根据定义能不能写出相对原子质量的数学计算式? 相对原子质量=该原子的实际质量
标准碳原子质量的1/12
注意:相对原子质量只是一个比值,不是原子的实际质量,国际单位是1,常省略不写
例题: 已知1个标准碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg,求氧原子的相对原子质量?氧原子的相对原子质量=2.657×10-26Kg=15.998答:氧原子的相对原子质量是16。解:≈161.993×10-26Kg×1/12根据概念理解计算:
1氢的相对原子质量
2碳的相对原子质量
3碳原子的质量为a㎏,一个原子的质量为
b ㎏,求该原子的
相对原子质量
观察下表,比较原子质量与相对原子质量
(1) 相对原子质量________ (“等于”或“不等于”)原子的实际质量,是个比值。
(2) 原子实际质量越大,它的相对原子质量数值 ____ (“越大”或“越小”),它们之间成___ (“正”或“反”)比关系。
(3)相对原子质量的单位是: ___ 。
(4)原子实际质量的单位是: ___ 。
不等于越大正“1”(常省略不写)千克找规律:相对原子质量的近似值与该原子的质子数,中子数的关系 规律:相对原子质量=质子数+中子数规律的应用:0
11166128816111123171735核电荷数=核内质子数=核外电子数
相对原子质量=质子数+中子数结论(2)碳原子质量*1/12约等于一个质子(或中子)的质量。结论(1)原子的质量绝大部分集中在原子核上,核外电子的质量忽略不计。即原子的质量由质子和中子的质量决定。谁来总结一下?
1、这节课我们都学了哪些知识?
2、你还有什么疑问?小结:
原子的构成
相对原子质量小结:原子的结构原子原子核
(带正电)电子(带负电)
(核外)质子(带正电)中子(不带电)不显电性核电荷数=核内质子数=核外电子数相对原子质量:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比相对原子质量=质子数+中子数
相对原子质量=该原子的实际质量
标准碳原子质量的1/12课堂练习下列叙述正确的是( )
A 原子核都由质子和中子构成
B 在原子中,核内的质子数与核外的电子数不一定相等
C 原子里有相对很大的空间,电子在这个空间里作高速运动
D 不同种类的原子,核内的质子数不同,核外电子数也不同C、D2 铁原子的相对原子质量是( )
A 56克 B 56
C 9.288*10-26 Kg D 1/563 组成一切原子必不可少的粒子是( )
A 质子 B 质子 电子
C 质子 中子 电子 D 质子 中子BB4 铝原子的相对原子质量为27,核电荷数为13,则铝原子由( )个质子和( )个中子构成一个原子核,核外有( )个电子作高速运动而构成.整个原子不显电性的原因是:131413质子和电子所带电量相等,电性相反3.完成下表,可总结出“在原子中质子数等于电子数”。还能总结出(至少写出两条) 1) ;
2) 。相对原子质量等于质子数加中子数不是所有的原子都含有中子082326 课外知识: 近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)“化学的新时代是从原子论开始的”
——恩格斯原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937) 板书笔记: 一:原子的结构原子 原子核
(带正电)电子(带负电)
(核外)质子(带正电)中子(不带电)不显电性核电荷数=核内质子数=核外电子数二:相对原子质量:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比相对原子质量=质子数+中子数
相对原子质量=该原子的实际质量
标准碳原子质量的1/12
原子的构成知 识 回 顾
1.分子:___________________________
2.原子:___________________________
3.分子与原子的区别:
——————————————————
4.用分子和原子知识解释化学变化的实质:
-------------------------------------------------------
保持物质化学性质的最小粒子化学变化中最小的粒子在化学变化中,分子可分,原子不可分在化学变化中,分子分成原子,然后原子重新组合成新的分子。学习目标(一)本节课我们要知道1、原子的内部结构
2、表示原子质量的方法 相对原子质量
自学指导(1)带着以下问题阅读课本P43-44 ,5分钟之后找同学来解答一下。用其他方法能否将原子继续分下去? 若能,它可以分为哪几部分?
原子是一个实心球体吗?相对于原子来说,原子核所占空间有多大?
原子核带电吗?带什么电?电子带电吗?带什么电?整个原子显电性吗?为什么?
原子核还能再分吗?如果能再分,它又是由什么粒子构成的呢?这些粒子有区别吗?
原子的质量主要集中在哪里?
1911年,卢瑟福用α粒子
去轰击金箔 设计实验:1911年,英国科学家卢瑟福用一 束平行高速运动的α粒子轰击金箔。
观察现象:
(1)大多数α粒子不改变原有的运动方向。
(2)有一小部分α粒子改变了原有的运动路径。
(3)极少数的α粒子被反弹回来。解释原因:
(1)说明:
原子内部有很大部分是空的(2)说明:原子内部存在着带正电的组成部分, α粒子受到斥力而改变了原有的运动路径(3)说明:原子内部存在着质量很大,体积很小的微粒。原子的结构原子 原子核
(带正电)电子(带负电)
(核外)质子(带正电)中子(不带电)不显电性思考讨论题:1.原子核所带的正电荷从何而来
2.质子数与原子核所带的正电荷数有什么关系?
3.电子数与原子核所带正电荷有什么关系?核电荷数=核内质子数=核外电子数观察下表找信息:构成原子的粒子的电性和质量(3)原子的质量绝大部分集中在原子核上,核外电子的质量忽略不计。即原子的质量由质子和中子的质量决定观察表格,思考下列问题: 1、 所有原子都是由质子、中子、电子构成的吗?3、不同种原子之间有哪些区别?2、质子数与中子数一定相等吗?不是,如氢原子只有质子和电子;不一定不同种原子,核内质子数不同(核外电子数也不同)。你能得出的信息有:
1.不是所有的原子都有中子
2.质子数不一定等于中子数
3. 质子数等于核外电子数
4.质子数不同,原子种类也不同
总结:
不同种类的原子,核内质子数不同
1、在 原 子 的 组 成 中, 带 正 电,
带 负 电, 不 带 电, 绕 着 做 高 速 运 动。 占 据 原 子 的 绝 大 部 分 体 积, 集 中原 子 的 主 要 质 量 。
电 子 质 子 中 子 电 子 原 子 核 电 子 原 子 核练习题2、填写下表16811263、月球土壤含有大量氦-3原子在,它可能成为未来核能的重要原料。氦-3原子核内有2个质子和1个中子。氦-3原子中的电子数为( )
A、1 B、2 C、3 D、4 B在分子、原子、质子、中子、电子这些粒子中,选择合适的答案,填在空格上。
(1)能直接构成物质的粒子有:
(2)在化学变化中最小的粒子有:
(3)不显电性的粒子有:
(4)带正电的粒子有:
(5)带负电的粒子有:
(6)质量最小的粒子有:
(7)构成原子的微粒有:
(8)构成原子核的微粒有:
比一比速度、准确度分子 原子 原子分子 原子 中子质子电子电子质子 中子 电子质子 中子二、原子质量的表示——相对原子质量问题:1、原子的质量如此小,无论书写、记忆、还是使用都极不方便。原子的质量又该怎样衡量呢?
2、什么叫相对原子质量?它是如何来表示原子的质量的?自学指导(2)
阅读课本P472分钟回答下面的问题相对原子质量:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比
根据定义能不能写出相对原子质量的数学计算式? 相对原子质量=该原子的实际质量
标准碳原子质量的1/12
注意:相对原子质量只是一个比值,不是原子的实际质量,国际单位是1,常省略不写
例题: 已知1个标准碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg,求氧原子的相对原子质量?氧原子的相对原子质量=2.657×10-26Kg=15.998答:氧原子的相对原子质量是16。解:≈161.993×10-26Kg×1/12根据概念理解计算:
1氢的相对原子质量
2碳的相对原子质量
3碳原子的质量为a㎏,一个原子的质量为
b ㎏,求该原子的
相对原子质量
观察下表,比较原子质量与相对原子质量
(1) 相对原子质量________ (“等于”或“不等于”)原子的实际质量,是个比值。
(2) 原子实际质量越大,它的相对原子质量数值 ____ (“越大”或“越小”),它们之间成___ (“正”或“反”)比关系。
(3)相对原子质量的单位是: ___ 。
(4)原子实际质量的单位是: ___ 。
不等于越大正“1”(常省略不写)千克找规律:相对原子质量的近似值与该原子的质子数,中子数的关系 规律:相对原子质量=质子数+中子数规律的应用:0
11166128816111123171735核电荷数=核内质子数=核外电子数
相对原子质量=质子数+中子数结论(2)碳原子质量*1/12约等于一个质子(或中子)的质量。结论(1)原子的质量绝大部分集中在原子核上,核外电子的质量忽略不计。即原子的质量由质子和中子的质量决定。谁来总结一下?
1、这节课我们都学了哪些知识?
2、你还有什么疑问?小结:
原子的构成
相对原子质量小结:原子的结构原子原子核
(带正电)电子(带负电)
(核外)质子(带正电)中子(不带电)不显电性核电荷数=核内质子数=核外电子数相对原子质量:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比相对原子质量=质子数+中子数
相对原子质量=该原子的实际质量
标准碳原子质量的1/12课堂练习下列叙述正确的是( )
A 原子核都由质子和中子构成
B 在原子中,核内的质子数与核外的电子数不一定相等
C 原子里有相对很大的空间,电子在这个空间里作高速运动
D 不同种类的原子,核内的质子数不同,核外电子数也不同C、D2 铁原子的相对原子质量是( )
A 56克 B 56
C 9.288*10-26 Kg D 1/563 组成一切原子必不可少的粒子是( )
A 质子 B 质子 电子
C 质子 中子 电子 D 质子 中子BB4 铝原子的相对原子质量为27,核电荷数为13,则铝原子由( )个质子和( )个中子构成一个原子核,核外有( )个电子作高速运动而构成.整个原子不显电性的原因是:131413质子和电子所带电量相等,电性相反3.完成下表,可总结出“在原子中质子数等于电子数”。还能总结出(至少写出两条) 1) ;
2) 。相对原子质量等于质子数加中子数不是所有的原子都含有中子082326 课外知识: 近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)“化学的新时代是从原子论开始的”
——恩格斯原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937) 板书笔记: 一:原子的结构原子 原子核
(带正电)电子(带负电)
(核外)质子(带正电)中子(不带电)不显电性核电荷数=核内质子数=核外电子数二:相对原子质量:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比相对原子质量=质子数+中子数
相对原子质量=该原子的实际质量
标准碳原子质量的1/12
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
