化学人教版(2019)必修第二册6.2.1化学反应速率(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2.1化学反应速率(共33张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-05-16 08:34:11 | ||
图片预览










文档简介
(共33张PPT)
6.2.1
化学反应的速率
溶洞的形成需几万年时间
铁桥生锈长年累月
炸弹爆炸瞬间完成
水果腐败变质需数天
【课堂引入】
不同的化学反应进行的快慢千差万别,快和慢是相对而言的,我们以上的判断方法都是定性地描述反应的快慢。而在科学研究和实际应用中,往往需要定量地描述一个反应的快慢。
例如:我们学过物理都知道:
(1) 光的传播速度是很快的;
(2) 光在空气中的传播速度3×108m/s。
定性描述
定量描述
那么化学上又是如何定量地判断一个化学反应的快慢的呢?
2、定义:
3、表达式:
4、单位:
mol/(L·s) 、mol/(L·min) 或 mol·L-1·min-1
v (B) = ——
Δc(B)
Δ t
1、意义:
表示 的物理量。
化学反应过程进行的快慢
反应物浓度的减少量
通常指单位时间内 或 。
生成物浓度的增加量
——化学反应速率
【新概念】
1 mol /(L · s)=60 mol /(L · min)
浓度的变化量
【例题1】在 N2 + 3H2 2 NH3反应中,自开始至2秒,氢气的浓度由1mol/L变为0. 6 mol/L,则以氢气表示的化学反应速率是多少?
= 0.2mol/(L·s)
解:v (H2) =
△c (H2)
△t
=
(1 – 0.6 )mol/L
2s
问:2秒末以氨气表示的化学反应速率是多少?
注意:(1)v表示平均反应速率,而非瞬时速率,且为正值。
【例题2】反应4NH3+5O2 4NO+6H2O 在5L的密闭容器中进行,30秒后,NO 的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?
= 0.002mol/ (L · s)
△c (NO) =
△n (NO)
V
=
0.3mol
5L
= 0.06 mol / L
v (NO) =
△c (NO)
△t
=
0.06 mol / L
30s
△
催化剂
2、定义:
3、表达式:
4、单位:
mol/(L·s) 、mol/(L·min) 或 mol·L-1·min-1
v (B) = ——
Δc(B)
Δ t
1、意义:
表示 的物理量。
化学反应过程进行的快慢
反应物浓度的减少量
通常指单位时间内 或 。
生成物浓度的增加量
——化学反应速率
【新概念】
1 mol /(L · s)=60 mol /(L · min)
=
Δn(B)
V Δ t
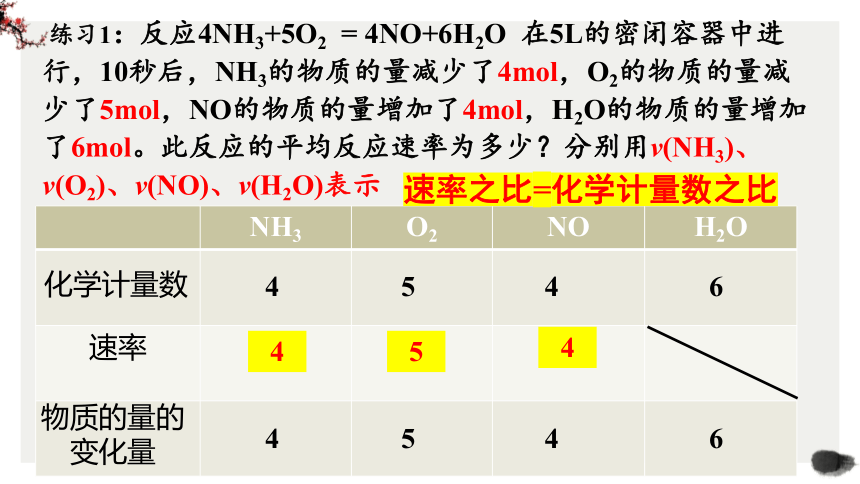
练习1:反应4NH3+5O2 = 4NO+6H2O 在5L的密闭容器中进行,10秒后,NH3的物质的量减少了4mol,O2的物质的量减少了5mol,NO的物质的量增加了4mol,H2O的物质的量增加了6mol。此反应的平均反应速率为多少?分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示
v(O2)=0.1mol/(L·s)
v(NH3)=0.08 mol/(L·s)
v(NO)=0.08 mol/(L·s)
注意:(3)不用固体或纯液体表示化学反应速率。
注意:(2)同一反应的速率可用不同物质来表示,其数值可能不同,但表示的意义相同,所以需要指明具体物质如v(NO)
练习1:反应4NH3+5O2 = 4NO+6H2O 在5L的密闭容器中进行,10秒后,NH3的物质的量减少了0.4mol,O2的物质的量减少了0.5mol,NO的物质的量增加了0.4mol,H2O的物质的量增加了0.6mol。此反应的平均反应速率为多少?分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示
v(O2)=0.1mol/(L·s)
v(NH3)=0.08 mol/(L·s)
v(NO)=0.08 mol/(L·s)
不用固体或纯液体表示化学反应速率。
这三个反应速率有什么规律吗?与化学计量数有关系吗?
练习1:反应4NH3+5O2 = 4NO+6H2O 在5L的密闭容器中进行,10秒后,NH3的物质的量减少了4mol,O2的物质的量减少了5mol,NO的物质的量增加了4mol,H2O的物质的量增加了6mol。此反应的平均反应速率为多少?分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示
NH3 O2 NO H2O
速率 0.08 0.1 0.08
化学计量数
4
5
4
4 5 4 6
速率之比=化学计量数之比
4 5 4 6
物质的量的
变化量
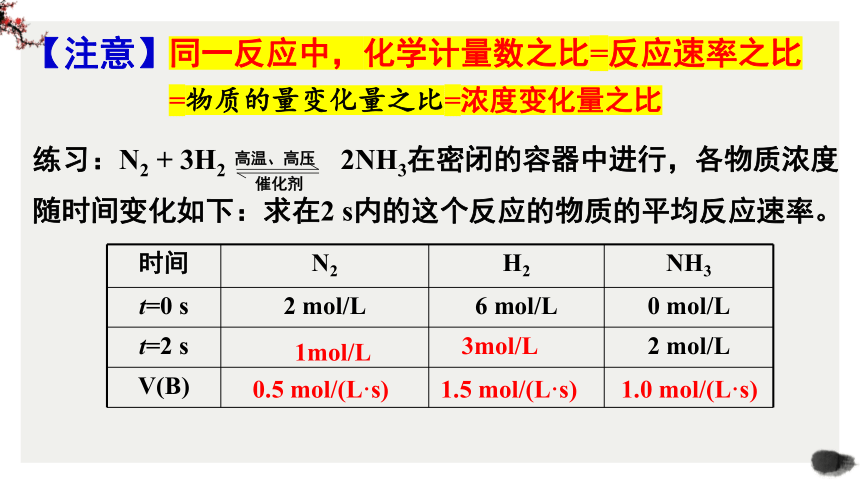
同一反应中,化学计量数之比=反应速率之比
【注意】
练习:N2 + 3H2 2NH3在密闭的容器中进行,各物质浓度随时间变化如下:求在2 s内的这个反应的物质的平均反应速率。
高温、高压
催化剂
时间 N2 H2 NH3
t=0 s 2 mol/L 6 mol/L 0 mol/L
t=2 s 2 mol/L
V(B)
0.5 mol/(L·s)
1.5 mol/(L·s)
1.0 mol/(L·s)
1mol/L
3mol/L
=物质的量变化量之比=浓度变化量之比
计算讲解
n始/mol
n/mol
0.6
1
3
0
n末/mol
1.2
0.4
0.8
【例题4】在2L密闭容器中,发生反应N2 + 3H2 2NH3,先加入1mol N2和3mol H2,反应2min后,n(N2)=0.6mol。求各物质的化学反应速率是多少?
v(N2)=
0.4mol
2L 2min
v(H2)=0.3mol/(L min)
1.8
0.8
N2 + 3H2 2NH3
= 0.1mol/(L min)
n(N2)
V体积 t
=
C
t
=
v(NH3)=0.2mol/(L min)
①写出有关反应的化学方程式;
②标出各物质的起始量、变化量、最终量;(c、n)
③根据已知条件列方程式计算。
三、“三段式”计算
练习2:在2 L的密闭容器中,加入1 mol N2和3 mol H2,发生 N2+3H2 2NH3 ,在2 s末时,测得容器中含有0.4 mol的NH3,求该反应的化学反应速率。
N2 + 3H2 2NH3
c始(mol/L)
c末(mol/L)
n(mol/L)
0.5 1.5 0
0.2
0.2
0.3
0.1
0.4
1.2
v(H2)=0.15mol/(L·s)
v(N2)=0.05mol/(L·s)
v(NH3)=0.1mol/(L·s)
练习3、根据下图填空:
(1)该反应的化学方程式是
3A+2B 3C
v(A)=3mol/(L·min)
v(B)=2 mol/(L·min)
v(C)=3mol/(L·min)
(2)2min内A、B、C三者的
反应速率是多少?
2. 根据各物质的反应速率之比写出化学方程式。
一定条件下,mA + nB === pC的反应中,各物质的化学反应速率为v(A)=a mol/(L·s),v(B)=0.5a mol/(L·s),v(C)=1.5a mol/(L·s),则该反应的化学方程式为 。
2A + B == 3C
比值法
1、反应3A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率最快的是( )
A.v(A)=0.15 mol/(L·s) B.v(B)=0.6 mol/(L·s)
C.v(C)=0.24 mol/(L·s) D.v(D)=0.45 mol/(L·s)
分别除以相应物质的化学计量数,所得数值大的速率大。
D
三、比较化学反应速率的大小
2、反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1) v(A) = 0.3mol/(L·s )
(2) v(B) = 1.8mol/(L·min)
(3) v(C) = 0.4mol/(L·s)
(4) v(D) = 0.45mol/(L·s)
则反应速率的快慢顺序为:
(1)>(4)>(3)>(2)
归一法
比较化学反应速率的大小时要同一物质,同一单位
三、比较化学反应速率的大小
在2L密闭容器中,发生反应:2SO2 (g) + O2(g) 2SO3(g) ,先加入2molSO2和2mol O2。反应2min后,SO3的物质的量浓度为0.4mol/L。计算:(1)2min时SO2、O2的浓度
(2)求用SO2、O2、SO3表示的化学反应速率。
【练习】在25℃时,向100mL含HCl 14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为 ;
(2)后4s内用HCl表示的平均反应速率为 ;
0.25mol/(L·s)
0.25mol/(L·s)
2、数学表达式:
1、定义:
3、常用的单位:mol/(L·min)或mol/(L·s)
④同一反应,用不同物质表示反应速率,在数值上可能不同,但是表示的快慢意义相同;而且它们的化学反应速率之比等于它们的计量数之比。
注意:① 化学反应速率为某段时间的平均速率,且是正值;
②一般不用固体和纯液体物质来表示化学反应速率;
③表示化学反应的速率时,必须指明是用反应体系中的哪种物质做标准;
用单位时间内反应物浓度的减小或生成物浓度的增大来表示。
课堂小结:化学反应速率
【思考2】为什么牛奶在标注保质期时,还要标注贮存条件(冰箱中冷藏)?影响化学反应速率的因素还有哪些?
不同物质的保质期不同
怎样定性地比较和判断反应的快慢?
①冒气泡快慢
②颜色变化
③固体量减少
④浑浊程度
⑤温度变化等
化学反应速率与哪些因素有关?
课本P45
1、向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺;
2、把食物存放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期;
3、做化学实验是,为加速反应的进行,通常将块状或颗粒状的固体试剂研细并混匀;
4、铁在空气中和纯氧中反应的剧烈程度明显不同。
温度、反应物的浓度、接触面积
探究影响化学反应速率的因素
研究思路与方法:
1、选择研究对象
有明显的实验现象
反应速率适中
安全、无污染、方便易行
【思考3】下列哪些反应适合作为探究影响化学反应速率因素的研究对象?
NaOH + HCl = NaCl + H2O
Zn + 2HCl = ZnCl2 + H2
2Na + 2H2O = 2NaOH + H2
2、设计实验方案
【实验用品】
5%H2O2溶液、1mol/L FeCl3溶液、MnO2固体、0.1mol/L 盐酸、2mol/L 盐酸、表面积大小相同的Zn片、热水、冷水。
探究温度对化学反应速率的影响
实验仪器、试剂
实验步骤
实验现象
5%H2O2溶液、试管、试管夹、酒精灯
取两支试管分别加入3mLH2O2溶液,其中一支放入热水浴中。
变量控制:科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题分别加以研究,最后再将几个单因素问题的研究结果加以综合。这种变量控制的方法是科学探究中常用的方法。例如,以上探究在比较不同温度对化学反应速率的影响时,控制浓度和其他影响因素相同。
课本P43页探究
探究浓度对化学反应速率的影响
实验仪器、试剂
实验步骤
实验现象
Zn片、0.1mol/L 盐酸、2mol/L 盐酸、试管
取两支试管分别加入一小块锌片,然后分别加入一滴管不同浓度的盐酸。
【实验用品】
5%H2O2溶液、1mol/L FeCl3溶液、MnO2固体、0.1mol/L 盐酸、2mol/L 盐酸、表面积大小相同的Zn片、热水、冷水。
探究不同催化剂对化学反应速率的影响
实验仪器、试剂 5%H2O2溶液、1mol/L FeCl3溶液、MnO2固体、试管
实验步骤
实验现象
【实验用品】
5%H2O2溶液、1mol/L FeCl3溶液、MnO2固体、0.1mol/L 盐酸、2mol/L 盐酸、表面积大小相同的Zn片、试管、试管夹、酒精灯。
在两支试管中分别加入3mL 5%H2O2溶液,向其中一支试管中加入几滴FeCl3溶液,向另一支试管中加入少量MnO2固体。
【拓展】催化剂的重大作用
中国石油催化剂之父——闵恩泽
其他影响因素
除温度、催化剂、溶液的浓度、气体的压强外,固体的表面积、反应物的状态、溶剂、光照、原电池、光波、电磁波、超声波等都可以影响化学反应速率。
粉末状和块状大理石与相同浓度的盐酸反应,哪一种化学反应的速率更快?
1、结合本节课所学内容,你会改变哪些条件,来提高合成氨的速率?
2、在恒容条件下,向容器中通入氦气,化学反应速率如何变化?
不变。容器体积不变,通入氦气,反应物的浓度不变,速率不变。
3、在恒压条件下,向容器中通入氦气,化学反应速率如何变化?
减小。总压强不变,通入氦气体积增大,反应物的浓度减小,反应速率减小。
【课后思考】
压强对化学反应速率的影响
对有气体参加的反应,改变压强对反应速率的影响实质是改变体系体积,使反应物的浓度改变。
增大压强(减小容器体积,增大反应物浓度),能加快化学反应速率。
减小压强(增大容器体积,减小反应物浓度),能减慢化学反应速率。
结论:
【课后思考】下图表示锌和稀盐酸反应时产生氢气的速率与反应时间的关系,回答下列问题:
V(H2)
t/秒
0 a b
(1)从0到a时间段内反应速率加快的原因是:
(2)从a到b时间段内反应速率减慢的原因是:
该反应是放热反应,在0到a时间段内浓度变化不大,但温度升高,以温度的影响为主,所以反应速率增大。
随着反应的进行,到a后盐酸的浓度不断降低,此时,浓度的影响为主要因素,反应速率将不断减小。
6.2.1
化学反应的速率
溶洞的形成需几万年时间
铁桥生锈长年累月
炸弹爆炸瞬间完成
水果腐败变质需数天
【课堂引入】
不同的化学反应进行的快慢千差万别,快和慢是相对而言的,我们以上的判断方法都是定性地描述反应的快慢。而在科学研究和实际应用中,往往需要定量地描述一个反应的快慢。
例如:我们学过物理都知道:
(1) 光的传播速度是很快的;
(2) 光在空气中的传播速度3×108m/s。
定性描述
定量描述
那么化学上又是如何定量地判断一个化学反应的快慢的呢?
2、定义:
3、表达式:
4、单位:
mol/(L·s) 、mol/(L·min) 或 mol·L-1·min-1
v (B) = ——
Δc(B)
Δ t
1、意义:
表示 的物理量。
化学反应过程进行的快慢
反应物浓度的减少量
通常指单位时间内 或 。
生成物浓度的增加量
——化学反应速率
【新概念】
1 mol /(L · s)=60 mol /(L · min)
浓度的变化量
【例题1】在 N2 + 3H2 2 NH3反应中,自开始至2秒,氢气的浓度由1mol/L变为0. 6 mol/L,则以氢气表示的化学反应速率是多少?
= 0.2mol/(L·s)
解:v (H2) =
△c (H2)
△t
=
(1 – 0.6 )mol/L
2s
问:2秒末以氨气表示的化学反应速率是多少?
注意:(1)v表示平均反应速率,而非瞬时速率,且为正值。
【例题2】反应4NH3+5O2 4NO+6H2O 在5L的密闭容器中进行,30秒后,NO 的物质的量增加了0.3mol,此反应的平均反应速率用NO来表示为多少?
= 0.002mol/ (L · s)
△c (NO) =
△n (NO)
V
=
0.3mol
5L
= 0.06 mol / L
v (NO) =
△c (NO)
△t
=
0.06 mol / L
30s
△
催化剂
2、定义:
3、表达式:
4、单位:
mol/(L·s) 、mol/(L·min) 或 mol·L-1·min-1
v (B) = ——
Δc(B)
Δ t
1、意义:
表示 的物理量。
化学反应过程进行的快慢
反应物浓度的减少量
通常指单位时间内 或 。
生成物浓度的增加量
——化学反应速率
【新概念】
1 mol /(L · s)=60 mol /(L · min)
=
Δn(B)
V Δ t
练习1:反应4NH3+5O2 = 4NO+6H2O 在5L的密闭容器中进行,10秒后,NH3的物质的量减少了4mol,O2的物质的量减少了5mol,NO的物质的量增加了4mol,H2O的物质的量增加了6mol。此反应的平均反应速率为多少?分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示
v(O2)=0.1mol/(L·s)
v(NH3)=0.08 mol/(L·s)
v(NO)=0.08 mol/(L·s)
注意:(3)不用固体或纯液体表示化学反应速率。
注意:(2)同一反应的速率可用不同物质来表示,其数值可能不同,但表示的意义相同,所以需要指明具体物质如v(NO)
练习1:反应4NH3+5O2 = 4NO+6H2O 在5L的密闭容器中进行,10秒后,NH3的物质的量减少了0.4mol,O2的物质的量减少了0.5mol,NO的物质的量增加了0.4mol,H2O的物质的量增加了0.6mol。此反应的平均反应速率为多少?分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示
v(O2)=0.1mol/(L·s)
v(NH3)=0.08 mol/(L·s)
v(NO)=0.08 mol/(L·s)
不用固体或纯液体表示化学反应速率。
这三个反应速率有什么规律吗?与化学计量数有关系吗?
练习1:反应4NH3+5O2 = 4NO+6H2O 在5L的密闭容器中进行,10秒后,NH3的物质的量减少了4mol,O2的物质的量减少了5mol,NO的物质的量增加了4mol,H2O的物质的量增加了6mol。此反应的平均反应速率为多少?分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示
NH3 O2 NO H2O
速率 0.08 0.1 0.08
化学计量数
4
5
4
4 5 4 6
速率之比=化学计量数之比
4 5 4 6
物质的量的
变化量
同一反应中,化学计量数之比=反应速率之比
【注意】
练习:N2 + 3H2 2NH3在密闭的容器中进行,各物质浓度随时间变化如下:求在2 s内的这个反应的物质的平均反应速率。
高温、高压
催化剂
时间 N2 H2 NH3
t=0 s 2 mol/L 6 mol/L 0 mol/L
t=2 s 2 mol/L
V(B)
0.5 mol/(L·s)
1.5 mol/(L·s)
1.0 mol/(L·s)
1mol/L
3mol/L
=物质的量变化量之比=浓度变化量之比
计算讲解
n始/mol
n/mol
0.6
1
3
0
n末/mol
1.2
0.4
0.8
【例题4】在2L密闭容器中,发生反应N2 + 3H2 2NH3,先加入1mol N2和3mol H2,反应2min后,n(N2)=0.6mol。求各物质的化学反应速率是多少?
v(N2)=
0.4mol
2L 2min
v(H2)=0.3mol/(L min)
1.8
0.8
N2 + 3H2 2NH3
= 0.1mol/(L min)
n(N2)
V体积 t
=
C
t
=
v(NH3)=0.2mol/(L min)
①写出有关反应的化学方程式;
②标出各物质的起始量、变化量、最终量;(c、n)
③根据已知条件列方程式计算。
三、“三段式”计算
练习2:在2 L的密闭容器中,加入1 mol N2和3 mol H2,发生 N2+3H2 2NH3 ,在2 s末时,测得容器中含有0.4 mol的NH3,求该反应的化学反应速率。
N2 + 3H2 2NH3
c始(mol/L)
c末(mol/L)
n(mol/L)
0.5 1.5 0
0.2
0.2
0.3
0.1
0.4
1.2
v(H2)=0.15mol/(L·s)
v(N2)=0.05mol/(L·s)
v(NH3)=0.1mol/(L·s)
练习3、根据下图填空:
(1)该反应的化学方程式是
3A+2B 3C
v(A)=3mol/(L·min)
v(B)=2 mol/(L·min)
v(C)=3mol/(L·min)
(2)2min内A、B、C三者的
反应速率是多少?
2. 根据各物质的反应速率之比写出化学方程式。
一定条件下,mA + nB === pC的反应中,各物质的化学反应速率为v(A)=a mol/(L·s),v(B)=0.5a mol/(L·s),v(C)=1.5a mol/(L·s),则该反应的化学方程式为 。
2A + B == 3C
比值法
1、反应3A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率最快的是( )
A.v(A)=0.15 mol/(L·s) B.v(B)=0.6 mol/(L·s)
C.v(C)=0.24 mol/(L·s) D.v(D)=0.45 mol/(L·s)
分别除以相应物质的化学计量数,所得数值大的速率大。
D
三、比较化学反应速率的大小
2、反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1) v(A) = 0.3mol/(L·s )
(2) v(B) = 1.8mol/(L·min)
(3) v(C) = 0.4mol/(L·s)
(4) v(D) = 0.45mol/(L·s)
则反应速率的快慢顺序为:
(1)>(4)>(3)>(2)
归一法
比较化学反应速率的大小时要同一物质,同一单位
三、比较化学反应速率的大小
在2L密闭容器中,发生反应:2SO2 (g) + O2(g) 2SO3(g) ,先加入2molSO2和2mol O2。反应2min后,SO3的物质的量浓度为0.4mol/L。计算:(1)2min时SO2、O2的浓度
(2)求用SO2、O2、SO3表示的化学反应速率。
【练习】在25℃时,向100mL含HCl 14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:
(1)前2s内用FeCl2表示的平均反应速率为 ;
(2)后4s内用HCl表示的平均反应速率为 ;
0.25mol/(L·s)
0.25mol/(L·s)
2、数学表达式:
1、定义:
3、常用的单位:mol/(L·min)或mol/(L·s)
④同一反应,用不同物质表示反应速率,在数值上可能不同,但是表示的快慢意义相同;而且它们的化学反应速率之比等于它们的计量数之比。
注意:① 化学反应速率为某段时间的平均速率,且是正值;
②一般不用固体和纯液体物质来表示化学反应速率;
③表示化学反应的速率时,必须指明是用反应体系中的哪种物质做标准;
用单位时间内反应物浓度的减小或生成物浓度的增大来表示。
课堂小结:化学反应速率
【思考2】为什么牛奶在标注保质期时,还要标注贮存条件(冰箱中冷藏)?影响化学反应速率的因素还有哪些?
不同物质的保质期不同
怎样定性地比较和判断反应的快慢?
①冒气泡快慢
②颜色变化
③固体量减少
④浑浊程度
⑤温度变化等
化学反应速率与哪些因素有关?
课本P45
1、向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺;
2、把食物存放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期;
3、做化学实验是,为加速反应的进行,通常将块状或颗粒状的固体试剂研细并混匀;
4、铁在空气中和纯氧中反应的剧烈程度明显不同。
温度、反应物的浓度、接触面积
探究影响化学反应速率的因素
研究思路与方法:
1、选择研究对象
有明显的实验现象
反应速率适中
安全、无污染、方便易行
【思考3】下列哪些反应适合作为探究影响化学反应速率因素的研究对象?
NaOH + HCl = NaCl + H2O
Zn + 2HCl = ZnCl2 + H2
2Na + 2H2O = 2NaOH + H2
2、设计实验方案
【实验用品】
5%H2O2溶液、1mol/L FeCl3溶液、MnO2固体、0.1mol/L 盐酸、2mol/L 盐酸、表面积大小相同的Zn片、热水、冷水。
探究温度对化学反应速率的影响
实验仪器、试剂
实验步骤
实验现象
5%H2O2溶液、试管、试管夹、酒精灯
取两支试管分别加入3mLH2O2溶液,其中一支放入热水浴中。
变量控制:科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题分别加以研究,最后再将几个单因素问题的研究结果加以综合。这种变量控制的方法是科学探究中常用的方法。例如,以上探究在比较不同温度对化学反应速率的影响时,控制浓度和其他影响因素相同。
课本P43页探究
探究浓度对化学反应速率的影响
实验仪器、试剂
实验步骤
实验现象
Zn片、0.1mol/L 盐酸、2mol/L 盐酸、试管
取两支试管分别加入一小块锌片,然后分别加入一滴管不同浓度的盐酸。
【实验用品】
5%H2O2溶液、1mol/L FeCl3溶液、MnO2固体、0.1mol/L 盐酸、2mol/L 盐酸、表面积大小相同的Zn片、热水、冷水。
探究不同催化剂对化学反应速率的影响
实验仪器、试剂 5%H2O2溶液、1mol/L FeCl3溶液、MnO2固体、试管
实验步骤
实验现象
【实验用品】
5%H2O2溶液、1mol/L FeCl3溶液、MnO2固体、0.1mol/L 盐酸、2mol/L 盐酸、表面积大小相同的Zn片、试管、试管夹、酒精灯。
在两支试管中分别加入3mL 5%H2O2溶液,向其中一支试管中加入几滴FeCl3溶液,向另一支试管中加入少量MnO2固体。
【拓展】催化剂的重大作用
中国石油催化剂之父——闵恩泽
其他影响因素
除温度、催化剂、溶液的浓度、气体的压强外,固体的表面积、反应物的状态、溶剂、光照、原电池、光波、电磁波、超声波等都可以影响化学反应速率。
粉末状和块状大理石与相同浓度的盐酸反应,哪一种化学反应的速率更快?
1、结合本节课所学内容,你会改变哪些条件,来提高合成氨的速率?
2、在恒容条件下,向容器中通入氦气,化学反应速率如何变化?
不变。容器体积不变,通入氦气,反应物的浓度不变,速率不变。
3、在恒压条件下,向容器中通入氦气,化学反应速率如何变化?
减小。总压强不变,通入氦气体积增大,反应物的浓度减小,反应速率减小。
【课后思考】
压强对化学反应速率的影响
对有气体参加的反应,改变压强对反应速率的影响实质是改变体系体积,使反应物的浓度改变。
增大压强(减小容器体积,增大反应物浓度),能加快化学反应速率。
减小压强(增大容器体积,减小反应物浓度),能减慢化学反应速率。
结论:
【课后思考】下图表示锌和稀盐酸反应时产生氢气的速率与反应时间的关系,回答下列问题:
V(H2)
t/秒
0 a b
(1)从0到a时间段内反应速率加快的原因是:
(2)从a到b时间段内反应速率减慢的原因是:
该反应是放热反应,在0到a时间段内浓度变化不大,但温度升高,以温度的影响为主,所以反应速率增大。
随着反应的进行,到a后盐酸的浓度不断降低,此时,浓度的影响为主要因素,反应速率将不断减小。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
